同型半胱氨酸(homocysteine,hcy)能促使机体生成氧化性低密度脂蛋白,对冠状动脉等血管内皮细胞具有间接细胞毒性[1],诱导血管内皮细胞损伤或凋亡,而血管内皮细胞损伤或凋亡是引起冠状动脉粥样硬化(atherosclerosis,As)的重要启动步骤,同时也贯穿了动脉粥样硬化的整个发生、发展过程。脂蛋白(a)[lipoproteino(a),Lpo(a)]其由载脂蛋白[apolipopr-otein(a),Apo(a)]构成[2],表达可受基因调控,故可从基因层面寻找阻止其生成的有效手段,达到根本上或显著控制Lpo(a)表达[3]。部分研究前期[4-5]通过生物信息学、miR芯片及基础实验证实,miR-23是降Apo(a)效果最显著的内源性miRs。目前,已有研究证实miR-23通过抑制Apo(a)表达,可显著缓解血管内皮细胞损伤,但关于其是否可缓解hcy对血管内皮细胞的间接毒性,尚无研究探讨。研究证实[6],正常状态下Apo(a)在细胞内呈现极低表达,而E26转录因子-1(E26 Transformation-specific 1,ETS-1)为Apo(a)的正调节转录因子之一,Apo(a)基因表达也受到其协同转录激活。故本研究拟通过以ETS1为靶基因预测和选取显著调控Apo(a)的内源性miR-23b,以验证其抑制血管内皮细胞内经高hcy激活小分子Apo(a)表达的效果,为治疗高hcy引起的As提供指导。
1 材料与方法 1.1 试剂和仪器人冠状动脉内皮细胞(human coronary artery endothelial cells,HCAECs)购自湖南丰晖生物科技有限公司,hcy粉购自美国OriGen公司,LipofectamineTM 2000试剂购自武汉锐博生物科技有限公司,兔抗人eNOS一抗、兔抗人Apo(a)一抗、兔抗人akt/p-akt一抗、兔抗人GAPDH一抗、兔抗人β-actin一抗、羊抗兔HRP标记二抗均购自美国Santa Cruz公司,pmir GLO质粒购自上海宸功生物技术有限公司,科华ST-360酶标仪购自山东博科生物产业有限公司,PCR仪购自上海皓庄仪器有限公司,MP-510电泳仪购自美国Major Science公司,双荧光素酶报告基因系统购自美国Promega公司。
1.2 方法 1.2.1 设计miR-23b-3p mimic/inhibitor进入http://www.targetscan.org/网站,以调控Apo(a)的ETS1为靶基因预测其内源性miRs,得到miR-23b-3p调控性最强,设计miR-23b-3p minics:5′-AUCACAUUGCCAGGG-AUUACC-3′,miR-23b-3p inhibitor:5′-CAGUACUUUUGUGUAGUACAA-3′,交由广州易锦生物技术有限公司合成。
1.2.2 构建pmirGLO- ETS1 3′-UTR质粒以Apo(a)基因序列设计合成引物,HCAECs细胞为DNA模板作PCR扩增,扩增条件:94 ℃预变性4 min,循环:94 ℃变性1 min、56 ℃ 30 s、72 ℃ 1 min,共30个循环,72 ℃ 8 min,总体系50 μL,产物1.5%凝胶电泳后回收纯化,通过SacⅠ和XbaⅠ双酶切载体pmirGLO连接高感受态细胞,提取质粒双酶切鉴定、测序,获得pmir GLO-ETS1 3′-UTR质粒,将ETS1基因mRNA的3′-UTR内miR-23a/b种子序列结合位点内的5个碱基做定点突变,同法构建靶基因突变型质粒pmirGLO-ETS1 3′-UTR mut,荧光报告载体如下:pmirGLO-ETS13′-UTR正义链5′-CGCGAGCTCTGTTCAATAATGTCCC-3′,反义链5′-GCTCTAGATTCCAAACACAAG-GGGC-3′;pmirGLO-ETS1 3′-UTR mut正义链5′-GCGC-GTCAATTTTAAGAAATAATATTTTA-3′,反义链5′-CG-CGCGAATTAATACAAACTTTCAAAG-3′。
1.2.3 测定转染细胞荧光素酶活性HCAECs细胞常规复苏后,含10%胎牛血清DMEM(高糖)培养基中,于37 ℃、5%CO2下培养4 d,PBS洗10 min,胰酶消化、重悬,1 100 r/min离心,弃上清液,胎牛血清重悬细胞,3×105/孔接种于6孔板,培养3 d后,2×104/孔移至96孔细胞板,每组设置6个复孔,接种12 h后,取对数期细胞依次转染分组:A组转染pmirGLO-ETS1 3′-UTR;B组转染miR-23b-3p inhibitor+pmirGLO-ETS1 3′-UTR;C组转染miR-23b-3p minics+pmirGLO-ETS13′-UTR;D组转染pmirGLO-ETS13′-UTR mut;E组转染miR-23b-3p minics+pmirGLO-ETS13′- UTR mut;F组共转染miR-23b-3p inhibitor+pmirGLO-ETS13′- UTR mut。各组3个复孔,置于37 ℃5%CO2,取相应转染质粒加入到50 μL opti-MEM无血清培养基混匀,1 μL Lipo2000溶解于50 μL opti-MEM无血清培养基中,混匀,室温下静置10 min。将上述2种试剂混合后孵育20 min。加1.9 mL血清培养基于70%细胞密度的六孔板,然后加入孵育后的转染试剂,混匀后培养箱培养48 h,双荧光素酶报告基因系统测定转染后细胞基因活性,公式:相对荧光值=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.2.4 分组转染HCAECs细胞取对数期HCAECs细胞,以1×106/孔接种于6孔板内,置于37 ℃、5%CO2下转染培养至细胞密度70%,分为:对照组、阴性对照组(接受miR-23b-3p inhibitor转染)和实验组(接受miR-23b-3p mimic转染),3组细胞均置于含1.0 mmol/L hcy培养基中培养,每组细胞按1×104/孔接种于96孔内,于37 ℃、5%CO2下继续培养7 d,每组设置6个复孔。
1.2.5 测定HCAECs细胞存活率取各组HCAECs,接种于96孔细胞培养板,每孔加5 g/L MTT液20 μL,孵育2 h去上清液,加DMSO 100 μL,振荡15 min待均匀后,移除培养液后,活细胞荧光染色试剂盒染色后,上荧光显微镜(×400)观察染色图片,计数1个视野内存活细胞。MTT法检测HCAECs细胞存活率,酶标仪测定490 nm波长处光密度值[D(490)]。每组设置5个复孔和1个空白对照组,重复测量3次取平均值,HCAECs细胞存活率=[D(490)测定组-D(490)对照组]/D(490)对照组×100%,同期测定未接受hcy诱导正常HCAECs细胞存活率。
1.2.6 反转录PCR(RT-PCR)测定细胞内miR-23b-3p和Apo(a) mRNA表达各组细胞培养7 d后,取细胞液20 μL,裂解30 s后,11 269×g离心10 min。TRIzol法提取各组细胞总RNA,逆转录成cDNA,使用反转录试剂盒对miR-23b-3p和Apo(a) mRNA进行RT-PCR检测,miR-23b-3p以U6为内参,Apo(a)以β-actin为内参,引物如下:miR-23b-3p正义链5′-CACAAAGGCATCTCTACGCCCATC-3′,反义链5′- TGTA-GCTGCCTCGCCAGAGGC-3′;U6正义链5′-TGCGGGT-GCTCGCTTCGGCAGC-3′,反义链5′-CCAGTGCAGGG-TCCGAGGT-3′;Apo(a)正义链5′-TGGACGGGAGACAGAGTGAAGCAT-3′,反义链5′-GGCATAGCTGGTA-GCTGGGAACA-3′;β-actin正义链5′-CCTCATGCCATCCTGCGTCTG-3′,反义链5′-TTGCTCGAAGTCTAGGG-CAACATAG-3′。
扩增长度123 bp,反应体系:荧光试剂SYBR10 μL、cDNA 1.0 μL、无RNA酶水8.0 μL、上游及下游引物各1 μL,共21 μL。反应产物1.5%琼脂糖凝胶和溴化乙啶染色,凝胶成像,测定mRNA表达。
1.2.7 蛋白质免疫印迹(Western blot)检测细胞内akt、p-akt、和eNOS蛋白表达各组细胞培养7 d后,取细胞液细胞裂解,11 269×g离心10 min,取上清液,BCA法定量蛋白质,取30 μg蛋白上样沸煮、电泳、PVDF膜转印,加入兔抗人akt、p-akt、eNOS、GAPDH一抗、羊抗兔HRP标记二抗,Western blot法测定akt、p-akt、eNOS蛋白表达,以GAPDH为内参,测定灰度值,计算灰度系数比,实验操作均根据实验试剂盒说明书执行。
1.3 统计学分析采用SPSS 19.0统计软件,多组计量资料分析选择单因素方差分析,组间比较采用SNK-q检验,不同时间检测使用重复测量的方差分析,组间比较采取配对t检验或独立t检验。
2 结果 2.1 Targetscan预测以ETS1为靶基因的miR进入http://www.targetscan.org/,点击“Submit”,ETS1的3′-UTR内包含miR-23b-3p的2~8nt“种子序列”的互补结合位点,见图 1,说明ETS1可能是miR-23b-3p靶基因。

|
| ∣:ETS1 mRNA 3′-UTR与miR-23b-3p的互补位点;↓:示ETS1 mRNA 3′-UTR突变位点 图 1 Targetscan预测以ETS1为靶基因的miR |
2.2 pmirGLO-ETS1 3′-UTR质粒及突变质粒构建结果
ETS1 mRNA的3′-UTR内有miR-23b-3p的2~8 nt“种子序列”互补结合位点,通过PCR扩增这些位点和克隆插入pmirGLO质粒,后将ETS1 mRNA的3′-UTR内miR-23a/b种子序列结合位点相关5个碱基作定点突变,同法构建mRNA 3′-UTR野生型质粒和突变型质粒,后均通过SacⅠ和XbaⅠ双酶切鉴定生成306 bp片段,经DNA序列测定,可得插入序列和预计ETS1基因3′-UTR序列、定点突变序列相符(图 2),证明成功构建质粒。
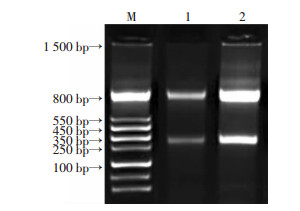
|
| M:标准;1:pmirGLO-ETS1 3′-UTR质粒;2:pmirGLO-ETS1 3′-UTR突变质粒(mut) 图 2 RT-PCR测定pmirGLO-ETS1 3′-UTR质粒及突变质粒构建 |
2.3 双荧光素酶报告基因实验验证结果
双荧光素酶报告系统检测各组细胞荧光素酶活性显示,pmirGLO-ETS1 3′-UTR+miR-23b-3p minics转染细胞荧光素酶活性低于pmirGLO-ETS1 3′-UTR+miR-23b-3p inhibitor转染(P < 0.01,图 3),pmirGLO-ETS1 3′-UTR mut+miR-23b-3p minics转染细胞荧光素酶活性和pmirGLO-ETS1 3′-UTR+miR-23b-3p inhibitor无明显区别,表明miR-23b-3p能够和ETS1 3′-UTR直接结合,可得ETS1是miR-23b-3p直接靶基因。
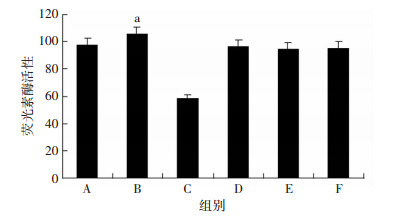
|
| A:pmirGLO-ETS1 3′-UTR转染组;B:miR-23b-3p inhibitor+pmirGLO-ETS1 3′-UTR转染组;C:miR-23b-3p minics+pmirGLO-ETS1 3′-UTR转染组;D:pmirGLO-ETS1 3′-UTR mut转染组;E:miR-23b-3p minics+pmirGLO-ETS1 3′-UTR mut转染组;F:miR-23b-3p inhibitor +pmirGLO-ETS1 3′-UTR mut转染组a:P < 0.01,与C组比较 图 3 双荧光素酶报告实验测定各组细胞荧光素酶活性(n=6,x±s) |
2.4 各组HCAECs细胞存活率
实验组HCAECs细胞存活率(66.22±5.17)%、阴性对照组HCAECs细胞存活率(42.12±2.35)%、对照组HCAECs细胞存活率(38.36±2.21)%均低于正常HCAECs细胞存活率(85.22±7.87)%(P < 0.01),说明hcy可损伤正常HCAECs,减少HCAECs存活。实验组、阴性对照组、对照组HCAECs细胞存活率比较差异具有统计学意义(F=54.53,P < 0.01),实验组HCAECs细胞存活率显著高于阴性对照组和对照组细胞(P < 0.01,图 4)。
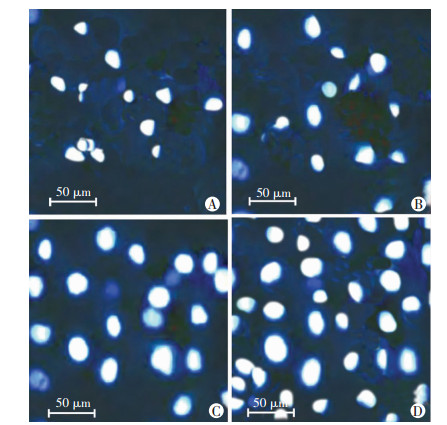
|
| A:对照组;B:阴性对照组;C:实验组;D:正常对照组 图 4 荧光显微镜观察各组HCAECs细胞存活率 |
2.5 各组HCAECs细胞miR-23b-3p和Apo(a) mRNA表达
转染后,实验组miR-23b-3p mRNA(82.34±3.86)%表达显著高于阴性对照组(44.21±3.72)%和对照组(42.18±3.64)%(P < 0.01),实验组Apo(a) mRNA表达(30.82±3.59)%显著低于阴性对照组(102.52± 4.02)%和对照组(99.51±3.94)%(P < 0.01),阴性对照组和对照组miR-23b-3p和Apo(a) mRNA均无明显差异(P > 0.05,图 5)。

|
| M:标准;1:对照组;2:阴性对照组;3:实验组A:HCAECs细胞miR-23b-3p mRNA;B:HCAECs细胞Apo(a) mRNA 图 5 RT-PCR测定各组HCAECs细胞miR-23b-3p和Apo(a) mRNA表达 |
2.6 各组细胞akt、p-akt和eNOS蛋白表达
转染后,实验组p-akt表达和eNOS蛋白相对表达显著高于阴性对照组和对照组(P < 0.01),阴性对照组和对照组p-akt表达和eNOS蛋白相对表达均无明显差异(P > 0.05,图 6)。
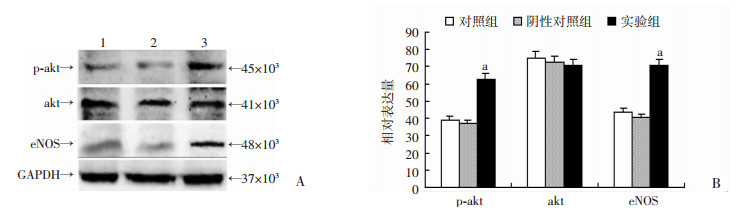
|
| A:akt、p-akt和eNOS蛋白表达蛋白质免疫印迹检测 1:对照组;2:阴性对照组;3:实验组;B:各组HCAECs细胞akt、p-akt和eNOS蛋白表达(n=6,x±s) a:P<0.01,与对照组和阴性对照组比较 图 6 蛋白质免疫印迹检测HCAECs细胞akt、p-akt、eNOS蛋白的表达 |
3 讨论
文献[7]报道,hcy是诱发冠状动脉粥样的独立危险因素之一,可直接引起血管壁炎症、血管内皮细胞损伤、血栓和血管平滑肌增生等病理性改变,诱发血管内皮细胞氧化,引起血液及机体内活性氧含量增加,氧化低密度脂蛋白使其具备细胞毒性,毒化、破坏动脉血管内皮细胞内纤维肌动蛋白,从而提升内皮细胞通透性,导致大量黏附因子穿透进入动脉血皮细胞内,恶化内皮细胞损伤,加重As[8]。本研究结果显示,hcy诱导后的HCAECs细胞存活率(38.36±2.21)%显著低于正常HCAECs细胞存活率(85.22±7.87)%(P < 0.01),说明hcy可损伤正常HCAECs,减少HCAECs存活。由此可见,通过研究可抑制hcy对冠状动脉血管内皮细胞的间接毒理作用的机制,对有效治疗As具有显著的临床指导意义。
资料显示,LDL-C血症患者Lp(a)表达越高,其早发性冠心病的发病率越高,高Lp(a)患者在未诊出As斑块时,其乙酰胆碱舒张反应呈现下降趋势,而As斑块内检出高Lp(a)表达时,容易破裂,且破裂斑块伴有泡沫细胞[9]。ZENG等[10]和PENÇE等[11]研究报道,Lp(a)还参与冠状动脉血栓形成、动脉内皮血管壁泡沫细胞形成和致炎进程,直接损伤血管内皮细胞和内皮祖细胞。ZHAN等[12]研究也证明,Lp(a)和小颗粒Apo(a)高表达与管状动脉血管疾病发病率具有显著相关性,Apo(a)颗粒越小,血管疾病发病率越高。因此,部分研究者通过降低Apo(a)表达,阻断其转录为Lp(a),并通过反义寡核苷酸抑制Apo B100 mRNA,显著降低血清Lp(a)表达,证明阻断Lp(a)基因启动子上游DNA内区段与特质基因结合,可显著影响Apo(a)转录成Lp(a),由此推断通过抑制Apo(a)表达可在一定程度上缓解As进程[1, 13]。
文献[14]报道反义核苷酸可抑制Apo(a)表达,而miR对基因表达的调控原理与反义核苷酸接近,其通过结合到靶基因的3′-UTR、5′-UTR或蛋白编码区促进或抑制靶基因表达,但其调控能力远大于反义核苷酸。相关资料也表明[15-16],miRs可通过HNF4家族基因、PKCα基因等靶基因间接调控Apo(a)表达转录。本文通过生物学信息筛查检出miR-23b-3p作用于靶基因ETS1时,能够显著调控Apo(a)表达,同时双荧光素酶报告基因实验结果显示,miR-23b-3p能够和ETS1 3′-UTR直接结合,证实ETS1是miR-23b-3p调控Apo(a)的直接靶基因。本研究以含有ETS1 mRNA的3′-UTR内的miR-23b-3p的“种子序列”为互补结合位点,与pmirGLO质粒结合成功构建pmirGLO-ETS1 3′-UTR和pmirGLO-ETS1 3′-UTR mut质粒,转染实验组管状动脉血管内皮细胞后,其miR-23b-3p mRNA表达显著高于阴性对照组和对照组(P < 0.01),Apo(a) mRNA表达显著低于阴性对照组和对照组(P < 0.01),提示经过miR-23b-3p抑制调控后,能够降低hcy诱导作用下血管内皮细胞内Apo(a)表达,这可能因为特定基因信号可与Apo(a)基因启动子上的DR-1位点结合,加快其基因转录,而ETS1靶向构建的miR-23b-3p下游靶基因SHR被激活后,能够竞争性结合这些特定基因信号启动子域内结合位点,降低其表达,从而抑制Apo(a)基因转录[17]。由于Apo(a)表达与As发生及发展存在相关性,同时结果也显示,实验组HCAECs细胞存活率显著高于阴性对照组和对照组细胞(P < 0.01),由此推断miR-23b-3p通过抑制Apo(a)表达,能提升HCAECs细胞存活率,可能缓解As进程。
研究发现[18],akt/eNOS信号通路由多个信号分子组成,其中akt是该通路的中心信号分子,也是其发挥调控作用的主要靶酶。akt经磷酸化生成p-akt,能够调控细胞凋亡及细胞内蛋白合成等。NOS包括结构型和诱导型,前者为eNOS和nNOS,后者为iNOS。研究显示[19],eNOS处于应激状态时,能够缓解或抑制冠状动脉等血管痉挛,降低炎性因子侵入血管内皮细胞,缓解动脉粥样硬化,eNOS还可在Ca2+和钙调蛋白作用下,激活机体内的L-精氨酸合成内源性一氧化氮(NO),NO能够扩张血管、抗凝,阻断或抑制血小板聚集。周涛龙[20]研究证明,微小RNA能够激活akt磷酸化过程,调高p-akt蛋白表达,增加eNOS活性,加快细胞释放NO,从而显著抑制血管内皮细胞损伤。本研究结果显示,实验组p-akt表达和eNOS蛋白相对表达显著高于阴性对照组和对照组(P < 0.01),这表明miR-23b-3p通过靶向下调hcy诱导损伤的内皮细胞中Apo(a)表达,降低Apo(a)对血凝素样ox-LDL受体(LOX-1)及其配体JAG1的抑制作用[21],而LOX-1/JAG1信号通路能够调节下游基因血管生成因子(VEGF),增加内皮细胞p-akt蛋白和eNOS蛋白表达[22],可能是miR-23b-3p降低hcy对内皮细胞间接毒性损伤的机制之一,从而缓解As进程。
综上所述,miR-23b-3p能够以ETS1为靶基因,可能通过akt/eNOS信号通路下调hcy诱导损伤的内皮细胞中Apo(a)表达,从而保护冠状动脉血管内皮细胞。但本研究未对miR-23b-3p调控Apo(a)保护hcy诱导内皮细胞损伤是否存在时间和剂量依赖进行更深层次的探讨,存在不足,需要进一步研究以完善。
| [1] | GRIECO F A, SEBASTIANI G, JUAN-MATEU J, et al. MicroRNAs miR-23a-3p, miR-23b-3p, and miR-149-5p regulate the expression of proapoptotic BH3-only proteins DP5 and PUMA in human pancreatic β-cells[J]. Diabetes, 2017, 66(1): 100–112. DOI:10.2337/db16-0592 |
| [2] |
仓沈元. 血清同型半胱氨酸、脂蛋白(a)与冠心病的相关性研究[J].
国际检验医学杂志, 2017, 38(3): 389–391.
CANG S Y. Correlation between serum homocysteine, lipoprotein (a) and coronary heart disease[J]. Int J Lab Med, 2017, 38(3): 389–391. DOI:10.3969/j.issn.1673-4130.2017.03.041 |
| [3] |
郑冠群, 盛晓东, 周建龙, 等. 高敏C反应蛋白、同型半胱氨酸、白细胞介素2和脂蛋白相关磷脂酶A2与冠心病的相关性研究[J].
中国心血管杂志, 2016, 21(3): 50–54.
ZHENG G Q, SHENG X D, ZHOU J L, et al. Correlation study among high-sensitivity C-reactive protein, homocysteine, interleukin-2, ipoproteinassociated phospholipase A2 and coronary heart disease[J]. Chin J Cardiovasc Med, 2016, 21(3): 50–54. DOI:10.3969/j.issn.1007-5410.2016.03.010 |
| [4] |
童海, 雷建军, 莫学靓, 等. miR-23b-3p对肝核因子4的靶基因及效用分析[J].
湘南学院学报(医学版), 2015, 2(1): 1–4.
TONG H, LEI J J, MO X L, et al. Target gene and effect analysis of miR-23b-3p on hepatocyte nuclear factor 4[J]. J Xiangnan Univ (Med Sci), 2015, 2(1): 1–4. DOI:10.16500/j.cnki.1673-498x.2015.01.001 |
| [5] | LIU X, EDINGER R S, KLEMENS C A, et al. A microRNA cluster miR-23-24-27 is upregulated by aldosterone in the distal kidney nephron where it alters sodium transport[J]. J Cell Physiol, 2017, 232(6): 1306–1317. DOI:10.1002/jcp.25599 |
| [6] | KAROLAK A M, VAN DER VAART A. Importance of local interactions for the stability of inhibitory helix 1 of Ets-1 in the apo state[J]. Biophys J, 2012, 102(3): 447. DOI:10.1016/j.bpj.2011.11.2449 |
| [7] |
李理, 汤哲, 孙菲, 等. 北京地区老年人高同型半胱氨酸血症(Hhcy)与动脉硬化疾病关系的调查研究[J].
北京医学, 2016, 38(10): 980–983.
LI L, TANG Z, SUN F, et al. Investigation of the relationship between Hyperhomocysteinemia(Hhcy) and arteriosclerotic-related diseases of Beijing elderly[J]. Beijing Med, 2016, 38(10): 980–983. DOI:10.15932/j.0253-9713.2016.10.004 |
| [8] |
林小龙, 何兴兰, 王佐. 脂蛋白(a)合成的调节[J].
中国生物化学与分子生物学报, 2014, 2(1): 23–29.
LI X L, HE X L, WANG Z. The regulation of synthesis of lipoprotein (a)[J]. Chin J Biochem Mol Biol, 2014, 2(1): 23–29. DOI:10.13865/j.cnki.cjbmb.2014.01.013 |
| [9] |
段厚全, 王鹤. LDL-C、LP-a与Hcy联合检测在冠心病诊治中的应用[J].
海南医学, 2015, 26(10): 1463–1465.
DUAN H Q, WANG H. Application of joint detection of serum LDL-C, LP-a and hcy in the diagnosis and treatment of coronary heart disease[J]. Hainan Med, 2015, 26(10): 1463–1465. DOI:10.3969/j.issn.1003-6350.2015.10.0521 |
| [10] | ZENG J F, ZENG Z L, ZHANG K, et al. miR-23b-3p and miR-125b-5p downregulate apo(a) expression by targeting Ets1 in HepG2 cells[J]. Cell Biol Int, 2018, 42(3): 313–323. DOI:10.1002/cbin.10896 |
| [11] | PENÇE S, ÖZBEK E, OZAN T N, et al. Deregulation of seven CpG island-harboring miRNAs in bladder cancer: miR-155 and miR-23b as the most promising oncomiRs[J]. Cell Mol Biol, 2016, 62(3): 25. |
| [12] | ZHAN L, YAN Y, FU H, et al. Protective role of miR-23b-3p in kainic acid-induced seizure[J]. Neuroreport, 2016, 27(10): 764–768. DOI:10.1097/WNR.0000000000000610 |
| [13] | CHO J H, LEE D Y, LEE E S, et al. Increased risk of coronary artery calcification progression in subjects with high baseline Lp(a) levels: The Kangbuk Samsung Health Study[J]. Int J Cardiol, 2016, 222(9): 233–237. DOI:10.1016/j.ijcard.2016.07.219 |
| [14] |
田永凤, 莫学靓, 雷建军, 等. 胆酸通过上调miR-23b-3p抑制载脂蛋白A表达[J].
中国动脉硬化杂志, 2016, 24(8): 769–773.
TIAN Y F, MO X L, LEI J J, et al. Bile acid inhibits apolipoprotein A expression in HepG2 cells by up-regulation of miR-23b-3p[J]. Chin J Arterioscler, 2016, 24(8): 769–773. |
| [15] |
何兴兰. H2S通过PKCα/FXR及AKT/HNF4α信号途径抑制HepG2细胞apo(a)表达[D].衡阳: 南华大学, 2015.
HE X L. H2S inhibits apo (a) expression in HepG2 cells through PKC alpha /FXR and AKT/HNF4 alpha signaling pathways[D]. Hengyang: Nanhua University, 2015. |
| [16] | LI Y, ZALZALA M, JADHAV K, et al. Carboxylesterase 2 prevents liver steatosis by modulating lipolysis, ER stress and lipogenesis and is regulated by HNF4α[J]. Hepatology, 2016, 63(6): 1860–1874. DOI:10.1002/hep.28472 |
| [17] |
赵岳. miR-23b-3p和miR-125b-5p通过Ets1下调HepG2细胞内apo(a)的研究[D].衡阳: 南华大学, 2014.
ZHAO Y. MiR-23b-3p and miR-125b-5p downregulateapo (a) in HepG2 cells by Ets1[D]. Hengyang: Nanhua University, 2014. |
| [18] |
令狐克刚, 曾玉, 张彦燕, 等. 基于p-Akt/eNOS信号的阿司匹林对ox-LDL诱导的人主动脉内皮细胞损伤的保护作用[J].
贵阳医学院学报, 2015, 40(8): 785–788.
LINGHU K G, ZENG Y, ZHANG Y Y, et al. Protective effects of p-Akt/eNOS based aspirin on ox-LDL induced human aortic endothelial cells injury[J]. J Guizhou Med Coll, 2015, 40(8): 785–788. |
| [19] |
郭敏, 李世平, 张彤哲, 等. 缬沙坦通过PI3K/Akt/eNOS通路保护2型糖尿病大鼠主动脉内皮细胞免受氧化损伤的研究[J].
中国医药导报, 2016, 13(19): 18–21.
GUO M, LI S P, ZHANG T Z, et al. Study on the protective effect of Valsartan against oxidative injury of aortic endothelial cells in rats with type 2 diabetes via PI3K/Akt/eNOS pathway[J]. China Medical Herald, 2016, 13(19): 18–21. |
| [20] |
周涛龙.微小RNA-429/455-3p通过VEGFR对血管内皮细胞生物学行为的影响[D].广州: 暨南大学, 2016.
ZHOU T L. Effect of micro RNA-429/455-3p on biological behavior of vascular endothelial cells through VEGFR[D]. Guangzhou: Jinan University, 2016. |
| [21] |
翟仰魁.红景天苷对体外高糖缺氧环境下大鼠心肌微血管内皮细胞Flk-1/Akt/eNOS信号通路等影响的研究[D].北京: 北京协和医学院, 2013.
ZHAI Y K.Effects of salidroside on Flk-1/Akt/eNOS signaling pathway in rat myocardial microvascular endothelial cells under high glucose and hypoxia in vitro[D]. Beijing: Peiking Union Medical College, 2013. |
| [22] | REN K, LI T, ZHANG W, et al. miR-199a-3p inhibits cell proliferation and induces apoptosis by targeting YAP1, suppressing Jagged1-Notch signaling in human hepatocellular carcinoma[J]. J Biomed Sci, 2016, 23(1): 79. DOI:10.1186/s12929-016-0295-7 |



