2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院急诊科
2. Department of Emergency Medicine, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
骨关节炎(osteoarthritis,OA)是一种以软骨损伤、继发性骨质增生为特征的慢性退行性疾病,其主要症状为关节疼痛、僵硬和关节功能受限[1]。不仅影响患者生活质量,同时也是世界上重要的致残因素之一[2]。OA的危险因素包括炎症、代谢综合征、关节负荷和关节损伤、职业因素、遗传因素等[1]。目前糖尿病作为OA的危险因素已被广泛认可[3-5]。研究表明高血糖会导致软骨的代谢异常及软骨丢失[4]。越来越多的研究认为1型糖尿病(type 1 diabetes mellitus, T1DM)会加重OA的发生、发展[6]。与非T1DM人群相比,T1DM人群罹患OA的风险更高,二者具有明确的相关性[7]。OA进展周期长,目前治疗方法还十分有限,而针对合并T1DM的OA,胰岛素治疗对于延缓OA进展并无明显作用[8]。目前,针对重组人甲状旁腺素(parathyroid hormone, PTH1-34)用于治疗OA的研究不断增多,认为其能抑制小鼠OA模型的关节软骨中的蛋白多糖丢失[9-10],同时能维持Col-Ⅱ纤维走行结构[9, 11],但PTH1-34作用于T1DM性OA的研究尚少见报道。本研究拟通过T1DM小鼠OA模型,观察T1DM和PTH在OA发生早期产生的影响及作用,以期为OA早期干预的治疗途径和方法提供线索。
1 材料与方法 1.1 实验动物优选SPF级12周龄雄性C57BL/6J小鼠24只,体质量(18±2)g,采购自陆军军医大学第三附属医院实验动物中心,动物批准号:SCXK(渝)2012-0001。实验动物采用完全随机分组法分为3组(各8只):野生小鼠组、T1DM小鼠组(T1DM组)、T1DM小鼠PTH1-34干预组(T1DM+PTH组),其中野生小鼠组又分为2个亚组:小鼠右下肢OA建模设为WT组,左下肢不建模作为自身对照,设为对照组。适应性饲养1周后开始实验。
1.2 主要仪器及试剂显微手术器械、15°斜切刀及穿刺刀购自中国爱尔医疗器械厂,石蜡切片机购自德国Leica公司,Micro-CT购自瑞士Scanco viva40公司,倒置显微镜购自日本Olympus公司,苏木精、伊红购自上海生工,固绿、番红、链脲佐菌素(streptozotocin,STZ)、PTH1-34购自美国Sigma公司。
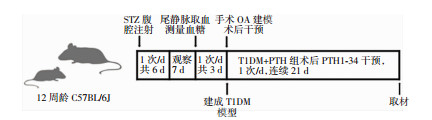
1.3 小鼠模型的建立首先完成T1DM模型建立,T1DM组及T1DM+PTH组腹腔注射STZ溶液6 d,间隔1周,连续3 d测量空腹血糖均符合标准的小鼠纳入下一步实验。3组小鼠同时进行右下肢OA建模。OA建模后T1DM+PTH组小鼠连续腹腔注射PTH1-34溶液21 d后统一取材(图 1)。具体方法:小鼠禁食(自由饮水)14 h,T1DM组和T1DM+TPH组小鼠腹腔注射1% STZ溶液4.5 μL/g,WT组小鼠腹腔注射生理盐水4.5 μL/g,完成后正常喂食,每日1次,连续6 d,建模完成1周后测小鼠空腹血糖[12-13]。确认T1DM造模成功后采用手术诱导不稳定的内侧半月板(destabilization of the medial meniscus,DMM)手术[14]合并部分内侧半月板切除构建小鼠膝关节OA模型[15]。此手术效果稳定,关节失稳明确,最快1周即可出现关节损伤[16]。小鼠麻醉后仰卧位固定,术区消毒,右下肢膝关节(OA造模关节)内侧纵向剪开皮肤约1 cm,暴露术区视野。髌骨及韧带翻向外侧,用15°斜切刀挑断内侧半月板胫骨韧带,穿刺刀切除内侧部分半月板,清洗后缝合组织与皮肤,术中注意避免损伤关节软骨。对照组为野生小鼠自身左侧膝关节,仅切开皮肤及肌肉,不离断韧带及半月板,术后小鼠笼内自由活动。T1DM+PTH组小鼠术后每日1次腹腔注射0.001% PTH1-34溶液10 μL/g,连续3周[11],其他小鼠每日腹腔注射等量生理盐水。小鼠建模评价:小鼠空腹血糖连续3 d超过250 mg/dL认为T1DM模型成功建立[12]。OA建模完成后,番红O-固绿染色发现OA样改变视为OA建模成功[17]。
|
| 图 1 动物建模及干预流程图 |
1.4 Micro-CT扫描
1.3中造模及干预满3周后小鼠过量麻醉处死,取双下肢膝关节置于4%多聚甲醛4 ℃固定24 h后剔除周围软组织,进行离体Micro-CT扫描。骨组织标本模具固定于扫描台上,采用瑞士Scanco viva40 Micro-CT进行扫描,描取关节上下软骨下骨全层进行重建,阈值采用210[18]。
1.5 组织学处理1.4中标本完成扫描后取0.01 mol/L PBS漂洗后用15% EDTA(pH 7.2~7.4)室温下摇床脱钙1周,时间过久会导致软骨蛋白多糖丢失过多[19]。常规梯度酒精脱水,石蜡包埋,避开交叉韧带部分矢状面4 μm制备石蜡切片。
1.6 HE染色挑选1.5中5张切片,60 ℃烘片2 h后常规脱蜡和梯度酒精水化后,用苏木精液染色3 min,自来水漂洗后1%盐酸酒精分化10 s。自来水漂洗15 min后0.5%伊红液染色1 min,蒸馏水洗10 s后常规梯度酒精脱水、二甲苯透明、中性树胶封片。
1.7 番红O-固绿染色间隔80 μm挑选1.5中15张切片,60 ℃烘片2 h后常规脱蜡和梯度酒精水化后,0.02%固绿5 min(不冲洗),1%乙酸30 s(不冲洗),0.1%番红O 20 min(不冲洗),常规梯度酒精脱水、二甲苯透明、中性树胶封片。
1.8 人工关节炎组织病理学评分收集1.7中各组小鼠OA关节组织染色切片,倒置显微镜100倍视野下采用国际骨关节炎学会(OARSI)推荐的组织病理学评分方法对小鼠关节炎样改变进行评分,全部15张切片评分相加为总分。所有切片观察经4名病理科医师独立在光镜下完成,并在1周后进行重复,再经3名初次接触评分方法的实验员评估评分的可重复性[17]。
1.9 统计学分析采用SPSS 23.0统计软件,计量资料以x±s表示,数据分析使用单因素方差分析,两两比较进行方差齐性检验,方差齐使用最小显著性差异法(LSD),方差不齐使用Tamhane’s T2检验。P < 0.05表示差异有统计学意义。
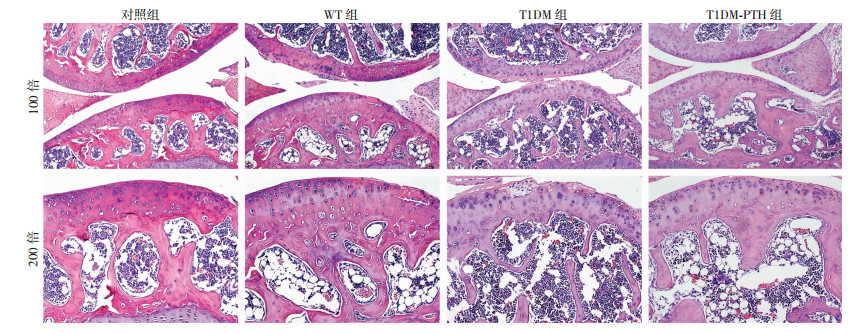
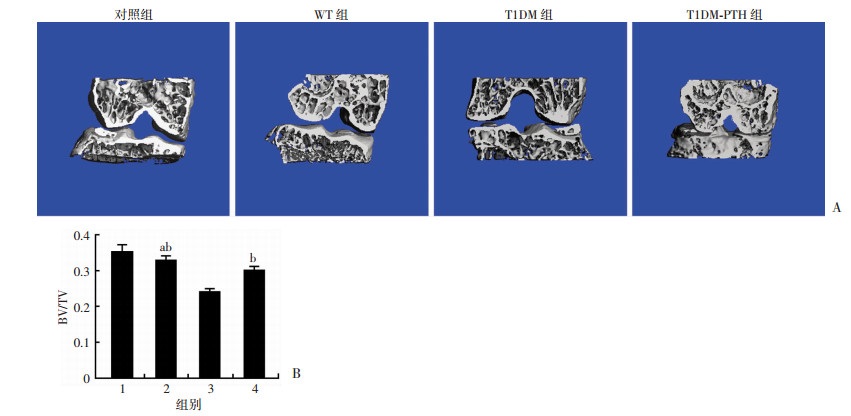
2 结果 2.1 T1DM小鼠OA早期软骨下骨改变及T1DM对OA进展的影响T1DM建模后小鼠多饮、多食、多尿明显,OA建模后小鼠活动良好。实验期间偶有小鼠死亡及血糖不达标小鼠,重新选择小鼠按完整建模流程建模补充。HE染色可以观察到除对照组关节,其余组别手术关节均形成OA样改变。T1DM组小鼠OA关节面破坏明显,软骨细胞排列紊乱,聚集较多,软骨损伤明显,软骨下骨小梁结构减少、纤细、排列紊乱(图 2)。Micro-CT重建三维剖面图可见,WT组小鼠OA关节软骨下骨小梁较对照组关节减少,T1DM小鼠OA关节软骨下骨小梁较WT组OA关节进一步减少,并出现结构紊乱。CT结果显示,各组软骨下骨BV/TV差异有统计学意义(F=93.005, P < 0.01), 两两比较差异均有统计学意义(P < 0.05)。在OA发生3周,WT组小鼠OA关节软骨下骨BV/TV较对照组关节下降,T1DM组小鼠OA关节下降更为明显(图 3)。Micro-CT扫描软骨下Tb.N和Tb.Th提示:各组软骨下骨Tb.N和Tb.Th差异有统计学意义(F=56.081/25.579, P < 0.01), 两两比较差异均有统计学意义(P < 0.05)。表明OA发生早期T1DM会明显降低关节软骨下骨小梁数量并导致其微结构损伤(表 1)。
|
| A: NC组;B:LV3-1组;C:LV3-2组 图 2 HE染色观察各组小鼠骨关节软骨细胞及软骨下骨改变 |
|
| A:各组小鼠关节Micro-CT三维重建图;B:各组小鼠关节软骨下骨BV/TV分析 1:对照组;2: WT组;3:T1DM组;4:T1DM-PTH组;a:P < 0.05, 与对照组比较; b:P < 0.05, 与T1DM组比较 图 3 Micro-CT三维重建观察及分析各组小鼠关节软骨下骨BV/TV改变 |
| 指标 | Tb.N | Tb.Th |
| 对照组 | 4.33±0.15 | 0.083±0.001 |
| WT组 | 3.90±0.13a | 0.076±0.003a |
| T1DM组 | 3.11±0.13b | 0.068±0.002b |
| T1DM+PTH组 | 3.58±0.11c | 0.074±0.002c |
| a:P < 0.05,与对照组比较;b:P < 0.05,与WT组比较;c:P < 0.05,与T1DM组比较 | ||
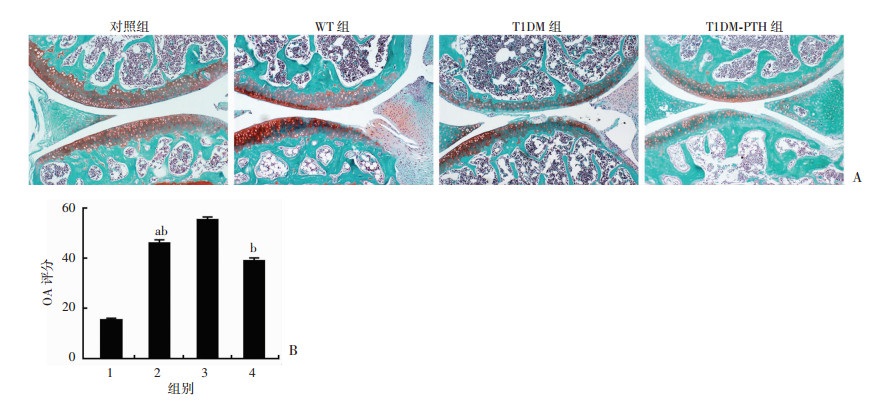
关节软骨组织番红O-固绿染色可发现:软骨基质呈红色,WT组OA关节面软骨浅层损伤,基质较丰厚,出现部分蛋白多糖丢失;T1DM组OA关节软骨已出现基质丢失,缺损部位深及钙化软骨层,关节面损伤范围较大,软骨下骨小梁结构疏松紊乱。组织病理学评分显示:各组评分差异有统计学意义(F=983.219, P < 0.01), 两两比较差异均有统计学意义(P < 0.05)。3组建模关节均出现关节损伤、OA样改变,T1DM组OA关节最为严重(图 4)。
|
| A:番红O-固绿染色观察各组小鼠关节改变;B:各组小鼠关节组织病理学评分 1:对照组;2:WT组;3:T1DM组;4:T1DM-PTH组;а:P < 0.05,与对照组比较;b: P < 0.05, 与T1DM组比较 图 4 番红O-固绿染色观察各组小鼠关节改变及组织病理学评分 |
2.2 PTH1-34对T1DM小鼠OA早期软骨下骨及关节软骨的保护作用
PTH1-34经腹腔注射给药,给药后小鼠状态良好。HE染色显示,T1DM+PTH1-34组小鼠OA关节软骨较为完整,软骨细胞排列相对整齐,潮线较为清晰,较T1DM组OA关节整体改善明显;软骨下骨小梁结构较T1DM组OA关节数量增多,厚度增厚(图 2)。Micro-CT扫描三维剖面图可见,T1DM+PTH1-34组小鼠OA关节软骨下骨小梁数量较T1DM组OA关节改善明显,排列顺序相对整齐。CT数据分析显示,T1DM+PTH1-34组小鼠OA关节软骨下骨BV/TV较T1DM组OA关节明显升高(图 3)。应用PTH1-34干预后T1DM小鼠OA关节软骨下骨Tb.N及Tb.Th明显改善(表 1)。提示PTH1-34能够增加T1DM性OA关节软骨下骨骨小梁数量并改善其微结构损伤。番红O-固绿染色及评分显示,T1DM+PTH1-34组小鼠OA关节面基本完整,仅局限出现软骨浅层损伤,少量蛋白多糖丢失,软骨下骨小梁增多增厚。T1DM同期PTH1-34干预后关节组织病理学评分明显降低(图 4)。
3 讨论随着世界人口日趋老龄化,OA的发病率愈来愈高,症状性患者平均年龄越来越低,给社会带来了巨大的经济和卫生负担[1]。OA的发病机制至今尚未研究透彻,高脂、高糖等代谢因素作为OA的危险因素也被更多的学者接受[3, 6]。目前,体外细胞培养研究发现外源性PTH1-34能够维持软骨细胞状态,抑制其凋亡[10]。因此,PTH1-34用于治疗OA的研究逐渐成为热点。
本研究构建T1DM小鼠模型,在T1DM小鼠上利用手术诱导OA模型,同期设立PTH1-34干预组。HE及番红O-固绿染色、组织病理学评分结果显示T1DM会促进小鼠OA早期进展,PTH1-34干预后可以延缓T1DM性OA的早期进展,起到明显保护作用。Micro-CT及HE染色结果表明,在OA发生早期,软骨下骨以骨量丢失为主要改变,T1DM促进OA的早期软骨下骨丢失,加重软骨下骨的结构损伤。PTH1-34改善T1DM小鼠OA早期软骨损伤及软骨下骨的破坏。此外,Micro-CT结果及组织病理学评分还提示,不仅软骨下骨量丢失,骨小梁的微结构损伤也与关节炎的进展加重程度一致,这和相关研究提出的关节软骨作为无血管组织,软骨营养及稳态维持依赖于关节软骨及软骨下骨之间的相互作用的观点是类似的[20]。一直以来关于PTH1-34对于OA的机制研究集中在关节软骨蛋白多糖、软骨细胞肥大凋亡等方面,忽略了OA的病变是骨及关节的整体改变。本研究结果显示,T1DM小鼠OA早期进展程度和软骨下骨改变趋势一致。虽然已有研究提示高糖环境通过炎症因子造成关节软骨破坏[21],但本研究T1DM的影响限定于OA发生早期,离体研究中单纯高糖的体内微环境尚不足以导致足够程度的软骨破坏[22]。这提示我们应该重新认识T1DM导致的软骨下骨骨量丢失对OA早期进展的重要性。这也和骨质疏松性OA研究中发现软骨下骨的微结构损伤及重构不利于软骨稳态维持的观点[20]一致。PTH1-34能够明显改善软骨下骨骨量及微结构,延缓T1DM小鼠OA早期进展速度。而ORTH等[23]在兔OA模型研究中发现,PTH1-34诱导的正常软骨下骨微结构改变可能引发早期OA的发生,长期使用可能诱导骨肉瘤的发生。
综上所述,T1DM会加速OA进展,且可能是通过软骨下骨改变引起,PTH1-34也可能通过恢复软骨下骨的稳态维持关节软骨稳态,从而延缓T1DM小鼠早期OA的进展。本研究未就PTH1-34对T1DM性OA的作用位点及机制进行探讨,对PTH1-34应用于OA晚期的干预未做观察。因此,对于临床应用PTH1-34治疗OA应持谨慎态度,尚需要进行进一步的机制研究和安全性观察。
| [1] | VINA E R, KWOH C K. Epidemiology of osteoarthritis: lite- rature update[J]. Curr Opin Rheumatol, 2018, 30(2): 160–167. DOI:10.1097/BOR.0000000000000479 |
| [2] | PALAZZO C, NGUYEN C, LEFEVRE-COLAU M M, et al. Risk factors and burden of osteoarthritis[J]. Ann Phys Rehabil Med, 2016, 59(3): 134–138. DOI:10.1016/j.rehab.2016.01.006 |
| [3] | SCHWARZ S, MROSEWSKI I, SILAWAL S, et al. The interrelation of osteoarthritis and diabetes mellitus: considering the potential role of interleukin-10 and in vitro models for further analysis[J]. Inflamm Res, 2018, 67(4): 285–300. DOI:10.1007/s00011-017-1121-8 |
| [4] |
王飞, 薛庆云. 代谢综合征与骨关节炎发生、发展相关性的研究进展[J].
中华骨科杂志, 2016, 36(4): 248–256.
WANG F, XUE Q Y. Research progress on the relationship between metabolic syndrome and the occurrence and development of osteoarthritis[J]. Chin J Orthop, 2016, 36(4): 248–256. DOI:10.3760/cma.j.issn.0253-2352.2016.04.009 |
| [5] |
王华军, 查振刚. 糖尿病对骨关节炎影响的研究进展[J].
暨南大学学报(自然科学与医学版), 2016, 37(1): 1–6.
WANG H J, ZHA Z G. The research progress in the adverse effects of diabetes on osteoarthritis[J]. J Jinan Univ (Nat Sci Med Ed), 2016, 37(1): 1–6. |
| [6] | LOUATI K, VIDAL C, BERENBAUM F, et al. Association between diabetes mellitus and osteoarthritis: systematic literature review and meta-analysis[J]. RMD Open, 2015, 1(1): e000077. DOI:10.1136/rmdopen-2015-000077 |
| [7] |
王华军, 陈均源, 罗斯敏, 等. 糖尿病与骨关节炎相关性的Meta分析[J].
中国矫形外科杂志, 2017, 25(11): 994–998.
WANG H J, CHEN J Y, LUO S M, et al. Correlation between diabetes and osteoarthritis:a meta-analysis[J]. Orthopedic J China, 2017, 25(11): 994–998. |
| [8] | NIEVES-PLAZA M, CASTRO-SANTANA L E, FONT Y M, et al. Association of hand or knee osteoarthritis with diabetes mellitus in a population of Hispanics from Puerto Rico[J]. J Clin Rheumatol, 2013, 19(1): 1–6. DOI:10.1097/RHU.0b013e31827cd578 |
| [9] |
邵李涛, 戴慕巍, 刘光源, 等. 甲状旁腺激素1-34对骨关节炎患者关节软骨及软骨下骨的作用研究进展[J].
临床合理用药杂志, 2017, 10(18): 175–176.
SHAO L T, DAI M W, LIU G Y, et al. Research progress on effects of parathyroid hormone 1-34 on articular cartilage and subchondral bone in osteoarthritis patients[J]. Chin J Clin Ration Drug Use, 2017, 10(18): 175–176. |
| [10] | CHEN C H, HO M L, CHANG L H, et al. Parathyroid hormone-(1-34) ameliorated knee osteoarthritis in rats via autophagy[J]. J Appl Physiol, 2018, 124(5): 1177–1185. DOI:10.1152/japplphysiol.00871.2017 |
| [11] | MORITA Y, ITO H, ISHIKAWA M, et al. Subchondral bone fragility with meniscal tear accelerates and parathyroid hormone decelerates articular cartilage degeneration in rat osteoarthritis model[J]. J Orthop Res, 2018, 36(7): 1959–1968. DOI:10.1002/jor.23840 |
| [12] | ABDELRAZEK H, KILANY O E, MUHAMMAD M, et al. Black seed thymoquinone improved insulin secretion, hepatic glycogen storage, and oxidative stress in streptozotocin-induced diabetic male wistar rats[J]. Oxid Med Cell Longev, 2018, 2018: 8104165. DOI:10.1155/2018/8104165 |
| [13] | NOVIKOVA L, SMIRNOVA I V, RAWAL S, et al. Variations in rodent models of type 1 diabetes: islet morphology[J]. J Diabetes Res, 2013, 2013: 965832. DOI:10.1155/2013/965832 |
| [14] |
唐浚洲, 苏楠, 周思儒, 等. 手术诱导的小鼠骨关节炎模型中关节软骨MMP-13表达上调[J].
第三军医大学学报, 2014, 36(9): 919–922.
TANG J Z, SU N, ZHOU S R, et al. Increased expression of MMP-13 in articular cartilage in surgically induced osteoarthritis mice[J]. J Third Mil Med Univ, 2014, 36(9): 919–922. |
| [15] |
谢靖, 杨冠. 一种新的半月板切断导致小鼠骨关节炎方法的建立[J].
军事医学, 2013, 37(9): 708–711.
XIE J, YANG G. A novel model of osteoarthritis in mice induced by transection of medial meniscus[J]. Mil Med Sci, 2013, 37(9): 708–711. |
| [16] | GLASSON S, LITTLE C. The recent paper "Multimodal imaging demonstrates concomitant changes in bone and cartilage after destabilization of the medial meniscus and increased joint laxity"[J]. Osteoarthr Cartil, 2011, 19(8): 1076–1077. DOI:10.1016/j.joca.2011.04.018 |
| [17] | GLASSON S S, CHAMBERS M G, VAN DEN BERG W B, et al. The OARSI histopathology initiative—recommendations for histological assessments of osteoarthritis in the mouse[J]. Osteoarthr Cartil, 2010, 18: S17–S23. DOI:10.1016/j.joca.2010.05.025 |
| [18] |
吉喆, 党晓谦, 王坤正, 等. 小鼠骨关节炎模型中胫骨软骨下骨微结构的Micro-CT分析[J].
西安交通大学学报(医学版), 2015, 36(5): 623–627.
JI Z, DANG X Q, WANG K Z, et al. Micro-CT analysis on subchondral-bone microstructure of tibia in a mouse model of osteoarthritis[J]. J Xi'an Jiaotong Univ (Med Sci), 2015, 36(5): 623–627. |
| [19] | SAVI F M, BRIERLY G I, BALDWIN J, et al. Comparison of different decalcification methods using rat mandibles as a model[J]. J Histochem Cytochem, 2017, 65(12): 705–722. DOI:10.1369/0022155417733708 |
| [20] | BELLIDO M, LUGO L, ROMAN-BLAS J A, et al. Subchondral bone microstructural damage by increased remodelling aggravates experimental osteoarthritis preceded by osteoporosis[J]. Arthritis Res Ther, 2010, 12(4): R152. DOI:10.1186/ar3103 |
| [21] | LAIGUILLON M C, COURTIES A, HOUARD X, et al. Characterization of diabetic osteoarthritic cartilage and role of high glucose environment on chondrocyte activation: toward pathophysiological delineation of diabetes mellitus-related osteoarthritis[J]. Osteoarthr Cartil, 2015, 23(9): 1513–1522. DOI:10.1016/j.joca.2015.04.026 |
| [22] | MOONEY R A, SAMPSON E R, LEREA J, et al. High-fat diet accelerates progression of osteoarthritis after meniscal/ligamentous injury[J]. Arthritis Res Ther, 2011, 13(6): R198. DOI:10.1186/ar3529 |
| [23] | ORTH P, CUCCHIARINI M, WAGENPFEIL S, et al. PTH[1-34]-induced alterations of the subchondral bone provoke early osteoarthritis[J]. Osteoarthr Cartil, 2014, 22(6): 813–821. DOI:10.1016/j.joca.2014.03.010 |



