乙型肝炎病毒(hepatitis B virus,HBV)感染可导致急、慢性肝炎,肝硬化及肝细胞癌等多种肝脏疾病[1]。全球大约有3.5亿人感染HBV,其中约1/4个体最后进展为终末期肝病,给人民的健康和国民经济造成了严重的影响[2-3]。HBV基因组为全长3.2 kb的环状、松弛双链DNA,其4个主要的开放性阅读框架编码了HBsAg、HBeAg、HBx、病毒聚合酶等HBV的全部已知蛋白[4-5]。目前对于HBV患者的治疗主要为核苷酸类似物及干扰素两大类药物,由于无法根除HBV生活周期中产生的共价闭合环状DNA(covalently closed circular,cccDNA),导致用药时间长,副作用大等问题[6]。现对HBV致病机制尚不完全清楚,充分认识并理解HBV致病机制,为抗病毒治疗寻找新的方法与出路,仍是当务之急。
长链非编码RNA(long intergenic non-coding RNA,LincRNA)是由超过200个核苷酸组成的非编码RNA,由RNA聚合酶Ⅱ转录[7]。多项研究均发现LincRNA作为内源性调控因子,可在抗病毒天然免疫反应及病毒表观遗传学调控中发挥重要作用[8-9]。HBV亦可通过调控宿主内源性基因实现对宿主的感染,并参与肝细胞癌的发生[10]。本研究前期通过基因芯片检测发现Linc00238在HBV感染肝组织中的表达明显下调,进一步通过荧光定量检测以及功能学研究证实Linc00238对HBV复制及蛋白表达具有抑制作用。
1 材料与方法 1.1 主要试剂及仪器 1.1.1 组织标本的采集选取50例在重庆医科大学附属第二医院行根治性肝癌切除术患者的癌旁组织(距离肿瘤组织边缘>5 cm),其中HBV(+)及HBV(-)的肝癌患者各25例。手术切除后30 min内液氮速冻标本,-80 ℃冰箱内保存。本研究已通过重庆医科大学伦理委员会批准(2015年)。
1.1.2 实验细胞及质粒人的肝癌细胞HepG2、HepG2.2.15、HepAD38均购于中科院上海细胞所,其中HepG2.2.15细胞是HepG2细胞内导入HBV基因后所得,可稳定复制HBV DNA及分泌Dane颗粒至上清液中。HepAD38细胞是四环素诱导后稳定表达HBV的细胞系,在培养基中含有四环素时,HBV复制水平受到显著抑制,撤除四环素后,HBV复制可以快速恢复。pCH9/3091、pCDNA-linc00238及HBV启动子pHBs-luc、pHBx-luc、pHBc-luc为实验室构建保存[11]。sh-00238、sh-NC合成于广州锐博生物公司,sh00238正向序列:5′-CGGUCAUGGAGCUCCUUAAGG-3′,反向序列:5′-UUAAGGAGCUCCAUGACCGAG-3′,sh-NC序列:5′-GCAACAAGATGAAGAGCACCAA-3′。
1.1.3 主要试剂DMEM培养基、胎牛血清购自美国HyClone公司,TRIzol Reagent购自美国Ambion公司;LipofectamineTM 2000购自美国Invitrogen公司;Dual-Glo Luciferase Assay System、逆转录试剂盒购自美国Promega公司;SYBR Green试剂盒购自日本TaKaRa公司;HBsAg和HBeAg ELISA检测试剂盒购自上海科华生物工程有限公司;细胞总蛋白提取试剂盒购自江苏凯基生物技术股份有限公司,小鼠抗人HBcAg抗体购自英国Abcam公司;鼠抗GAPDH单抗、二抗马抗小鼠IgG抗体二抗购自北京中杉金桥生物公司;地高辛标记检测试剂盒、尼龙膜购自瑞士Roche公司;链霉素购自美国Sigma公司。
1.2 方法 1.2.1 细胞培养与转染HepG2、HepG2.2.15、HepAD38细胞培养在含10%胎牛血清DMEM培养基中,在37 ℃、5%CO2培养箱中培养。取对数期生长的HepG2及HepAD38细胞,在转染前12 h接种于6孔板内,细胞融合度为50%时,按照LipofectamineTM 2000说明书分别在pCDNA-linc00238组、pCDNA3.1对照组及Linc00238+sh-NC组、Linc00238+sh00238组、pCDNA-NC+sh00238组、pCDNA-NC+sh-NC组转染HepG2及HepAD38细胞。
1.2.2 LincRNA芯片采用广州锐博公司LincRNA芯片比较HBV(+)与HBV(-)肝组织样本细胞中LincRNA的表达。
1.2.3 Real-time PCR检测按TRIzol说明书提取细胞内总RNA,逆转录成cDNA,按照SYBR Green试剂盒说明书以cDNA或DNA为模板进行操作。对转染pCH9/3091组、阴性对照组、HepG2.2.15细胞组、HepG2细胞组、HepAD38细胞组、HepAD38细胞诱导组Linc00238复制水平进行检测。Linc00238引物序列为上游:5′-TGGAACAAGACATTCGAGGCA-3′,下游:5′-GGGATTTGGGAGCCTTTCCA-3′,214 bp;GAPDH引物序列为上游:5′-GGAAGGTGAAGGTCGGAGTC-3′,下游:5′-GACCACCTGGTGCTCAGTGT-3′,169 bp。检测条件为:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min,循环40次。分别在pCDNA-linc00238组及pCDNA3.1对照组中对HBV DNA复制水平进行比较;HBV DNA引物序列为上游:5′-ACCGACCTTGAGGCATACTT-3′,下游:5′-GCCTACAGCCTCCTAGTACA-3′,187 bp;β-actin引物序列为上游:5′-CACACCCGCCACCAGTTCG-3′,下游:5′-GTCCTTCTGACCCATTCCCACC-3′,126 bp。反应条件为:95 ℃ 10 min;95 ℃ 20 s,60 ℃ 30 s,循环40次。每组设置3个复孔。
1.2.4 Southern blot检测HepAD38细胞在转染pCDNA-Linc00238及pCDNA-NC后传代培养96 h,提取细胞质核心颗粒HBV-DNA,分别在pCDNA-linc00238组、对照组及内参组内对HBV复制中间体的表达进行检测,具体步骤如下:用PBS洗涤细胞2次后,加入500 μL细胞裂解液(10 mmol/L Tris-HCl pH= 8.0、1%NP40、1 mmol/L EDTA、2%蔗糖),均匀混合后37 ℃孵育15 min,收集细胞裂解液15 000×g离心5 min。收集上清液至1.5 mL EP管中,加入40 U/mL DNase Ⅰ和10 mmol/L MgCl2,37 ℃孵育4 h后加入含有1.5 mmol/L NaCl的35% PEG 8000 200 μL,冰浴1 h后11 000×g、4 ℃离心5 min,弃上清液后加入500 μL消化液(25 mmol/L Tris-HCl pH=8.0、5%SDS、150 mmol/L NaCl、10 mmol/L EDTA)和终浓度1 mg/mL的蛋白酶K。45 ℃水浴过夜。常规酚氯仿抽提2次,75%乙醇沉淀后溶于Elution缓冲液中。经提取的HBV DNA样品经0.9%琼脂糖凝胶电泳后,在毛细管虹吸法转膜后120 ℃烤干固定。预杂交1 h后加入地高辛标记DNA探针杂交过夜,洗膜、化学发光、图片采集、结果标记。
1.2.5 ELISA检测收集培养基上清液,使用ELISA试剂盒(上海科华生物工程公司),按照说明书检测细胞HBsAg和HBeAg水平。
1.2.6 Western blot检测HepAD38细胞经转染48 h后,对pCDNA-linc00238组、pCDNA3.1对照组及Linc00238+sh-NC组、Linc00238+sh00238组、pCDNA-NC+sh00238组、pCDNA-NC+sh-NC组HBc水平进行检测。采用细胞总蛋白提取试剂盒(凯基生物技术公司)提取细胞总蛋白,BCA发测定蛋白浓度,每孔蛋白上样量为60 μg,经10%SDS-PAGE电泳后电转至PVDF膜上,5%脱脂牛奶室温封闭1 h,分别加入小鼠抗HBcAg抗体(1 :10 000)及鼠抗GAPDH单抗(1 :1 000)4 ℃孵育过夜,PBST洗膜3次,每次10 min,再加入二抗马抗小鼠IgG抗体(1 :7 000)室温孵育1 h,PBST洗膜3次,每次10 min,ECL化学发光显影。
1.2.7 双荧光素酶报告系统接种对数期HepG2细胞于96孔板中,采用LipofectamineTM 2000在Linc00238组及对照组中分别转染pHBs-luc、pHBx-luc、pHBc-luc及pCDNA-linc00238,每组设置3个复孔,48 h后按利用Dual-Glo Luciferase Assay System说明书检测培养基荧光值。以报告基因荧光值/内参基因荧光值为结果。
1.3 统计学分析采用SPSS 17.0统计软件,实验结果以x±s表示。两组间比较采用独立样本t检验,检验水准:α=0.05。
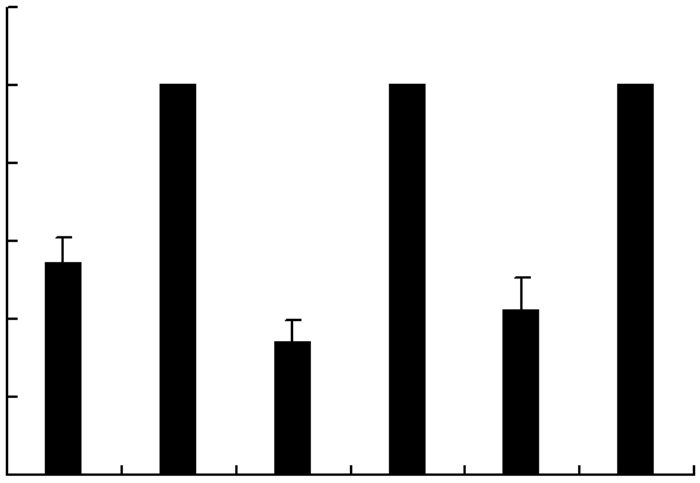
2 结果 2.1 LincRNA在HBV感染细胞中的表达差异前期利用LincRNA芯片技术比较LincRNA在5例HBV(+)及5例HBV(-)肝组织样本之间的表达差异,发现13条LincRNA表达具有差异,其中2条上调,11条下调(表 1)。进一步扩大组织样本量,Real-time PCR比较Linc00238在HBV(+)与HBV(-)肝组织中的表达差异。结果发现Linc00238在HBV(+)肝组织样本中的表达明显低于HBV(-)肝组织样本(表 2)。Real-time PCR检测HepG2细胞瞬时转染HBV载体pCH9/3091后Linc00238的表达明显低于阴性对照组,在HBV稳定表达细胞株HepG2.2.15及HepAD38中均观察到类似现象(P<0.05,图 1)。结果提示HBV感染后可抑制Linc00238表达。
| LincRNA名称 | 变化倍数 |
| Linc00336 | 5.255 9 |
| Linc00471 | 2.490 3 |
| Linc00310 | -5.391 3 |
| Linc00421 | -5.523 8 |
| Linc00263 | -2.984 8 |
| Linc00310 | -3.849 8 |
| Linc00487 | -5.717 7 |
| Linc00238 | -95.445 3 |
| Linc00092 | -5.336 8 |
| Linc00472 | -2.624 7 |
| Linc00478 | -7.736 7 |
| Linc00235 | -2.702 6 |
| Linc00478 | -7.729 6 |
| HBV(+)肝组织样本编号 | Linc00238变化倍数 | HBV(+)肝组织样本编号 | Linc00238变化倍数 | HBV(-)肝组织样本编号 | Linc00238变化倍数 | HBV(-)肝组织样本编号 | Linc00238变化倍数 | |
| 1 | 1.54 | 11 | 0.75 | 1 | 3.46 | 11 | 4.22 | |
| 2 | 0.79 | 12 | 1.76 | 2 | 5.89 | 12 | 2.78 | |
| 3 | 1.22 | 13 | 4.98 | 3 | 7.97 | 13 | 1.65 | |
| 4 | 0.53 | 14 | 2.21 | 4 | 6.87 | 14 | 7.23 | |
| 5 | 2.26 | 15 | 0.88 | 5 | 12.76 | 15 | 5.38 | |
| 6 | 1.74 | 16 | 0.52 | 6 | 2.89 | 16 | 3.57 | |
| 7 | 0.53 | 17 | 0.72 | 7 | 9.75 | 17 | 6.27 | |
| 8 | 0.46 | 18 | 0.15 | 8 | 8.54 | 18 | 3.32 | |
| 9 | 0.32 | 19 | 0.32 | 9 | 5.33 | 19 | 8.41 | |
| 10 | 0.67 | 20 | 0.54 | 10 | 6.31 | 20 | 2.98 |
|
| 1:转染pCH9/3091组;2:阴性对照组; 3:HepG2.2.15细胞组;4:HepG2细胞组;5:HepAD38细胞组;6:HepAD38细胞诱导组;a:P<0.05,与阴性对照组比较; b:P<0.05,与HepG2细胞组比较; c:P<0.05,与HepAD38细胞诱导组比较 图 1 Real-time PCR检测Linc00238在HBV感染细胞中的表达差异 |
2.2 高表达Linc00238后抑制HBV蛋白表达
在HepAD38细胞中转染pCDNA-linc00238,设置pCDNA3.1对照组。结果表明:HepAD38细胞中过表达Linc00238明显降低HBV蛋白的表达(P<0.05,图 2),结果证实Linc00238对HBV蛋白表达具有抑制作用。

|
| A:ELISA检测HepAD38细胞中转染pCDNA-linc00238后HBsAg及HBeAg水平a:P<0.05,与pCDNA3.1对照组比较;B:Western blot检测HepAD38细胞中转染pCDNA-linc00238后HBc水平1:pCDNA-linc00238组;2:pCDNA3.1对照组 图 2 HepAD38细胞过表达Linc00238后HBV蛋白的表达 |
2.3 高表达Linc00238后抑制HBV DNA复制
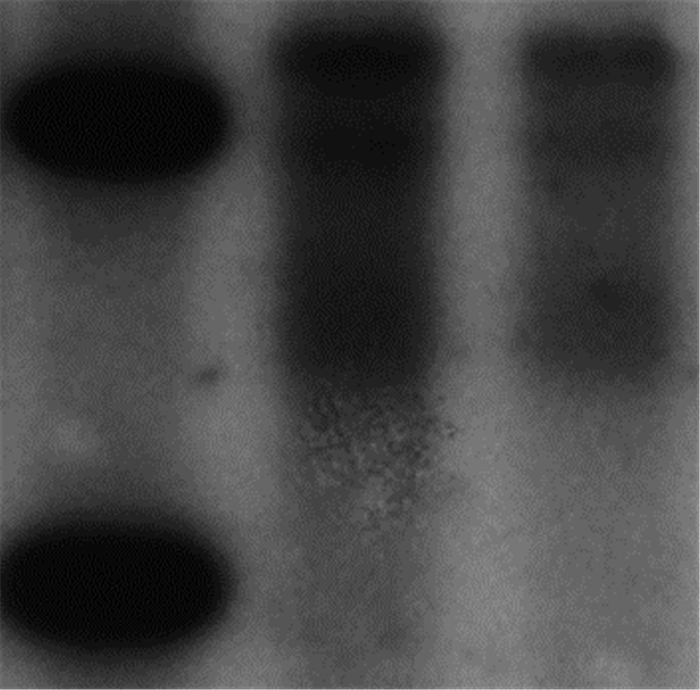
在HepAD38细胞中转染pCDNA-Linc00238,HBV DNA复制水平较对照组明显降低(P<0.05),HBV复制中间体的表达较对照组亦明显降低(图 3),结果证实Linc00238对HBV DNA复制具有抑制作用。
|
| 1:内参组;2:对照组;3:pCDNA-linc00238组 图 3 Southern blot检测HepAD38细胞过表达Linc00238后HBV复制中间体的表达 |
2.4 干扰Linc00238作用后上调HBV蛋白表达
HepAD38细胞中分别过表达Linc00238+sh-NC、Linc00238+sh00238、pCDNA-NC+sh00238、pCDNA-NC+sh-NC,采用ELISA检测HBs及HBe表达。结果显示:过表达Linc00238后HBV蛋白表达得到抑制,而当干扰外源性Linc00238表达后,HBV蛋白表达得到部分恢复,差异具有统计学意义(P<0.05,图 4)。该结果进一步明确了Linc00238对HBV生活周期具有抑制作用。

|
| 1:Linc00238+sh-NC组;2:Linc00238+sh00238组;3:pCDNA-NC+ sh00238组;4:pCDNA-NC+sh-NC组;a:P<0.05,与pCDNA-NC+sh-NC组比较A:ELISA检测HepAD38细胞中干扰pCDNA-linc00238后HBsAg及HBeAg水平;B:Western blot检测HepAD38细胞中干扰pCDNA-linc00238后HBc水平 图 4 HepAD38细胞中干扰pCDNA-linc00238表达后HBV蛋白的表达 |
2.5 Linc00238对HBV启动子无明显抑制作用
在HepG2细胞中共转染pHBs-luc、pHBx-luc、pHBc-luc及pCDNA-linc00238,双荧光素酶报告系统检测荧光素酶活性。与对照比较,转染Linc00238对HBV各启动子活性无明显影响(P>0.05,图 5)。这提示Linc00238对HBV的抑制作用并非通过与HBV启动子相互作用而实现。

|
| 图 5 HepG2细胞中转染HBV启动子与pCDNA-Linc00238后各启动子荧光素酶活性 |
3 讨论
本研究探讨了Linc00238对HBV生活周期的影响,结果发现在HBV稳定表达的HepG2.2.15细胞、HepAD38细胞和HBV(+)的肝组织样本及HBV瞬时表达的HepG2细胞中Linc00238的表达都明显下调。在HepAD38细胞过表达Linc00238可抑制HBV的复制及蛋白表达,而干扰LincRNA00238的表达可减少对HBV复制及蛋白表达的抑制作用。研究进一步证实Linc00238对HBV启动子无明显抑制作用,提示Linc00238可能通过间接作用于HBV调控因子进而调控HBV生活周期。
已有多项研究表明LincRNA可通过下列形式发挥作用。①信号分子:这类LincRNA表达具有组织特异性,内源性或外源性刺激因素可导致LincRNA表达发生改变,从而影响下游效应分子水平[12]。②分子诱饵:这部分LincRNA可作为分子诱饵吸附蛋白及RNA,对靶基因进行调控[13-14]。③分子向导:LincRNA可以与特定蛋白结合并引导其与靶基因结合形成效应复合物[15]。④细胞支架:LincRNA可以作为支架促进多种效应分子聚集,通过选择性利用特定效应分子发挥相应的细胞生物学功能[16]。本研究证实Linc00238不能直接作用于HBV蛋白启动子序列调节HBV生活周期,推测Linc00238可能间接作用于HBV调控因子,从而间接实现对HBV的调控作用。LincRNA与miRNA同为内源性RNA,且具有一定的组织特异性。
本课题组通过GEO数据库检索发现,Linc00238在包括肝脏肿瘤、酒精性肝炎、病毒性感染、血液系统肿瘤、干细胞分化等病理生理过程中的表达发生明显改变。这提示Linc00238可能在疾病发生、发展过程中起到一定作用。由于非编码RNA作用方式多种多样,目前Linc00238如何调控HBV生活周期机制,尚待进一步研究明确。
多项研究证实LincRNA可作用于miRNA。一方面LncRNA可以作为竞争性内源RNA(competing endogenous RNA, ceRNA)与miRNA竞争靶基因作用位点从而抑制miRNA对靶基因调控作用;另一方面,miRNA作为重要的内源性调控分子,同样影响着LincRNA表达,并在疾病产生中发挥重要作用[17-19]。本研究利用生物信息学软件DIANA-LncBase(http://www.microrna.gr/LncBase)对Linc00238序列进行分析,发现其含有miR-516a-3p、miR-455-5p、miR-377、miR-596、miR-330-3p、miR-200b-5p、miR-583等miRNA结合位点,提示Linc00238可能与miRNA相作用,从而间接影响HBV的生活周期,下调HBV复制及蛋白表达。
综上所述,本研究证实了Linc00238可下调HBV复制及蛋白表达。研究进一步表明其机制与HBV启动子关系不大,可能是Linc00238与miRNA相互作用有关。本研究在细胞层面探讨了Linc00238与HBV的相互关系,为将来Linc00238应用于HBV感染相关性肝病的治疗提供了新思路。
| [1] | ZHOU Y, WAN Y, YE Z W, et al. How hepatitis B virus causes cirrhosis and liver cancer[J]. Med Hypotheses, 2017, 108: 52–53. DOI:10.1016/j.mehy.2017.08.005 |
| [2] | DUSHEIKO G, AGARWAL K. Delineating the global challenges of hepatitis B virus infection[J]. Lancet Gastroenterol Hepatol, 2018, 3(6): 372–373. DOI:10.1016/S2468-1253(18)30093-1 |
| [3] | EL-SERAG H B. Epidemiology of viral hepatitis and hepatocellular carcinoma[J]. Gastroenterology, 2012, 142(6): 1264–1273. DOI:10.1053/j.gastro.2011.12.061 |
| [4] | LAMONTAGNE R J, BAGGA S, BOUCHARD M J. Hepatitis B virus molecular biology and pathogenesis[J]. Hepatoma Res, 2016, 2: 163–186. DOI:10.20517/2394-5079.2016.05 |
| [5] | VENKATAKRISHNAN B, ZLOTNICK A. The structural biology of hepatitis B virus: form and function[J]. Annu Rev Virol, 2016, 3(1): 429–451. DOI:10.1146/annurev-virology-110615-042238 |
| [6] | GUO J T, GUO H. Metabolism and function of hepatitis B virus cccDNA: Implications for the development of cccDNA-targeting antiviral therapeutics[J]. Antiviral Res, 2015, 122: 91–100. DOI:10.1016/j.antiviral.2015.08.005 |
| [7] | NOH J H, KIM K M, MCCLUSKY W G, et al. Cytoplasmic functions of long noncoding RNAs[J]. Wiley Interdiscip Rev RNA, 2018, 9(3): e1471. DOI:10.1002/wrna.1471 |
| [8] | OUYANG J, ZHU X, CHEN Y, et al. NRAV, a long noncoding RNA, modulates antiviral responses through suppression of interferon-stimulated gene transcription[J]. Cell Host Microbe, 2014, 16(5): 616–626. DOI:10.1016/j.chom.2014.10.001 |
| [9] | SAAYMAN S, ACKLEY A, TURNER A W, et al. An HIV- encoded antisense long noncoding RNA epigenetically regulates viral transcription[J]. Mol Ther, 2014, 22(6): 1164–1175. DOI:10.1038/mt.2014.29 |
| [10] | GONG X, WEI W, CHEN L, et al. Comprehensive analysis of long non-coding RNA expression profiles in hepatitis B virus-related hepatocellular carcinoma[J]. Oncotarget, 2016, 7(27): 42422–42430. DOI:10.18632/oncotarget.9880 |
| [11] | REN J H, TAO Y, ZHANG Z Z, et al. Sirtuin 1 regulates hepatitis B virus transcription and replication by targeting transcription factor AP-1[J]. J Virol, 2014, 88(5): 2442–2451. DOI:10.1128/JVI.02861-13 |
| [12] | HUARTE M, GUTTMAN M, FELDSER D, et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response[J]. Cell, 2010, 142(3): 409–419. DOI:10.1016/j.cell.2010.06.040 |
| [13] | GUTTMAN M, RINN J L. Modular regulatory principles of large non-coding RNAs[J]. Nature, 2012, 482(7385): 339–346. DOI:10.1038/nature10887 |
| [14] | CESANA M, CACCHIARELLI D, LEGNINI I, et al. A long noncoding RNA controls muscle differentiation by functioning as a competing endogenous RNA[J]. Cell, 2011, 147(2): 358–369. DOI:10.1016/j.cell.2011.09.028 |
| [15] | GUPTA R A, SHAH N, WANG K C, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature, 2010, 464(7291): 1071–1076. DOI:10.1038/nature08975 |
| [16] | KOTAKE Y, NAKAGAWA T, KITAGAWA K, et al. Long non-coding RNA ANRIL is required for the PRC2 recruitment to and silencing of p15(INK4B) tumor suppressor gene[J]. Oncogene, 2011, 30(16): 1956–1962. DOI:10.1038/onc.2010.568 |
| [17] | ZHANG X, ZHANG E, MA Z, et al. Modulation of hepatitis B virus replication and hepatocyte differentiation by microRNA-1[J]. Hepatology, 2011, 53(5): 1476–1485. DOI:10.1002/hep.24195 |
| [18] | QIU L, FAN H, JIN W, et al. miR-122-induced down-regulation of HO-1 negatively affects miR-122-mediated suppression of HBV[J]. Biochem Biophys Res Commun, 2010, 398(4): 771–777. DOI:10.1016/j.bbrc.2010.07.021 |
| [19] | POTENZA N, PAPA U, MOSCA N, et al. Human microRNA hsa-miR-125a-5p interferes with expression of hepatitis B virus surface antigen[J]. Nucleic Acids Res, 2011, 39(12): 5157–5163. DOI:10.1093/nar/gkr067 |



