2. 241000 安徽 芜湖,皖南医学院第一附属医院弋矶山医院教育处
2. Department of Education, Yijishan Hospital, the First Affiliated Hospital of Wannan Medical College, Wuhu, Anhui Province, 241000, China
富勒烯(fullerene,C60)是一种完全由碳元素构成的球型分子,因其独特的理化性质一直备受科学界广泛关注[1]。富勒烯极低的水溶特性极大地限制了其在生物医学领域中的发展。引入羟基功能团的富勒烯衍生物(富勒醇)保留其大多数优良性质的同时,也丰富了其在生物医学领域中的应用,如肿瘤靶向治疗、抗病毒效应、抗氧化作用和神经保护功能等[2-8]。铅中毒是全球性污染问题。金属铅在生物体内并没有生理作用,反而有无数的害处[9-15]。传统的观点认为:铅毒性的产生原因在于引起组织氧化应激反应[10]。基于我们之前的研究,发现富勒醇部分修复铅中毒导致损伤的可能机制与一氧化氮(nitric oxide,NO)-一氧化氮合酶(nitric oxide synthase,NOS)系统有关[16-17]。NO在不同的组织器官中发挥着多重效应,但是,NO本身具有自由基的特性,非生理条件下产生的过量NO会对机体造成损伤[18]。而体内NO主要来源是NOS的催化作用,特别是诱导型一氧化氮合酶(iducible NOS,iNOS)的作用[19]。本研究旨在探讨富勒醇对铅中毒大鼠肝肾功能损伤及血液学异常表现的修复作用,并从NO-NOS系统的角度解释其可能机制。
1 材料与方法 1.1 动物与分组Wistar种鼠[7~8周龄,(200±20)g,雄性14只,雌性21只]购于上海斯莱克实验动物中心,饲养于皖南医学院细胞电生理研究室。饲养时保持温度和相对湿度适宜、昼夜节律稳定。F1代仔鼠出生后完全随机分为3组(雌雄不拘,每组10只):正常对照组(给予正常饮水),铅中毒模型组和富勒醇干预组(给予含0.2%醋酸铅水)。至3周龄时富勒醇干预组每天按体质量5 mg/kg腹腔注射富勒醇溶液,连续注射10 d。其余两组腹腔注射等剂量生理盐水。5周龄时用于实验。本研究中涉及动物实验部分均严格依照皖南医学院制定的《实验动物饲养和使用条例》。
1.2 主要试剂富勒醇购于美国M.E.R.公司,避光保存于4 ℃冰箱,使用时溶于生理盐水。醋酸铅购于上海生工生物工程股份有限公司,使用时滴加几滴冰醋酸有助于其溶解于蒸馏水。BCA蛋白浓度检测试剂盒(P0010)、RIPA裂解液(P0013B)和总NO检测试剂盒(S0024)均购于中国上海碧云天生物技术有限公司。小鼠抗iNOS单抗(ab49999)、兔抗GAPDH多抗(ab181602)和山羊抗小鼠IgG H & L (Alexa Fluor® 488,ab150113)均购于英国Abcam公司。
1.3 实验方法 1.3.1 电子显微成像0.01 mg/mL富勒醇水溶液超声震荡30 min后,滴加于铜网,场发射透射电子显微镜(Tecnai G2 F20 S-Twin,FEI,美国)下观察其物理特征。
1.3.2 HE染色大鼠麻醉后断头处死,快速取出肝肾组织,投入预冷的现配固定液(4%多聚甲醛)中直至蛋白变性凝固完全。然后修块、脱水、浸蜡包埋、切片、脱蜡、HE染色。酒精脱水,二甲苯透明,树胶封片,在光学显微镜(DMI 3000 B,Leica,德国,图像采集软件为LAS V3.8)下观察并拍照。
1.3.3 血常规检测大鼠麻醉后,采用真空采血管穿刺心脏取血,每管至少3 mL。在皖南医学院第二附属医院检验科进行血常规检测。本实验分析6个常用参数,分别是红细胞(red blood cell,RBC)、血红蛋白(hemoglobin,HGB)、红细胞比容(red blood cell specific volume,HCT)、平均红细胞体积(erythrocyte means corpuscular volume,MCV)、平均血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)和白细胞(white blood cell,WBC)。
1.3.4 组织样品处理以及BCA蛋白浓度检测大鼠麻醉后断头,在冰上快速且小心地剥离出脑组织。按比例加入RIPA裂解液和PMSF蛋白酶抑制剂,冰浴条件下使用玻璃匀浆器将样品研磨成组织匀浆液。4 ℃,12 500×g,离心3 min后,取上清液待用或者-20 ℃保存。蛋白浓度检测时,先用RIPA裂解液将标准品和样品分别稀释成适宜浓度。然后与现配BCA工作液37 ℃反应30 min。最后在570 nm处检测光密度值D(570),绘制标准曲线并计算蛋白浓度。
1.3.5 总NO浓度检测首先将50 μL样品加热变性,12 000×g离心5 min,取上清待用。然后根据试剂盒使用说明书,避光操作,依次加入试剂,混匀并37 ℃孵育。最后使用格里斯试剂特异验证亚硝酸根,室温孵育10 min后,在540 nm处检测光密度值D(540),绘制标准曲线并计算NO浓度。
1.3.6 Western blot检测样品经沸水浴加热变性后,按比例与上样缓冲液混合,最终上样量为10 μL。蛋白经SDS-PAGE凝胶电泳分离,冰浴下湿转法以270 mA转膜2 h,再用5%脱脂奶粉室温封闭1 h。一抗4 ℃过夜孵育,二抗室温孵育2 h,ECL化学发光法显影并存储照片。
1.4 统计学分析采用Grubbs检验法分析实验数据,剔除异常数据,保留有效数据。采用Origin 8.0(OriginLab Corporation,美国)统计软件,数据以x±s表示。组间差异用单因素方差分析以及Bonferroni检验,检验水准:α=0.05。
2 结果 2.1 纳米材料富勒醇以胶团形式存在于水溶液引入羟基功能团后的纳米材料富勒醇,具有较高的水溶特性。为明确富勒醇水溶液的物理性征,采用电子显微镜观察富勒醇的分布状态。如图 1所示:绝大多数富勒醇是以胶团形式存在的,直径为20~100 nm,易溶于水,利于实验研究。

|
| A:富勒醇在电子显微镜下的分布状态;B:放大图 图 1 电子显微镜观察纳米材料富勒醇的水溶特性 |
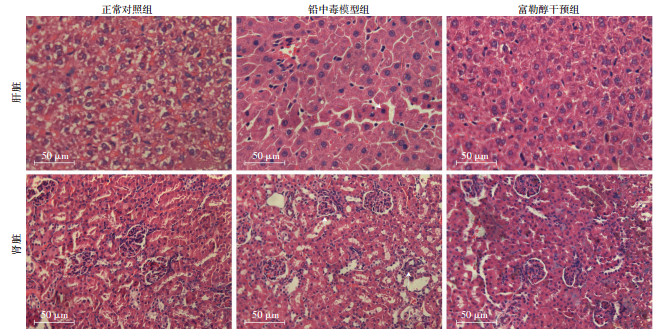
2.2 富勒醇干预改善铅毒性引起的肝肾组织形态学异常
铅毒性对肝肾组织形态学有显著性影响,为了明确富勒醇干预是否能改善铅毒性,取大鼠肝肾组织做切片,行HE染色。正常对照组中肝组织细胞质染色均匀,细胞排列整齐;与正常对照组比较,铅中毒模型组中肝细胞略微肿胀,且核固缩,组织轻微病变;而富勒醇干预组中肝细胞恢复成正常大小,细胞排列紧密,与正常对照组比较无明显差异(图 2)。正常对照组中肾组织肾小球形态完整,肾小管清晰可见;与正常对照组比较,铅中毒模型组中肾小球部分萎缩,肾小管空泡变性;而富勒醇干预组中肾小球体积无明显萎缩变化,肾小管也无明显空泡现象(图 2)。
|
| ↘示核固缩细胞;↑示肾小球萎缩 图 2 HE染色观察各组大鼠肝肾组织形态 |
2.3 富勒醇干预改善铅毒性引起的血液学指标异常
与正常对照组比较,铅中毒模型组大鼠中与贫血相关的重要血液学指标(RBC、HGB、HCT、MCV、MCHC、WBC)呈现出明显的异常,表明铅毒性能引起血液学指标异常变化。同时,富勒醇干预组与正常对照组之间无明显差异,但是与铅中毒模型组比较,有些重要指标(RBC、HGB、MCV和MCHC)呈现显著性变化(P<0.05,表 1)。
| 组别 | n | WBC/109·L-1 | RBC/1012·L-1 | HGB/g·L-1 | HCT/% | MCV/fL | MCH/pg | MCHC/g·L-1 | PLT/109·L-1 |
| 正常对照组 | 6 | 4.86±1.31 | 6.73±0.17 | 122.33±2.92 | 44.52±1.18 | 66.22±0.79 | 18.18±0.17 | 275.00±2.52 | 1 020.67±87.95 |
| 铅中毒模型组 | 9 | 8.81±0.95a | 5.74±0.05a | 105.89±1.07a | 39.67±0.48a | 69.14±0.41a | 18.46±0.08 | 267.00±1.60a | 1 322.89±87.35 |
| 富勒醇干预组 | 9 | 6.25±0.70 | 6.29±0.14b | 114.11±2.60b | 41.49±0.88 | 66.01±0.69b | 18.14±0.14 | 275.11±1.61b | 1 098.56±75.72 |
| a:P<0.05,与正常对照组比较;b:P<0.05,与铅中毒模型组比较 | |||||||||
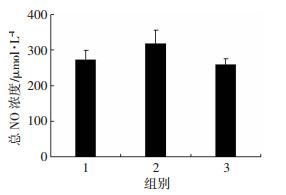
2.4 富勒醇干预抑制铅毒性引起总NO浓度上调趋势
总NO浓度检测结果显示:3组总NO浓度差异不明显,但是与正常对照组比较,铅中毒模型组的总NO浓度有上升趋势,而富勒醇干预组则抑制该倾向,表现出下降趋势。表明铅毒性能引起大鼠脑组织中总NO浓度上调趋势,而富勒醇干预能有效抑制该上调趋势(图 3)。
|
| 1:正常对照组(n=6);2:铅中毒模型组(n=9);3:富勒醇干预组(n=9) 图 3 各组大鼠脑组织的总NO浓度 |
2.5 富勒醇干预抑制铅毒性引起的iNOS蛋白浓度上调
Western blot检测结果显示:与正常对照组(0.35± 0.05)比较,铅中毒模型组(0.58±0.06)大鼠脑组织的目标蛋白iNOS浓度显著提高(P<0.05);而富勒醇干预组则抑制该趋势,与铅中毒模型组相比,富勒醇干预组(0.39±0.05)大鼠脑组织的目标蛋白iNOS浓度显著降低(P<0.05)。表明铅毒性能引起大鼠脑组织中iNOS蛋白浓度上调,而富勒醇干预能有效抑制该上调表现(图 4)。

|
| 1:正常对照组(n=6);2:铅中毒模型组(n=9);3:富勒醇干预组(n=9) 图 4 Western blot检测各组大鼠脑组织的iNOS蛋白表达 |
3 讨论
本研究以NO-NOS系统为着眼点,主要研究了纳米材料富勒醇如何通过调节NO-NOS系统进而影响铅中毒大鼠的损伤修复过程。本研究结果显示:富勒醇能明显改变铅中毒导致的大鼠肝肾组织形态学异常和与贫血相关重要血液学指标异常;同时,能显著降低铅中毒大鼠体内总NO浓度和iNOS蛋白表达。
铅中毒能导致大鼠肝肾组织的形态学异常和与贫血相关的重要血液学指标异常[20]。本研究发现富勒醇能明显修复这些异常。铅中毒目前仍没有特效解毒剂,中毒后只能使用驱铅剂将铅螯合后排出体外,但是铅中毒造成的损伤为不可逆,一般无法自行修复。本研究HE染色结果表明:纳米材料富勒醇对铅中毒大鼠肝肾组织具有保护作用,可以明显降低铅毒性对肝肾组织造成的损伤。此外,根据前人研究,发现铅暴露可能是缺铁性贫血发生的危险因素之一[21]。本研究再次证明了铅中毒的表现之一是贫血,而且也证明了富勒醇可以修复这些血液学指标异常。
本研究发现铅能提高总NO浓度趋势和增强iNOS活性,而富勒醇能明显降低铅中毒大鼠体内的iNOS蛋白表达,并有降低总NO浓度的趋势。NO与超氧离子自由基反应产生的过氧化亚硝基具有很高的反应活性,大量的NO激活下游通路,可以对机体造成兴奋性毒性[18-19]。本研究中总NO浓度检测和Western blot检测结果表明:纳米材料富勒醇对铅中毒大鼠NO-NOS系统具有抑制作用,可以降低铅中毒大鼠体内的总NO浓度和iNOS活性。这些结果提示:富勒醇对铅中毒大鼠肝肾功能的修复作用可能与体内的NO-NOS系统有关,但是具体的机制还需今后更多的实验探索和分析。
综上所述,本研究结果提示:富勒醇能修复铅毒性引起的肝肾功能损伤和血液异常,并影响NO-NOS系统。该项研究为探索铅中毒治疗新途径提供了理论依据,为评估富勒醇的生物学应用提供了理论参考。
志谢 感谢皖南医学院第一附属医院病理科汪向明医生对本研究中HE实验的帮助;感谢皖南医学院第二附属医院检验科张普宏医生对本研究中血常规检测部分内容的帮助| [1] | BOGDANOVIC G, DJORDJEVIC A. Carbon nanomaterials:Biologically active fullerene derivatives[J]. Srp Arh Celok Lek, 2016, 144(3/4): 222–231. |
| [2] | SHI J, ZHANG H, WANG L, et al. PEI-derivatized fullerene drug delivery using folate as a homing device targeting to tumor[J]. Biomaterials, 2013, 34(1): 251–261. DOI:10.1016/j.biomaterials.2012.09.039 |
| [3] | FAN J, FANG G, ZENG F, et al. Water-dispersible fullerene aggregates as a targeted anticancer prodrug with both chemo-and photodynamic therapeutic actions[J]. Small, 2013, 9(4): 613–621. DOI:10.1002/smll.201201456 |
| [4] | GANAPATHY V, THANGARAJU M, PRASAD P D. Nutrient transporters in cancer:relevance to Warburg hypothesis and beyond[J]. Pharmacol Ther, 2009, 121(1): 29–40. DOI:10.1016/j.pharmthera.2008.09.005 |
| [5] | SHOJI M, TAKAHASHI E, HATAKEYAMA D, et al. Anti-influenza activity of C60 fullerene derivatives[J]. PloS ONE, 2013, 8(6): e66337. DOI:10.1371/journal.pone.0066337 |
| [6] | ISAKOVIC A, MARKOVIC Z, TODOROVIC-MARKOVIC B, et al. Distinct cytotoxic mechanisms of pristine versus hydroxylated fullerene[J]. Toxicol Sci, 2006, 91(1): 173–183. DOI:10.1093/toxsci/kfj127 |
| [7] | DUGAN L L, GABRIELSEN J K, YU S P, et al. Buckminsterfullerenol free radical scavengers reduce excitotoxic and apoptotic death of cultured cortical neurons[J]. Neurobiol Dis, 1996, 3(2): 129–135. DOI:10.1006/nbdi.1996.0013 |
| [8] | JIN H, CHEN W Q, TANG X W, et al. Polyhydroxylated C (60), fullerenols, as glutamate receptor antagonists and neuroprotective agents[J]. J Neurosci Res, 2000, 62(4): 600–607. DOI:10.1002/1097-4547(20001115)62:4<600::AID-JNR15>3.0.CO;2-F |
| [9] | WHITE L D, CORY-SLECHTA D A, GILBERT M E, et al. New and evolving concepts in the neurotoxicology of lead[J]. Toxicol Appl Pharm, 2007, 225(1): 1–27. DOI:10.1016/j.taap.2007.08.001 |
| [10] | NIU Y, YU W, FANG S, et al. Lead poisoning influences TCR-related gene expression patterns in peripheral blood T-lymphocytes of exposed workers[J]. J Immunotoxicol, 2015, 12(1): 92–97. DOI:10.3109/1547691X.2014.899412 |
| [11] | NEEDLEMAN H. Lead poisoning[J]. Annu Rev Med, 2004, 55: 209–222. DOI:10.1146/annurev.med.55.091902.103653 |
| [12] | XU J, YAN H C, YANG B, et al. Effects of lead exposure on hippocampal metabotropic glutamate receptor subtype 3 and 7 in developmental rats[J]. J Negat Results Biomed, 2009, 8: 5. DOI:10.1186/1477-5751-8-5 |
| [13] | PARK S K, O'NEILL M S, VOKONAS P S, et al. Air pollution and heart rate variability:effect modification by chronic lead exposure[J]. Epidemiology, 2008, 19(1): 111–120. DOI:10.1097/EDE.0b013e31815c408a |
| [14] | LEE C M, TERRIZZI A R, BOZZINI C, et al. Chronic lead poisoning magnifies bone detrimental effects in an ovariectomized rat model of postmenopausal osteoporosis[J]. Exp Toxicol Pathol, 2016, 68(1): 47–53. DOI:10.1016/j.etp.2015.09.007 |
| [15] | CLEVELAND L M, MINTER M L, COBB K A, et al. Lead hazards for pregnant women and children:part 1:immigrants and the poor shoulder most of the burden of lead exposure in this country.Part 1 of a two-part article details how exposure happens, whom it affects, and the harm it can do[J]. Am J Nurs, 2008, 108(10): 40–49. DOI:10.1097/01.NAJ.0000337736.76730.66 |
| [16] | ZHA Y Y, YANG B, TANG M L, et al. Concentration-dependent effects of fullerenol on cultured hippocampal neuron viability[J]. Int J Nanomed, 2012, 7: 3099–3109. DOI:10.2147/IJN.S30934 |
| [17] | WANG X X, ZHA Y Y, YANG B, et al. Suppression of synaptic plasticity by fullerenol in rat hippocampus in vitro[J]. Int J Nanomed, 2016, 11: 4947–4955. DOI:10.2147/IJN |
| [18] | WEI T, CHEN C, ZHAO B, et al. EPC-K1 attenuates peroxynitrite-induced apoptosis in cerebellar granule cells[J]. Biochem Mol Biol Int, 1998, 46(1): 89–97. DOI:10.1080/15216549800203592 |
| [19] | COSTA E D, REZENDE B A, CORTES S F, et al. Neuronal nitric oxide synthase in vascular physiology and diseases[J]. Front Physiol, 2016, 7: 206. DOI:10.3389/fphys.2016.00206 |
| [20] | EL-SOKKARY G H, ABDEL-RAHMAN G H, KAMEL E S. Melatonin protects against lead-induced hepatic and renal toxicity in male rats[J]. Toxicology, 2005, 213(1/2): 25–33. DOI:10.1016/j.tox.2005.05.003 |
| [21] | TURGUT S, POLAT A, INAN M, et al. Interaction between anemia and blood levels of iron, zinc, copper, cadmium and lead in children[J]. Indian J Pediatr, 2007, 74(9): 827–830. DOI:10.1007/s12098-007-0147-2 |



