动脉粥样硬化(atherosclerosis,AS)严重威胁人类心血管健康[1-2],在其进程中,血管内皮细胞氧化应激损伤是始动环节,已成为AS防治的重要靶点[3-5]。前期研究表明,多种植物性食物中广泛存在的多酚类植物化学物——白藜芦醇(resveratrol,RSV)具有潜在的心血管保护和抗AS效应,但其具体机制尚未完全阐明[6]。新近研究表明,细胞转录因子EB(transcription factor EB, TFEB)作为螺旋-环-螺旋亮氨酸拉链转录因子MiTF/TFE家族成员之一,在调节细胞代谢稳态和抑制氧化应激损伤中发挥了关键作用[7-8]。TFEB不仅参与了个体发育、血管形成,还是自噬以及溶酶体合成等代谢调控通路中的重要调控分子[9-11]。本实验室前期研究发现,RSV可以通过调节自噬发挥内皮保护效应[12]。但是,白藜芦醇对TFEB是否存在相关调控机制尚无相关研究。同时,TFEB是否是白藜芦醇发挥内皮保护效应的关键因素也亟待探索。棕榈酸(palmitate,PA)学名“十六烷酸”,又叫软脂酸,是一种饱和高级脂肪酸,常用于建立细胞氧化应激、脂质过氧化等损伤模型。因此,本研究以原代人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为研究对象,用PA处理细胞,建立氧化应激损伤模型,围绕TFEB探讨了RSV在抑制HUVECs氧化应激损伤中的可能作用机制。
1 材料与方法 1.1 材料 1.1.1 主要试剂RSV、PA以及Histone H3抗体均购自美国Sigma公司;CCK-8(cell counting kit-8)试剂盒购自日本Dojindo公司;DMEM液体培养基和胎牛血清购自美国Gibco公司;2′, 7′-dichlorofluorescin diacetate (DCFH-DA)荧光探针、脂质氧化MDA检测试剂盒均购自碧云天生物技术有限公司;TFEB siRNA (human, sc-38509)、control siRNA (sc-44230)、siRNA转染试剂(sc-29528)以及β-actin抗体均购自美国Santa公司;TFEB抗体购自Cell Signaling Technology公司;RSV以DMSO溶解至储备浓度100 mmol/L,于-20 ℃保存,全程避光;PA用NAOH梯度温度溶解,储备浓度为5 mmol/L,-20 ℃保存。
1.1.2 细胞原代人脐静脉内皮细胞来源于陆军军医大学第一、二附属医院妇产科,取足月新生儿脐静脉,按照本实验室原代内皮细胞分离培养方法进行实验,取第3~5代细胞用于实验[13]。本研究2014年获得第三军医大学伦理委员会批准。
1.2 实验处理和分组用不同浓度(100、150、200、250、300 μmol/L)、不同时间(14、16、18、20、22、24 h)的PA处理内皮细胞,CCK-8法检测细胞增殖活力,确定PA建模的适宜浓度和时间。100、200、300 μmol/L PA处理细胞24 h,荧光酶标仪检测细胞内ROS和MDA水平,建立内皮细胞氧化应激损伤模型。
检测RSV对PA诱导的内皮细胞氧化应激损伤的影响,实验分组为:①对照组;②200 μmol/L PA处理24 h组;③不同浓度白藜芦醇预处理2 h,再加200 μmol/L PA处理24 h组;④白藜芦醇(10 μmol/L)单独处理组。
检测TFEB在RSV抗氧化应激中的作用,Western blot实验分组为:①对照组; ②200 μmol/L PA处理24 h组;③白藜芦醇(10 μmol/L)预处理2 h,再加200 μmol/L PA处理24 h组。细胞增殖活力、ROS水平以及MDA水平检测实验分组为:①对照组; ② 200 μmol/L PA处理24 h组; ③白藜芦醇(10 μmol/L)预处理2 h,再加200 μmol/L PA处理24 h组;④TFEB siRNA转染,再白藜芦醇(10 μmol/L)预处理2 h,然后200 μmol/L PA处理24 h组。
1.3 方法 1.3.1 细胞增殖活力检测取生长状态良好的第3~5代HUVECs,以2.5×104个/mL密度接种到96孔板。待细胞贴壁后,按CCK-8试剂盒说明书进行后续处理。结果用酶标仪在490 nm处检测各组光密度值[D(490)]。设空白组细胞增殖活力为100%,其余各组细胞增殖活力=[处理组D(490)/空白组D(490)]×100%。
1.3.2 荧光酶标仪检测ROS生成接种HUVECs方法同上,用无血清培养基稀释DCFH-DA荧光染料至10 μmol/L,处理细胞后于37 ℃避光孵育20 min,吸弃染料,用无血清培养基轻洗细胞3次,荧光酶标仪检测荧光强度,全过程避光。DCFH-DA本身没有荧光,进入细胞后被ROS氧化为有带绿色荧光的DCF,通过检测DCF的荧光强度即可判断细胞内活性氧的水平。IPP 5.0软件分析各组平均荧光强度。
1.3.3 MDA试剂盒检测脂质过氧化水平丙二醛(malondialdehyde, MDA)是一种脂质氧化的天然产物。氧化应激时,细胞会发生脂质氧化,通过检测MDA的含量即可代表脂质氧化的水平。收集细胞进行充分裂解,1 600×g离心10 min,取上清,按试剂盒说明书进行后续处理。酶标仪检测读数,再根据标准曲线计算出样品上清液中的MDA含量,最后通过单位质量的蛋白含量来表示最初样品中的MDA含量。
1.3.4 qRT-PCR法检测TFEB mRNA表达用TRIzol总RNA提取试剂,提取各组RNA,核酸蛋白分析仪测定D(260)/D(280)及总RNA浓度。各组分别取2 μg总RNA,按照常规方法进行逆转录反应,cDNA产物放于-20 ℃保存。配制qPCR反应体系,进行实时荧光定量PCR,每组各3个平行。目的基因(TFEB)和内参基因(GAPDH、β-actin)的引物序列如表 1所示。IQ5.0软件进行结果分析。
| 基因 | 引物序列 | 产物大小/bp |
| TFEB | 正义链:5′-ACCTGTCCGAGACCTATGGG-3′ | |
| 反义链:5′-CGTCCAGACGCATAATGTTGTC-3′ | 1 073 | |
| β-actin | 正义链:5′-CGAGGCCCCCCTGAAC-3′ | |
| 反义链:5′-GCCAGAGGCGTACAGGGATA-3′ | 324 | |
| GAPDH | 正义链:5′-TGCACCACCAACTGCTTAG-3′ | |
| 反义链:5′-GATGCAGGGATGATGTTC-3′ | 616 |
1.3.5 Western blot检测TEFB在白藜芦醇抑制氧化应激损伤中的作用
使用Solarbio公司核蛋白提取试剂盒(货号R0050),按说明书操作分离各组的核蛋白和浆蛋白。用Solarbio公司的BCA蛋白定量试剂盒(货号PC0020)测定蛋白浓度,变性各组蛋白,保存在-80 ℃备用。各组分别取60 μg蛋白进行电泳,然后电转移至0.22 μm的PVDF膜上。5% BSA封闭2 h,用一抗稀释液按1 :1 000稀释一抗,4 ℃摇床孵育过夜,用TBST振摇洗膜10 min×3次,按1 :5 000稀释二抗,室温孵育2 h,然后再洗膜10 min×3次。ECL底物化学发光显色后机器扫描存盘,用Image lab软件进行条带分析。
1.3.6 抑制TFEB对RSV调控HUVECs氧化应激损伤的影响① 接种:取第3~5代呈对数生长的HUVECs,2×105个细胞每孔接种到6孔板培养。②制备A液:6 μL的siRNA加入100 μL无血清培养基中轻柔混匀。③制备B液:6 μL siRNA转染试剂加入100 μL无血清培养基中混匀。④将A液轻柔加入B液混匀,室温放置30 min。⑤无血清培养基洗细胞2次,弃上清。⑥在原EP管中(即A+B=200 μL),加入800 μL无血清培养基,混匀后加入6孔板中。⑦孵箱培养5~7 h,根据细胞状态确定终止孵育时间。⑧终止:每孔加入1 mL含双倍血清、双倍双抗的培养基。⑨继续培养24 h后换液为完全培养基,接着开始进一步实验。
1.4 统计学分析数据以x±s表示,用GraphPad Prism 6软件作图,采用SPSS 13.0统计软件进行单因素方差分析。检验水准α=0.05。
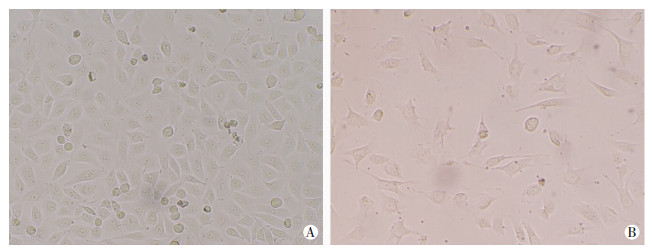
2 结果 2.1 HUVECs形态学观察实验中选取P3~P6代的HUVECs,正常组HUVECs呈贴壁生长,鹅卵石样排列,增殖状态良好(图 1A)。浓度为200 μmol/L的PA处理24 h后,HUVECs出现形态学改变,细胞梭变呈不规则形态,细胞贴壁减少(图 1B)。
|
| A:空白对照组;B: 200 μmol/L PA处理组 图 1 倒置显微镜观察两组HUVECs形态变化(×200) |
2.2 细胞增殖活力检测
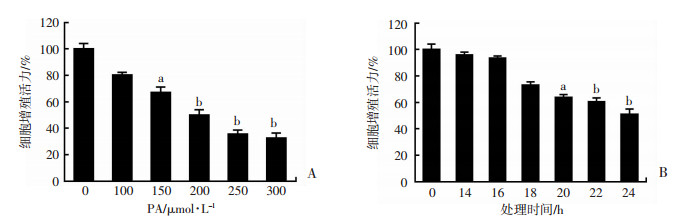
用不同浓度(100、150、200、250、300 μmol/L)的PA处理HUVECs 24 h,以及用200 μmol/L PA处理HUVECs不同时间(14、16、18、20、22、24 h),CCK-8法检测细胞增殖活力发现,PA的半抑制浓度(IC50)约为200 μmol/L,处理24 h能显著抑制HUVECs增殖活力(P<0.01,图 2)。
|
| a:P < 0.05,b:P < 0.01,与空白对照组比较 图 2 不同浓度(A)、不同时间(B)PA处理对HUVECs增殖活力的影响 |
2.3 PA诱导的HUVECs氧化应激损伤检测
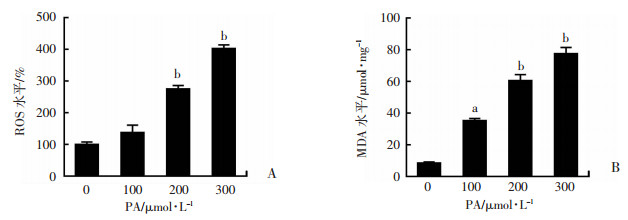
荧光酶标仪检测HUVECs的ROS和MDA水平发现,与对照组比较,200、300 μmol/L的PA处理24 h后,细胞内ROS和MDA水平显著升高(P < 0.01,图 3),并与PA浓度呈剂量依赖关系,说明PA可诱导HUVECs氧化应激损伤。
|
| a:P < 0.05,b:P < 0.01,与空白对照组比较 图 3 荧光酶标仪检测细胞内ROS(A)及MDA(B)水平 |
2.4 RSV对PA诱导的内皮细胞氧化应激损伤的影响
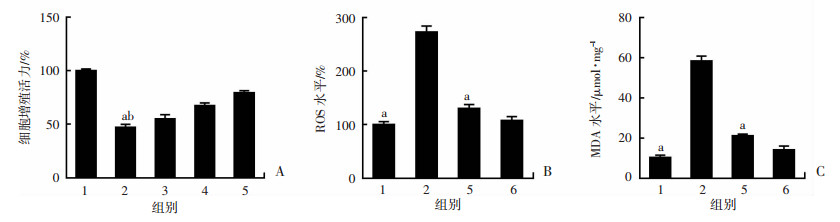
CCK-8法检测细胞增殖活力发现,不同浓度(0.1、1.0、10.0 μmol/L)白藜芦醇预处理2 h后,可以抑制PA诱导的内皮细胞活力降低,并与RSV浓度呈剂量依赖关系(P < 0.05, 图 4A)。荧光酶标仪检测ROS和MDA水平发现,PA 200 μmol/L处理HUVECs 24 h,能显著升高细胞ROS和MDA水平,而10 μmol/L白藜芦醇预处理2 h能显著抑制该作用(P < 0.01, 图 4B、C)。结果显示:白藜芦醇能显著抑制PA诱导的内皮细胞氧化应激损伤。
|
| 1:对照组;2:PA 200 μmol/L组;3~5:0.1、1.0、10.0 μmol/L白藜芦醇+PA 200 μmol/L组;6:10 μmol/L白藜芦醇组A:CCK-8法检测细胞增殖活力;a:P < 0.05,与4组比较;b:P < 0.01,与5组比较;B:荧光酶标仪检测ROS水平;a:P < 0.01,与2组比较;C:荧光酶标仪检测MDA水平;a:P < 0.01,与PA 200 μmol/L组比较 图 4 RSV对PA诱导的内皮细胞氧化应激损伤的影响 |
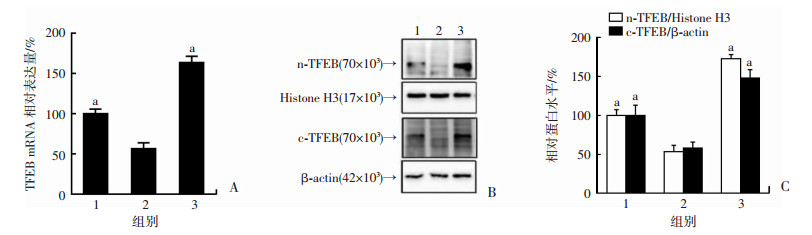
2.5 RSV对TFEB的mRNA和蛋白表达水平的影响
qRT-PCR法检测RSV对TFEB的mRNA表达水平的影响,结果显示,与对照组相比,PA 200 μmol/L处理HUVECs 24 h,对TFEB mRNA表达有明显抑制作用,而10 μmol/L的RSV预处理后,TFEB的mRNA表达显著增加(P < 0.01,图 5A)。Western blot检测结果显示,与对照组比较,PA对细胞核TFEB和细胞质TFEB的蛋白表达均有明显抑制作用(P < 0.01),白藜芦醇预处理后,细胞核TFEB和细胞质TFEB的蛋白表达均显著增加(图 5B、C),且细胞核TFEB的表达增加更多。结果显示:白藜芦醇可以显著上调PA刺激下的TFEB表达水平,且可能促进了TFEB的核转位。
|
| 1:对照组;2:PA 200 μmol/L组;3: 10 μmol/L白藜芦醇+PA 200 μmol/L组A:qRT-PCR法检测TFEB的mRNA表达水平;B:Western blot检测TFEB的蛋白表达水平;C:半定量分析;a:P < 0.01,与PA 200 μmol/L组比较 图 5 RSV对TFEB的mRNA和蛋白表达水平的影响 |
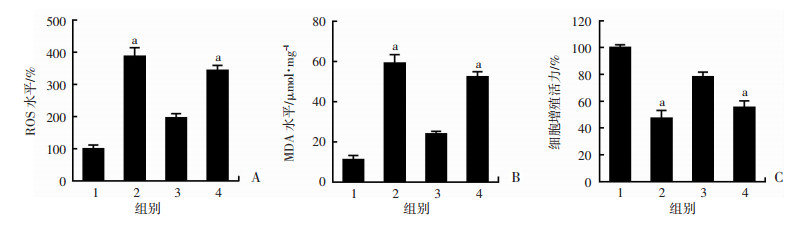
2.6 抑制TFEB对RSV调控HUVECs氧化应激损伤的影响
细胞进行siRNA转染后,RSV预处理2 h,PA处理24 h,酶标仪检测ROS和MDA水平,结果显示,RSV预处理能明显抑制PA诱导的内皮细胞ROS和MDA水平升高,而TFEB siRNA转染组中,RSV的作用被明显抑制(P < 0.01,图 6A、B)。CCK-8法检测结果显示,白藜芦醇预处理能显著抑制PA诱导的细胞活力降低,而TFEB siRNA转染组,白藜芦醇的作用明显减弱(P < 0.01,图 6C)。结果显示:RSV是通过调控TFEB从而抑制PA诱导的内皮细胞氧化应激损伤。
|
| 1:对照组;2:PA 200 μmol/L组;3: 10 μmol/L白藜芦醇+PA 200 μmol/L组;4:10 μmol/L白藜芦醇+PA 200 μmol/L+siTFEB干扰组;A:ROS水平检测;B:MDA水平检测;C:细胞增殖活力检测;a:P < 0.01,与10 μmol/L白藜芦醇+PA 200 μmol/L组比较 图 6 抑制TFEB对RSV调控HUVECs氧化应激损伤的影响 |
3 讨论
RSV作为多酚类植物化合物的代表,已有许多研究表明其具有多种健康生物学功效,可以调节脂质代谢,减少血小板聚集,诱导血管舒张,还可以抑制ROS的生成,增加NO生成,抑制炎症因子表达,维持内皮功能稳态,具有显著的心血管保护作用[14-19]。但是,RSV的具体作用机制至今尚未完全阐明。本研究用PA处理HUVECs,通过检测细胞活力指标、氧化应激指标以及脂质过氧化指标,发现PA处理诱导了内皮细胞氧化应激损伤,RSV预处理可显著抑制细胞氧化应激水平,维持内皮细胞稳态。在这一抗氧化效应基础上,我们进一步探索RSV可能的作用机制。
前期研究表明,RSV可以通过调节沉默信息调节子SIRT1依赖的自噬信号通路,发挥与能量限制(caloric restriction,CR)相似的促长寿效应[20]。RSV可以通过激活自噬,维持内皮细胞稳态[12]。并且,RSV可以通过激活AMPK-SIRT1-PGC1α轴减轻肾脏脂毒性[21],以及可以通过激活AMPK-PGC1α-SIRT3轴发挥抗氧化应激效应[6]。SETTEMBRE等[9]研究发现,饥饿可以诱导TFEB产生,TFEB是一种调节溶酶体生成和自噬产生的重要转录因子,可以激活PGC1α相关脂质代谢通路,同时,激活TFEB也可以产生CR类似效应。因此,我们推测,TFEB的激活可能是RSV发挥保护性生物效应的关键因素,而目前尚少见相关研究报道。因此,我们运用TFEB siRNA转染等实验技术,开展了围绕TFEB的RSV新机制探索研究。
本研究发现,RSV可显著抑制PA诱导的TFEB mRNA和蛋白表达水平降低,并且,胞核蛋白中的TFEB增加程度较胞质蛋白更为明显,提示RSV有促进TFEB核转位,激活TFEB效应。转染TFEB siRNA后,RSV的抗氧化应激保护效应被明显减弱,由此,揭示了在RSV抑制PA诱导的血管内皮细胞氧化应激损伤中,TFEB是其关键环节。TFEB的研究将可能成为RSV抗AS研究的一个突破点,因此,下一步可以围绕TFEB的上下游通路进行探索,例如上游可能存在RSV-AMPK-TFEB-PGC1α调节轴。此外,TFEB作为调节自噬及溶酶体生成过程中的关键分子,我们还可以进一步探索TFEB对相关的基因如ATP6V0D1、LAMP1、CTSB、MAP1LC3B、UVRAG等mRNA表达的影响;以及对LC3、P62、LAMP1等蛋白表达的影响;还可以做自噬小体检测、溶酶体生成检测、TFEB核转位荧光检测等,这也都是本团队后续的研究重点。
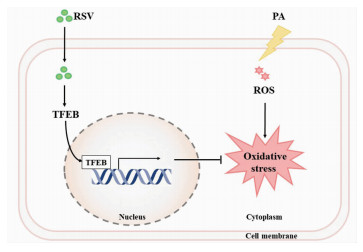
综上所述,本研究发现RSV通过激活TFEB,抑制了PA诱导的HUVECs氧化应激损伤(图 7)。这对于探索AS防治的新策略具有重要价值,为将来围绕TFEB开展RSV抗AS研究提供了实验基础和理论支持。
|
| 图 7 RSV通过激活TFEB抑制PA诱导的HUVECs氧化应激损伤模式 |
| [1] | CHANG P P, WRUCK L M, SHAHAR E, et al. Trends in hospitalizations and survival of acute decompensated heart failure in four US communities (2005-2014): ARIC study community surveillance[J]. Circulation, 2018, 138(1): 12–24. DOI:10.1161/CIRCULATIONAHA.117.027551 |
| [2] | SHAW L J, GOYAL A, MEHTA C, et al. 10-Year resource utilization and xosts for cardiovascular care[J]. J Am Coll Cardiol, 2018, 71(10): 1078–1089. DOI:10.1016/j.jacc.2017.12.064 |
| [3] | SCHOBER A, WEBER C. Mechanisms of microRNAs in atherosclerosis[J]. Annu Rev Pathol, 2016, 11: 583–616. DOI:10.1146/annurev-pathol-012615-044135 |
| [4] | TAJBAKHSH A, REZAEE M, KOVANEN P T, et al. Efferocytosis in atherosclerotic lesions: malfunctioning regulatory pathways and control mechanisms[J]. Pharmacol Ther, 2018, 188: 12–25. DOI:10.1016/j.pharmthera.2018.02.003 |
| [5] | FÖRSTERMANN U, XIA N, LI H. Roles of vascular oxidative stress and nitric oxide in the pathogenesis of atherosclerosis[J]. Circ Res, 2017, 120(4): 713–735. DOI:10.1161/CIRCRESAHA.116.309326 |
| [6] | ZHOU X, CHEN M, ZENG X, et al. Resveratrol regulates mitochondrial reactive oxygen species homeostasis through Sirt3 signaling pathway in human vascular endothelial cells[J]. Cell Death Dis, 2014, 5: e1576. DOI:10.1038/cddis.2014.530 |
| [7] |
苏倩. Akt信号通路通过激活TFEB而抑制氧化应激诱导的神经细胞凋亡[D]. 石家庄: 河北医科大学, 2017.
SU Q. Activation of Akt signaling pathway suppresses oxidative stress-induced neuronal apoptosis through phosphorylating TFEB[D]. Shijiazhuang: Hebei Medical University, 2017. |
| [8] |
徐得莱. 转录因子EB在氧化应激诱导细胞自噬中的作用[D]. 苏州: 苏州大学, 2016.
XU D L. The role of transcription factor EB in oxidative stress induced cell autophagy[D]. Suzhou: Soochow University, 2016. |
| [9] | SETTEMBRE C, DE CEGLI R, MANSUETO G, et al. TFEB controls cellular lipid metabolism through a starvation-induced autoregulatory loop[J]. Nat Cell Biol, 2013, 15(6): 647–658. DOI:10.1038/ncb2718 |
| [10] | SETTEMBRE C, DI MALTA C, POLITO V A, et al. TFEB links autophagy to lysosomal biogenesis[J]. Science, 2011, 332(6036): 1429–1433. DOI:10.1126/science.1204592 |
| [11] | SARDIELLO M, PALMIERI M, DI RONZA A, et al. a gene network regulating lysosomal biogenesis and function[J]. Science, 2009, 325(5939): 473–477. DOI:10.1126/science.1174447 |
| [12] | CHEN M L, YI L, JIN X, et al. Resveratrol attenuates vascular endothelial inflammation by inducing autophagy through the cAMP signaling pathway[J]. Autophagy, 2013, 9(12): 2033–2045. DOI:10.4161/auto.26336 |
| [13] |
周曦, 易龙, 金鑫, 等. SIRT1/UCP2通路在白藜芦醇抑制血管内皮细胞氧化应激损伤中的作用[J].
第三军医大学学报, 2013, 35(16): 1671–1675.
ZHOU X, YI L, JIN X, et al. Role of SIRT1/UCP2 signaling pathway in resveratrol-induced inhibition of oxidative injure in vascular endothelial cells[J]. J Third Mil Med Univ, 2013, 35(16): 1671–1675. |
| [14] | ZHU X D, LEI X P, DONG W B. Resveratrol as a potential therapeutic drug for respiratory system diseases[J]. Drug Des Devel Ther, 2017, 11: 3591–3598. DOI:10.2147/DDDT.S148868 |
| [15] | POLLACK R M, BARZILAI N, ANGHEL V, et al. Resveratrol improves vascular function and mitochondrial number but not glucose metabolism in older adults[J]. J Gerontol a Biol Sci Med Sci, 2017, 72(12): 1703–1709. DOI:10.1093/gerona/glx041 |
| [16] | LI Y R, LI S, LIN C C. Effect of resveratrol and pterostilbene on aging and longevity[J]. Biofactors, 2018, 44(1): 69–82. DOI:10.1002/biof.1400 |
| [17] | BONKOWSKI M S, SINCLAIR D A. Slowing ageing by design: the rise of NAD+ and sirtuin-activating compounds[J]. Nat Rev Mol Cell Biol, 2016, 17(11): 679–690. DOI:10.1038/nrm.2016.93 |
| [18] | PETROVSKI G, GURUSAMY N, DAS D K. Resveratrol in cardiovascular health and disease[J]. Ann N Y Acad Sci, 2011, 1215: 22–33. DOI:10.1111/j.1749-6632.2010.05843.x |
| [19] | CSISZAR A. Anti-inflammatory effects of resveratrol: possible role in prevention of age-related cardiovascular disease[J]. Ann N Y Acad Sci, 2011, 1215: 117–122. DOI:10.1111/j.1749-6632.2010.05848.x |
| [20] | MORSELLI E, MAIURI M C, MARKAKI M, et al. Caloric restriction and resveratrol promote longevity through the sirtuin-1-dependent induction of autophagy[J]. Cell Death Dis, 2010, 1: e10. DOI:10.1038/cddis.2009.8 |
| [21] | KIM M Y, LIM J H, YOUN h H, et al. Resveratrol prevents renal lipotoxicity and inhibits mesangial cell glucotoxicity in a manner dependent on the AMPK-SIRT1-PGC1α axis in db/db mice[J]. Diabetologia, 2013, 56(1): 204–217. DOI:10.1007/s00125-012-2747-2 |



