非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是导致肝细胞癌的主要因素之一[1],目前NAFLD在中国的发病率已经超过了10%,而在发达国家中更是高达20%左右[2],但针对NAFLD仍缺乏特效的预防和治疗药物。“二次打击假说”认为:第一次打击以脂质在肝脏中大量蓄积为主要特征,而没有炎症性改变或仅伴有非常轻微的炎症改变;然后引发第二次打击,以肝脏的炎症性改变、坏死甚至纤维化的发生为主要特征,由异常细胞因子释放、细胞氧化应激所引起,是疾病发生发展的重要过程[3]。肝脏产生炎症反应及脂代谢紊乱是NAFLD发生过程中的重要因素,而炎症反应更是贯穿其始终[4]。CD36属于B类清道夫受体家族,是一个双跨膜表面糖蛋白[5-6]。CD36能够与众多的配体识别并发生反应[7]。CD36在脂肪酸转运中具有重要的作用,如与肌肉、心肌对脂肪酸的摄取能力有关[8-9]。
本课题组已有研究表明,炎症因子能够刺激肝脏、肾脏等CD36的表达上调[10-11]。本研究使用炎症因子TNF-α和IL-6处理HepG2细胞,诱发肝细胞炎症反应,观察炎症对细胞脂质沉积和外源性脂肪酸摄取的影响;进一步对HepG2细胞进行CD36 siRNA干扰,旨在阐明CD36在其中所扮演的角色。
1 材料与方法 1.1 细胞及主要试剂HepG2购自美国模式培养物集存库(American Type Culture Collection, ATCC)。细胞培养基(DMEM)及胎牛血清购自美国HyClone公司;牛血清白蛋白(bovine serum albumin, BSA)购于美国Sigma公司;Trizol RNA抽提试剂、SYBR Green PCR Master Mix及逆转录试剂盒购自日本TaKaRa公司。TG和FFA检测试剂盒分别购于南京建成、武汉华美;细胞ROS和H2O2检测试剂盒均购于碧云天生物技术研究所;荧光标记脂肪酸(BODIPY FL C16)购自美国Invitrogen公司。转染试剂X-treme GENE SiRNA Transfection Reagent购自瑞士Roche公司。PCR引物采用TaqMan Primer Express软件设计,由北京六合华大基因科技公司合成,CD36 siRNA由上海吉玛制药有限公司化学合成。
1.2 细胞培养HepG2细胞在DMEM高糖(不含丙酮酸钠)培养基中培养,其中含有胎牛血清(10%)和青链霉素(100 U/mL、100 μg/mL)。细胞置于37 ℃、5% CO2培养箱中培养,1~2 d换液,3~4 d传代。
1.3 实验分组待细胞生长至汇合度70%~80%时,用含0.2% BSA的无血清DMEM培养基处理,24 h后再按照以下处理分为3个组:(1)Control组:0.2% BSA+0.04 mmol/L软脂酸;(2)TNF-α组:0.2% BSA+0.04 mmol/L软脂酸+25 ng/mL TNF-α;(3)IL-6组:0.2% BSA+0.04 mmol/L软脂酸+20 ng/mL IL-6。以上3组处理24 h后收集细胞进行以下检测。
1.4 小干扰RNA(small interference RNA, siRNA)的合成及转染siRNA交由上海吉玛公司设计和合成(CD36-siRNA正义链:5′-GGCUGUGUUUGGAGGUAUUCUTT-3′,反义链:5′-AGAAUACCUCCAAACACAGCCTT-3′)和阴性对照siRNA(NC-siRNA正义链:5′-UUCUCCGA-ACGUGUCACGUTT-3′,反义链:5′-ACGUGACACGUU-CGGAGAATT-3′)。
当细胞融合度至30%~50%时,将CD36-siRNA及NC-siRNA分别转染到HepG2细胞:50 μL DMEM培养基加入0.5 μg DNA,短暂轻柔漩涡,加入1.5 μL X-tremeGENE HP DNA Transfection Reagent,短暂轻柔漩涡,室温孵育15~30 min(15~25 ℃),将转染复合物逐滴加入到细胞中,7~8 h在显微镜下观察转染效率。
1.5 实时荧光定量PCR检测mRNA的表达使用RNAiso Plus提取细胞总RNA,然后用PrimeScript®RT reagent Kit将总RNA反转录成cDNA。反转录条件是:37 ℃ 15 min,85 ℃ 5 s,保存于-20 ℃。再以cDNA为模板,实时荧光定量PCR检测基因的mRNA表达水平。PowerSYBR Green PCR Master Mix试剂盒进行扩增,反应条件:50 ℃ 2 min,95 ℃ 5 min预变性;95 ℃ 20 s,55 ℃ 20 s,40个循环。反应体系为25 μL,用ΔΔCt计算基因的表达水平,公式如下:ΔCt=目的基因Ct值-β-actin基因Ct值,ΔΔCt=实验组ΔCt-对照组ΔCt,实验组相对于对照组基因表达水平的倍数=2-ΔΔCt。设计的引物序列见表 1。
| 基因名称 | 引物序列 |
| CD36 | 上游: 5′-ACGGGCTGAGCAAGGTTGA-3′ |
| 下游: 5′-TTCGTTGGGTGGGTAGATGG-3′ | |
| β-actin | 上游: 5′-CCTGGCACCCAGCACAAT-3′ |
| 下游: 5′-GCCGATCCACACGGAGTA-3′ |
1.6 TG及FFA含量的测定
使用6孔板接种细胞(每孔接种约5×105个),经过实验处理后,收集细胞并提取细胞脂质,然后收集细胞上清液,在真空条件下进行干燥。用比色法检测其TG含量,ELISA法检测FFA的含量;再分别计算TG、FFA与细胞总蛋白量的比值,得出各组TG及FFA的相对含量。
1.7 H2O2及ROS含量测定分别按照检测试剂盒说明书进行操作,对于ROS的测定,需先使用10 μmol/L的2’, 7’-二氯荧光素二醋酸盐荧光探针(2’, 7’-dichlorofluorescin diacetate, DCFH-DA)在37.0 ℃孵育细胞40 min。然后BCA法测定各组细胞的蛋白浓度,分别计算H2O2及ROS含量与总蛋白量的比值,求出各组H2O2及ROS的相对含量。
1.8 统计学分析所有数据采用GraphPad Prism 5统计分析软件进行处理,数据均以x±s表示,独立样本t检验用于两样本均数间的比较,检验水准α=0.05。
2 结果 2.1 炎症因子促进HepG2细胞TG及FFA的累积炎症因子处理后,HepG2细胞的FFA及TG含量均显著增加。其中IL-6组的FFA含量增加110.97%(P=0.000),TG含量增加45.96%(P=0.229);TNF-α组的FFA含量增加99.82%(P=0.000),TG含量增加39.95%(P=0.005)。见图 1。
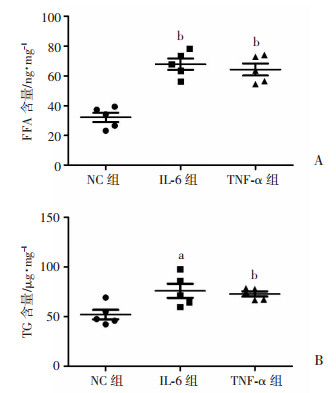
|
| A:FFA含量;B:TG含量;a:P < 0.05,b:P < 0.01,与NC组比较 图 1 炎症因子对HepG2细胞FFA及TG含量的影响(n=5, x±s) |
2.2 CD36低表达的HepG2细胞模型构建成功
在HepG2细胞中瞬时转入CD36-siRNA,成功构建CD36低表达的HepG2细胞(CD36 KD组)和阴性对照HepG2细胞(NC HepG2组)。NC组及CD36 KD组的CD36 mRNA表达定量值分别为1.001±0.056及0.380±0.148。与NC组相比,CD36 KD组中HepG2细胞的CD36 mRNA表达降低了62.03%,差异具有统计学意义(P=0.002)。
2.3 下调CD36抑制HepG2细胞FFA及TG的累积在炎症因子刺激下,对照组HepG2细胞(NC组)的细胞内脂质积聚明显增加(P < 0.05)。而当CD36的表达下调之后,CD36 KD组炎症因子促进胞内FFA及TG含量上升的趋势得到了抑制(P < 0.05),从而改善了细胞脂质异常积聚的现象(图 2)。

|
| A:FFA含量;B:TG含量;a:P < 0.05, 与Control组比较;b:P < 0.05, 与NC比较 图 2 CD36低表达时HepG2细胞中FFA及TG测定结果(n=4, x±s) |
2.4 下调CD36抑制炎症引起的HepG2细胞脂肪酸的动态摄取增加
在炎症因子刺激下,对照组HepG2细胞(NC组)脂肪酸的动态摄取量明显增加(P < 0.05)。而当CD36的表达下调之后,CD36 KD组炎症因子引起的HepG2细胞的脂肪酸动态摄取量增加的现象得到了改善(P < 0.05,表 2、3)。
| 组别 | 0 s | 28s | 56 s | 84 s | 112 s | 140 s | 168 s |
| NC组 | 0.000±0.000 | 5.239±0.287 | 7.452±0.599 | 9.945±0.609 | 12.228±1.082 | 13.725±0.328 | 15.589±1.232 |
| NC+IL-6组 | 0.000±0.000 | 9.558±2.119a | 16.228±2.166b | 21.619±2.559b | 26.088±3.720b | 28.107±3.009b | 29.667±3.989b |
| CD36 KD+IL-6组 | 0.000±0.000 | 5.740±0.313c | 8.442±0.942d | 10.704±2.151d | 13.388±1.483d | 15.623±1.075d | 15.933±1.131d |
| a:P < 0.05,b:P < 0.01,与NC组比较;c:P < 0.05,d:P < 0.01,与NC+IL-6组比较 | |||||||
| 组别 | 0 s | 28 s | 56 s | 84 s | 112 s | 140 s | 168 s |
| NC组 | 0.000±0.000 | 5.239±0.287 | 7.452±0.599 | 9.945±0.609 | 12.228±1.082 | 13.725±0.328 | 15.589±1.232 |
| NC+TNF-α组 | 0.000±0.000 | 9.166±2.188a | 13.374±2.778a | 17.938±3.183a | 22.517±4.003a | 26.797±4.300b | 28.628±4.188b |
| CD36 KD+TNF-α组 | 0.000±0.000 | 5.833±0.426 | 8.109±0.887c | 11.364±2.134c | 15.104±2.198c | 17.116±2.512c | 20.063±1.062c |
| a:P < 0.05,b:P < 0.01,与NC组比较;c:P < 0.05,与NC+TNF-α组比较 | |||||||
2.5 CD36下调后缓解炎症引起的HepG2细胞氧化应激
在炎症因子刺激下,对照组HepG2细胞(NC组)中的过氧化氢和活性氧含量明显增加(P < 0.05)。而当HepG2细胞中的CD36表达下调后,炎症因子引起的肝细胞氧化应激被改善(P < 0.01),从而减轻了对HepG2细胞的损害(图 3)。
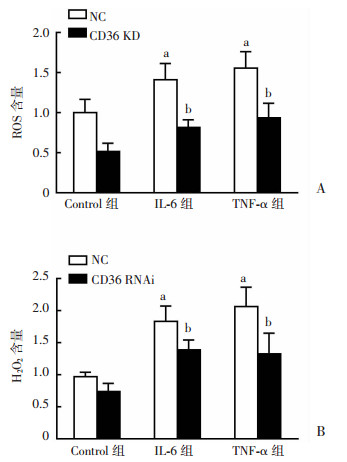
|
| A:ROS含量;B:H2O2含量;a:P < 0.05, 与Control组比较;b:P < 0.05, 与NC比较 图 3 CD36对炎症状态下HepG2细胞氧化应激的影响(n=4, x±s) |
3 讨论
脂代谢紊乱和炎症反应是NAFLD发生发展的重要原因。我们课题组长期致力于研究炎症与脂质代谢的关系,以阐释炎症与脂质代谢如何相互作用,共同促进NAFLD的发生发展。我们前期大量的研究结果已经表明炎症能够影响脂质代谢平衡:能够通过LDLr调节增加对胆固醇的摄取,通过ABCA1抑制其外流,并通过调节胆固醇合成酶HMG-coA减少胆固醇的合成[12],且能够通过脂肪酸的内源性合成影响脂肪酸的代谢[13]。脂肪酸的代谢平衡由脂肪酸摄取、内源性合成、TG外排共同维持,其中肝脏的脂质60%左右来源于外源性的脂肪酸摄取,可见脂肪酸摄取对于调节肝脏脂质代谢平衡具有重要贡献。在前期研究的基础上,我们的研究旨在探讨炎症对外源性脂肪酸摄取的影响,以完善炎症对脂质代谢调节的理论。在本研究中,我们发现炎症状态下HepG2细胞的FFA及TG的含量明显增加,同时在FFA动态摄取实验中观察到,炎症刺激能够引起细胞对脂肪酸的摄取增加,提示炎症可能通过促进脂肪酸摄取引起胞内脂质积聚。
前期研究结果提示:CD36与炎症密切相关,互为因果。一方面,CD36能够介导炎症反应的产生[14]。CD36能够与氧化型低密度脂蛋白(ox-LDL)结合,激活JNK信号通路诱发炎症反应;另外,CD36能够介导ROS的产生,通过激活NLRP3炎症小体[5],促进炎症反应的发生。另一方面,炎症也能促进CD36的异常高表达,有研究表明炎症能够刺激肝脏及血管中CD36的蛋白表达增加[15]。由于炎症和CD36的密切相关性,我们进一步探讨了炎症是否通过CD36介导外源性脂肪酸的摄取,诱发脂质积聚。在实验中我们观察到:当CD36被干扰后,炎症引起的脂质积聚得到抑制;并且炎症引起的HepG2细胞的脂肪酸摄取增加得到了控制,说明CD36可能是炎症促进脂肪酸摄取的关键因素。
前期研究也证实了CD36可能是代谢综合征的一个潜在治疗靶点,且与NAFLD的发生密切相关。临床实验表明,NAFLD患者体内CD36表达量上升,与肝脏中脂肪的含量呈正相关[16],并且人血清中游离的CD36蛋白和肝脏中的CD36含量呈正相关,与NAFLD患者的脂肪变性组织学分级、胰岛素抵抗、体质指数等也呈正相关。目前已有研究证实,在肝脏中,CD36能通过介导脂质积聚导致NAFLD的发生[17-18]。
细胞脂毒性,包括细胞内非酯化的FFA和TG的积累,被认为是导致器官功能障碍的重要因素[19]。比如,肝细胞内的FFA增多会导致很强的细胞毒性,而后又通过加强IL-6等细胞因子的毒性,引起氧化应激和内质网应激等反应,进一步导致细胞功能的下降甚至细胞的凋亡[20]。我们的研究结果表明:炎症因子能够上调HepG2细胞内过氧化氢和活性氧含量,而CD36的表达下调能够缓解炎症因子导致的肝细胞的氧化应激现象,从而减轻了对HepG2细胞的损害,这说明CD36的下调在炎症状态下对肝脏有保护作用。
本研究结果表明,炎症因子能够通过CD36上调HepG2细胞对外源性FFA的摄取,造成胞内大量的脂质积聚,进而诱发细胞脂毒性。本研究为深入研究CD36在肝脏代谢性炎症中的作用提供了初步的实验证据,同时提示CD36可能是防治NAFLD的潜在靶点。
| [1] | KHOONSARI M, MOHAMMAD HOSSEINI AZAR M, GHAVAM R, et al. Clinical manifestations and diagnosis of nonalcoholic fatty liver disease[J]. Iran J Pathol, 2017, 12(2): 99–105. |
| [2] | DAY C P. Pathogenesis of steatohepatitis[J]. Best Pract Res Clin Gastroenterol, 2002, 16(5): 663–678. DOI:10.1053/bega.2002.0333 |
| [3] | SAXTON R A, SABATINI D M. mTOR signaling in growth, metabolism, and disease[J]. Cell, 2017, 169(2): 361–371. DOI:10.1016/j.cell.2017.03.035 |
| [4] | PEPINO M Y, KUDA O, SAMOVSKI D, et al. Structure-function of CD36 and importance of fatty acid signal transduction in fat metabolism[J]. Annu Rev Nutr, 2014, 34: 281–303. DOI:10.1146/annurev-nutr-071812-161220 |
| [5] | LIU W, YIN Y, ZHOU Z, et al. OxLDL-induced IL-1 beta secretion promoting foam cells formation was mainly via CD36 mediated ROS production leading to NLRP3 inflammasome activation[J]. Inflamm Res, 2014, 63(1): 33–43. DOI:10.1007/s00011-013-0667-3 |
| [6] | GOTODA T, IIZUKA Y, YAMADA N. Complex connection between CD36 and atherosclerosis, lipid metabolism, and insulin resistance syndromes[J]. Curr Atheroscler Rep, 2000, 2(6): 453–454. DOI:10.1007/s11883-000-0042-z |
| [7] | STEWART C R, STUART L M, WILKINSON K, et al. CD36 ligands promote sterile inflammation through assembly of a Toll-like receptor 4 and 6 heterodimer[J]. Nat Immunol, 2010, 11(2): 155–161. DOI:10.1038/ni.1836 |
| [8] | GHARIB M, TAO H, FUNGWE T V, et al. Cluster differentiating 36 (CD36) deficiency attenuates obesity-associated oxidative stress in the heart[J]. PLoS ONE, 2016, 11(5): e0155611. DOI:10.1371/journal.pone.0155611 |
| [9] | MA K L, RUAN X Z, POWIS S H, et al. Inflammatory stress exacerbates lipid accumulation in hepatic cells and fatty livers of apolipoprotein E knockout mice[J]. Hepatology, 2008, 48(3): 770–781. DOI:10.1002/hep.22423 |
| [10] | WANG C, HU L, ZHAO L, et al. Inflammatory stress increases hepatic CD36 translational efficiency via activation of the mTOR signalling pathway[J]. PLoS ONE, 2014, 9(7): e103071. DOI:10.1371/journal.pone.0103071 |
| [11] | YANG P, XIAO Y, LUO X, et al. Inflammatory stress promotes the development of obesity-related chronic kidney disease via CD36 in mice[J]. J Lipid Res, 2017, 58(7): 1417–1427. DOI:10.1194/jlr.M076216 |
| [12] | ZHONG S, ZHAO L, LI Q, et al. Inflammatory stress exacerbated mesangial foam cell formation and renal injury via disrupting cellular cholesterol homeostasis[J]. Inflammation, 2015, 38(3): 959–971. DOI:10.1007/s10753-014-0058-0 |
| [13] | ZHAO L, ZHONG S, QU H, et al. Chronic inflammation aggravates metabolic disorders of hepatic fatty acids in high-fat diet-induced obese mice[J]. Sci Rep, 2015, 5: 10222. DOI:10.1038/srep10222 |
| [14] | BIEGHS V, VAN GORP P J, WALENBERGH S M, et al. Specific immunization strategies against oxidized low-density lipoprotein: a novel way to reduce nonalcoholic steatohepatitis in mice[J]. Hepatology, 2012, 56(3): 894–903. DOI:10.1002/hep.25660 |
| [15] | ZHOU F, PAN Y, HUANG Z, et al. Visfatin induces cholesterol accumulation in macrophages through up-regulation of scavenger receptor-A and CD36[J]. Cell Stress Chaperones, 2013, 18(5): 643–652. DOI:10.1007/s12192-013-0417-z |
| [16] | KOONEN D P, JACOBS R L, FEBBRAIO M, et al. Increased hepatic CD36 expression contributes to dyslipidemia associated with diet-induced obesity[J]. Diabetes, 2007, 56(12): 2863–2871. DOI:10.2337/db07-0907 |
| [17] | INOUE M, OHTAKE T, MOTOMURA W, et al. Increased expression of PPARgamma in high fat diet-induced liver steatosis in mice[J]. Biochem Biophys Res Commun, 2005, 336(1): 215–222. DOI:10.1016/j.bbrc.2005.08.070 |
| [18] | GARCÍA-MONZÓN C, LO IACONO O, CRESPO J, et al. Increased soluble CD36 is linked to advanced steatosis in nonalcoholic fatty liver disease[J]. Eur J Clin Invest, 2014, 44(1): 65–73. DOI:10.1111/eci.12192 |
| [19] | HUA W, HUANG H Z, TAN L T, et al. CD36 mediated fatty acid-induced podocyte apoptosis via oxidative stress[J]. PLoS ONE, 2015, 10(5): e0127507. DOI:10.1371/journal.pone.0127507 |
| [20] | SMITH B K, JAIN S S, RIMBAUD S, et al. FAT/CD36 is located on the outer mitochondrial membrane, upstream of long-chain acyl-CoA synthetase, and regulates palmitate oxidation[J]. Biochem J, 2011, 437(1): 125–134. DOI:10.1042/BJ20101861 |



