氮芥(nitrogen mustard, NM)属于经典化学战剂中糜烂性毒剂,有重要的军事意义。皮肤是氮芥损伤的主要靶器官,其病理过程与烧伤类似,属于难愈性创面。氮芥诱导的皮肤损伤机制复杂,尚无特效治疗药物[1]。Fra-1基因为Fos家族(c-Fos、Fos-B、Fra-1和Fra-2)一员,在人正常皮肤表达较低[2]。Fra-1与ERK1/2及AP-1信号通路关系密切[3-4],而后者与皮肤的增殖、迁移、炎性反应等有关[4-6]。新近研究表明,ERK1/2及AP-1信号通路在氮芥染毒鼠皮肤后有改变[6],提示Fra-1可能也参与了相关作用。然而,针对Fra-1在氮芥皮肤损伤中的研究国内外报道甚少。本研究通过建立氮芥诱导皮肤损伤的体内外模型,围绕Fra-1的表达、定位及其对细胞迁移、炎性因子合成的影响,初步揭示了Fra-1的变化在其中发挥的作用。
1 材料与方法 1.1 无毛小鼠氮芥皮肤损伤模型构建氮芥盐酸盐(mechlorethamine hydrochloride)购自上海笛柏化学(分析纯,纯度>98%)。无毛小鼠SKH购自上海公共卫生中心并按标准饲养。选择12只7~9周龄健康雄性小鼠分为4组用于实验,体质量23~27 g。氮芥配置过程需保持低温,现用现配。实验过程需在良好的通风橱中操作,佩戴手套、呼吸和眼保护装置。新鲜配置1%戊巴比妥钠水溶液麻醉剂,小鼠按8 mL/kg剂量腹腔注射。待小鼠麻醉后,用PBS稀释氮芥配置成浓度2.0%,吸取20 μL均匀涂抹在背部上1/3中点处预先划定的8 mm直径的圆形区域。皮肤染毒后,小鼠于通风橱静置4 h以让皮肤充分吸收和毒剂挥发,之后将其放回动物房单笼饲养。剩余的毒物及接触物品均浸泡在10%氯胺T的醇水溶液中消毒处理。
1.2 HE染色与免疫组化在氮芥损伤鼠1、3、7、14 d时,对损伤部位取材。取材范围包括损伤区域及周边皮肤(不超过0.5 cm)。取材样本经常规固定、浸蜡、包埋方法制备蜡块。用于HE染色和免疫组化的切片厚度均为5 μm。免疫组化采用博士德的SABC试剂盒,并严格按照产品说明书进行操作。兔抗鼠Fra-1一抗为ABclonal公司产品(编号:A5372),工作时1 :100稀释,过夜孵育。二抗为生物素标记的羊抗兔抗体。镜下控制DAB显色时间,待显色合适后,水洗-脱水-透明-封片,进行观察分析。
1.3 siRNA转染角质形成细胞永生化角质形成细胞株(HaCaT)本室保存。角质形成细胞常规培养于含5%胎牛血清(康源,天津)的RIPM培养基(HyClone,USA),于CO2培养箱37 ℃培养。培养基中添加青-链霉素双抗,终浓度为100 U。角质形成细胞长满后传代至24孔板,培养24 h至细胞达到30%~50%融合度,采用siRNA Transfection试剂盒(锐博,广州)转染Fra-1 siRNA及其对照(上海吉玛)。siRNA终浓度为每孔30 nmol/L。Fra-1 siRNA序列:5′-CACCATGAGTGGCAGTCAG-3′。
1.4 染毒细胞模型建立及评价待HaCaT细胞于80%~90%融合度时进行染毒操作。采用无血清培养基新鲜配置10 mmol/L氮芥储备液,置于冰上备用。染毒前,将储备液用完全培养基稀释至工作浓度,并迅速加入培养板中。细胞染毒1 h后去除含氮芥的培养基,换成无毒剂的新鲜培养基。
细胞活性实验中,角质形成细胞接种至96孔板至第2天90%以上密度时氮芥染毒,10 h后取出按照说明书向每孔中加入10 μL的MTS溶液(Promega, USA)并混匀,放回培养箱继续培养20 min后取出,在酶标仪上以490 nm读取各孔内数值。以正常组作为对照计算其他染毒组的细胞相对活性。
1.5 细胞迁移实验Transwell小室(Corning,USA)预先用鼠尾胶原包被,其后放置在含500 μL完全培养基的24孔板中待用。siRNA转染角质形成细胞后24~48 h使用。待各组角质形成细胞长至70%~80%融合度时,改用1%血清饥饿处理24 h以抑制细胞生长。胰酶消化细胞并用PBS充分洗涤,其后换含0.2% BSA的RIMP培养基重悬。EGF处理组此刻加入表皮生长因子(EGF,PeproTech),使其终浓度为10 ng/mL。调整细胞密度为106/mL,向Trasnwell小室中加入0.1 mL细胞悬液。放置CO2培养箱培养10 h后,取出Transwell小室。吸弃小室内残留液体,并使用棉头擦拭掉残留在上层的细胞。其后倒扣小室,用结晶紫染色下层膜上细胞10 min,PBS洗涤后镜下观察拍照。为进一步统计分析,将小室浸泡于500 μL 33%醋酸溶液中并不时摇晃,待结晶紫完全溶解后,于酶标仪570 nm下进行光密度D(570)值测量。扣除本底后所得数值与每孔细胞迁移的数量呈正比。计算相对细胞迁移能力。
1.6 Western blot检测培养的细胞采用含蛋白酶抑制剂的RIPA裂解液裂解(博士德,武汉)。皮肤由于组织韧性较强,需充分粉碎以提高蛋白得率。具体方法为,将损伤皮肤(含创缘约2~3 mm)及对照皮肤小心剪下,对照皮肤采自同1只小鼠染毒附近处正常皮肤。剪下后称质量并放置于2 mL EP管内,按照1 :10的比例(质量体积比)加入含蛋白酶抑制剂的RIPA裂解液并放置于冰盒中。使用手持式电动组织匀浆机(上海净信)将探头加入管中进行高速匀浆(10 000 r/min),每操作1 min停下间隔2 min以维持样本低温,共3 min。其后4 ℃下10 000×g离心5 min,吸上清,并再次经过0.45 μm的过滤柱10 000×g离心以去除不溶物。收集滤过后的样本,并经蛋白浓度测定和变性后-80 ℃冻存备用。蛋白印迹一抗抗体:IL-1β(cell signal, USA), IL-6(博士德,武汉),Fra-1(ABclonal, USA)和β-actin(Santa cruz, USA)。蛋白印迹按照常规方法操作。
1.7 统计学分析实验均重复3次以上。采用SPSS 13.0统计软件进行t检验和单因素方差分析。检验水准α=0.01。
2 结果 2.1 氮芥损伤皮肤愈合的病理观察正常小鼠皮肤表皮层数少,角质形成细胞排列规则,细胞核明显且圆润(图 1A)。氮芥损伤1 d,创缘处部分表皮细胞胞核梭形变,排列欠规则(图 1B)。创面中心皮肤均质变性,表皮及真皮层固有有核细胞数均明显减少,并可见核碎片(图 1C)。损伤3 d,创缘处表皮增厚,上层细胞核淡染而基底层细胞核仍明显,提示分化加快(图 1D)。损伤7 d,创缘处表皮更加增厚,表皮细胞胞体明显增大,基底层和上层细胞核均淡染(图 1E)。损伤14 d,创缘处表皮有核细胞胞体减小,细胞排列紧密,层数增多,表皮细胞核染色深。靠近损伤一侧,细胞极化明显,有明显的迁移趋势。离迁移前缘稍远的上皮细胞可以辨认出组织学分层,基底层细胞排列整齐,细胞核垂直于真皮;棘层细胞胞体多型;颗粒层细胞扁平;角质层细胞缺少细胞核,细胞均染(图 1F)。以上结果提示,氮芥染毒中心区域受到高浓度氮芥作用而变性坏死,周边皮肤在氮芥损伤后1~2 d为应激和炎症反应期,损伤3~7 d创缘皮肤处于早期增殖阶段,7 d之后出现明显向损伤中心迁移表现,14 d时可以看到已再上皮化的创面进入皮肤塑型阶段。
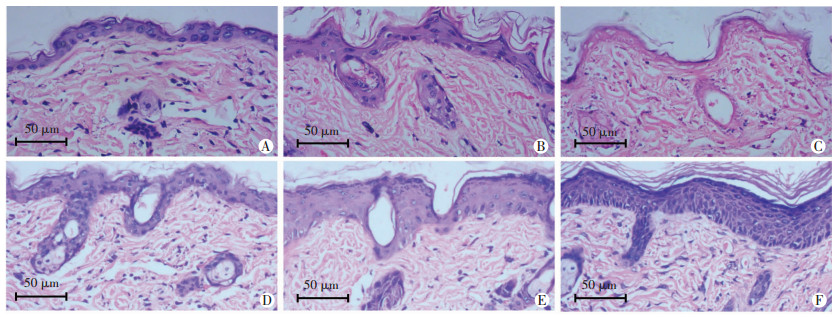
|
| A:正常皮肤;B:氮芥损伤1 d皮肤创缘;C:氮芥损伤1 d皮肤创面中心;D:氮芥损伤3 d皮肤创缘;E:氮芥损伤7 d皮肤创缘;F:氮芥损伤14 d皮肤创缘 图 1 HE染色观察氮芥染毒无毛鼠皮肤的损伤愈合过程 |
2.2 Fra-1在鼠皮肤氮芥损伤后的动态变化及定位
皮肤组织蛋白印迹结果显示,正常鼠皮肤中Fra-1水平较低,伤后3 d和14 d皮肤Fra-1增加,而且以伤后14 d增加最为显著(图 2)。免疫组化结果显示,正常小鼠中Fra-1水平在表皮中较低,真皮层有少量散在阳性细胞(图 3A)。伤后3 d,在创缘处表皮内可见散在的Fra-1阳性角质形成细胞(图 3B)。氮芥损伤14 d,在创缘处可见基底层内大量成簇状紧密排列的Fra-1阳性细胞,Fra-1表达阳性信号主要在细胞质。真皮层内仍可见散在Fra-1阳性细胞(图 3C)。
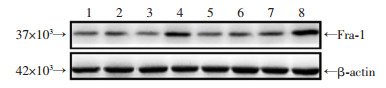
|
| 1:对照1 d;2:染毒1 d;3:对照3 d;4:染毒3 d;5:对照7 d;6:染毒7 d;7:对照14 d;8:染毒14 d 图 2 Western blot检测氮芥染毒皮肤及对照中Fra-1蛋白含量变化 |
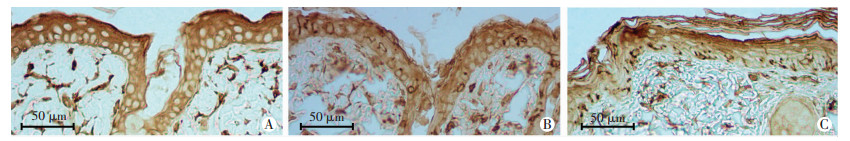
|
| A:正常皮肤;B:氮芥损伤3 d皮肤创缘;C:氮芥损伤14 d皮肤创缘 图 3 免疫组化检测正常及创缘处皮肤Fra-1的表达(SABC) |
2.3 Fra-1参与角质形成细胞炎性因子IL-6合成
HE染色结果显示,氮芥染毒3 d表皮尚处于损伤应激和炎性反应阶段,修复刚刚启动。在体外实验中通过剂量-细胞活性研究,证实20 μmol/L以上剂量明显影响细胞活性(图 4A)。进而,采用20 μmol/L的氮芥染毒角质形成细胞,验证Fra-1的表达并观察其是否对炎性因子有调控作用。结果显示,染毒后Fra-1表达自氮芥染毒细胞后3 h就明显增加,染毒10 h和24 h上升更高。IL-1β在染毒10 h及24 h表达显著增加,IL-6在染毒后24 h表达显著增加。siRNA抑制Fra-1可以显著抑制IL-6的增加,而对IL-1β表达无明显影响(图 4B)。上述结果说明,氮芥损伤角质形成细胞可以依赖增强Fra-1的方式增强IL-6炎性因子的合成。
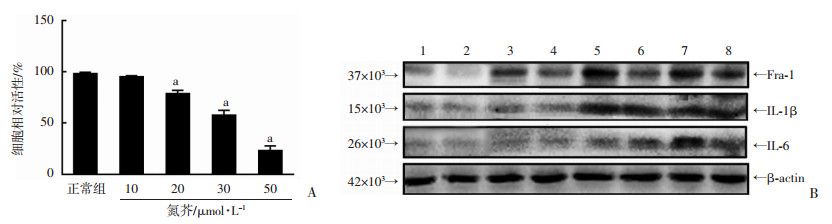
|
| A:角质形成细胞经不同浓度氮芥染毒10 h后MTS检测细胞的相对活性变化(n=3);a:P < 0.01,与正常组比较;B:Western blot检测角质形成细胞中Fra-1蛋白及细胞炎性因子IL-1β和IL-6的变化;1: si-ctrl组; 2:si-Fra-1组; 3:si-ctrl(20 μmol/L氮芥3 h)组; 4:si-Fra-1(20 μmol/L氮芥3 h)组; 5: si-ctrl(20 μmol/L氮芥10 h)组; 6:si-Fra-1(20 μmol/L氮芥10 h)组; 7:si-ctrl(20 μmol/L氮芥14 h)组; 8:si-Fra-1(20 μmol/L氮芥14 h)组 图 4 Fra-1在氮芥损伤角质形成细胞后的表达及对炎性因子调控 |
2.4 Fra-1参与调控角质形成细胞迁移
在角质形成细胞中Fra-1是否有促进细胞迁移作用尚不清楚。Western blot检测结果显示,正常人角质形成细胞中Fra-1有表达,10 ng/mL EGF显著诱导Fra-1表达增加,Fra-1 siRNA能够有效抑制细胞内Fra-1水平(图 5A)。细胞迁移实验结果显示,Fra-1 siRNA不仅能对正常细胞,也能对EGF刺激的角质形成细胞迁移有显著抑制作用(图 5B、C)。这些结果证实Fra-1参与角质形成细胞迁移的调控。
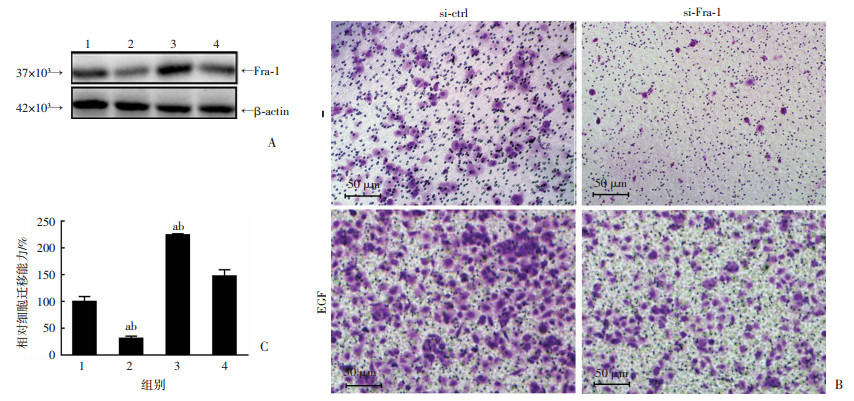
|
| A:Western blot检测EGF处理10 h及Fra-1 siRNA对Fra-1蛋白水平影响;B:Transwell显色EGF(10 h)及Fra-1 siRNA处理后迁移角质形成细胞(结晶紫);C:酶标仪检测结晶紫染色迁移细胞相对细胞迁移能力(n=3);1:si-ctrl组,2:si-Fra-1组,3:si-ctrl(10 ng/mL EGF)组,4:si-Fra-1(10 ng/mL EGF)组;a:P < 0.01,与si-ctrl组比较;b: P < 0.01,与si-Fra-1(10 ng/mL EGF)组比较 图 5 Fra-1对角质形成细胞迁移的调控 |
3 讨论
本研究发现,Fra-1在正常小鼠表皮中表达较低;在氮芥损伤早期,Fra-1阳性信号出现并散在分布于创缘的表皮基底层细胞;随着再上皮化的进展,Fra-1阳性细胞簇状分布于基底层细胞,呈现出表达与损伤修复进程正相关的特点。Fra-1早期增加可能与皮肤急性损伤引起的应激反应有关,研究报道动物皮肤ERK1/2磷酸化在氮芥暴露后24 h处于激活状态[6]。Fra-1在修复期的增加可能与伤处皮肤EGF和TGF等生长因子的增加有关。Fra-1由于含有核定位信号通常位于胞核中。我们观察到Fra-1主要分布在全层表皮细胞的胞质,只在部分基底层细胞胞核聚集,这可能与细胞的增殖状态或细胞处于氧化应激状态有关。研究报道高水平的氧化应激会延长胞核染色质上磷酸化ERK1/2和磷酸化c-Fos的积累,抑制胞质中Fra-1进入胞核,同时维持了Fra-1蛋白的稳定性[7-10]。
目前认为,AP-1的功能及作用方式多样,主要与参与形成的Fos/Jun的组分有关。c-Fos/AP-1二聚体被认为是主要的AP-1转录活性因子。Fra-1自身缺乏转录活性的功能域,其形成的Fra-1/AP-1二聚体的转录活性低,仅存在一些有限的基因调控功能。Fra-1主要通过与c-Fos竞争结合Jun,抑制二聚体c-Fos/AP-1的形成发挥作用[11]。既往研究表明,c-Fos/AP-1的水平在经历染毒后12 h的升高后于3 d显著降低,其后又在5 d增加[6]。本研究所得的Fra-1的变化结果也间接证明其对c-Fos/AP-1的负调控作用。此外,我们检测到Fra-1参与了氮芥染毒后角质形成细胞IL-6表达的调控,而类似的调节机制在巨噬细胞中也存在,且是以Fra-1直接结合到IL-6启动子区域发挥作用[12]。氮芥染毒早期皮肤处于应激状态,炎性水平较高,其中,IL-6是一个重要的炎性因子,参与了芥子气皮肤损伤的炎性反应[13]。此外,我们证实Fra-1有促进体外培养的角质形成细胞迁移的作用,结合氮芥染毒鼠后期(14 d)皮肤基底层细胞中广泛表达Fra-1,我们推测Fra-1也参与了氮芥皮肤损伤后的修复过程。有文献报道Fra-1可以通过抑制整合素-β1的激活保持RHO-GTP的低活性以促进迁移[14],也有报道Fra-1可以调控如CD44、MMP-1和MMP-9等迁移分子[15-16]。相关机制是否在角质细胞中存在需要后期进一步研究阐明。Fra-1的增加在氮芥皮肤损伤后可能还有其他作用,研究表明,皮肤移植后Fra-1增加可以抑制角质形成细胞VEGF的分泌,从而阻碍皮肤微环境的重建[17]。因此,Fra-1准确的时空调控在皮肤成功修复过程中有重要作用。
本研究建立了氮芥无毛鼠皮肤损伤的模型,并对Fra-1的时空变化进行了检测,发现Fra-1的表达和分布方式在氮芥表皮损伤的应急期和修复期存在差异。Fra-1促进了染毒表皮早期的IL-6合成和后期的细胞迁移修复,进一步揭示相关的调控机制,加深芥子气皮肤损伤修复作用机制的理解。
| [1] | KEHE K, BALSZUWEIT F, STEINRITZ D, et al. Molecular toxicology of sulfur mustard-induced cutaneous inflammation and blistering[J]. Toxicology, 2009, 263(1): 12–19. DOI:10.1016/j.tox.2009.01.019 |
| [2] | MEHIC D, BAKIRI L, GHANNADAN M, et al. Fos and jun proteins are specifically expressed during differentiation of human keratinocytes[J]. J Invest Dermatol, 2005, 124(1): 212–220. DOI:10.1111/j.0022-202X.2004.23558.x |
| [3] | BARROS J C, MARSHALL C J. Activation of either ERK1/2 or ERK5 MAP kinase pathways can lead to disruption of the β-actin cytoskeleton[J]. J Cell Sci, 2005, 118(Pt 8): 1663–1671. DOI:10.1242/jcs.02308 |
| [4] | ECKERT R L, ADHIKARY G, YOUNG C A, et al. AP1 transcription factors in epidermal differentiation and skin cancer[J]. J Skin Cancer, 2013, 2013: 537028. DOI:10.1155/2013/537028 |
| [5] | ROSKOSKI R JR. ERK1/2 MAP kinases: structure, function, and regulation[J]. Pharmacol Res, 2012, 66(2): 105–143. DOI:10.1016/j.phrs.2012.04.005 |
| [6] | KUMAR D, TEWARI-SINGH N, AGARWAL C, et al. Nitrogen mustard exposure of murine skin induces DNA damage, oxidative stress and activation of MAPK/Akt-AP1 pathway leading to induction of inflammatory and proteolytic mediators[J]. Toxicol Lett, 2015, 235(3): 161–171. DOI:10.1016/j.toxlet.2015.04.006 |
| [7] | CASALINO L, DE CESARE D, VERDE P. Accumulation of Fra-1 in ras-transformed cells depends on both transcriptional autoregulation and MEK-dependent posttranslational stabilization[J]. Mol Cell Biol, 2003, 23(12): 4401–4415. DOI:10.1128/mcb.23.12.4401-4415.2003 |
| [8] | BURCH P M, YUAN Z, LOONEN A, et al. An extracellular signal-regulated kinase 1- and 2-dependent program of chromatin trafficking of c-Fos and fra-1 is required for cyclin D1 expression during cell cycle reentry[J]. Mol Cell Biol, 2004, 24(11): 4696–4709. DOI:10.1128/mcb.24.11.4696-4709.2004 |
| [9] | VIAL E, MARSHALL C J. Elevated ERK-MAP kinase activity protects the FOS family member FRA-1 against proteasomal degradation in colon carcinoma cells[J]. J Cell Sci, 2003, 116(Pt 24): 4957–4963. DOI:10.1242/jcs.00812 |
| [10] | GOMARD T, JARIEL-ENCONTRE I, BASBOUS J, et al. Fos family protein degradation by the proteasome[J]. Biochem Soc Trans, 2008, 36(Pt 5): 858–863. DOI:10.1042/BST0360858 |
| [11] | KAISER A, BREMBECK F H, V MARSCHALL Z, et al. Fra-1: a novel target for retinoid action[J]. FEBS Lett, 1999, 448(1): 45–48. DOI:10.1016/s0014-5793(99)00326-9 |
| [12] | WANG Q, NI H, LAN L, et al. Fra-1 protooncogene regulates IL-6 expression in macrophages and promotes the generation of M2d macrophages[J]. Cell Res, 2010, 20(6): 701–712. DOI:10.1038/cr.2010.52 |
| [13] | SHAKARJIAN M P, HECK D E, GRAY J P, et al. Mechanisms mediating the vesicant actions of sulfur mustard after cutaneous exposure[J]. Toxicol Sci, 2010, 114(1): 5–19. DOI:10.1093/toxsci/kfp253 |
| [14] | VIAL E, SAHAI E, MARSHALL C J. ERK-MAPK signaling coordinately regulates activity of Rac1 and RhoA for tumor cell motility[J]. Cancer Cell, 2003, 4(1): 67–79. DOI:10.1016/S1535-6108(03)00162-4 |
| [15] | RAMOS-NINO M E, BLUMEN S R, PASS H, et al. Fra-1 governs cell migration via modulation of CD44 expression in human mesotheliomas[J]. Mol Cancer, 2007, 6: 81. DOI:10.1186/1476-4598-6-81 |
| [16] | RATTANASINCHAI C, LLEWELLYN B J, CONRAD S E, et al. MLK3 regulates FRA-1 and MMPs to drive invasion and transendothelial migration in triple-negative breast cancer cells[J]. Oncogenesis, 2017, 6(6): e345. DOI:10.1038/oncsis.2017.44 |
| [17] | SEITZ O, SCHVRMANN C, PFEILSCHIFTER J, et al. Identification of the Fra-1 transcription factor in healing skin flaps transplants: a potential role as a negative regulator of VEGF release from keratinocytes[J]. J Craniomaxillofac Surg, 2012, 40(4): 379–386. DOI:10.1016/j.jcms.2011.07.001 |



