骨髓增生异常综合征(myelodysplastic syndrome, MDS)是造血系统恶性肿瘤,以无效造血、外周血细胞减少和高风险向急性髓系白血病(acute myeloid leukemia, AML)转化为特征[1]。目前研究表明,超过三分之一的MDS患者最终将发展为AML。治愈这种疾病的唯一方法是异基因造血干细胞移植(hematopoietic stem cell transplant, HSCT),但这种治疗方法仅适用于有合适供体的患者[2]。近期的研究已经很大程度上阐明了MDS的基因组序列[3],但是对MDS的发病机制和发展机制知之甚少。因此,阐明MDS的发病及发展机制对改善患者预后以及探索更多有效的靶向治疗药物有着重大的意义。
越来越多的证据表明,微小RNA失调与癌症的增殖、分化、凋亡和转移有关。微小RNA作为癌基因或肿瘤的抑制因子,成为了治愈癌症的一种理想的治疗方法[4]。研究报道称,miR-143在结直肠癌[5]、乳腺癌[6]、前列腺癌[7]以及人骨肉瘤[8]等各种肿瘤中起到肿瘤抑制剂的作用。自从2004年POY等[9]指出miR-375可能成为糖尿病治疗的新靶点以来,越来越多的基因治疗和分子靶向治疗研究走进人们的视野。microRNA作为抗肿瘤药物开发的重要靶点,可设计相应的药物,通过上调或下调microRNA从而实现治疗疾病的目的。近期的一些肿瘤表观遗传学研究表明miR-143能够通过激活Caspase-3,-9靶向激活Bcl-2从而诱导骨肉瘤细胞以及白血病细胞的凋亡、减少癌细胞增殖和侵袭能力[10-11]。然而,miR-143在MDS中的表达情况以及分子机制尚未完全阐明。本研究旨在利用过表达以及低表达miR-143重组慢病毒载体感染SKM-1细胞,全面研究miR-143对SKM-1细胞增殖和凋亡的影响,并且对miR-143下游靶基因进行初步探索,为探索MDS新的疾病预测靶点提供新的思路。
1 材料与方法 1.1 材料收集2012年10月至2014年4月间于重庆医科大学附属第一医院血液科就诊患者骨髓标本共44例,其中包含健康对照11例,MDS/AML 33例,患者均签署知情同意书,本研究经本院医院伦理委员会审批(2012年);人骨髓增生异常综合征细胞株SKM-1由华中科技大学附属同济医院周剑锋教授馈赠;含有LV-hsa-miR-143、LV-hsa-miR-143-inhibitors和LV-control的慢病毒载体系统(包括pGC-GV载体、质粒pHelper1.0和pHelper2.0)由上海汉恒生物科技有限公司提供。
1.2 试剂及仪器胎牛血清、RPMI1640培养基购自美国HyClone公司;Ficoll-Paque Plus淋巴细胞分离液购自美国GE Healthcare公司;RNA提取试剂RNAiso Plus、逆转录试剂盒、荧光定量PCR试剂盒均购自日本TaKaRa公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒由江苏凯基生物技术股份有限公司提供;双荧光素酶报告基因检测试剂盒、蛋白提取试剂RIPA裂解液以及山羊抗兔HRP标记抗体购自上海碧云天生物研究所;AF9抗体和GAPDH抗体购自美国CST公司。
倒置荧光显微镜为德国Leica公司产品;CytoFLEX流式细胞仪为美国Beckman Coulter公司产品;荧光定量PCR仪、凝胶成像仪为美国Bio-Rad公司产品。
1.3 细胞培养SKM-1细胞用含10%胎牛血清的RPMI 1640培养基在37 ℃、5% CO2饱和湿度的孵箱中培养。
1.4 细胞转染将状态良好的SKM-1细胞,按1×105/mL接种于12孔板中。24 h后,从冰箱取出慢病毒并在冰上缓慢融化,将细胞吸出后离心(500 r/min,4 min),弃去上清液后将慢病毒以10的感染复数(multiplicity of infection,MOI)感染SKM-1细胞,室温放置10 min后加入1/2体积,即0.5 mL新鲜培养基,混匀后,37 ℃小体积感染4 h,4 h后补齐另一半培养基。感染后12 h将病毒液换出,感染后第6天于倒置荧光显微镜下观察荧光强度,并用流式细胞仪检测感染效率。实验分3组,①过表达组:用含LV-hsa-miR-143的慢病毒载体感染SKM-1细胞;②低表达组:用含LV-hsa-miR-143-inhibitors的慢病毒载体感染SKM-1细胞;③阴性对照组:用含空病毒LV-control的慢病毒载体感染SKM-1细胞。
1.5 RNA提取和实时荧光定量逆转录聚合酶链反应(qRT-PCR)使用Ficoll-Paque分离骨髓标本中的单核细胞(MNC)以及用RNAiso Plus提取各组细胞的总RNA。用特异性miR-143逆转录引物将RNA逆转录成cDNA,反应条件:16 ℃退火30 min,42 ℃反转录反应45 min,85 ℃预变性10 min。然后按说明书配制10 μL的PCR反应体系,并在Bio-Rad CFX96仪器上进行定量PCR扩增反应,每组设置3个复孔。miR-143上游引物:5′-TGTGACACTGAGATGAAGCACTG-3′,下游引物:5′-TATGGTTGTTCTGCTCTCTGTCTC-3′;U6上游引物:5′-ATTGGAACGATACAGAGAAGATT-3′,下游引物:5′-GGAACGCTTCACGAATTTG-3′。扩增条件为:95 ℃ 3 min,95 ℃变性20 s,62 ℃退火50 s,40个循环。用2-ΔΔCt法计算各组基因的相对表达量。
1.6 蛋白印迹法检测蛋白表达水平收集各组细胞,用含有1 μmol/L PMSF的RIPA裂解液提取总蛋白,并用BCA法测蛋白浓度标准曲线。将蛋白浓度调平后,根据蛋白分子量大小配制相应浓度的SDS-PAGE凝胶并取50 μg蛋白上样,电泳后用湿转法将蛋白转移到PVDF膜上,再用5%脱脂牛奶进行封闭。封闭后加入按比例稀释的一抗,4 ℃孵育PVDF膜过夜。次日用TBST洗膜3次后加入二抗室温孵育2 h,再次洗膜3次之后用ECL试剂进行显影拍照,最后用Image J 1.51软件分析条带灰度值。
1.7 CCK-8法检测细胞增殖将各组SKM-1细胞接种于96孔板中,调整细胞数为5×104/mL,每孔100 μL体系,每组6个复孔。细胞接种完毕后24、48、72 h分别给每孔加入10 μL CCK-8溶液,37 ℃孵育2 h后,用酶标仪测量450 nm波长下的光密度值[D(450)],并绘制生长曲线。
1.8 流式细胞仪检测细胞周期离心收集细胞后,预冷PBS洗2遍,再加入预冷的75%酒精4 ℃固定过夜,将固定好的细胞在PI染液(含50 μg/mL RNA酶)中室温孵育30 min,最后用流式细胞仪检测细胞周期分布情况。
1.9 Annexin V/APC双染法检测细胞凋亡低速离心(500 r/min,5 min)收集各组细胞,用孵育缓冲液洗涤细胞1次离心后,加入100 μL标记溶液重悬细胞,室温下避光孵育10 min,离心沉淀细胞再用孵育缓冲液洗1次,随后加入荧光溶液4 ℃孵育20 min,用流式细胞仪检测细胞凋亡情况。
1.10 双荧光素酶报告基因检测将AF9 mRNA的野生型和突变型的3’-UTR片段克隆至双荧光素酶报告载体中。将HEK293T细胞接种到24孔板中,并于荧光素酶报告载体和LV-hsa-miR-143/LV-control共转染。转染48 h后,根据说明书使用双荧光素酶报告基因检测系统(Promega)检测荧光素酶活性。
1.11 统计学分析采用Graphpad Prism 5.01统计软件,数据以x±s表示,两组间比较采用独立样本t检验,多组间比较采用Friedman检验,检验水准α=0.05。
2 结果 2.1 骨髓标本中miR-143的表达共收集33位MDS/AML患者以及11位健康人的骨髓标本,将骨髓标本中的淋巴细胞分离并提取RNA,利用qRT-PCR法检测两组miR-143的表达水平,以健康对照作为参照,以U6作为内参,结果用2-ΔΔCt表示。结果表明,与健康对照比较,MDS/AML组的miR-143相对表达水平明显降低(P < 0.05,图 1)。
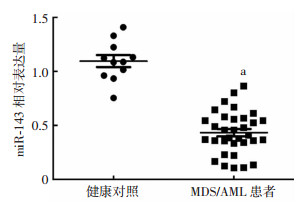
|
| a:P < 0.05,与健康对照比较 图 1 qRT-PCR检测miR-143在骨髓标本中的表达水平 |
2.2 miR-143重组慢病毒在SKM-1细胞中转染效率的检测
慢病毒感染SKM-1细胞6 d后,利用倒置荧光显微镜检测GFP绿色荧光的转染效果(图 2A),与各组同一视野下白光(图 2B)对比,3组细胞均有很强的GFP绿色荧光信号。利用流式细胞仪检测GFP荧光从而得到细胞的转染效率(图 2C),显示3组转染率均大于85%。证明慢病毒载体LV-hsa-miR-143和LV-hsa-miR-143-inhibitors成功感染SKM-1细胞。
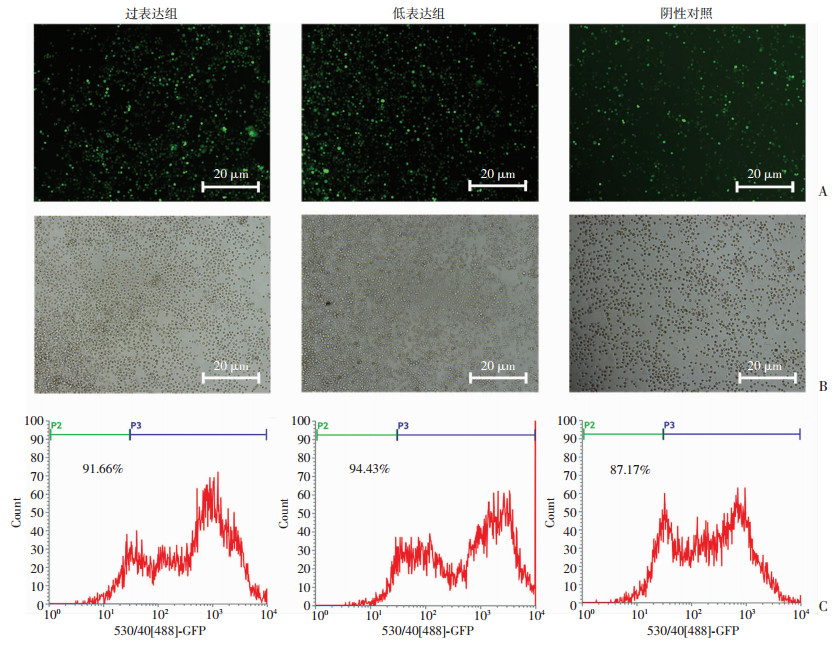
|
| A:GFP绿色荧光;B:同视野白光;C:细胞转染效率 图 2 倒置荧光显微镜和流式细胞仪检测3组慢病毒转染效率 |
2.3 qRT-PCR检测慢病毒转染后miR-143的相对表达量
结果发现过表达组的miR-143表达量为(9.15± 0.53),明显高于阴性对照组(1.19±0.21,P < 0.05);而低表达组的miR-143表达量为(0.33±0.14),明显低于阴性对照组(P < 0.05)。证明得到了可以稳定表达的过表达miR-143和低表达miR-143的SKM-1细胞系。
2.4 miR-143对SKM-1细胞生长的影响用CCK-8法检测各组细胞增殖情况,结果显示,与阴性对照组比较,过表达组细胞的生长速度明显减慢,而低表达组细胞的生长速度明显增加(图 3)。过表达组的光密度值在第3天为(0.562±0.069),明显低于阴性对照组(0.739±0.041,P < 0.05);低表达组的光密度值在第3天为(1.537±0.094),明显高于阴性对照组(P < 0.05)。表明过表达miR-143能够抑制SKM-1细胞的增殖,而低表达miR-143会促进SKM-1细胞的增殖。
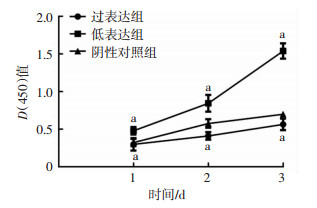
|
| a:P < 0.05,与阴性对照组比较 图 3 CCK-8法检测各组SKM-1细胞增殖的变化 |
2.5 miR-143对SKM-1细胞周期的影响
结果显示,过表达组G0/G1期细胞比例[(57.92±3.58)%]明显高于阴性对照组[(38.75±2.78)%,P < 0.05];低表达组G0/G1期细胞比例[(29.73±2.44)%]明显低于阴性对照组(P < 0.05);而过表达组S期细胞比例为(39.12±2.45)%,明显低于阴性对照组[(45.37±2.39)%,P < 0.05];低表达组S期细胞比例[(56.38±1.75)%]明显高于阴性对照组(P < 0.05,图 4)。表明miR-143可将SKM-1细胞周期阻滞于G0/G1期,从而抑制其增殖。
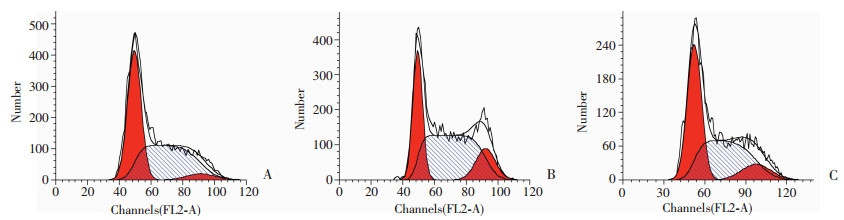
|
| A:过表达组;B:低表达组;C:阴性对照组 图 4 流式细胞仪检测各组细胞周期分布情况 |
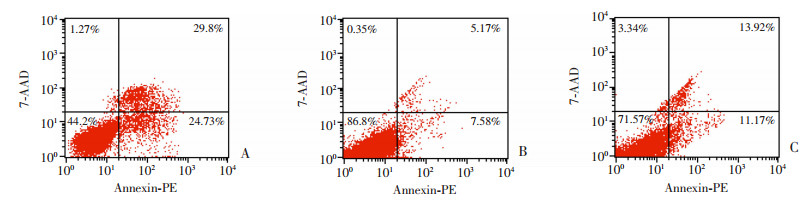
2.6 miR-143对SKM-1细胞凋亡的影响
结果显示,过表达miR-143组细胞凋亡率为(29.80± 2.53)%,明显高于阴性对照组[(13.92±1.49)%,P < 0.05];而低表达miR-143组细胞凋亡率为(5.17±1.04)%,明显低于阴性对照组(P < 0.05,图 5)。表明miR-143可以促进SKM-1细胞的凋亡。
|
| A:过表达组;B:低表达组;C:阴性对照组 图 5 流式细胞仪检测各组细胞凋亡情况 |
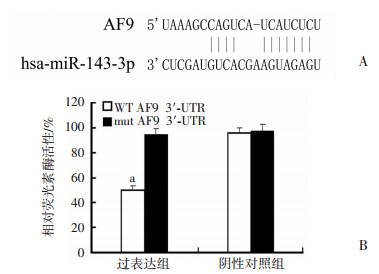
2.7 miR-143通过结合AF9的3’-UTR端抑制其表达
为了进一步解释可能的分子机制,利用Targetscan网站进行靶基因预测(http://www.targetscan.org/)。生物信息学分析预测,AF9基因是miR-143的一个靶基因(图 6A)。利用双荧光素酶报告基因检测发现,与阴性对照组比较,miR-143可以显著抑制AF9 3’-UTR野生型的报告基因活性而不能抑制AF9 3’-UTR突变型的报告基因活性(图 6B)。表明miR-143可以作用于AF9的3’-UTR区。
|
| A:靶基因结合位点;B:双荧光素酶报告基因统计;a:P < 0.05,与阴性对照组比较 图 6 靶基因预测以及miR-143荧光素酶活性检测 |
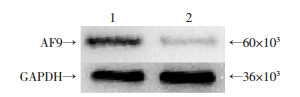
2.8 低表达miR-143导致AF9蛋白表达上调
Western blot检测结果显示,低表达组AF9蛋白表达水平(1.189±0.162)明显高于阴性对照组(0.568± 0.054)(P < 0.05,图 7)。
|
| 1:低表达组;2:阴性对照组 图 7 Western blot检测AF9蛋白表达水平 |
3 讨论
以往的研究提示,miR-143在食管癌[12]、子宫内膜癌[13]及大肠癌[14]等多种肿瘤中都存在异常表达现象,并且都发挥着抑制肿瘤生长的作用,它在造血系统中同样发挥着非常重要的作用[11, 15]。本研究构建了过表达慢病毒载体(LV-hsa-miR-143)和低表达慢病毒载体(LV-hsa-miR-143-inhibitors)以及空病毒载体(LV-control),发现过表达miR-143对骨髓增生异常综合征SKM-1细胞起到抑制增殖和诱导凋亡的作用,这提示miR-143很有可能是MDS的抑癌基因。
miR-143抑制肿瘤发生的机制可能是其激活了Fas/FasL凋亡通路[16]或是其抑制了表皮生长因子受体[17]。课题组前期的研究发现,在人MDS细胞株SKM-1细胞中,miR-143通过激活Fas/FasL凋亡通路诱导细胞凋亡。为了进一步探讨miR-143在SKM-1细胞中发挥作用的机制,本研究选择对miR-143下游靶标基因AF9的作用进行探究。
研究证实,AF9/MLLT3基因是急性白血病相关基因[18-20]。我们利用生物信息学预测网站检索发现miR-143与AF9基因有着较高分值的位点匹配。从基因层面和蛋白层面分别利用双荧光素酶报告检测和Western blot对AF9基因进行验证,结果发现,过表达miR-143可以显著抑制AF9 3’-UTR野生型的报告基因活性而不能抑制AF9 3’-UTR突变型的报告基因活性,表明miR-143可以作用于AF9的3’-UTR区。Western blot分析结果显示低表达miR-143组AF9蛋白表达水平明显高于阴性对照组,说明低表达miR-143导致AF9蛋白表达上调。
综上所述,本研究利用LV-hsa-miR-143、LV-hsa-miR-143-inhibitors重组慢病毒载体成功构建了过表达和低表达miR-143的SKM-1细胞模型,证明了过表达miR-143能够抑制SKM-1细胞的生长,促进其凋亡,将细胞周期阻滞在G0/G1期,miR-143能够负性调节其靶基因AF9。本研究有助于为研发新型MDS抗肿瘤治疗药物提供新的思路,其作用还需广泛的临床试验加以证实。
| [1] | MONTALBAN-BRAVO G, GARCIA-MANERO G. Myelodysplastic syndromes: 2018 update on diagnosis, risk-stratification and management[J]. Am J Hematol, 2018, 93(1): 129–147. DOI:10.1002/ajh.24930 |
| [2] | DE WITTE T, BOWEN D, ROBIN M, et al. Allogeneic hematopoietic stem cell transplantation for MDS and CMML: recommendations from an international expert panel[J]. Blood, 2017, 129(13): 1753–1762. DOI:10.1182/blood-2016-06-724500 |
| [3] | PELLAGATTI A, BOULTWOOD J. The molecular pathogenesis of the myelodysplastic syndromes[J]. Eur J Haematol, 2015, 95(1): 3–15. DOI:10.1111/ejh.12515 |
| [4] | KUANG X, CHI J, WANG L. Deregulated microRNA expression and its pathogenetic implications for myelodysplastic syndromes[J]. Hematology, 2016, 21(10): 593–602. DOI:10.1080/10245332.2016.1193962 |
| [5] | YU B, LIU X, CHANG H. MicroRNA-143 inhibits colorectal cancer cell proliferation by targeting MMP7[J]. Minerva Med, 2017, 108(1): 13–19. DOI:10.23736/S0026-4806.16.04651-6 |
| [6] | JOHANNESSEN C, MOI L, KISELEV Y, et al. Expression and function of the miR-143/145 cluster in vitro and in vivo in human breast cancer[J]. PLoS ONE, 2017, 12(10): e0186658. DOI:10.1371/journal.pone.0186658 |
| [7] | RODR GUEZ M, BAJO-SANTOS C, HESSVIK N P, et al. Identification of non-invasive miRNAs biomarkers for prostate cancer by deep sequencing analysis of urinary exosomes[J]. Mol Cancer, 2017, 16(1): 156. DOI:10.1186/s12943-017-0726-4 |
| [8] | SUN X, DAI G, YU L, et al. miR-143-3p inhibits the proliferation, migration and invasion in osteosarcoma by targeting FOSL2[J]. Sci Rep, 2018, 8(1): 606. DOI:10.1038/s41598-017-18739-3 |
| [9] | POY M N, ELIASSON L, KRUTZFELDT J, et al. A pancreatic islet-specific microRNA regulates insulin secretion[J]. Nature, 2004, 432(7014): 226–230. DOI:10.1038/nature03076 |
| [10] | LI W H, WU H J, LI Y X, et al. MicroRNA-143 promotes apoptosis of osteosarcoma cells by caspase-3 activation via targeting Bcl-2[J]. Biomed Pharmacother, 2016, 80: 8–15. DOI:10.1016/j.biopha.2016.03.001 |
| [11] | SHEN J Z, ZHANG Y Y, FU H Y, et al. Overexpression of microRNA-143 inhibits growth and induces apoptosis in human leukemia cells[J]. Oncol Rep, 2014, 31(5): 2035–2042. DOI:10.3892/or.2014.3078 |
| [12] | ANSARI M H, IRANI S, EDALAT H, et al. Deregulation of miR-93 and miR-143 in human esophageal cancer[J]. Tumour Biol, 2016, 37(3): 3097–3103. DOI:10.1007/s13277-015-3987-9 |
| [13] | CHANG L, ZHANG D, SHI H, et al. MiR-143 inhibits endometrial cancer cell proliferation and metastasis by targeting MAPK1[J]. Oncotarget, 2017, 8(48): 84384–84395. DOI:10.18632/oncotarget.21037 |
| [14] | GOMES S E, PEREIRA D M, ROMA-RODRIGUES C, et al. Convergence of miR-143 overexpression, oxidative stress and cell death in HCT116 human colon cancer cells[J]. PLoS ONE, 2018, 13(1): e0191607. DOI:10.1371/journal.pone.0191607 |
| [15] | ZHOU J, CHAUDHRY H, ZHONG Y, et al. Dysregulation in microRNA expression in peripheral blood mononuclear cells of sepsis patients is associated with immunopathology[J]. Cytokine, 2015, 71(1): 89–100. DOI:10.1016/j.cyto.2014.09.003 |
| [16] | ZHONG W, QIN S, ZHU B, et al. Oxysterol-binding protein-related protein 8 (ORP8) increases sensitivity of hepatocellular carcinoma cells to Fas-mediated apoptosis[J]. J Biol Chem, 2015, 290(14): 8876–8887. DOI:10.1074/jbc.M114.610188 |
| [17] | ZHANG H B, SUN L C, LING L, et al. miR-143 suppresses the proliferation of NSCLC cells by inhibiting the epidermal growth factor receptor[J]. Exp Ther Med, 2016, 12(3): 1795–1802. DOI:10.3892/etm.2016.3555 |
| [18] | LIDA S, SETO M, YAMAMOTO K, et al. MLLT3 gene on 9p22 involved in t(9;11) leukemia encodes a serine/proline rich protein homologous to MLLT1 on 19p13[J]. Oncogene, 1993, 8(11): 3085–3092. |
| [19] | NAKAMURA T, ALDER H, GU Y, et al. Genes on chromosomes 4, 9, and 19 involved in 11q23 abnormalities in acute leukemia share sequence homology and/or common motifs[J]. Proc Natl Acad Sci U S A, 1993, 90(10): 4631–4635. DOI:10.1073/pnas.90.10.4631 |
| [20] | MEYER C, HOFMANN J, BURMEISTER T, et al. The MLL recombinome of acute leukemias in 2013[J]. Leukemia, 2013, 27(11): 2165–2176. DOI:10.1038/leu.2013.135 |



