2. 233004 安徽 蚌埠,蚌埠医学院第一附属医院呼吸与危重症医学科,安徽省呼吸系病临床基础重点实验室;
3. 100850 北京,军事医学科学院放射与辐射研究所
2. Department of Respiratory and Critical Care Medicine, Anhui Provincial Key Laboratory of Respiratory Diseases, the First Affiliated Hospital of Bengbu Medical College, Bengbu, Anhui Province, 233004;
3. Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing, 100850, China
肺癌是与吸烟关系最密切的恶性肿瘤[1-2]。烟草中的尼古丁、苯并芘等多种致癌物,可通过作用关键致癌基因及其信号通路导致肺癌的发生,但致癌的分子机制尚未阐明[3]。核因子κB抑制蛋白E抗体(inhibitor of nuclear factor kappa-B kinase subunit epsilon,IKBKE)是一种新发现的癌基因。人和小鼠的乳腺癌细胞中IKBEK过表达[4]。人非小细胞肺癌细胞株中亦发现IKBKE特异性高表达,敲减IKBKE能增加非小细胞肺癌细胞对化疗敏感性[5]。前期研究证实:IKEBKE过表达与肺癌的发生密切相关[6]。本研究通过体内外实验观察IKBKE在烟草致肺癌发生过程中的重要作用及其分子机制,旨在为明确肺癌发病机制和高危人群的早期干预提供科学依据。
1 材料与方法 1.1 动物、细胞标本永生化人支气管上皮细胞株BEP2D由军事医学科学院朱茂祥教授馈赠,由我室长期传代保存。使用无血清培养液LHC-8,在37 ℃、5%CO2条件下培养。有自发形成肺腺癌倾向的A/J小鼠,4~6周龄,购自江苏君科生物工程有限公司。动物实验得到蚌埠医学院实验动物管理和伦理委员会审批(2016-062)。
1.2 主要试剂和材料鼠抗人STAT3单克隆抗体、兔抗人phosphoY705单克隆抗体、IKBKE多克隆抗体购自Abcam公司,二抗羊抗兔IgG-HRP购自博士德公司,IL-6(SRP3096)购自Sigma-Aldrich公司,利用单通道吸烟机(北京慧荣和科技公司,型号HRH-SM120)制备卷烟烟气凝集物(cigarette smoke condensate,CSC),动物卷烟烟气染毒柜由军事医学科学院研制。
1.3 CSC的制备、染毒及细胞培养用LHC-8稀释CSC到预设浓度处理细胞直接进行细胞染毒。设立对照组(BEP2D)、酒精组及CSC(预实验最佳浓度为0.001支烟/mL,焦油标识量为11 mg/支,烟碱量为1.0 mg/支)染毒后的10、20、30、40、50、60代和70代细胞组(分别命名为P10、P20、P30、P40、P50、P60、P70),37 ℃、5%CO2饱和湿度条件下培养。CSC(预实验最佳浓度0.006支烟/mL)对BEP2D细胞进行急性染毒处理,4、8、12、24 h和48 h收集细胞进行检测。
1.4 裸鼠成瘤实验P0、P50、P70细胞胰酶消化、稀释至1×107/mL,在雌性BALB/c裸鼠右前肢腋下接种,每组6只,观察移植瘤生长情况,测量肿瘤体积。处死裸鼠后取出瘤体,甲醛固定,包埋,切片,HE染色并作免疫组化鉴定组织类型。
1.5 Western blot实验提取各染毒代数和各染毒时间点细胞蛋白,蛋白样品煮沸5 min变性,10%SDS-PAGE凝胶电泳,转至PVDF膜上;封闭液室温封闭90 min,加入稀释后的一抗(1 :800稀释IKBKE、1 :400稀释β-actin),4 ℃孵育过夜;次日TBST缓冲液洗膜3次,37 ℃二抗孵育20 min,室温摇床摇动80 min(60 r/min);TBST缓冲液洗膜3次,配置化学发光试剂。应用AlphaView软件对目的条带进行灰度分析。
1.6 A/J小鼠烟熏成瘤实验A/J雄鼠被分至各个饲养笼,5只/笼,放入动物吸烟机中进行烟气暴露实验[50 min/d,6 d/周,烟气含量尼古丁7 mg/m3、相对湿度(48±5)%,温度(21±1)℃]。每周称小鼠体质量。分为实验组和对照组(每组40只),烟熏处理前,烟熏1、3、9个月分别在实验组和对照组各取10只小鼠处死。取小鼠肺组织甲醛固定,包埋,切片,HE染色观察肺部成瘤情况并进行免疫组化和IKBKE检测。
1.7 免疫组化实验60 ℃烤箱烘片4 h脱蜡、水洗,抗原修复,DAB显色,苏木精复染,封片。结果判定由2位病理科医师背靠背读片。IKEBE阳性显色主要定位于细胞核。半定量积分法判定结果。首先按着色强度评分,标本无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;再依据阳性细胞在观察细胞中所占比例评分,阳性数≤10%判读为1分,>10%~50%判读为2分,>50%~<75%判读为3分,≥75%判读为4分。每张切片最后的得分为2次评分的乘积。
1.8 IKBKE-siRNA慢病毒包装、感染及敲减效率验证根据IKBKE的核苷酸序列(NM_014002)。根据基因Blast并参考文献[7],挑选3条特异性序列,委托上海吉凯基因生物公司合成。同时合成1条与IKBKE序列无同源性的片段作为阴性对照。IKBKE序列为KD1:5′-GAGCATTGGAGTGACCTTGTA-3′;KD2:5′-TGGGCAGGAGCTAATGTTTCG-3′,KD3:5′-GCATC-ATCGAACGGCTAAATA-3′;阴性对照序列为5′-TTCT-CCGAACGTGTCACGTTTC-3′。胰酶消化P70细胞,制备细胞悬液(4×104个/mL),接种6孔板,继续培养使感染时细胞密度为30%。IKBKE慢病毒感染的MOI值为20。慢病毒感染细胞72 h左右,荧光显微镜观察GFP表达,评估感染率,感染效率达到70%方可进行实验。qRT-PCR检测IKEBKE表达:TRIzol提取总RNA,然后依照说明书进行反转录、扩增。GAPDH基因作为内参对照。IKBKE的上游引物序列为5′- TG-CTCCCAAAATATCACGGA-3′,下游引物序列为5′-CTGGATGCTTCTGTCCTCAT-3′。内参GAPDH基因的上游引物序列为5′-TGACTTCAACAGCGACACCCA-3′,下游引物序列为5′-CACCCTGTTGCTGTAGCCAAA-3′。
1.9 敲减IKBKE对STAT3通路的影响IKBKE siRNA慢病毒感染细胞72 h后收集细胞,Western blot检测IKBKE、STAT3(一抗稀释液以1 :5 000稀释)和pSTAT3表达水平(一抗稀释液以1 :15 000稀释)。方法同1.5。
1.10 MTT检测细胞活力为了研究IKBKE对P70恶性转化细胞生物学功能和STAT3通路的影响,进一步观察IKBKE siRNA慢病毒和STAT3通路激活剂IL-6对P70细胞增殖、细胞克隆形成和凋亡的影响。分为4组,分别为空白组、空病毒组、KD组和KD+IL-6组;慢病毒感染流程同1.8。KD+IL-6组细胞感染慢病毒72 h后加入IL-6,IL-6工作浓度根据文献[8]报道选用100 ng/mL。每次换液时加入IL-6。胰酶消化各组对数生长期细胞,重悬成细胞悬液、计数;细胞铺板的密度为2×103/孔;20 μL 5 mg/mL的MTT在培养终止前4 h加入孔中;4 h后吸除培养液,加100 μL DMSO溶解甲瓒颗粒;在振荡器中振荡2~5 min,酶标仪检测光密度值[D(490)/D(570)]。
1.11 细胞克隆形成实验分组和处理同1.10。6孔板中每孔接种约500个细胞,每隔3天换液并观察细胞状态;实验终止前荧光显微镜下对细胞克隆进行拍照,PBS洗涤细胞;每孔加入1 mL多聚甲醛,固定细胞30 min,PBS再次洗涤细胞1次,每孔加入500 μL Giemsa染液,染细胞20 min;ddH2O洗涤细胞数次,晾干,拍照、克隆计数。
1.12 Annexin V-APC单染法检测细胞凋亡分组同1.10。慢病毒感染P70细胞72 h后加入IL-6,24 h后观察6孔板细胞生长至覆盖率约为70%;收集细胞Annexin V-APC检测凋亡。操作步骤参照eBioscience公司细胞凋亡检测试剂盒说明书。
1.13 统计学处理采用SPSS 19.0统计软件进行分析。数据以x±s表示,两组间比较行t检验,单因素方差分析用于多组之间比较,组间的两两比较行q检验,计数资料行χ2检验。检验水准:α=0.05。
2 结果 2.1 CSC对各代细胞形态的影响与P0组和酒精组细胞相比,CSC染毒的各代支气管上皮细胞生长速度逐渐加快,P50、P70组细胞体积增大,以复层生长为主,排列较为紊乱,细胞生长以无序的团块状或条索状生长为主(图 1)。
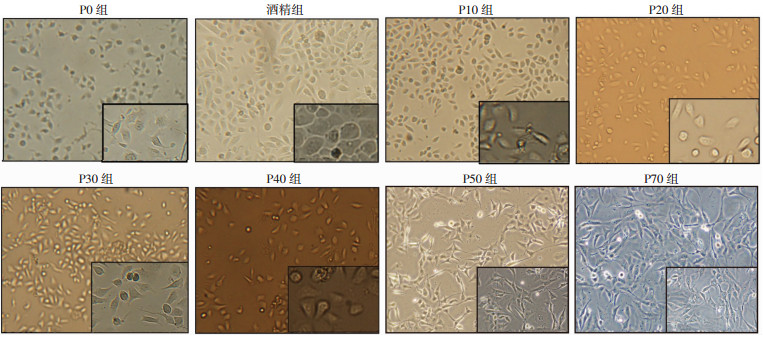
|
| 方框内为局部放大(×200) 图 1 CSC诱导的各代细胞形态(LM ×100) |
2.2 P70染毒BEP2D细胞裸鼠成瘤
分别采用P0、P50、P70代细胞行裸鼠成瘤实验,结果提示P70细胞在裸鼠腋下成瘤,取瘤体行HE染色提示P70细胞已发生恶性转化,免疫组化提示腺癌(TTF-1、CK-7强阳性,图 2、3)。

|
| A:P0;B:P50;C:P70 ↑:示裸鼠皮下的瘤体 图 2 P0、P50、P70细胞裸鼠成瘤实验 |

|
| 图 3 瘤体组织的HE染色和免疫组化染色观察 |
2.3 CSC急性染毒BEP2D细胞对IKBKE表达的影响
CSC染毒8 h即出现IKBKE表达增高,12 h达峰,显著高于4 h的表达水平(P<0.01),24 h和48 h,BEP2D细胞IKBKE表达水平也高于CSC染毒前(P<0.05)。CSC染毒前和染毒4 h相比,IKBKE表达水平差异无统计学意义(P>0.05,图 4A、B)。
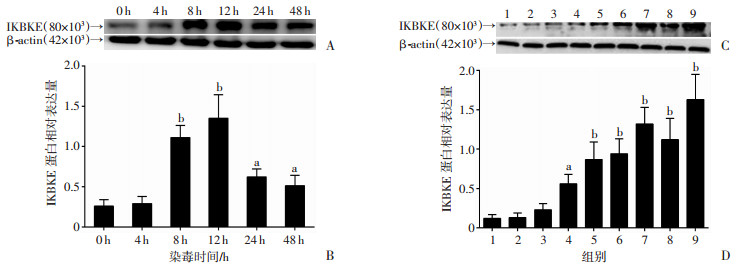
|
| A:Western blot检测CSC急性染毒对BEP2D细胞IKBKE表达的影响;B:Western blot半定量分析结果;C:Western blot检测CSC慢性染毒对各代BEP2D细胞IKBKE表达的影响;D:Western blot半定量分析结果1:P0组;2:酒精组;3:P10组;4:P20组;5:P30组;6:P40组;7:P50组;8:P60组;9:P70组a:P<0.05,b:P<0.01,与对照组比较 图 4 CSC染毒永生化支气管上皮细胞BEP2D对IKBKE表达的影响 |
2.4 CSC慢性染毒BEP2D细胞对IKBKE表达的影响
IKBKE蛋白在9组细胞中表达的总体均数差异有统计学意义(F=49.555,P<0.05)。IKBKE蛋白在P0组和酒精组表达最低;在其余各代细胞中表达呈逐渐增高的趋势(P<0.05,图 4C、D)。
2.5 烟熏对AJ小鼠肺组织和瘤体IKBKE表达的影响烟熏前、烟熏1个月和3个月的各组A/J小鼠肺部均未发现肿瘤形成,烟熏9个月时实验组A/J小鼠全部发生肺部肿瘤,其中8例腺癌,2例腺瘤,对照组均无成瘤。烟熏1、3、9个月小鼠肺组织IKBKE表达显著高于对照组(P<0.01,图 5、6)。
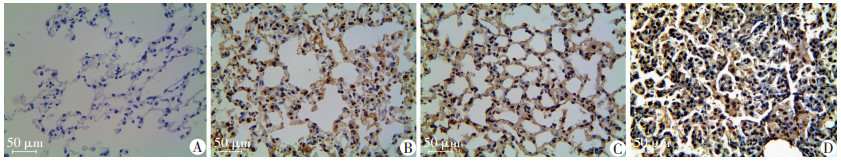
|
| A:烟熏前;B:烟熏后1个月;C:烟熏后3个月;D:烟熏后9个月 图 5 烟熏前、1个月、3个月和9个月A/J小鼠IKBKE肺组织和瘤体IKBKE表达(免疫组化) |
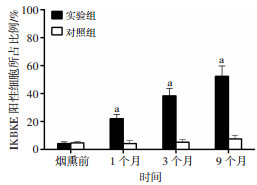
|
| a:P<0.01,与对照组比较 图 6 半定量分析各时间点A/J小鼠肺组织和瘤体IKBKE表达水平 |
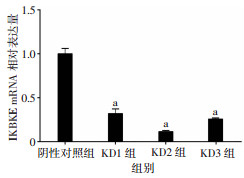
2.6 IKBKE慢病毒感染P70细胞后的基因敲减效率
qRT-PCR检测结果显示,P70细胞中,相对于阴性对照组,KD1、KD2、KD3组显著下调IKBKE表达,KD2组敲减效率最高,达87.2%,该序列为最有效的干扰靶点,用于后续实验(图 7)。
|
| a:P<0.01,与阴性对照组比较 图 7 不同序列IKBKE-siRNA对目的基因敲减效率的比较 |
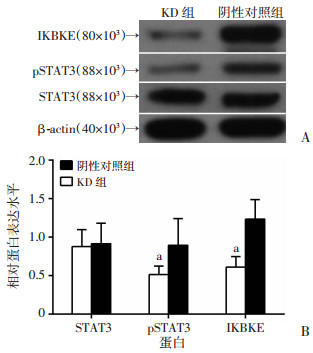
2.7 敲减IKBKE基因对P70细胞STAT3通路分子表达的影响
慢病毒siRNA敲减IKBKE基因后STAT3蛋白的表达与阴性对照组比较,差异无统计学意义(P>0.05),而KD组IKBKE、pSTAT3蛋白表达明显低于阴性对照组(P<0.01,图 8)。
|
| a:P<0.01,与阴性对照组比较 图 8 敲减IKBKE对STAT3磷酸化表达水平的影响(A)和半定量分析结果(B) |
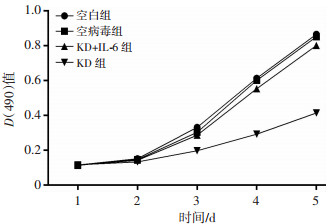
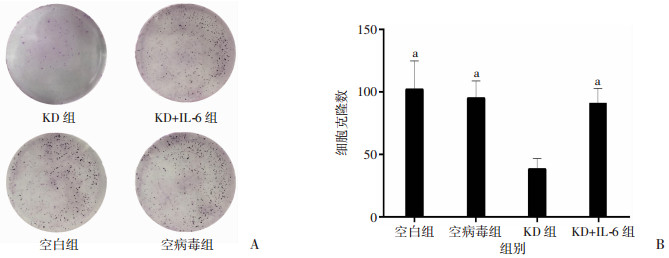
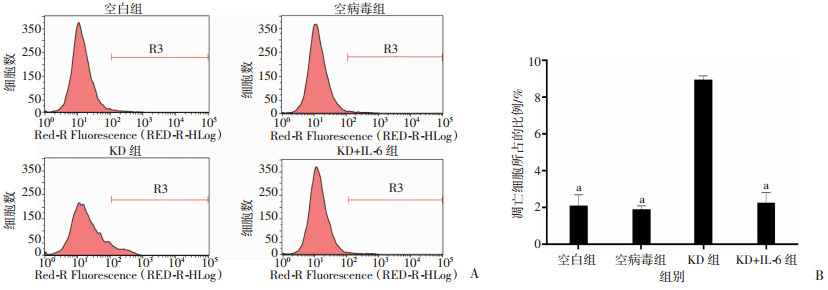
2.8 激活STAT3信号通路后敲减IKBKE对P70细胞增殖、细胞克隆形成和凋亡的影响
MTT检测结果显示,相比空白组、空病毒组,KD组细胞第5天增殖倍数显著降低(P<0.01,图 9);细胞克隆形成实验结果显示,敲减IKBKE基因显著抑制P70细胞的集落形成能力(P<0.01,图 10)。Annexin V-APC单染色法检测凋亡结果显示,相比空白组、空病毒组,KD组凋亡数显著增高(P<0.01,图 11)。进一步观察IL-6激活STAT3通路对生物学特性的影响。IL-6激活STAT3信号通路后,敲减P70细胞IKBKE,细胞增殖与空白组、空病毒组相比,差异无统计学意义(P>0.05,图 9)。细胞克隆形成实验和凋亡检测结果显示,IL-6显著阻滞了敲减IKBKE对细胞克隆形成和细胞凋亡的影响。
|
| 图 9 敲减IKBKE对P70细胞增殖的影响 |
|
| A:细胞克隆形成实验;B:定量分析结果a:P<0.01,与KD组比较 图 10 敲减IKBKE对P70细胞克隆形成的影响 |
|
| A:流式细胞仪检测结果;B:定量分析结果a:P<0.01,与KD组比较 图 11 敲减IKBKE对P70细胞凋亡的影响 |
3 讨论
香烟中尼古丁、多环芳烃等致癌物可通过影响增殖和凋亡环节诱导肺癌的发生、发展[9]。我们前期研究发现CSC可以激活Notch通路和STAT3通路参与支气管上皮细胞的恶性转化[10-11]。探讨吸烟相关的分子事件有助于阐明肺癌发生的分子机制,寻找早期干预手段。
IKBKE是一种丝氨酸/苏氨酸蛋白激酶,是IKK家族的新成员,最早从LPS诱导小鼠巨噬细胞中被发现[12]。IKBKE由氨基端激酶区、泛素样结构域、羧基端亮氨酸拉链和螺旋-环-螺旋结构组成。IKBKE磷酸化Akt后,可间接磷酸化RelA,增加NF-κB活性,促进肿瘤的发生[13]。IKBKE通过磷酸化SerS644调控FOXO3a,也可促进肿瘤发生[14]。IKBKE是预测食管癌复发的重要指标之一,与患者总生存显著负相关[15]。IKBKE高表达于脑胶质瘤中,通过作用YAP1促进胶质母细胞的增殖和侵袭[16]。胰腺导管癌小鼠模型中IKBKE以不依赖经典IKK复合的途径,而通过GLI1和AKT通路促进肿瘤的发生、发展[7]。IKBKE下调胶质瘤细胞中Hippo通路的下游效应分子YAP1和TEAD2,促进上皮间质转化,参与肿瘤形成[17]。IKBKE 153位酪氨酸残基和179位酪氨酸残基的磷酸化与非小细胞肺癌表皮生长因子受体酪氨酸激酶抑制剂耐药有关,并提出靶向IKBKE可以作为逆转表皮生长因子受体酪氨酸激酶抑制剂耐药的新思路[18],但IKBKE在烟草致癌中的作用尚不清楚。
目前烟草致癌研究多以短期诱导实验为主,本研究模拟了人类吸烟诱导支气管上皮细胞恶性转化的长期过程,与人类吸烟诱发的肿瘤更为接近。我们前期通过血清抗性及锚着独立性等方面对CSC诱导各代BEP2D细胞的恶性转化特征进行了初步鉴定[6]。本实验最终通过慢性染毒细胞成瘤证实P70细胞成功实现了恶性转化,为下一步研究烟草诱导肺癌机制研究提供了理想细胞模型。本实验结果显示,无论急性染毒还是慢性染毒,IKBKE均出现表达升高。这说明IKBKE可能参与了烟草导致的细胞恶性转化。有趣的是,CSC急性染毒8 h即出现IKBKE的表达上调,说明IKBKE上调可能是烟草诱导细胞恶性转化的早期分子事件。A/J小鼠有自发形成腺癌的倾向,常用于致癌物研究的理想模式动物[19]。A/J小鼠烟熏与人类吸烟过程非常相似。我们在烟熏9个月时造模成功,10只A/J小鼠肺部全部成瘤。通过免疫组化动态观察了IKBKE的表达,瘤体IKBKE表达显著高于对照组,烟熏的早期阶段(1个月)IKBKE明显升高,与细胞实验结果吻合。
为了观察IKBKE对转化细胞生物学特性的影响,我们利用慢病毒siRNA敲减IKBKE后发现,细胞增殖、细胞克隆形成和细胞凋亡显著降低,证实了IKBKE在CSC诱导的支气管上皮细胞恶性转化中担任关键作用。本研究进一步探究了IKBKE作用的信号通路机制。前期研究发现pSTAT3在CSC诱导各代支气管上皮细胞中,与IKBKE类似,有逐步活化的趋势,推测IKBKE可能与STAT3通路相关[11]。Western blot检测结果证实敲减IKBKE确实能降低STAT3磷酸化水平。这提示CSC诱导细胞恶性转化过程中IKBKE参与了对STAT3通路的调控。该调控作用在三阴性乳腺癌中得到证实,IKBKE小分子抑制剂CYT387可抑制STAT通路的活化,这种作用与细胞因子CCL5和IL-6导致的免疫微环境的失调有关[20]。我们进一步利用STAT3通路激动剂IL-6和IKBKE siRNA共同作用P70细胞,结果显示,IL-6显著阻滞了敲减IKBKE对细胞增殖、克隆形成和凋亡的影响,证实了支气管上皮恶性转化过程中IKBKE对STAT3通路的调控作用。
总之,本研究表明,IKBKE可能通过调控STAT3通路抑制细胞凋亡,促进细胞增殖,参与吸烟诱导肺癌的发生过程,为明确肺癌发生的分子机制及高危人群的干预提供了新的实验数据。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7–30. DOI:10.3322/caac.21332 |
| [2] | LORTET-TIEULENT J, KULHANOVA I, JACOBS E J, et al. Cigarette smoking-attributable burden of cancer by race and ethnicity in the United States[J]. Cancer Causes Control, 2017, 28(9): 981–984. DOI:10.1007/s10552-017-0932-9 |
| [3] | LEE H M, KIM C W, HWANG K A, et al. Three components of cigarette smoke altered the growth and apoptosis of metastatic colon cancer cells via inducing the synthesis of reactive oxygen species and endoplasmic reticulum stress[J]. Environ Toxicol Phar, 2016, 45: 80–89. DOI:10.1016/j.etap.2016.05.016 |
| [4] | RAJURKAR M, DE JESUS-MONGE W E, DRISCOLL D R, et al. The activity of Gli transcription factors is essential for Kras-induced pancreatic tumorigenesis[J]. Proc Natl Acad Sci U S A, 2012, 109(17): E1038–E1047. DOI:10.1073/pnas.1114168109 |
| [5] | GUO J, KIM D, GAO J, et al. IKBKE is induced by STAT3 and tobacco carcinogen and determines chemosensitivity in non-small cell lung cancer[J]. Oncogene, 2013, 32(2): 151–159. DOI:10.1038/onc.2012.39 |
| [6] | LI W, CHEN Y, ZHANG J, et al. IKBKE upregulation is positively associated with squamous cell carcinoma of the lung in vivo and malignant transformation of human bronchial epithelial cells in vitro[J]. Med Sci Monit, 2015, 21: 1577–1586. DOI:10.12659/MSM.893815 |
| [7] | RAJURKAR M, DANG K, FERNANDEZ-BARRENA M G, et al. IKBKE is required during KRAS-induced pancreatic tumorigenesis[J]. Cancer Res, 2017, 77(2): 320–329. DOI:10.1158/0008-5472.CAN-15-1684 |
| [8] | CAO C, ZHAO G W, YU W, et al. Activation of STAT3 stimulates AHSP expression in K562 cells[J]. Sci China Life Sci, 2014, 57: 488–494. DOI:10.1007/s11427-014-4652-z |
| [9] | GE G Z, XU T R, CHEN C. Tobacco carcinogen NNK- induced lung cancer animal models and associated carcinogenic mechanisms[J]. Acta Biochim Biophys Sin(Shanghai), 2015, 47(7): 477–487. DOI:10.1093/abbs/gmv041 |
| [10] | LI W, ZHOU J, CHEN Y, et al. Cigarette smoke enhances initiation and progression of lung cancer by mutating Notch1/2 and dysregulating downstream signaling molecules[J]. Oncotarget, 2017, 8(70): 115128–115139. DOI:10.18632/oncotarget.22924 |
| [11] |
袁娜娜, 李伟, 陈余清, 等. 信号传导及转录激活子3通路参与卷烟烟气凝集物诱导永生化人支气管上皮细胞的恶性转化[J].
中国药理学与毒理学杂志, 2016, 30(10): 833–842.
YUAN N N, LI W, CHEN Y Q, et al. STAT3 signaling pathway participates in malignant transformation of Immortalized human bronchial epithelial cells induced by cigarette smoke condensate[J]. Chin J Pharmacol Toxicol, 2016, 30(10): 833–842. DOI:10.3867/j.issn.1000-3002.2016.11.009 |
| [12] | PETERS R T, LIAO S M, MANIATIS T. IKKepsilon is part of a novel PMA-inducible IkappaB kinase complex[J]. Mol cell, 2000, 5(3): 513–522. DOI:10.1016/S1097-2765(00)80445-1 |
| [13] | HARRIS J, OLIERE S, SHARMA S, et al. Nuclear accumulation of cRel following C-terminal phosphorylation by TBK1/IKK epsilon[J]. J Immunol, 2006, 177(4): 2527–2535. DOI:10.4049/jimmunol.177.4.2527 |
| [14] | GUO J P, TIAN W, SHU S, et al. IKBKE phosphorylation and inhibition of FOXO3a: a mechanism of IKBKE oncogenic function[J]. PLoS ONE, 2013, 8(5): e63636. DOI:10.1371/journal.pone.0063636 |
| [15] | YANG W, QU Y, TAN B, et al. Prognostic significance of preoperative IKBKE expression in esophageal squamous cell carcinoma[J]. OncoTargets Ther, 2018, 11: 1305–1314. DOI:10.2147/OTT.S156818 |
| [16] | ZHANG Z, LU J, GUO G, et al. IKBKE promotes glioblastoma progression by establishing the regulatory feedback loop of IKBKE/YAP1/miR-Let-7b/I[J]. Tumour Biol, 2017, 39(7): 1010428317705575. DOI:10.1177/1010428317705575 |
| [17] | LU J, YANG Y, GUO G, et al. IKBKE regulates cell proliferation and epithelial-mesenchymal transition of human malignant glioma via the Hippo pathway[J]. Oncotarget, 2017, 8(30): 49502–49514. DOI:10.18632/oncotarget.17738 |
| [18] | CHALLA S, GUO J P, DING X, et al. IKBKE is a substrate of EGFR and a therapeutic target in non-small cell lung cancer with activating mutations of EGFR[J]. Cancer Res, 2016, 76(15): 4418–4429. DOI:10.1158/0008-5472.CAN-16-0069 |
| [19] | YE H, YANG X, WU K, et al. Inhibitory effect of 5F on development of lung cancer in A/J mice[J]. Int J Clin Exp Pathol, 2015, 8(4): 4138–4142. DOI:10.1007/s00109-010-0676-4 |
| [20] | BARBIE T U, ALEXE G, AREF A R, et al. Targeting an IKBKE cytokine network impairs triple-negative breast cancer growth[J]. J Clin Invest, 2014, 124(12): 5411–5423. DOI:10.1172/JCI75661 |



