2. 610072 成都,四川省人民医院药学部;
3. 637000 四川南充,川北医学院药学院;
4. 4040004 重庆 万州,重庆三峡中心医院药学部
2. Department of Pharmacy, Sichuan Provincial People's Hospital, Chengdu, Sichuan Province, 610072;
3. School of Pharmacy, North Sichuan Medical Collage, Nanchong, Sichuan Province, 637000;
4. Department of Pharmacy, Chongqing Three Gorges Central Hospital, Wanzhou, Chongqing, 404000, China
糖尿病是一种慢性进展性疾病,其发病率逐年升高。据估计,到2030年成人糖尿病患者将到达4.39亿,占成人人口的7.7%[1-2]。中国是世界上糖尿病人口最多的国家(9 800万),到2035年将达到1.43亿,大部分为2型糖尿病[3]。2型糖尿病患者最初通过控制饮食和锻炼来降低血糖,随着病情的发展需要药物才能控制血糖,二甲双胍通常作为一线药物应用,能有效降低血糖,减少体质量,但部分患者不能耐受其带来的胃肠道不良反应。当单药不能控制血糖时,就需要在此基础上添加其他药物,包括磺酰脲类、噻唑烷二酮类等。尽管血糖得到有效控制,随之的不良反应也出现,有体质量增加、低血糖、肾功能不全等[1, 4],限制了临床的应用。所以,既能有效控制血糖,又不增加不良反应的理想药物仍空缺。最近,钠-葡萄糖共转运蛋白-2抑制剂(sodium-glucose cotransporter-2 inhibitors,SGLT2抑制剂)作为新型的降血糖药,陆续在国外上市。卡格列净、恩格列净和达格列净也即将在中国上市。SGLT2抑制剂降血糖机制不依赖于胰岛素的功能,而是通过增强肾小管对尿糖的滤过率,来降低血糖,减少热量[5]。SGLT2抑制剂相对于安慰剂能明显控制血糖、降低血压,降低糖化血红蛋白水平[6],多项临床试验证实其有较好的疗效。但临床用药面临多个药物的选择,新药又缺乏头对头的临床试验,相对于其他药物疗效及安全性如何,仍缺乏证据。因此本研究通过网状Meta分析,全面、详细地评价卡格列净、恩格列净和达格列净的安全性。
1 资料与方法 1.1 检索策略及纳入标准 1.1.1 检索策略两名研究人员根据检索策略,独立检索PubMed、Cochrane Central Register of Controlled Trials(CENTRAL)、Embase数据库,检索时限从建库至2018年1月,同时手工检索Clinical Trials.gov网站,并且追溯纳入研究及已发表Meta分析的参考文献。检索词包括:“SGLT2、Empagliflozin、Dapagliflozin、Canagliflozin”等。
1.1.2 纳入标准符合以下标准的研究将会被纳入:患者年龄≥18岁;2型糖尿病不合并肾功能障碍、心血管疾病;试验周期≥18周;对照组为安慰剂或阳性药物;无论剂量;至少提供因不良反应退出、生殖器感染、尿路感染、低血糖事件其中之一数据,低血糖定义为血糖测定≤3.9 mmol/L,无论是否出现相关症状;交叉试验、开放试验将会被排除;同一人群两次试验,将取试验周期较长的;如果多臂试验出现A vs B vs A+B,只取A vs B。
1.2 数据提取及质量评价 1.2.1 数据提取两名研究员根据预先制定资料提取表,独立提取信息,任何分歧将会由第三人或讨论决定,提取信息包括:第一作者(发表年份)、背景治疗、主要人群、疗程、用法、干预措施、样本量、平均病程、年龄、糖化血红蛋白(HbA1c%)、临床试验注册号(NCT)、结局指标、试验类型。同时提取,首要指标:因不良反应退出人数、HbA1c<7%达标人数。次要指标:生殖器感染、尿路感染、低血糖人数。如果原始数据无法提取便联系作者,联系无果将排除此研究。
1.2.2 质量评价两名研究员通过Cochrane偏倚风险评估工具[7],从以下方面评价文献质量:随机序列、盲法、分配隐藏、选择性报告、数据完整、其他偏倚,以“低风险、不确定风险、高风险”评价每个方面。如果无足够信息判断,将以“不确定”评价。
1.3 统计学方法所有数据合成将由STATA 14完成。第一步,传统Meta分析:直接比较数据由随机效应模型合成,I2大小判断异质性:I2 < 25%属于低异质性;25%<I2<75%属于中等异质性;I2>75%属于高异质性。二分类变量,由比值比(OR)及95%CI合并表示。提前设定以下亚组分析:背景治疗、主要人群、安慰剂或阳性药物对照、性别。第二步,网状Meta分析:应用频率学方法,通过随机效应模型合成间接比较和直接比较数据,“设计-干预交互模型(design-by-treatment interaction model)”评价网状Meta分析的整体异质性[8],当P>0.05表示未发现明显异质性,闭合三环或四环由“环不一致性(loop-specific)”方法检测,当95%CI达到0时,认为不存在不一致性[9]。发表偏倚由“比较-校正漏斗图(comparison-adjusted funnel plot)”检测,两侧基本对称表明无明显发表偏倚[10]。累计排序曲线下面积(surface under the cumulative ranking curve,SUCRA)和平均排序用来对各干预措施优劣进行排序[11]。
2 结果 2.1 文献纳入初步检索获得2 028篇相关文献,临床试验网462项研究。经过逐步筛选后共34篇文献,35项RCTs纳入网状Meta分析,包括21 216名患者,8个干预措施。检索流程图见图 1。检索策略如下:PubMed:
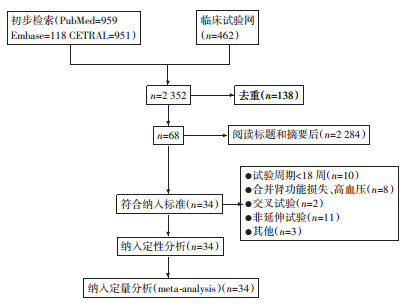
|
| 图 1 3种药物治疗2型糖尿病文献检索及筛选流程图 |
#1 Sodium glucose co-transporter OR SGLT2 inhibitors OR sodium-glucose co-transport 2 inhibitors
#2 SGLT2 OR SGLT-2 OR SGLT 2
#4 Empagliflozin OR Jardiance
#5 dapagliflozin OR Farxiga OR Forxiga
#6 Canagliflozin OR Invokana
#7 OR#1- #6
#8 random*
#9 “Randomized Controlled Trial”[Publication Type]
#10 controlled clinical trial[pt]
#11 randomized[tiab]
#12 placebo[tiab]
#13 randomly[tiab]
#14 trial[tiab]
#15 groups[tiab]
#16 drug therapy[sh]
#17 OR#8- #16
#18 #7 AND #17
2.2 文献特征2011年到2017年35项随机双盲试验纳入定量分析。疗程18~104周,背景治疗包括饮食和锻炼、单药治疗(二甲双胍、磺酰脲类、批格列酮、胰岛素等)、双药治疗。病程0.4~13.6年,年龄51.4~63.6岁,糖化血红蛋白7.6~9.3%,对照药物包括格列美脲、西格列汀、二甲双胍等,主要人群为亚洲人和白人,2篇[12-13]为可变剂量,其余为固定剂量,HENRY[14]文献包括2项RCT。12篇文献研究了卡格列净,10篇文献研究了恩格列净,12篇文献研究了达格列净。详见表 1。
| 作者,年份 | 背景治疗 | 人群 | 疗程(周) | 用法 | 对照组 | n | 病程(年) | 年龄(岁) | HbA1c(%) | NCT | 结局指标 | 试验类型 |
| 卡格列净 | ||||||||||||
| Leiter,2015[15] | MET | 白人 | 104 | 100 mg QD,300 mg QD | GLIM | 1450 | 6.6 | 56.2 | 7.8 | 00968812 | ①②③④ | MC,R,DB |
| Schernthaer,2013[17] | MET+SU | 白人 | 52 | 300 mg QD | SITA | 755 | 9.6 | 56.7 | 8.1 | 01137812 | ①②③④ | MC,R,DB |
| Stenlof,2013[18] | 饮食、锻炼 | 白人 | 26 | 100 mg QD,300 mg QD | PLA | 584 | 4.3 | 55.4 | 8.0 | 01081834 | ①②③④ | MC,R,DB |
| Lavalle-González,2013[19] | MET | 白人 | 52 | 100 mg QD,300 mg QD | SITA | 1101 | 6.9 | 55.4 | 7.9 | 01106677 | ①②③④ | MC,R,DB |
| Wilding,2013[20] | MET+SU | 白人 | 52 | 100 mg QD,300 mg QD | PLA | 469 | 9.6 | 56.8 | 8.1 | 01106625 | ①②③④ | MC,R,DB |
| Inagaki,2014[21] | 饮食、锻炼 | 亚洲人 | 24 | 100 mg QD | PLA | 272 | 5.4 | 58 | 8.0 | 014 13204 | ①②③④ | MC,R,DB |
| Forst,2014[22] | MET+PIOG | 白人 | 26 | 100 mg QD,300 mg QD | PLA | 342 | 10.5 | 57.4 | 7.9 | 01106690 | ①②③④ | MC,R,DB |
| Bode,2015[23] | INS/SU | 白人 | 104 | 100 mg QD,300 mg QD | PLA | 714 | 11.7 | 63.6 | 7.7 | 01106651 | ①②③④ | MC,R,DB |
| Qiu,2014[24] | MET | 白人 | 18 | 50 mg BID,150 mg BID | PLA | 279 | 7.0 | 57.4 | 7.6 | 01340664 | ①②③④ | MC,R,DB |
| Rosenstock,2016[25] | 饮食、锻炼 | 白人 | 26 | 100 mgQD,300 mg QD | MET | 712 | 3.3 | 54.9 | 8.8 | 01809327 | ①②③④ | MC,R,DB |
| Ji,2015[3] | MET/MET+SU | 亚洲人 | 18 | 100 mg QD,300 mg QD | PLA | 676 | 6.7 | 56.2 | 8.0 | 01381900 | ①②③④ | MC,R,DB |
| Rodbard,2016[12] | MET+SITA | 白人 | 26 | 100~300 mg QD | PLA | 216 | 9.9 | 57.4 | 8.5 | - | ①②③④ | MC,R,DB |
| 恩格列净 | ||||||||||||
| Ridderstr#229;le,2014[16] | MET | 白人 | 104 | 25 mg QD | GLIM | 1545 | >1-5 | 56.0 | 7.92 | 01809327 | ①②③④ | MC,R,DB |
| Roden,2015[26] | 饮食、锻炼 | 亚洲人 | 76 | 10 mg QD,25 mg QD | PLA/SITA | 899 | 1-5 | 55.0 | 7.88 | 01289990 | ①②③④ | MC,R,DB |
| S fteland,2017[27] | MET+LINA | 白人 | 24 | 10mg QD,25 mg QD | PLA | 332 | 5-10 | 55.2 | 7.97 | 01734785 | ①②③④ | MC,R,DB |
| Merker,2015[28] | MET | 白人 | 76 | 10 mg QD,25 mg QD | PLA | 637 | 1-5 | 55.7 | 7.9 | 01289990 | ①②③④ | MC,R,DB |
| Haering,2013[29] | MET+SU | 亚洲人 | 24 | 10 mg QD,25 mg QD | PLA | 663 | >10 | 57.1 | 8.1 | 01159600 | ①②③④ | MC,R,DB |
| Kovacs,2015[30] | MET+PIOG/MET | 亚洲人 | 76 | 10 mg QD,25 mg QD | PLA | 498 | 1-5 | 54.5 | 8.1 | 01210001 | ①②③④ | MC,R,DB |
| DeFronzo,2015[31] | MET | 白人 | 52 | 10 mg QD,25 mg QD | LINA | 405 | 1-5 | 56.2 | 8.0 | 01422876 | ①②③④ | MC,R,DB |
| Lewin,2015[32] | 饮食、锻炼 | 白人 | 52 | 10 mg QD,25 mg QD | LINA | 405 | 1-5 | 54.2 | 8.02 | 01422876 | ①②③④ | MC,R,DB |
| Rosenstock,2014[33] | INS | 白人 | 52 | 10 mg QD,25 mg QD | PLA | 563 | >10 | 56.7 | 8.34 | 01306214 | ①②③④ | MC,R,DB |
| Hadjadj,2016[34] | 饮食、锻炼 | 白人 | 24 | 10 mg QD,25 mg QD | MET | 680 | ≤1 | 52.9 | 8.69 | 01719003 | ①②③④ | MC,R,DB |
| 达格列净 | ||||||||||||
| Ji,2014[35] | 饮食、锻炼 | 亚洲人 | 24 | 5 mg QD,10 mg QD | PLA | 393 | 1.4 | 51.4 | 8.3 | 01095653 | ①②③④ | MC,R,DB |
| Ferrannini,2010[36] | 饮食、锻炼 | 白人 | 24 | 5 mg QD,10 mg QD | PLA | 485 | 0.4 | 52.6 | 7.92 | 00528372 | ①②③④ | MC,R,DB |
| Rosenstock,2014[37] | MET | 白人 | 24 | 10 mg QD | SAXA | 355 | 7.6 | 54 | 8.94 | 01606007 | ①②③④ | MC,R,DB |
| Bailey,2013[38] | MET | 白人 | 102 | 2.5 mg QD,5 mg QD,10 mg QD | PLA | 546 | 6.1 | 53.9 | 8.05 | 00528879 | ①②③④ | MC,R,DB |
| Frias,2016[39] | MET | 白人 | 28 | 10 mg QD | EXE | 463 | 7.4 | 54.3 | 9.3 | 02229396 | ①②③④ | MC,R,DB |
| Strojek,2014[40] | GLIM | 白人 | 48 | 5 mg QD,10 mg QD | PLA | 596 | 7.4 | 59.8 | 8.1 | 00680745 | ①②③④ | MC,R,DB |
| Jabbour,2014[41] | SITA+MET/SITA | 白人 | 24 | 10 mg QD | PLA | 451 | 5.7 | 54.9 | 7.9 | 00984867 | ①②③④ | MC,R,DB |
| Bailey,2012[42] | 饮食、锻炼 | 白人 | 24 | 5 mg QD | PLA | 282 | 1.4 | 53.0 | 7.9 | - | ①②③④ | MC,R,DB |
| Henry,2012[14] | 饮食、锻炼 | 白人 | 24 | 5 mg QD,10 mg QD | MET/PLA | 1645 | 1.6/2.1 | 51.9/51.6 | 9.17/9.1 | 00643851/00859898 | ①②③④ | MC,R,DB |
| Nauck,2011[13] | MET | 白人 | 52 | 2.5~10 mg QD | GLIP | 914 | 6 | 58 | 7.7 | 00660907 | ①②③④ | MC,R,DB |
| Bolinder,2012[43] | MET | 白人 | 24 | 10 mg QD | PLA | 182 | 6.0 | 60.6 | 7.19 | 00855166 | ①②③④ | MC,R,DB |
| Wilding,2012[44] | INS | 白人 | 24 | 2.5 mg QD,5 mg QD,10 mg QD | PLA | 807 | 13.6 | 59.5 | 8.55 | 00673231 | ①②③④ | MC,R,DB |
| MET:二甲双胍SU:磺酰脲类PIOG:批格列酮INS:胰岛素GLIM:格列美脲PLA:安慰剂SITA:西格列汀LINA:利格列汀SAXA:沙格列汀GLIP:格列吡嗪NCT:试验编号MC:多中心R:随机DB:双盲①:因不良反应退出②:生殖器感染③:尿路感染④:低血糖 | ||||||||||||
2.3 文献质量
30篇文献报告了具体的随机方法,其余研究未报告随机方法,所有RCTs均采用双盲,24篇文献报告了分配隐藏方法,其余未报告,所有RCTs均由厂商赞助。见图 2。
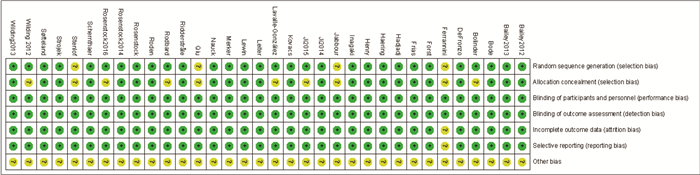
|
| 图 2 纳入文献质量评价偏倚风险总结图s |
2.4 网络图
8种干预措施被纳入分析,包括4个阳性对照药物(DPP-4、GLP-1、MET、SU)、安慰剂、恩格列净、卡格列净、达格列净。10项双臂研究,21项三臂研究,3项四臂研究。总体上,因不良反应退出指标包含了21 216例患者,发生865例;生殖器感染指标包含21 216例患者,发生1 187例;尿路感染指标包含21 216例患者,发生1 729例;低血糖包含17 411例患者,发生2 038例,4个指标网络图大致相同,见图 3。
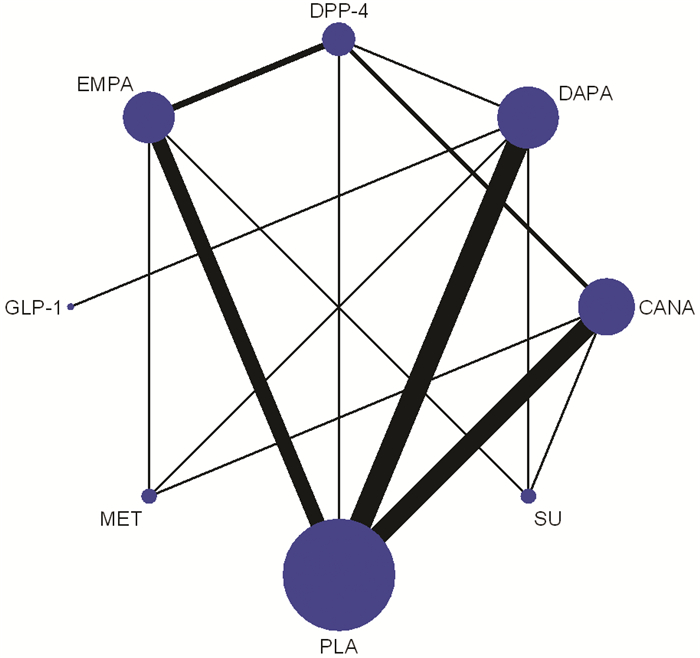
|
| CANA=canagliflozin;EMPA=empagliflozin;DAPA=dapagliflozin.点代表干预措施样本量,线代表直接比较研究,点越大代表样本量越大,线条越粗代表直接比较研究越多 图 3 各分析指标网络结构图 |
2.5 传统Meta分析与网状Meta分析 2.5.1 传统Meta分析结果
因不良反应退出方面:卡格列净、恩格列净、达格列净在整体上因不良反应退出人数与对照组无明显差异(P>0.05),3个亚组分析表明卡格列净、恩格列净、达格列净因不良反应退出人数与对照组也无明显差异(P>0.05);生殖器感染方面:卡格列净、恩格列净、达格列净在整体上生殖器感染人数明显多于对照组,差异有统计学意义(P < 0.05),4个亚组分析也表明卡格列净、恩格列净、达格列净在整体上生殖器感染人数明显多于对照组,差异有统计学意义(P < 0.05),其中3种药物中女性发生生殖器感染人数要明显多于男性,差异有统计学意义(P < 0.05);尿路感染方面:卡格列净和恩格列净在整体上尿路感染发生人数与对照组相比无明显差别,差异无统计学意义(P>0.05),亚组分析也无统计意义(P>0.05),而达格列净在整体尿路感染人数明显多于对照组,差异有统计学意义(P < 0.05),在饮食和锻炼的治疗背景下,达格列净尿路感染人数明显多于对照组,差异有统计学意义(P < 0.01),与安慰剂相比,达格列净尿路感染人数明显多于对照组,差异有统计学意义(P < 0.05),在达格列净组中,女性发生尿路感染的人数明显多于男性,差异有统计学意义(P < 0.01);低血糖方面:当纳入LEITER[15]、RIDDERSTRÅLE[16]、NAUCK[13]文献时出现了明显的异质性(I2>90%),排除这3篇文献后,异质性明显降低(I2 < 27%)。恩格列净和达格列净无论在整体上和亚组分析与对照组相比,低血糖人数都相当,差异无统计学意义(P>0.05),仅卡格列净在整体和亚组分析与对照相比,低血糖人数明显更多,差异有统计学意义(P < 0.05)。见表 2~6。
| 药物 | 亚组 | 研究数 | SGLT2i(例数/n) | 对照组(例数/n) | OR(95%CI) | 异质性(I2) |
| 卡格列净 | 总体 | 12 | 235/4887 | 105/2683 | 1.21(0.96~1.53) | 10.7 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 3 | 23/1046 | 8/522 | 1.41(0.66~2.99) | 0 | |
| 单药 | 4 | 150/2366 | 16/1178 | 1.12(0.84~1.50) | 20.5 | |
| 双药 | 5 | 62/1475 | 30/983 | 1.38(0.89~2.12) | 42 | |
| 主要人群 | ||||||
| 白人 | 10 | 219/4258 | 100/2364 | 1.19(0.94~1.51) | 20.1 | |
| 亚洲人 | 2 | 16/629 | 5/319 | 1.57(0.63~3.91) | 0 | |
| 对照药物 | ||||||
| 安慰剂 | 8 | 98/2332 | 39/1220 | 1.28(0.89~1.85) | 30.9 | |
| 阳性药物 | 4 | 137/2555 | 66/1463 | 1.17(0.87~1.57) | 0 | |
| 恩格列净 | 总体 | 11 | 177/4347 | 112/2727 | 0.99(0.77~1.26) | 0 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 4 | 59/1503 | 38/928 | 0.88(0.58~1.35) | 24.2 | |
| 单药 | 4 | 90/1848 | 57/1302 | 1.13(0.80~1.59) | 0 | |
| 双药 | 3 | 28/996 | 17/497 | 0.81(0.43~1.52) | 0 | |
| 主要人群 | ||||||
| 白人 | 7 | 111/2679 | 71/1888 | 1.12(0.82~1.52) | 0 | |
| 亚洲人 | 4 | 66/1668 | 44/839 | 0.80(0.53~1.20) | 0 | |
| 对照药物 | ||||||
| 安慰剂 | 6 | 86/2249 | 51/1120 | 0.83(0.58~1.19) | 0 | |
| 阳性药物 | 5 | 91/2098 | 61/1607 | 1.15(0.82~1.60) | 0 | |
| 达格列净 | 总体 | 13 | 163/4315 | 93/2704 | 1.10(0.84~1.43) | 33.5 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 7 | 111/2378 | 58/1385 | 1.14(0.82~1.59) | 46.2 | |
| 单药 | 1 | 7/225 | 5/226 | 1.41(0.45~4.45) | - | |
| 双药 | 5 | 45/1712 | 30/1093 | 0.97(0.59~1.58) | 37.6 | |
| 主要人群 | ||||||
| 白人 | 1 | 6/261 | 1/132 | 2.41(0.50~11.70) | - | |
| 亚洲人 | 12 | 157/4054 | 92/2572 | 1.07(0.82~1.41) | 35.5 | |
| 对照组 | ||||||
| 安慰剂 | 4 | 57/1240 | 49/1223 | 1.16(0.79,1.72) | 49 | |
| 阳性药物 | 9 | 106/3075 | 44/1481 | 1.04(0.72~1.50) | 33.3 |
| 药物 | 亚组 | 研究数 | SGLT2i(例数/n) | 对照组(例数/n) | OR(95%CI) | 异质性(I2) |
| 卡格列净 | 总体 | 12 | 396/4887 | 54/2683 | 3.07(2.51~3.76)a | 18.6 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 3 | 43/1046 | 5/522 | 2.90(1.57~5.34)a | 0 | |
| 单药 | 4 | 248/2366 | 27/1200 | 3.16(2.43~4.10)a | 0 | |
| 双药 | 5 | 105/1475 | 22/983 | 2.97(2.05~4.31)a | 59.8 | |
| 主要人群 | ||||||
| 白人 | 10 | 386/4258 | 51/2364 | 3.14(2.55~3.85)a | 26.7 | |
| 亚洲人 | 2 | 10/629 | 3/319 | 1.62(0.51~5.14) | 0 | |
| 对照药物 | ||||||
| 安慰剂 | 8 | 165/2332 | 28/1220 | 2.55(1.87~3.48)a | 26.7 | |
| 阳性药物 | 4 | 231/2555 | 26/1463 | 3.52(2.70~4.59)a | 0 | |
| 男女比 | ||||||
| 男性 | 12 | 128/2375 | - | 0.45(0.36~0.55)a | 32.2 | |
| 女性 | 260/2285 | - | ||||
| 恩格列净 | 总体 | 11 | 305/4347 | 52/2727 | 3.13(2.51~3.90) | 0 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 4 | 86/1503 | 19/928 | 2.46(1.64~3.70)a | 0 | |
| 单药 | 4 | 177/1848 | 24/1302 | 3.92(2.92~5.26)a | 0 | |
| 双药 | 3 | 42/996 | 9/497 | 2.08(1.15~3.77)a | 0 | |
| 主要人群 | ||||||
| 白人 | 7 | 216/2679 | 39/1888 | 3.34(2.57~4.33)a | 15.8 | |
| 亚洲人 | 4 | 89/1668 | 13/839 | 2.64(1.74~4.03)a | 0 | |
| 对照药物 | ||||||
| 安慰剂 | 6 | 133/2249 | 17/1120 | 2.81(1.99~3.99)a | 0 | |
| 阳性药物 | 5 | 172/2098 | 35/1607 | 3.36(2.52~4.48)a | 28.9 | |
| 男女比 | ||||||
| 男性 | 12 | 98/2144 | - | 0.41(0.32~0.53)a | 30.3 | |
| 女性 | 180/1756 | - | ||||
| 达格列净 | 总体 | 13 | 354/4315 | 53/2704 | 3.26(2.62~4.05) | 0 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 5 | 121/1712 | 22/1093 | 3.18(2.22~4.57)a | 0 | |
| 单药 | 7 | 214/2378 | 30/1385 | 3.08(2.32~4.09)a | 0 | |
| 双药 | 1 | 19/225 | 1/226 | 6.58(2.69~16.11)a | - | |
| 主要人群 | ||||||
| 白人 | 12 | 344/4054 | 52/2572 | 3.26(2.62~4.07)a | 0 | |
| 亚洲人 | 1 | 10/261 | 1/132 | 3.09(0.87~10.96) | - | |
| 对照药物 | ||||||
| 安慰剂 | 9 | 239/3075 | 28/1481 | 2.90(2.19~3.83)a | 0 | |
| 阳性药物 | 4 | 115/1240 | 25/1223 | 3.88(2.76~5.46)a | 0 | |
| 男女比 | ||||||
| 男性 | 7 | 69/1428 | - | 0.34(0.27~0.44)a | 0 | |
| 女性 | 200/1488 | - | ||||
| a:有统计学意义 | ||||||
| 药物 | 亚组 | 研究数 | SGLT2i(例数/n) | 对照组(例数/n) | OR(95%CI) | 异质性(I2) |
| 卡格列净 | 总体 | 12 | 326/4887 | 147/2683 | 1.19(0.98~1.45) | 0 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 3 | 34/1046 | 12/522 | 1.39(0.74~2.6) | 0 | |
| 单药 | 4 | 222/2366 | 82/1178 | 1.37(1.06~1.75)a | 0 | |
| 双药 | 5 | 70/1475 | 53/983 | 0.82(0.56~1.20) | 0 | |
| 主要人群 | ||||||
| 白人 | 10 | 311/4258 | 135/2364 | 1.24(1.01~1.52) | 0 | |
| 亚洲人 | 2 | 15/629 | 12/319 | 0.6(0.27~1.36) | 0 | |
| 对照药物 | ||||||
| 安慰剂 | 8 | 163/2332 | 67/1220 | 1.24(0.93~1.66) | 0 | |
| 阳性药物 | 4 | 163/2555 | 80/1463 | 1.14(0.87~1.50) | 11.6 | |
| 恩格列净 | 总体 | 11 | 523/4347 | 339/2730 | 0.96(0.82~1.11) | 0 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 4 | 145/1503 | 90/928 | 0.97(0.73~1.28) | 0 | |
| 单药 | 4 | 251/1848 | 179/1302 | 0.98(0.79~1.21) | 0 | |
| 双药 | 3 | 127/996 | 70/500 | 0.89(0.64~1.23) | 0 | |
| 主要人群 | ||||||
| 白人 | 7 | 326/2679 | 232/1888 | 0.98(0.81~1.18) | 0 | |
| 亚洲人 | 4 | 197/1668 | 107/842 | 0.91(0.70~1.18) | 0 | |
| 对照组 | ||||||
| 安慰剂 | 6 | 279/2249 | 152/1123 | 0.9(0.72~1.12) | 0 | |
| 阳性药物 | 5 | 244/2098 | 187/1613 | 1.01(0.82~1.24) | 0 | |
| 男女比 | ||||||
| 男性 | 10 | 89/2150 | - | 0.19(0.15~0.23) | 18.2 | |
| 女性 | 393/1750 | - | ||||
| 达格列净 | 总体 | 13 | 289/4315 | 146/2704 | 1.26(1.02~1.55)a | 0 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 5 | 122/1712 | 56/1093 | 1.54(1.11~2.12)a | 0 | |
| 单药 | 7 | 156/2378 | 81/1385 | 1.08(0.81~1.44) | 0 | |
| 双药 | 1 | 11/225 | 9/225 | 1.24(0.51~3.03) | - | |
| 主要人群 | ||||||
| 白人 | 12 | 277/4054 | 142/2572 | 1.25(1.01~1.55) | 0 | |
| 亚洲人 | 1 | 12/261 | 4/132 | 1.49(0.52~4.30) | - | |
| 对照组 | ||||||
| 安慰剂 | 9 | 174/3075 | 70/1481 | 1.39(1.06~1.83)a | 0 | |
| 阳性药物 | 4 | 84/1240 | 76/1223 | 1.10(0.8~1.51) | 36.7 | |
| 男女比 | ||||||
| 男性 | 7 | 76/1428 | - | 0.49(0.38~0.65)a | 0 | |
| 女性 | 151/1488 | - | ||||
| a:有统计学意义 | ||||||
| 药物 | 亚组 | 研究数 | SGLT2i(例数/n) | 对照组(例数/n) | OR(95%CI) | 异质性(I2) |
| 卡格列净 | 总体 | 11 | 654/3919 | 324/2201 | 1.44(1.23~1.69)a | 27 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 3 | 41/1046 | 19/522 | 1.08(0.63~1.87) | 11.2 | |
| 单药 | 3 | 278/1398 | 108/696 | 1.45(1.11~1.88)a | 0 | |
| 双药 | 5 | 335/1475 | 197/983 | 1.51(1.22~1.87)a | 59.7 | |
| 主要人群 | ||||||
| 白人 | 9 | 591/3290 | 310/1882 | 1.38(1.17~1.63)a | 27.7 | |
| 亚洲人 | 2 | 63/629 | 14/319 | 2.12(1.30~3.48)a | 0 | |
| 对照药物 | ||||||
| 安慰剂 | 8 | 425/2332 | 144/1220 | 1.71(1.39~2.12)a | 0 | |
| 阳性药物 | 3 | 229/1587 | 180/981 | 1.15(0.90~1.47) | 34.9 | |
| 恩格列净 | 总体 | 10 | 316/3582 | 153/1951 | 1.07(0.84~1.37) | 0 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 4 | 15/1503 | 7/928 | 1.23(0.51~2.97) | 0 | |
| 单药 | 3 | 229/1083 | 119/522 | 0.92(0.67~1.23) | 0 | |
| 双药 | 3 | 72/996 | 27/501 | 1.38(0.89~2.14) | 42.8 | |
| 主要人群 | ||||||
| 白人 | 6 | 239/1914 | 123/1108 | 0.96(0.7~1.29) | 0 | |
| 亚洲人 | 4 | 77/1668 | 30/843 | 1.33(0.87~2.02) | 19.3 | |
| 对照药物 | ||||||
| 安慰剂 | 6 | 298/2249 | 145/1124 | 1.05(0.81~1.37) | 20.2 | |
| 阳性药物 | 4 | 18/1333 | 8/827 | 1.22(0.54~2.77) | 0 | |
| 达格列净 | 总体 | 12 | 447/3909 | 148/2296 | 1.17(0.92~1.49) | 0 |
| 背景治疗 | ||||||
| 饮食和锻炼 | 5 | 23/1712 | 16/1093 | 0.99(0.5~1.93) | 36.5 | |
| 单药 | 6 | 418/1972 | 128/977 | 1.18(0.91~1.54) | 0 | |
| 双药 | 1 | 6/225 | 4/226 | 1.51(0.43~5.28) | - | |
| 主要人群 | ||||||
| 白人 | 11 | 445/3648 | 146/2164 | 1.18(0.93~1.51) | 0 | |
| 亚洲人 | 1 | 2/261 | 2/132 | 0.48(0.06~3.82) | - | |
| 对照药物 | ||||||
| 安慰剂 | 9 | 440/3075 | 137/1481 | 1.22(0.95~1.57) | 0 | |
| 阳性药物 | 3 | 7/834 | 11/815 | 0.62(0.25~1.58) | 0 | |
| a:有统计学意义 | ||||||
| 治疗措施 | 因不良反应退出 | 生殖器感染 | 尿路感染 | 低血糖 | |||||||
| SUCRA | 平均排名 | SUCRA | 平均排名 | SUCRA | 平均排名 | SUCRA | 平均排名0 | ||||
| 卡格列净 | 46% | 4.8 | 16.6% | 6.8 | 23.9% | 6.3 | 32.3% | 5.7 | |||
| 恩格列净 | 85.8% | 2.0 | 21.9% | 6.5 | 72.9% | 2.9 | 76.8% | 3.9 | |||
| 达格列净 | 42.2% | 5.0 | 6.4% | 7.6 | 18.6% | 6.7 | 58.9% | 2.6 | |||
| 二甲双胍 | 5.4% | 7.6 | 65.1% | 3.4 | 76.4% | 2.7 | 22.8% | 6.4 | |||
| DPP-4抑制剂 | 36.2% | 5.5 | 80.9% | 2.3 | 38.4% | 5.3 | 59.1% | 3.9 | |||
| GLP-1 | 65% | 3.4 | 57.3% | 4 | 39.8% | 5.2 | 64.2% | 3.5 | |||
| 磺酰脲类 | 81% | 2.3 | 93.9% | 1.4 | 68.4% | 3.2 | 0 | 8 | |||
| 安慰剂 | 38.8% | 5.3 | 57.8% | 4 | 61.6% | 3.7 | 85.8% | 2.0 | |||
2.5.2 网状Meta分析结果
因不良反应退出和生殖器感染方面:卡格列净、恩格列净、达格列净与安慰剂和阳性药物比较,因不良反应退出人数无明显区别,同时3个药物之间比较也无明显差别;卡格列净与DDP-4抑制剂、MET、SU、安慰剂相比生殖器感染人数明显增多,差异有统计学意义(OR:3.14~5.16,P < 0.05),达格列净与DDP-4抑制剂、GLP-1抑制剂、MET、SU、安慰剂相比生殖器感染人数明显增多,差异有统计学意义(OR:3.34~6.60,P < 0.05),恩格列净与DDP-4抑制剂、MET、SU、安慰剂相比生殖器感染人数明显增多,差异有统计学意义(OR:2.88~5.16,P < 0.05),3个药物之间比较无明显差异。尿路感染和低血糖方面:卡格列净、恩格列净、达格列净与安慰剂和阳性药物比较,尿路感染人数无明显区别,同时3个药物之间比较也无明显差别;在剔除明显导致异质性的3[13, 5, 16]个研究后,卡格列净与恩格列净、安慰剂相比,低血糖发生人数明显较多,差异有统计学意义[OR=1.53,95%CI(1.02,2.30);OR=1.74,95%CI(1.32,2.30),P < 0.05],恩格列净和达格列净与其他干预措施比较无明显差异。
2.6 整体异质性与环不一致性4个指标通过“设计-干预交互模型”检测均未发现明显异质性(P>0.05),同时环不一致性检测,各闭合环未发现明显的不一致性,见图 4。
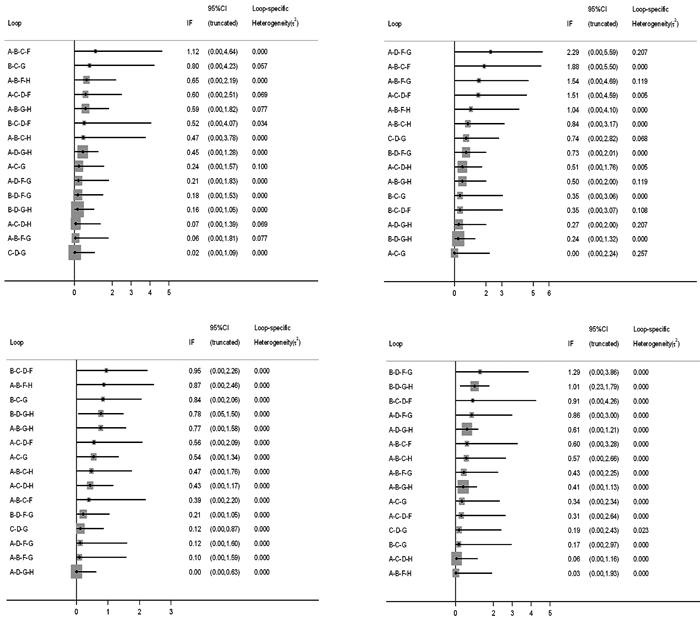
|
|
A:CANA;B:DAPA;C:DPP-4;D:EMPA;E:GLP-1;F:MET;G:PLA;H:SU a:因不良反应退出;b:生殖器感染;c:尿路感染;d:低血糖 图 4 3种药物治疗2型糖尿病各指标环不一致性检验图 |
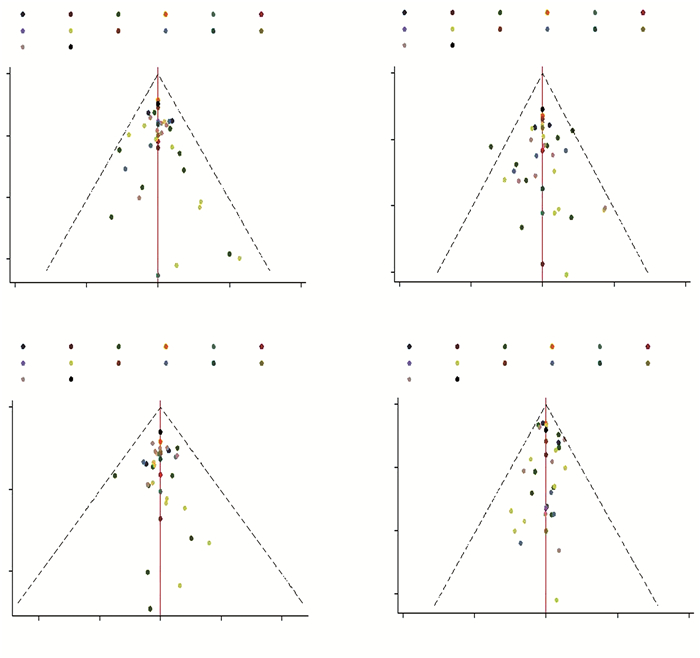
2.7 比较-校正漏斗图
漏斗图检测,4个指标纳入研究基本对称分布在无效线两侧,均未发现明显的发表偏倚。见图 5。
|
|
A:CANA;B:DAPA;C:DPP-4;D:EMPA;E:GLP-1;F:MET;G:PLA;H:SU a:因不良反应退出;b:生殖器感染;c:尿路感染;d:低血糖 图 5 3种药物治疗2型糖尿病各指标比较-校正漏斗图 |
2.8 累计排序曲线下面积
恩格列净在因不良反应退出方面最优(SUCRA=85.8%),磺酰脲类在生殖器感染方面最优(SUCRA=93.9%),恩格列净和二甲双胍在尿路感染方面最优(SUCRA=72.9%、76.4%),恩格列净除安慰剂外低血糖方面最优(SUCRA=76.8%),而磺酰脲类则排名最后(SUCRA=0%)。见表 6。
3 讨论肾脏对维持血糖稳定发挥了重要作用,肾脏近曲小管负责对原尿中的葡萄糖进行重吸收,在没超过肾糖阈的情况下,葡萄糖将会通过SGLT1和SGLT2被全部吸收,随后被葡萄糖转运蛋白转运至周围毛细血管网中。而T2DM患者肾糖阈和重吸收能力显著增加,致使肾脏中糖原聚集。SGLT2位于肾脏近曲小管,具有低亲和力、高转运力的特点,负责90%以上葡萄糖的重吸收。SGLT2抑制剂抑制了SGLT2转运葡萄糖的能力,增加尿糖的排泄,降低血糖水平[45-46]。
本研究发现:3种SGLT2抑制剂与安慰剂和阳性药物相比,不会增加因不良反应退出的事件,其发生率约为4%,耐受性较好。而3种药物明显增加了生殖器感染的发生率,约5.6%,同时是对照组的2到6倍,其中干预措施排序发现,达格列净导致生殖器感染的人数最多(SUCRA=6.4%),男女发生率也有显著的差别,女性感染人数大概是男性3倍,尤其是绝经期、曾经有过生殖器感染史、肥胖的女性。可能是SGLT2抑制剂增加了尿糖的排泄,患者出现多尿的症状,为真菌的感染提供了营养基础或者由于高血糖水平减弱了患者免疫力[46, 47]所导致。整体上,3种药物不会增加尿路感染的发生率,在传统Meta分析中,仅达格列净轻微增加了尿路感染的人数,同时干预措施排序发现,达格列净导致尿路感染的人数最多(SUCRA=18.6%)。但无论是生殖器感染或尿路感染,患者在药物的治疗下,都能痊愈,不会导致患者退出研究。关于低血糖,由于磺酰脲类能明显导致低血糖的发生,出现了明显的异质性,因此进行Meta分析时剔除关于磺酰脲类的研究,最后干预措施排序中也发现,其导致低血糖的人数最多(SUCRA=0%),整体上,恩格列净和达格列净没有增加低血糖的风险,但卡格列净与恩格列净和安慰剂相比,低血糖人数有明显的增加,约1.5倍。最后,在不一致性检测中,尿路感染和低血糖中“B-D-G-H”环出现了不一致性,但仅是15个环其中之一,不会导致结果的不一致。
本研究存在以下不足:①纳入研究随访时间较短,最长104周,3种药物对于患者血脂及糖化血红蛋白长期的影响不能做出评价;②不能排除背景治疗对试验的影响;③尽管漏斗图表明不存在发表偏倚,但本研究仅纳入英文文献,缺少其他的语言文献的纳入,可能会存在发表偏倚;④3种药物涉及的剂量较多,因此没有分析是否上述不良反应与剂量有关。
综上所述,3种SGLT2抑制剂治疗2型糖尿病,安全性和耐受性均较好,其中恩格列净耐受性和安全性可能最好。
| [1] | Executive summary: Standards of medical care in diabetes—2012[J]. Diabetes Care, 2012, 35(Suppl 1): S4-S10. DOI: 10.2337/dc12-s004. |
| [2] | CHEN L, MAGLIANO D, ZIMMET P Z. The worldwide epidemiology of type 2 diabetes mellitus—present and future perspectives[J]. Nat Rev Endocrinol, 2011, 8(4): 228–236. DOI:10.1038/nrendo.2011.183 |
| [3] | JI L, HAN P, LIU Y, et al. Canagliflozin in Asian patients with type 2 diabetes on metformin alone or metformin in combination with sulphonylurea[J]. Diabetes Obes Metab, 2015, 17(1): 23–31. DOI:10.1111/dom.12385 |
| [4] | INZUCCHI S E, BERGENSTAL R M, BUSE J B, et al. Management of hyperglycaemia in type 2 diabetes: a patient- centered approach. Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD)[J]. Diabetologia, 2012, 35(6): 1364–1379. DOI:10.1007/s00125-012-2534-0 |
| [5] | BASILE J N. The potential of sodium glucose cotransporter 2 (SGLT2) inhibitors to reducecardiovascular risk in patients with type 2 diabetes (T2DM)[J]. J Diabetes Complicat, 2013, 27(3): 280–286. DOI:10.1016/j.jdiacomp.2012.12.004 |
| [6] | SHYANGDAN D S, UTHMAN O A, WAUGH N, et al. SGLT-2 receptor inhibitors for treating patients with type 2 diabetes mellitus: a systematic review and network meta-analysis[J]. BMJ Open, 2016, 6(2): e009417. DOI:10.1136/bmjopen-2015-009417 |
| [7] | HIGGINS J P T, ALTMAN D G, STERNE A C. Chapter 8: Assessing risk of bias in included studies.[M]//Higgins J, Green S, eds. Cochrane Handbook for Systematic Reviews of Interventions Version 510 (updated March 2011): The Cochrane Collaboration, 2011 Accessed August 15, 2016. |
| [8] | HIGGINS J P, JACKSON D, BARRETT J K, et al. Consistency and inconsistency in network meta-analysis: concepts and models for multi-arm studies[J]. Res Synth Methods, 2012, 3(2): 98–110. DOI:10.1002/jrsm.1044 |
| [9] | VERONIKI A A, VASILIADIS H S, HIGGINS J P, et al. Evaluation of inconsistency in networks of interventions[J]. Int J Epidemiol, 2013, 42(1): 332–345. DOI:10.1093/ije/dys222 |
| [10] | CHAIMANI A, SALANTI G. Using network meta-analysis to evaluate the existence of small-study effects in a network of interventions[J]. Res Synth Methods, 2012, 3(2): 161–176. DOI:10.1002/jrsm.57 |
| [11] | SALANTI G, ADES A E, IOANNIDIS J P. Graphical methods and numerical summaries for presenting results from multiple- treatment meta-analysis: an overview and tutorial[J]. J Clin Epidemiol, 2011, 64(2): 163–171. DOI:10.1016/j.jclinepi.2010.03.016 |
| [12] | RODBARD H W, SEUFERT J, AGGARWAL N, et al. Efficacy and safety of titrated canagliflozin in patients with type 2 diabetes mellitus inadequately controlled on metformin and sitagliptin[J]. Diabetes Obes Metab, 2016, 18(8): 812–819. DOI:10.1111/dom.12684 |
| [13] | NAUCK M A, DEL PRATO S, MEIER J J, et al. Dapagliflozin versus glipizide as add-on therapy in patients with type 2 diabetes who have inadequate glycemic control with metformin: a randomized, 52-week, double-blind, active-controlled noninferiority trial[J]. Diabetes Care, 2011, 34(9): 2015–2022. DOI:10.2337/dc11-0606 |
| [14] | HENRY R R, MURRAY A V, MARMOLEJO M H, et al. Dapagliflozin, metformin XR, or both: initial pharmacotherapy for type 2 diabetes, a randomised controlled trial[J]. Int J Clin Pract, 2012, 66(5): 446–456. DOI:10.1111/j.1742-1241.2012.02911.x |
| [15] | LEITER L A, YOON K H, ARIAS P, et al. Canagliflozin provides durable glycemic improvements and body weight reduction over 104 weeks versus glimepiride in patients with type 2 diabetes on metformin: a randomized, double-blind, phase 3 study[J]. Diabetes Care, 2015, 38(3): 355–364. DOI:10.2337/dc13-2762 |
| [16] | RIDDERSTRÅLE M, ANDERSEN K R, ZELLER C, et al. Comparison of empagliflozin and glimepiride as add-on to metformin in patients with type 2 diabetes: a 104-week randomised, active-controlled, double-blind, phase 3 trial[J]. Lancet Diabetes Endocrinol, 2014, 2(9): 691–700. DOI:10.1016/S2213-8587(14)70120-2 |
| [17] | SCHERNTHANER G, GROSS J L, ROSENSTOCK J, et al. Canagliflozin compared with sitagliptin for patients with type 2 diabetes who do not have adequate glycemic control with metformin plus sulfonylurea: a 52-week randomized trial[J]. Diabetes Care, 2013, 36(9): 2508–2515. DOI:10.2337/dc12-2491 |
| [18] | STENLÖF K, CEFALU W T, KIM K A, et al. Efficacy and safety of canagliflozin monotherapy in subjects with type 2 diabetes mellitus inadequately controlled with diet and exercise[J]. Diabetes Obes Metab, 2013, 15(4): 372–382. DOI:10.1111/dom.12054 |
| [19] | LAVALLE-GONZáLEZ F J, JANUSZEWICZ A, DAVIDSON J, et al. Efficacy and safety of canagliflozin compared with placebo and sitagliptin in patients with type 2 diabetes on background metformin monotherapy: a randomised trial[J]. Diabetologia, 2013, 56(12): 2582–2592. DOI:10.1007/s00125-013-3039-1 |
| [20] | WILDING J P, CHARPENTIER G, HOLLANDER P, et al. Efficacy and safety of canagliflozin in patients with type 2 diabetes mellitus inadequately controlled with metformin and sulphonylurea: a randomised trial[J]. Int J Clin Pract, 2013, 67(12): 1267–1282. DOI:10.1111/ijcp.12322 |
| [21] | INAGAKI N, KONDO K, YOSHINARI T, et al. Efficacy and safety of canagliflozin monotherapy in Japanese patients with type 2 diabetes inadequately controlled with diet and exercise: a 24-week, randomized, double-blind, placebo-controlled, Phase Ⅲ study[J]. Expert Opin Pharmacother, 2014, 15(11): 1501–1515. DOI:10.1517/14656566.2014.935764 |
| [22] | FORST T, GUTHRIE R, GOLDENBERG R, et al. Efficacy and safety of canagliflozin over 52 weeks in patients with type 2 diabetes on background metformin and pioglitazone[J]. Diabetes Obes Metab, 2014, 16(5): 467–477. DOI:10.1111/dom.12273 |
| [23] | BODE B, STENLÖF K, HARRIS S, et al. Long-term efficacy and safety of canagliflozin over 104 weeks in patients aged 55-80 years with type 2 diabetes[J]. Diabetes Obes Metab, 2015, 17(3): 294–303. DOI:10.1111/dom.12428 |
| [24] | QIU R, CAPUANO G, MEININGER G. Efficacy and safety of twice-daily treatment with canagliflozin, a sodium glucose co-transporter 2 inhibitor, added on to metformin monotherapy in patients with type 2 diabetes mellitus[J]. J Clin Transl Endocrinol, 2014, 1(2): 54–60. DOI:10.1016/j.jcte.2014.04.001 |
| [25] | ROSENSTOCK J, CHUCK L, GONZÁLEZ-ORTIZ M, et al. Initial combination therapy with canagliflozin plus metformin versus each component as monotherapy for drug-Naïve type 2 diabetes[J]. Diabetes Care, 2016, 39(3): 353–362. DOI:10.2337/dc15-1736 |
| [26] | RODEN M, MERKER L, CHRISTIANSEN AV, et al. Safety, tolerability and effects on cardiometabolic risk factors of empagliflozin monotherapy in drug-naïve patients with type 2 diabetes: a double-blind extension of a Phase Ⅲ randomized controlled trial[J]. Cardiovasc Diabetol, 2015, 14: 154. DOI:10.1186/s12933-015-0314-0 |
| [27] | SØFTELAND E, MEIER J J, VANGEN B, et al. Empagliflozin as add-on therapy in patients with type 2 diabetes inadequately controlled with linagliptin and metformin: a 24-week randomized, double-blind, parallel-group trial[J]. Diabetes Care, 2017, 40(2): 201–209. DOI:10.2337/dc16-1347 |
| [28] | MERKER L, HÄRING H U, CHRISTIANSEN A V, et al. Empagliflozin as add-on to metformin in people with Type 2 diabetes[J]. Diabet Med, 2015, 32(12): 1555–1567. DOI:10.1111/dme.12814 |
| [29] | HÄRING H U, MERKER L, SEEWALDT-BECKER E, et al. Empagliflozin as add-on to metformin plus sulfonylurea in patients with type 2 diabetes: a 24-week, randomized, double-blind, placebo-controlled trial[J]. Diabetes Care, 2013, 36(11): 3396–3404. DOI:10.2337/dc12-2673 |
| [30] | KOVACS C S, SESHIAH V, MERKER L, et al. Empagliflozin as add-on therapy to pioglitazone with or without metformin in patients with type 2 diabetes mellitus[J]. Clin Ther, 2015, 37(8): 1773–1788. DOI:10.1016/j.clinthera.2015.05.511 |
| [31] | DEFRONZO R A, LEWIN A, PATEL S, et al. Combination of empagliflozin and linagliptin as second-line therapy in subjects with type 2 diabetes inadequately controlled on metformin[J]. Diabetes Care, 2015, 38(3): 384–393. DOI:10.2337/dc14-2364 |
| [32] | LEWIN A, DEFRONZO R A, PATEL S, et al. Initial combination of empagliflozin and linagliptin in subjects with type 2 diabetes[J]. Diabetes Care, 2015, 38(3): 394–402. DOI:10.2337/dc14-2365 |
| [33] | ROSENSTOCK J, JELASKA A, FRAPPIN G, et al. Improved glucose control with weight loss, lower insulin doses, and no increased hypoglycemia with empagliflozin added to titrated multiple daily injections of insulin in obese inadequately controlled type 2 diabetes[J]. Diabetes Care, 2014, 37(7): 1815–1823. DOI:10.2337/dc13-3055 |
| [34] | HADJADJ S, ROSENSTOCK J, MEINICKE T, et al. Initial combination of empagliflozin and metformin in patients with type 2 diabetes[J]. Diabetes Care, 2016, 39(10): 1718–1728. DOI:10.2337/dc16-0522 |
| [35] | JI L, LI H, MANSFIELD T A, et al. Dapagliflozin as monotherapy in drug-naive asian patients with type 2 diabetes mellitus: a randomized, blinded, prospective phase Ⅲ study[J]. Clin Ther, 2014, 36(1): 84–100. DOI:10.1016/j.clinthera.2013.11.002 |
| [36] | FERRANNINI E, RAMOS S J, SALSALI A, et al. Dapagliflozin monotherapy in type 2 diabetic patients with inadequate glycemic control by diet and exercise: a randomized, double-blind, placebo-controlled, phase 3 trial[J]. Diabetes Care, 2010, 33(10): 2217–2224. DOI:10.2337/dc10-0612 |
| [37] | ROSENSTOCK J, HANSEN L, ZEE P, et al. Dual add-on therapy in type 2 diabetes poorly controlled with metformin monotherapy: a randomized double-blind trial of saxagliptin plus dapagliflozin addition versus single addition of saxagliptin or dapagliflozin to metformin[J]. Diabetes Care, 2015, 38(3): 376–383. DOI:10.2337/dc14-1142 |
| [38] | BAILEY C J, GROSS J L, HENNICKEN D, et al. Dapagliflozin add-on to metformin in type 2 diabetes inadequately controlled with metformin: a randomized, double-blind, placebo-controlled 102-week trial[J]. BMC Med, 2013, 11: 43. DOI:10.1186/1741-7015-11-43 |
| [39] | FRÍAS J P, GUJA C, HARDY E, et al. Exenatide once weekly plus dapagliflozin once daily versus exenatide or dapagliflozin alone in patients with type 2 diabetes inadequately controlled with metformin monotherapy (DURATION-8): a 28 week, multicentre, double-blind, phase 3, randomised controlled trial[J]. Lancet Diabetes Endocrinol, 2016, 4(12): 1004–1016. DOI:10.1016/S2213-8587(16)30267-4 |
| [40] | STROJEK K, YOON K H, HRUBA V, et al. Dapagliflozin added to glimepiride in patients with type 2 diabetes mellitus sustains glycemic control and weight loss over 48 weeks: a randomized, double-blind, parallel-group, placebo-controlled trial[J]. Diabetes Ther, 2014, 5(1): 267–283. DOI:10.1007/s13300-014-0072-0 |
| [41] | JABBOUR S A, HARDY E, SUGG J, et al. Dapagliflozin is effective as add-on therapy to sitagliptin with or without metformin: a 24-week, multicenter, randomized, double-blind, placebo-controlled study[J]. Diabetes Care, 2014, 37(3): 740–750. DOI:10.2337/dc13-0467 |
| [42] | BAILEY C J, IQBAL N, T'JOEN C, et al. Dapagliflozin monotherapy in drug-naïve patients with diabetes: a randomized- controlled trial of low-dose range[J]. Diabetes Obes Metab, 2012, 14(10): 951–959. DOI:10.1111/j.1463-1326.2012.01659.x |
| [43] | BOLINDER J, LJUNGGREN Ö, KULLBERG J, et al. Effects of dapagliflozin on body weight, total fat mass, and regional adipose tissue distribution in patients with type 2 diabetes mellitus with inadequate glycemic control on metformin[J]. J Clin Endocrinol Metab, 2012, 97(3): 1020–1031. DOI:10.1210/jc.2011-2260 |
| [44] | WILDING J P, WOO V, SOLER NG, et al. Long-term efficacy of dapagliflozin in patients with type 2 diabetes mellitus receiving high doses of insulin: a randomized trial[J]. Ann Intern Med, 2012, 156(6): 405–415. DOI:10.7326/0003-4819-156-6-201203200-00003 |
| [45] |
孙静媛, 马丽娜, 高凌. 钠-葡萄糖共转运蛋白1和2的研究新进展[J].
世界华人消化杂志, 2016, 24(25): 3673–3682.
SUN J Y, MA L N, GAO L. New perspectives on research of sodium-glucose cotransporters1 and 2[J]. World Chin J Diges, 2016, 24(25): 3673–3682. DOI:10.11569/wcjd.v24.i25.3673 |
| [46] | HALIMI S, VERGÉS B. Adverse effects and safety of SGLT-2 inhibitors[J]. Diabetes Metab, 2014, 40(6 Suppl 1): S28–34. DOI:10.1016/S1262-3636(14)72693-X |
| [47] | LI D, WANG T, SHEN S, et al. Urinary tract and genital infections in patients with type 2 diabetes treated with sodium-glucose co-transporter 2 inhibitors: A meta-analysis of randomized controlled trials[J]. Diabetes Obes Metab, 2017, 19(3): 348–355. DOI:10.1111/dom.12825 |



