癫痫是一种广泛而复杂的可发生于各个年龄段的神经疾病,影响着全世界7 000多万人口[1]。大量患者即使接受抗癫痫药物治疗,仍无法终止癫痫发作甚至发展为药物难治性癫痫。周期性的癫痫发作给患者的心理造成了极大的负面影响,继而给家庭和社会带来了沉重的负担[2]。然而,癫痫的发生机制尚不完全明确,因此对癫痫发生、发展中机制的研究对癫痫的诊治至关重要。
丛生蛋白(clusterin)又称载脂蛋白J (Apo J),首次提取于在山羊精液的一种分子伴侣蛋白[3]。在1989年,DE SILVA等[4]在人类血浆中分离得到Clusterin。Clusterin在中枢神经系统中广泛表达,作为一种分子伴侣蛋白,Clusterin可与诸多蛋白结合,参与免疫反应、补体反应、炎症反应、细胞凋亡、神经元可塑性等调节功能,继而对神经系统诸多疾病具有保护作用[5]。其中,KANG等[6]发现,Clusterin通过结合高度保守的微管解聚蛋白Stathmin家族成员促进PC12细胞突触的生长和神经网络的形成。Stathmin家族有4个成员,其中Stathmin2能通过多种磷酸化作用调节神经系统结构,最终在神经元的凋亡、树突形成、神经元分化、神经网络的构建与重塑中起着重要的作用。而神经网络的异常重塑,是癫痫形成的重要因素[7-8]。因此,基于此点,本研究试图通过观察Clusterin和Stathmin2在癫痫患者及戊四氮点燃的癫痫大鼠模型中脑组织的表达变化,探讨Clusterin和Stathmin2在癫痫的发生、发展中可能起到的作用。
1 材料与方法 1.1 人脑标本的收集及处理对照组(n=20)与癫痫组(n=20)人体标本取自于重庆医科大学附属第一医院神经病学重点实验室脑库。其中,癫痫组选取20例颞叶难治性癫痫脑组织标本来源于重庆医科大学附属第一医院、陆军军医大学(第三军医大学)第一、二附属医院神经外科住院患者于2012-2017年因手术切除颞叶皮质[男性12例,女性8例,年龄(30.27±12.89)岁]。纳入标准为:至少服用3种及以上一线抗癫痫药2年以上;影像学检查无颅内占位病变及变性疾病;无除外癫痫的神经系统或精神系统疾病的病史及家族史;术前定位和术中脑电图监测发现有固定的痫性放电病灶。对照组选取20例脑外伤患者,脑组织来源于重庆医科大学附属第一医院神经外科住院患者,于2013-2017年行颅内减压术切除的正常皮质[男性13例,女性7例,年龄(27.34±11.34)岁]。纳入标准:既往无癫痫病病史及家族史;未服用抗癫痫药物;标本病理检查提示组织形态相对正常;无神经、精神系统疾病及颅内占位性疾病。两组在年龄、性别上的差异无统计学意义(P<0.05)。本研究2016年获得重庆医科大学医学研究伦理委员会批准,符合赫尔辛基宣言的各项要求,所有患者均签署了知情同意书。部分标本(各组取n=8)用于Western blot检测和免疫共沉淀实验;部分标本(各组取n=8)按先前研究[9-12]方法制备石蜡切片,用于免疫组织化学染色。部分标本(各组取n=4)按先前研究[9-12]制备冰冻切片,用于免疫荧光染色。
1.2 大鼠标本的收集及处理100只SPF清洁级雄性SD大鼠(200~250 g,6~8周龄)购于重庆医科大学实验动物中心,合格证书SCXK(渝2007-0001)。符合动物实验伦理学要求。其中20只大鼠不做任何处理,作为对照组,即EP0组。另外80只大鼠均隔天腹腔注射35 mg/kg戊四氮(Sigma公司,美国)。分别于第1次注射后24 h的大鼠纳入EP1组(n=20);第5次注射后24 h的大鼠纳入EP2组(n=20);第10次注射后24 h的大鼠纳入EP3组(n=20);第15次注射后24 h的大鼠纳入EP4组(n=20)。若造模期间因癫痫发作致大鼠死亡者,需重新造模,使各组大鼠均为20只。每次腹腔注射戊四氮后观察行为学1 h,采用Racine评分[13]记录每只大鼠的发作级别。在3.5%水合氯醛(10 mg/kg)麻醉下制备以下标本:部分大鼠(各组取n=8)分离皮质海马后,用于Western blot检测和免疫共沉淀实验;部分大鼠(各组取n=8)按先前研究[9-12]方法制备石蜡切片,用于免疫组织化学染色。部分大鼠(各组取n=4)按先前研究[9-12]制备石蜡切片,用于免疫荧光染色。
1.3 免疫荧光染色冰冻切片自然晾干后,用冰丙酮外固定20 min。PBS冲洗(5 min每次×3次,下同)后滴加0.4% Triton X-100破膜5 min。PBS冲洗后滴加山羊血清,37 ℃孵箱孵育20 min。PBS冲洗后滴加一抗混合物(Clusterin+MAP2、Stathmin2+MAP2、Clusterin+GFAP、Stathmin2+GFAP) 4 ℃过夜。抗体比例为:兔来源Clusterin(1 :50,Proteintech公司,美国);兔来源Stathmin2(1 :50,Proteintech公司,美国);小鼠来源MAP2(1 :50,博士德公司,中国);小鼠来源GFAP(1 :50,博士德公司,中国)。取出过夜切片,37 ℃孵箱复温1 h。PBS冲洗后避光滴加二抗混合物(FITC+Alexa Fluor555)。抗体比例为:羊抗兔FITC(1 :50,Proteintech公司,美国);羊抗小鼠Alexa Fluor555(1 :50,碧云天公司,中国)。37 ℃孵箱孵育1 h。PBS冲洗后避光滴加DAPI(1 :200,KeyGEN BioTECH公司,中国)复染细胞核。37 ℃孵箱孵育5min。PBS冲洗后甘油封片。运用激光共聚焦显微镜(Nikon 1R,日本)采集图像。
1.4 免疫组织化学染色石蜡切片60 ℃恒温式烤箱中烘烤30 min,然后放入二甲苯Ⅰ和二甲苯Ⅱ溶液中分别脱蜡20 min,再用梯度酒精(100%、90%、85%和70%)各脱水5 min。按免疫组化试剂盒(博士德公司,中国)说明书进行染色。抗体比例为:兔来源Clusterin(1 :50,Proteintech公司,美国)和兔来源Stathmin2(1 :50,Proteintech公司,美国)。运用Olympus PM20全自动显微镜(Olympus,日本)在400倍视野下观察,运用Image-Pro Plus 6.0软件进行光密度值分析。
1.5 免疫共沉淀实验按Protein A/G Agarose beads(碧云天公司,中国)说明书处理标本,得到样品,尽快行Western blot检测。
1.6 Western blot检测按全蛋白提取试剂盒(碧云天公司,中国)提取总蛋白,按BCA浓度测定试剂盒(碧云天公司,中国)测定总蛋白浓度并配平。配平后的蛋白上样于聚丙烯酰胺凝胶电泳系统。经电转后将蛋白转至PVDF膜上,5%脱脂奶粉封闭2h后在相应条带滴加抗体。抗体比例为:兔来源Clusterin(1 :1 000,Proteintech公司,美国)、兔来源Stathmin2(1 :1 000,Proteintech公司,美国)和兔来源GAPDH(1 :4 000,Proteintech公司,美国)。4 ℃过夜后用PBS冲洗,滴加辣根过氧化物酶标记的羊抗兔二抗(1 :4 000,Proteintech公司,美国)孵育2 h。PBS洗膜后,运用ECL法在Fusion仪器显色,分析光密度值,计算Clusterin/GAPDH及Stathmin2/GAPDH的比值,进行统计分析。
1.7 统计学方法数据用x±s表示,应用SPSS 19.0统计软件进行分析。多组均数之间的比较采用One-way ANOVA检验,事后检验采用Tukey检验;两组均数比较采用t检验。检验水准:α=0.05。
2 结果 2.1 大鼠行为学观察大鼠腹腔注射PTZ前3次未出现Ⅳ级及其以上的发作,仅在第4次注射后陆续出现Ⅳ级及其以上,EP4组大鼠全部均达到点燃标准(连续3次出现Ⅳ级及其以上的发作)。在造模期间,一共死亡7只大鼠,分别为:第10次注射时死1只,第12次注射时死2只;第13次注射时死1只;第15次注射时死3只。死亡大鼠均重新造模补足。
2.2 Clusterin在人和大鼠中的定位检测MAP2是神经元特异性标记物,其可标记神经元树突和胞体。中枢神经系统中,含量最多的是神经元和胶质细胞,其中胶质细胞最多的类型为星型胶质细胞,因此本研究在观察Clusterin是否表达于神经元的同时,也验证Clusterin是否表达于星型胶质细胞。因此本研究应用星型胶质细胞特异性标记物GFAP。从图 1可以看出,无论是人脑组织(皮质),还是大鼠脑组织(皮质和海马)Clusterin(绿色)均与MAP2(红色)共表达,而与GFAP(红色)无共表达。
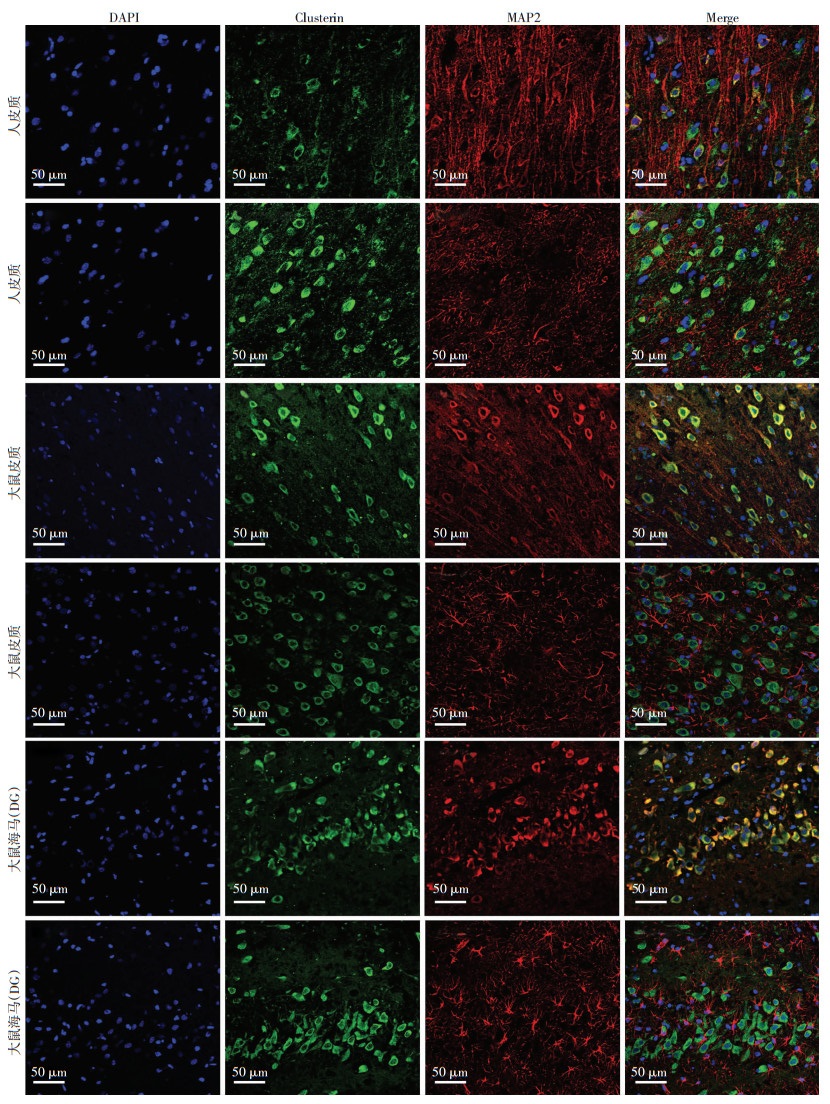
|
| 图 1 激光共聚焦显微镜观察Clusterin在人和大鼠中的定位 |
2.3 Stathmin2在人和大鼠中的定位检测
从图 2可以看出,无论是人脑组织(皮质),还是大鼠脑组织(皮质和海马)Stathmin2(绿色)均与MAP2(红色)共表达,而与GFAP(红色)无共表达。

|
| 图 2 激光共聚焦显微镜观察Stathmin2在人和大鼠中的定位 |
2.4 免疫组化染色对Clusterin和Stathmin2表达的检测
免疫组织化学染色可看出Clusterin和Stathmin2多表达于神经元的细胞膜和细胞质。与对照组人皮质组织相比,Clusterin在癫痫患者中染色较浅(P < 0.05,表 1,图 3),而Stathmin2在癫痫患者中染色较对照组较深(P < 0.05,表 1,图 4)。同样,我们检测Clusterin和Stathmin2在戊四氮注射0次大鼠(即EP0组,尚未注射PTZ)和注射15次大鼠(即EP4组,完全点燃)的免疫染色变化,无论大鼠皮质还是海马(DG区),与EP0组相比,Clusterin在EP4组相较于EP0组染色较浅(P < 0.05,表 1,图 3),而Stathmin2在EP4组相较于EP0组染色较深(P < 0.05,表 1,图 4)。
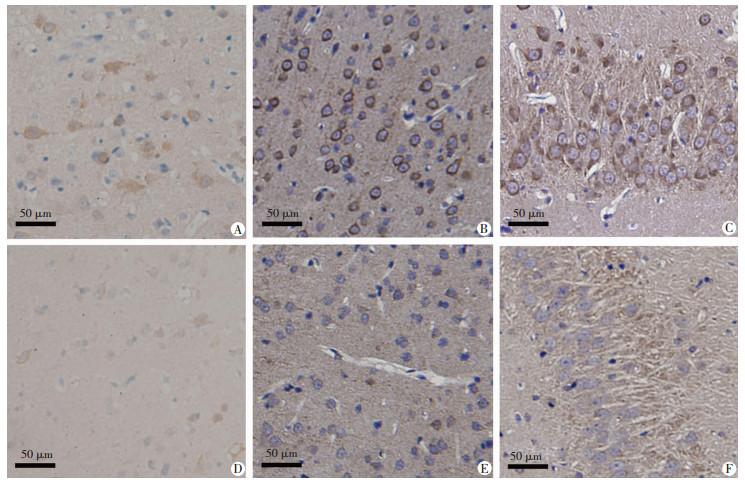
|
| A:人皮质对照组;B:大鼠皮质EP0组;C:大鼠海马(DG区)EP0组;D:人皮质癫痫组;E:大鼠皮质EP4组;F:大鼠海马(DG区)EP4组 图 3 免疫组化染色(SABC)检测各组Clusterin的表达 |
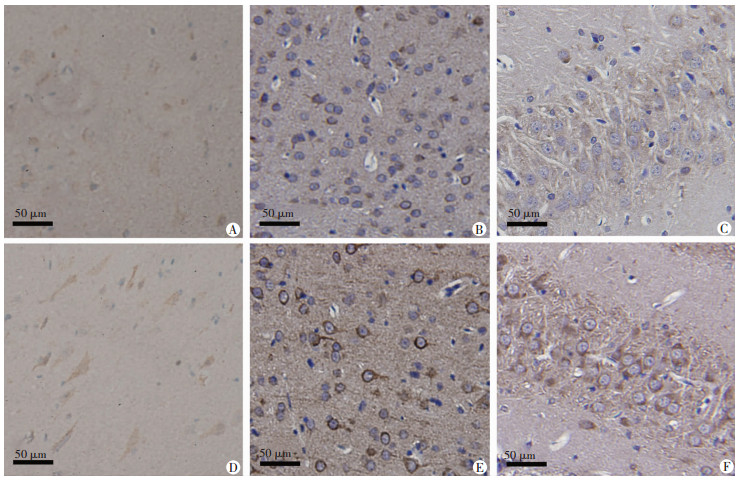
|
| A:人皮质对照组;B:大鼠皮质EP0组;C:大鼠海马(DG区)EP0组;D:人皮质癫痫组;E:大鼠皮质EP4组;F:大鼠海马(DG区)EP4组 图 4 免疫组化染色(SABC)检测各组Stathmin2的表达 |
| 组别 | Clusterin | Stathmin2 |
| 人脑对照组 | 1.395±0.042 | 0.486±0.061 |
| 人脑癫痫组 | 0.718±0.013a | 0.941±0.053a |
| 大鼠皮质EP0组 | 1.419±0.080 | 0.801±0.046 |
| 大鼠皮质EP4组 | 0.663±0.048b | 1.538±0.010b |
| 大鼠海马EP0组 | 1.231±0.063 | 0.789±0.037 |
| 大鼠海马EP4组 | 0.878±0.033c | 1.109±0.076c |
| a:P < 0.05,与人脑对照组比较;b:P < 0.05,与大鼠皮质EP0组比较;c:P < 0.05,与大鼠皮质EP0组比较 | ||
2.5 Western blot检测Clusterin和Stathmin2的表达
在人体脑组织中,通过Western blot检测发现,与对照组人皮质组织相比,Clusterin在癫痫患者中表达降低(P < 0.05,表 2,图 5),而Stathmin2在癫痫患者中表达升高(P < 0.05,表 2,图 5)。同样,我们用Western blot分别检测Clusterin和Stathmin2在第0、1、5、10次和15次注射PTZ后大鼠皮质和海马中的表达。发现无论皮质和海马,随着PTZ注射次数增多,Clusterin的表达逐渐降低,而Stathmin2的表达则逐渐升高(P < 0.05,表 2,图 5)。
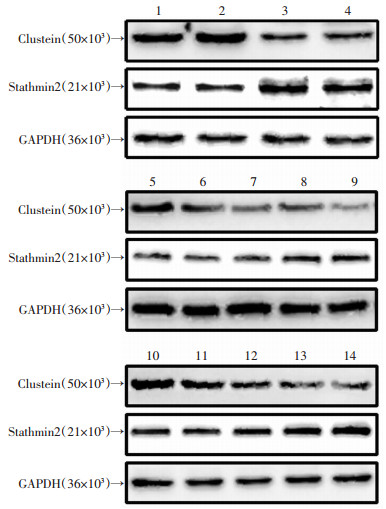
|
| 1-2:人脑对照组;3-4:人脑癫痫组;5:大鼠皮质EP0组;6:大鼠皮质EP1组;7:大鼠皮质EP2组;8:大鼠皮质EP3组;9:大鼠皮质EP4组;10:大鼠海马EP0组;11:大鼠海马EP1组;12:大鼠海马EP2组;13:大鼠海马EP3组;14:大鼠海马EP4组 图 5 Western blot检测各组Clusterin和Stathmin2的表达 |
| 组别 | Clusterin | Stathmin2 |
| 人脑对照组 | 1.209±0.071 | 0.712±0.041 |
| 人脑癫痫组 | 0.698±0.024a | 1.411±0.070a |
| 大鼠皮质EP0组 | 0.992±0.065 | 0.563±0.012 |
| 大鼠皮质EP1组 | 0.903±0.029b | 0.591±0.035b |
| 大鼠皮质EP2组 | 0.683±0.031c | 0.841±0.017c |
| 大鼠皮质EP3组 | 0.478±0.015d | 0.923±0.024d |
| 大鼠皮质EP4组 | 0.466±0.022e | 1.058±0.039e |
| 大鼠海马EP0组 | 1.332±0.065 | 0.650±0.034 |
| 大鼠海马EP1组 | 1.094±0.064f | 0.682±0.030f |
| 大鼠海马EP2组 | 0.684±0.033g | 0.940±0.030g |
| 大鼠海马EP3组 | 0.516±0.018h | 1.156±0.078h |
| 大鼠海马EP4组 | 0.457±0.015i | 1.327±0.061i |
| a:P < 0.05,与人脑对照组比较;b:P < 0.05, 与大鼠皮质EP0组比较;c:P < 0.05, 与大鼠皮质EP1组比较;d:P < 0.05, 与大鼠皮质EP2组比较;e:P < 0.05, 与大鼠皮质EP3组比较;f:P < 0.05, 与大鼠海马EP0组比较;g:P < 0.05, 与大鼠海马EP1组比较;h:P < 0.05, 与大鼠海马EP2组比较;i:P < 0.05, 与大鼠海马EP3组比较 | ||
2.6 Clusterin与Stathmin2相关性的检测
通过免疫共沉淀技术检测,发现无论在人癫痫皮质,还是大鼠癫痫皮质和海马,用Clusterin抗体处理的样品可发现有Stathmin2的表达,同样,用Stathmin2抗体处理的样品可发现有Clusterin的表达(图 6)。说明Clusterin与Stathmin2是相互结合的。

|
| 1:Clusterin抗体处理组;2:阴性对照组;3:阳性对照组;4:Stathmin2抗体处理组;5:阴性对照组;6:阳性对照组;①:人体脑组织(癫痫组);②:大鼠皮质(EP4组);③:大鼠海马(EP4组) 图 6 免疫共沉淀检测Clusterin与Stathmin2相关性 |
3 讨论
癫痫是最常见的神经系统疾病之一,其发病机制尚未完全阐明。目前认为,神经网络的异常重塑是癫痫发生、发展中的重要过程,而神经元中微管的动态平衡失调是影响神经网络异常重塑的重要因素[7-8]。
Clusterin在神经元细胞中广泛表达,分泌型Clusterin主要分布于细胞质,且通过阻止脂质氧化相关的细胞损伤,清除死亡细胞残留物及细胞外有害分子等途径来抑制细胞凋亡[14]。CLU生成及分泌对脑损伤有保护作用,其机制可能与稳定应急蛋白和抑制凋亡有关[15]。本课题组前期研究癫痫患者脑脊液的蛋白质谱改变,发现CLU在耐药性癫痫患者脑脊液中的含量与对照组相比显著性降低,提示CLU与癫痫的形成有着紧密联系[10]。本研究进一步在癫痫患者及癫痫大鼠脑组织中证实,Clusterin分布于细胞膜及细胞质,其在癫痫患者及癫痫大鼠脑组织中的表达较对照组明显降低,随疾病的发生、发展,Clusterin表达呈下降趋势,这与我们前期在癫痫患者脑脊液中的研究结果一致。Clusterin随病情进展表达下调,推测其抑制凋亡及脑保护作用减弱,影响神经元的异常重塑,参与癫痫的发生、发展过程。
Stathmin家族(包括Stathmin 1-4)是一种微管解聚蛋白,其磷酸化与去磷酸化是其调节自身活性的重要机制,对细胞周期的转换有重要影响[16-18]。STMN2与STMN3均是神经元特异性stathmin蛋白,STMN2能通过多种磷酸化作用调节神经系统结构,最终影响神经元的可塑性。神经元的异常重塑参与中枢神经系统多种疾病的发生、发展,如癫痫、帕金森等[7-8]。ZHANG等[19]发现高表达的Stathmin蛋白改变了MAP-2及α-tubulin的表达,继而影响微管形成和突触可塑性,导致癫痫的发生。文献[20-21]报道,高表达的Stathmin能诱导神经元异常突起的形成,从而影响突触可塑性。本研究证实Stathmin2主要表达于神经元的细胞膜和细胞质中。鉴于癫痫患者标本仅代表癫痫形成后期,故本实验引用动物模型模拟癫痫的发生、发展过程,发现随着注射戊四氮次数的增加,Stathmin 2在大鼠皮质和海马中的表达呈进行性升高,这与ZHANG等[19]的研究结果一致,提示Stathmin 2异常表达与癫痫的发生、发展密切相关,可能通过调节微管动力学,继而改变突触可塑性,最终参与癫痫的发生、发展。
KANG等[6]在PC12细胞中采用pull-down和免疫共沉淀技术发现,Clusterin的C-末端可以与Stathmin 3的N-末端棕榈酰化结构域相互作用形成复合体,同时证实Clusterin可以中断Stathmin 3对微管破坏的作用,而Stathmin 3和Stathmin 2具有相同的结构域[22]。本研究免疫共沉淀实验结果显示,在癫痫患者皮质及癫痫大鼠的皮质与海马组织中,Clusterin与Stathmin 2存在相互结合,同时证实Clusterin与Stathmin 2均表达于神经元的细胞膜和细胞质中,二者在癫痫组患者及大鼠实验组中的表达较对照组差异有统计学意义,且呈明显负相关。Clusterin可以中断Stathmin 2对微管破坏的作用。推测癫痫发生、发展过程中,Clusterin通过以直接或间接结合的方式与Stathmin 2相互作用,下调的clusterin通过协调Stathmin 2上调作用于微管去稳定化,影响突触可塑性,参与异常神经网络形成,最终导致癫痫发生。Clusterin作为分子伴侣,其调节Stathmin 2继而影响微管动力学的机制尚不清楚,尚需更进一步的研究。而对其机制的研究将可能发现癫痫发生、发展中新的调节机制和治疗靶点。
| [1] | SINGH A, TREVICK S. The epidemiology of global epilepsy[J]. Neurol Clin, 2016, 34(4): 837–847. DOI:10.1016/j.ncl.2016.06.015 |
| [2] | BOLING W, MEANS M, FLETCHER A. Quality of life and stigma in epilepsy, perspectives from selected regions of asia and sub-saharan africa[J]. Brain Sci, 2018, 8(4): 59. DOI:10.3390/brainsci8040059 |
| [3] | BLASCHUK O, BURDZY K, FRITZ I B. Purification and characterization of a cell-aggregating factor (clusterin), the major glycoprotein in ram rete testis fluid[J]. J Biol Chem, 1983, 258(12): 7714–7720. |
| [4] | DE SILVA H V, STUART W D, PARK Y B, et al. Purification and characterization of apolipoprotein J[J]. J Biol Chem, 1990, 265(24): 14292–14297. |
| [5] | ELLIOTT D A, WEICKERT C S, GARNER B. Apolipo-proteins in the brain: implications for neurological and psychiatric disorders[J]. Clin Lipidol, 2010, 51(4): 555–573. DOI:10.2217/CLP.10.37 |
| [6] | KANG S W, SHIN Y J, SHIM Y J, et al. Clusterin interacts with SCLIP (SCG10-like protein) and promotes neurite outgrowth of PC12 cells[J]. Exp Cell Res, 2005, 309(2): 305–315. DOI:10.1016/j.yexcr.2005.06.012 |
| [7] | MITCHISON T, KIRSCHNER M. Dynamic instability of microtubule growth[J]. Nature, 1984, 312(5991): 237–242. DOI:10.1038/312237a0 |
| [8] | DENT E W. Of microtubules and memory: implications for microtubule dynamics in dendrites and spines[J]. Mol Biol Cell, 2017, 28(1): 1–8. DOI:10.1091/mbc.E15-11-0769 |
| [9] | ZHANG Y, GAO B, XIONG Y, et al. Expression of SHANK3 in the temporal neocortex of patients with intractable temporal epilepsy and epilepsy rat models[J]. Cell Mol Neurobiol, 2017, 37(5): 857–867. DOI:10.1007/s10571-016-0423-7 |
| [10] | YU W, CHEN D, WANG Z, et al. Time-dependent decrease of clusterin as a potential cerebrospinal fluid biomarker for drug-resistant epilepsy[J]. J Mol Neurosci, 2014, 54(1): 1–9. DOI:10.1007/s12031-014-0237-3 |
| [11] | WEN Y, FU P, WU K, et al. Inhibition of calcineurin A by FK506 suppresses seizures and reduces the expression of gluN2B in membrane fraction[J]. Neurochem Res, 2017, 42(8): 2154–2166. DOI:10.1007/s11064-017-2221-0 |
| [12] |
吴昆仑, 温跃桃, 司凯闯, 等. Munc13-1及RIM1在颞叶癫痫患者及戊四氮大鼠模型中的表达[J].
第三军医大学学报, 2018, 40(6): 500–506.
WU K L, WEN Y T, SI K C, et al. Expression of mammalian uncoordinated 13-1 and rab-interacting molecules 1 in temporal lobe epilepsy patients and pentetrazole-induced rat model[J]. J Third Mil Med Univ, 2018, 40(6): 500–506. DOI:10.16016/j.1000-5404.201710176 |
| [13] | Racine R J. Modification of seizure activity by electrical stimulation: Ⅱ. Motor seizure[J]. Electroencephalograph Clin Neurophysiol, 1972, 32(3): 281–294. DOI:10.1016/0013-4694(72)90177-0 |
| [14] | ZHANG H, KIM J K, EDWARDS C A, et al. Clusterin inhibits apoptosis by interacting with activated Bax[J]. Nat Cell Biol, 2005, 7(9): 909–915. DOI:10.1038/ncb1291 |
| [15] | WIGGINS A K, SHEN P J, GUNDLACH A L. Delayed, but prolonged increases in astrocytic clusterin (ApoJ) mRNA expression following acute cortical spreading depression in the rat: evidence for a role of clusterin in ischemic tolerance[J]. Brain Res Mol Brain Res, 2003, 114(1): 20–30. DOI:10.1016/s0169-328x(03)00124-4 |
| [16] | BELLOUZE S, BAILLAT G, BUTTIGIEG D, et al. Stathmin 1/2-triggered microtubule loss mediates Golgi fragmentation in mutant SOD1 motor neurons[J]. Mol Neurodegener, 2016, 11(1): 43. DOI:10.1186/s13024-016-0111-6 |
| [17] | ZEITZ M, KIERFELD J. Feedback mechanism for microtubule length regulation by stathmin gradients[J]. Biophys J, 2014, 107(12): 2860–2871. DOI:10.1016/j.bpj.2014.10.056 |
| [18] | LU Y, LIU C, XU Y F, et al. Stathmin destabilizing microtubule dynamics promotes malignant potential in cancer cells by epithelial-mesenchymal transition[J]. HBPD INT, 2014, 13(4): 386–394. DOI:10.1016/s1499-3872(14)60038-2 |
| [19] | ZHANG L, FENG D, TAO H, et al. Increased stathmin expression strengthens fear conditioning in epileptic rats[J]. Biomed Rep, 2015, 3(1): 28–32. DOI:10.3892/br.2014.386 |
| [20] | HOWELL B, DEACON H, CASSIMERIS L. Decreasing oncoprotein 18/stathmin levels reduces microtubule catastrophes and increases microtubule polymer in vivo[J]. J Cell Sci, 1999, 112(Pt 21): 3713–3722. |
| [21] | YAMADA K, MATSUZAKI S, HATTORI T, et al. Increased stathmin1 expression in the dentate gyrus of mice causes abnormal axonal arborizations[J]. PLoS ONE, 2010, 5(1): e8596. DOI:10.1371/journal.pone.0008596 |
| [22] | OZON S, BYK T, SOBEL A. SCLIP: a novel SCG10-like protein of the stathmin family expressed in the nervous system[J]. J Neurochem, 1998, 70(6): 2386–2396. DOI:10.1046/j.1471-4159.1998.70062386.x |



