2. 215332 江苏 昆山,昆山市花桥人民医院妇产科;
3. 200235 上海,上海市第八人民医院普外科
2. Department of Gynecology and Obstetrics, Huaqiao People's Hospital of Kunshan City, Kunshan, Jiangsu Province, 215332;
3. Department of General Surgery, Shanghai Eighth People's Hospital, Shanghai, 200235, China
胎盘发育是一个复杂的过程,是怀孕中的一个关键因素,受众多因素调控,包括细胞因子、激素、生长因子和凋亡信号分子。颗粒蛋白前体(progranulin, PGRN)是一种普遍存在的分泌型糖蛋白,具有抗炎、细胞保护和促进细胞有丝分裂的功能,同时它也参与血管内稳态的调节[1]。在胚胎及滋养外胚层发育、细胞增殖与调控、细胞迁移和细胞转化过程中发挥着至关重要的作用。研究发现,PGRN表达于正常的滋养层细胞和转化的滋养层细胞(系)中,而且随着妊娠的进行,人早期和晚期妊娠胎盘中PGRN表达逐渐降低[1]。PGRN在细胞滋养层、合胞体滋养层以及绒毛外细胞滋养层细胞中都有表达,其表达模式跟细胞分化程度相关[2]。有研究[3-4]指出,子痫前期(preeclampsia, PE)胎盘中PGRN mRNA水平显著上调。一项横断面研究也指出,与正常血压孕妇相比,子痫前期孕妇的血清PGRN水平显著较高,且早发性子痫前期血清PGRN水平显著高于晚发性子痫前期[5]。PGRN水平在子痫前期中的这些异常提示我们,它可能参与了子痫前期的发生与发展。大多数学者认为,子痫前期发病的中心环节是滋养层细胞侵袭不足导致的子宫螺旋动脉重塑障碍[6]。基于上述结果,我们认为PGRN可能影响滋养层细胞的侵袭而对子痫前期发挥重要作用。本研究将利用滋养层细胞系及人原代滋养层细胞来研究PGRN在滋养层细胞侵袭中的作用,并解析其具体机制。
1 材料与方法 1.1 子痫前期患者样品来源选取12例子痫前期患者和12例正常妊娠的胎盘组织。样本来自昆山市花桥人民医院妇产科以及上海市第八人民医院普外科。样本来源人均签署了知情同意书。本研究获得上海市第八人民医院伦理委员会批准(2016-06-01)。
1.2 mRNA抽提及实时定量PCR利用Trizol(Invitrogen)裂解细胞或胚胎组织抽提总RNA。逆转录采用m-MLV逆转录试剂盒(Promega),取1 μg RNA用M-MLV反转录酶试剂盒(Thermo)获得cDNA。采取SYBR Premix Ex Taq试剂盒(TaKaRa)进行实时定量PCR,利用ABI 7500 fast real-time PCR system(Applied Biosystems)检测基因表达。
1.3 蛋白抽提及Western blot胎盘组织样本放入匀浆管中,加入1 mL RIPA裂解液(碧云天)和匀浆珠进行匀浆,将匀浆液转入EP管中,于4 ℃旋转摇床中旋转裂解30 min;用细胞刮收集培养的滋养层细胞于离心管中,加入500 μL RIPA裂解液于4 ℃裂解细胞30 min,上述裂解结束后于4 ℃,13 000 r/min离心15 min,得蛋白上清;采用BCA蛋白定量试剂盒测定蛋白浓度。于100 ℃蛋白变性后进行SDS-PAGE,电转至PVDF膜,5%脱脂牛奶室温封闭1 h,加入一抗4 ℃孵育过夜,PBST洗膜3次后加入二抗于室温孵育1 h,ECL显色,显影。
1.4 siRNA转染人PGRN siRNA oligo由上海吉玛公司合成,序列如下: si-GRN#1:正义链5′-GCGUGUGCGUUUCAAU-AAAdTdT-3′,反义链5′-UUUAUUGAAACGCACACGC-dTdT-3′; si-GRN#2:正义链5′-CCCACCUCUAUAUUG-AUAAdTdT-3′,反义链5′-UUAUCAAUAUAGAGGUGG-GdTdT-3′;si-GRN#3:正义链5′-GCGUUUCAAUAAAG-UUUGUdTdT-3′,反义链5′-ACAAACUUUAUUGAAAC-GCdTdT-3′。应用RNAiMAX(Invitrogen)向细胞中转染siRNA,转染步骤按照试剂盒说明书进行。转染后4~6 h更换细胞培养液。
1.5 GRN过表达载体构建与转染以克隆到pCMV6-XL5(OriGene)中的GRN全长cDNA序列为模板,构建GRN-pcDNA3.1(Invitrogen)过表达载体。GRN全长序列连接有NotⅠ和XbaⅠ限制性酶切位点。以pcDNA3.1空载体作为对照,把过表达载体转染进BeWo细胞中。具体构建方法和转染方法参考CHEUNG[7]的研究报道。
1.6 ELISA测定细胞外PGRN蛋白水平根据生产商提供的PGRN ELISA试剂盒(EterLife)说明书方法,对BeWo细胞培养基中的PGRN蛋白进行检测。
1.7 Transwell实验Transwell实验检测细胞侵袭按照说明书进行(BD)。培养于无血清培养液中siRNA沉默PGRN表达的BeWo细胞铺接种至用Matrigel预处理的Transwell小室,小室下层的培养板中是含有血清的培养液,于37 ℃含5% CO2培养箱中培养48 h,侵袭到下层培养板中的细胞用结晶紫染色并拍照定量。
1.8 细胞凋亡分析在BeWo细胞中利用siRNA沉默PGRN表达后48 h,消化细胞进行凋亡检测。凋亡的细胞用Annexin V-FITC Apoptosis Detection Kit(Sigma)标记,用流式细胞仪Calibur(BD)分析Annexin V-PI阳性细胞比例。利用DAPI核染色检测凋亡小体:早期凋亡细胞会呈现核浓缩,染色加深,或核染色质呈新月形聚集于核膜一边;晚期凋亡细胞表现为核碎裂成大小不等的圆形小体,并被细胞膜所包绕,即凋亡小体。
1.9 统计学分析数据均以x±s表示,n代表每个实验的样本数。利用DPS数据处理系统软件,对所有统计结果均采用非配对的Student’s t-test计算统计差异,双尾,检验水准α=0.05。
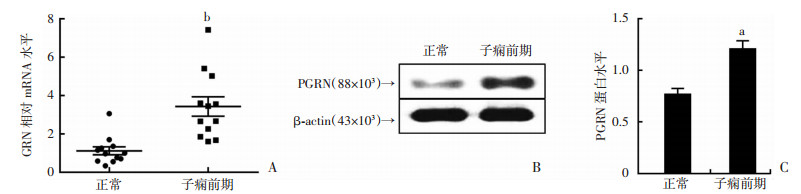
2 结果 2.1 PGRN在PE患者胎盘组织中高表达为了确定PGRN在PE患者胎盘组织中的表达情况,我们获得了12例PE患者和12例正常胎盘组织,抽提了蛋白质与总mRNA,分别于蛋白及mRNA两个层面检测PGRN的表达。定量PCR结果表明,PGRN在12例PE患者胎盘组织中的mRNA表达水平显著高于12例正常胎盘组织(P < 0.01, 图 1A)。选取3对具有代表性的胎盘组织,利用Western blot检测PGRN蛋白水平的表达,并通过灰度分析对蛋白表达进行半定量评估,结果显示在PE患者的胎盘组织中PGRN蛋白含量明显高于正常胎盘(P < 0.05, 图 1B、C)。上述结果从蛋白及mRNA两个层面证明PGRN在PE患者胎盘组织中高表达。
|
| A:qPCR检测来自12个PE患者和12个正常人胎盘组织中GRN的mRNA表达水平;B:Western blot检测PE患者和正常胎盘组织中PGRN蛋白表达水平;C:Image J软件对蛋白表达进行定量;a: P < 0.05, b: P < 0.01,与正常人胎盘组织比较 图 1 PGRN在PE患者胎盘组织中mRNA和蛋白水平高表达 |
2.2 PGRN在人原代滋养层细胞和细胞系中普遍表达
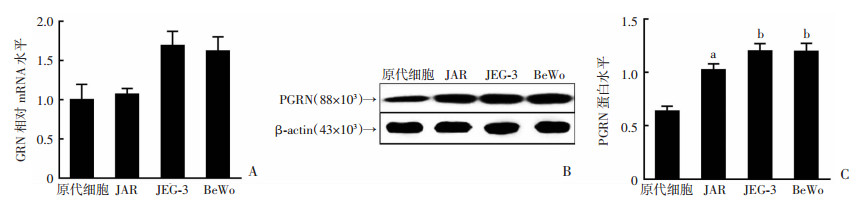
为了选取合适的滋养层细胞进行后续功能实验,需要进一步确定PGRN在各种滋养层细胞中的表达情况。我们分别检测了人原代滋养层细胞以及3株滋养层细胞系JEG-3、BeWo、JAR。qPCR结果表明,PGRN mRNA表达水平在3株细胞系与原代滋养层细胞中表达量接近,无统计学差异(P>0.05),但呈现一种高表达的状态(图 2A)。Western blot及其半定量结果显示,3种滋养层细胞系中的PGRN蛋白含量要显著高于原代滋养层细胞(P < 0.05,图 2B、C),其中PGRN在BeWo和JEG-3细胞系中的蛋白水平高于JAR(图 2C)。而已有研究报道称JEG-3细胞系中PGRN蛋白对其增殖、迁移和侵袭能力没有显著影响[4],综上,后续研究选用PGRN表达量较高的BeWo细胞进行。
|
| A:qPCR检测人原代滋养层细胞中GRN的mRNA表达水平;B:Western blot检测PGRN蛋白表达水平;C:Image J软件对蛋白表达进行定量;a: P < 0.05, b: P < 0.01,与原代细胞比较 图 2 PGRN在原代培养的滋养层细胞和JAR、JEG-3、BeWo细胞系中的表达情况 |
2.3 不同siRNA对BeWo细胞中PGRN表达沉默的效果
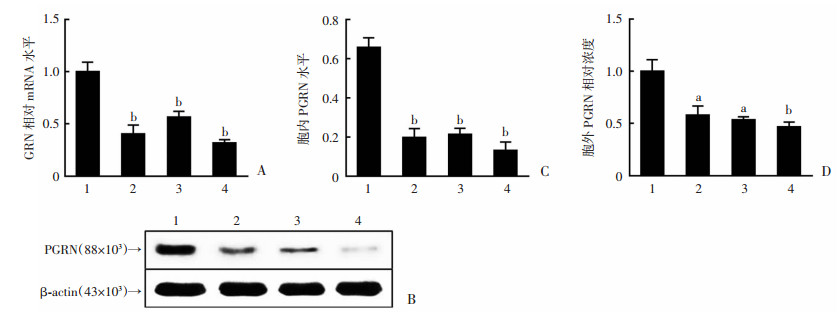
确定使用BeWo细胞系后,我们设计了3个特异靶向PGRN的siRNA,检测不同siRNA对PGRN的沉默效率。利用RNAiMAX将siRNA转入BeWo细胞中,qPCR检测PGRN表达,结果表明3个siRNA均能够显著下调PGRN的mRNA表达水平(P < 0.01,图 3A),其中si-PGRN#3的沉默效率最高。Western blot及半定量检测PGRN蛋白水平的沉默结果与qPCR结果相同,3个siRNA均能够显著下调PGRN蛋白表达(P < 0.01),si-PGRN#3的沉默效率最大(图 3B,C)。我们又通过ELISA测定了siRNA干扰后BeWo细胞分泌到胞外的PGRN蛋白水平。结果显示,3个siRNA均可以显著抑制PGRN向胞外的分泌(P < 0.05,图 3D),同样是si-PGRN#3的效果最好。综上,后续研究选择si-PGRN#3进行。
|
| A:qPCR检测在BeWo细胞中通过siRNA沉默后GRN的mRNA表达水平;B:Western blot检测siRNA沉默后PGRN蛋白表达水平;C:Image J软件对蛋白表达进行定量;D:ELISA测定细胞外PGRN蛋白水平;1:阴性对照,2:si-GRN#1, 3: si-GRN#2, 4: si-GRN#3; a: P < 0.05, b: P < 0.01,与阴性对照比较 图 3 siRNA对BeWo细胞中PGRN的沉默作用 |
2.4 PGRN沉默对BeWo细胞侵袭的影响
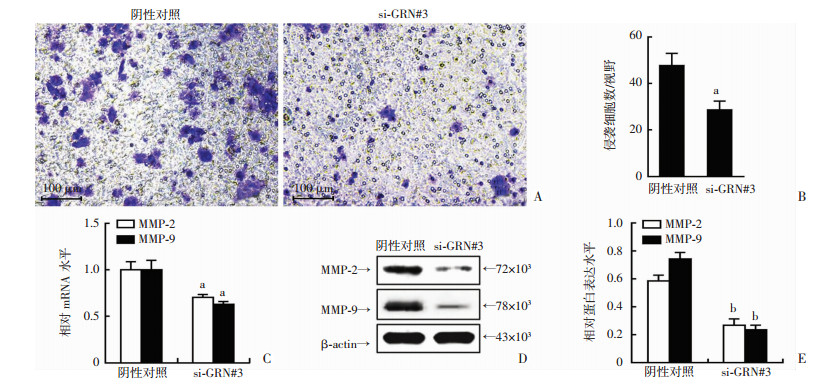
我们利用si-PGRN#3对PGRN沉默,并检测PGRN是否影响BeWo细胞的侵袭。向BeWo细胞中分别转入对照siRNA以及si-PGRN#3,利用Transwell实验检测BeWo细胞的侵袭。通过结晶紫染色并对阳性细胞进行定量,结果显示PGRN沉默显著抑制了BeWo细胞的侵袭(P < 0.05,图 4A、B)。PGRN沉默表达同时显著下调了MMP-2和MMP-9蛋白及mRNA水平的表达(P < 0.05,图 4C~E)。上述实验结果提示PGRN可能通过改变金属基质蛋白酶MMP-2和MMP-9的表达及活性,进而影响了BeWo细胞的侵袭。
|
| A:Transwell实验检测PGRN沉默后细胞的侵袭能力;B:结晶紫染色定量侵袭细胞的数目;C:qPCR检测MMP-2和MMP-9的mRNA表达;D:Western blot检测MMP-2和MMP-9的蛋白表达;E:Image J软件对蛋白表达进行定量;a: P < 0.05, b: P < 0.01,与阴性对照比较 图 4 BeWo细胞中PGRN沉默对细胞侵袭的影响 |
2.5 PGRN沉默对BeWo细胞凋亡的影响
通过流式细胞术检测Annexin V-PI标记的凋亡细胞,我们发现沉默PGRN能够诱导BeWo细胞凋亡(P < 0.01,图 5A、B),并可以诱导凋亡小体的出现(图 5C)。通过Western blot检测我们发现PGRN沉默显著上调凋亡相关蛋白cleaved Caspase-3水平(P < 0.01,图 5D、E)。综上,PGRN沉默促进了凋亡蛋白Caspase-3酶活性进而诱导BeWo细胞凋亡。
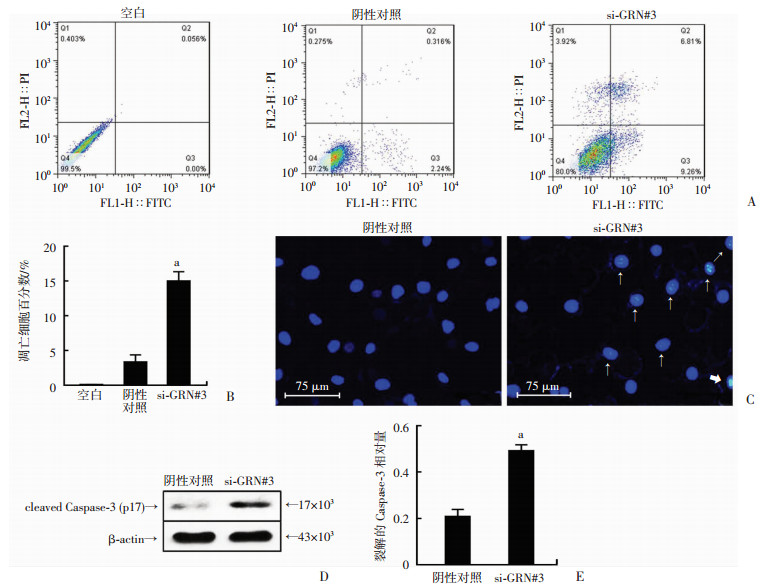
|
A:流式细胞检测siRNA沉默PGRN后细胞的凋亡情况;B:各组凋亡细胞定量分析;C:DAPI核染色检测凋亡小体;↑示早期凋亡细胞,呈现核浓缩,染色加深,或核染色质呈新月形聚集于核膜一边; 示晚期凋亡细胞,表现为核碎裂成大小不等的圆形小体,并被细胞膜所包绕,即凋亡小体;D:Western blot检测凋亡蛋白Caspase-3的活性;E:Image J软件对蛋白表达进行定量;a: P < 0.01,与阴性对照比较
图 5
BeWo细胞中PGRN沉默对细胞凋亡的影响 示晚期凋亡细胞,表现为核碎裂成大小不等的圆形小体,并被细胞膜所包绕,即凋亡小体;D:Western blot检测凋亡蛋白Caspase-3的活性;E:Image J软件对蛋白表达进行定量;a: P < 0.01,与阴性对照比较
图 5
BeWo细胞中PGRN沉默对细胞凋亡的影响
|
2.6 PGRN过表达对BeWo细胞侵袭和凋亡的影响
为了从反面证实PGRN的作用,我们构建了GRN过表达载体,研究了过表达GRN对BeWo细胞侵袭和凋亡的影响。以空载体为对照,转染GRN过表达载体的BeWo细胞分泌的PGRN蛋白显著升高(P < 0.01,图 6A),细胞侵袭能力也显著增强(P < 0.05,图 6B、C)。由于在正常条件下,BeWo细胞发生凋亡的比例不大,而PGRN主要表现为抗凋亡活性,因此,我们对细胞进行了双氧水(200 μmol/L)诱导24 h处理,使其发生一定程度的凋亡。与转染空载体的细胞相比,转染GRN过表达载体的细胞凋亡水平显著降低(P < 0.01)。
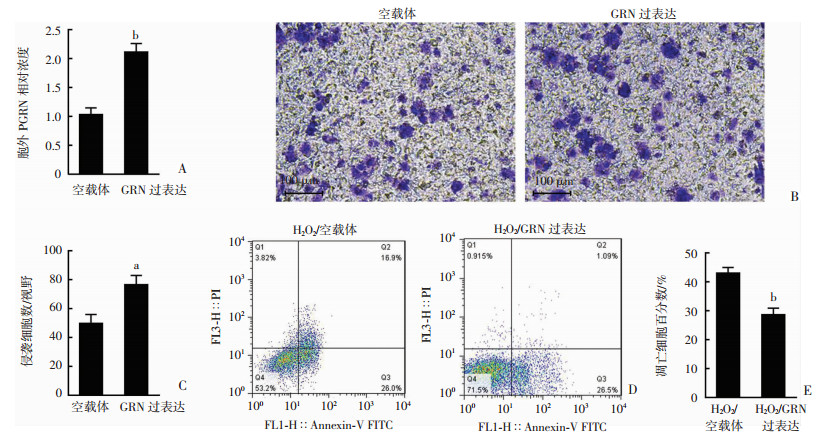
|
| A:转染GRN过表达载体后,分泌到胞外的PGRN蛋白浓度;B:Transwell侵袭实验测定PGRN过表达对细胞侵袭能力的变化;C:细胞迁移数量定量分析结果;D:流式细胞术分析PGRN过表达前后细胞凋亡能力的变化;E:细胞凋亡水平的定量分析结果;a: P < 0.05, b: P < 0.01,与空载体或H2O2/空载体比较 图 6 PGRN过表达对BeWo细胞侵袭和凋亡的影响 |
3 讨论
子痫前期属于胎盘源性疾病,胎盘灌注减少是子痫前期发生的根本原因。胎盘中的滋养层细胞侵袭不足导致的子宫螺旋支脉重塑障碍是子痫前期发病的中心环节,全身血管反应则是胎盘再灌注损伤的继发反应[8]。胎盘组织中最主要的细胞类型是滋养细胞,它的异常会直接导致胎盘发育的缺陷并引起子痫前期。滋养层细胞的侵袭和凋亡对胎盘发育至关重要,两者如若出现异常,均会导致胎盘发育缺陷,缺一不可。必须有足够的滋养层细胞存活,并且正常的侵袭,才会使胎盘正常的发育。滋养细胞的迁移、侵袭和浸润与血管床的发育密切相关,参与子痫前期的发病[9]。有研究指出,子痫前期胎盘滋养细胞凋亡增加,与疾病进展呈正相关[10]。综上,促进滋养细胞的侵袭、减少滋养细胞的凋亡能够有效控制子痫前期的发生发展。
我们的研究表明,颗粒蛋白前体PGRN能够显著促进滋养细胞的侵袭,降低滋养细胞的凋亡,提示我们PGRN是子痫发病的关键分子。PGRN又称为PCDGF(PC-cell derived growth factor,畸胎瘤细胞源性生长因子),含有593个氨基酸,分子量为68×103,由于糖基化修饰,相对分子量变为88×103[11]。PGRN是一种多功能的分泌性生长因子,广泛表达于各种组织,调控细胞的增殖、迁移、分化、生存以及信号转导途径,参与到胚胎发育、炎症反应、组织损伤修复、肿瘤发生以及神经退行性疾病等多种生物学过程中。PGRN多表达于快速增殖以及发生迁移的细胞中,研究表明,表皮损伤后PGRN的mRNA水平显著升高,向伤口迁移的角质细胞及炎症细胞中也出现了PGRN的高表达[12]。由于对增殖的促进及抑制凋亡的作用,PGRN在多数肿瘤细胞中高表达,对肿瘤的发生和发展发挥着关键作用[13]。此外,PGRN在胚胎发育过程中也是不可或缺的。研究表明,在胚胎发育早期,PGRN表达水平逐渐升高,在滋养外胚层中达到顶峰[14];PGRN通过促进生殖细胞和滋养层细胞的增殖加速囊胚腔的形成和扩张,促进胚胎发育[14]。我们向体外培养的滋养层细胞系BeWo中转染特异靶向PGRN的siRNA沉默其表达,利用Transwell实验证明了PGRN对滋养层细胞BeWo的侵袭是必需的,PGRN沉默后显著抑制了滋养层细胞的侵袭,PGRN过表达后滋养层细胞侵袭能力增强。此外,通过Annexin V-PI检测细胞凋亡,我们发现PGRN沉默后显著促进了滋养层细胞的凋亡,而PGRN水平增加能使细胞抗凋亡能力增加,表明PGRN具有保护细胞免于凋亡的作用。我们的实验结果与文献报道的PGRN抗凋亡促进侵袭的作用一致。
我们收集了12例子痫前期患者的胎盘组织以及12例正常的胎盘,利用qPCR及Western blot检测到PE患者中PGRN的mRNA及蛋白表达均上调,有文献报道称在PE患者胎盘组织中同样检测到了PGRN表达的上调,并且主要是滋养层细胞中的PGRN表达上调[4]。结合PGRN在滋养层细胞侵袭及凋亡中的作用,我们认为由于滋养层细胞凋亡的增加及侵袭减少而引起了PE的发生。为了控制细胞凋亡及侵袭能力,PGRN的表达代偿性的增加,因此在PE患者的胎盘中能够检测到PGRN表达上调。与此同时,PGRN表达上调量仍不足以控制细胞的凋亡及侵袭,需要进一步提高PGRN表达,以更好地抑制PE的发生。
综上,我们的研究指出PE患者胎盘中PGRN表达代偿性上调,是为了抑制胎盘滋养层细胞的凋亡,提高滋养层细胞的侵袭能力,抑制PE的发生发展。通过上调PGRN可能减少子痫前期的发生和发展。
| [1] | STUBERT J, KLEBER T, BOLZ M, et al. Acute-phase proteins in prediction of preeclampsia in patients with abnormal midtrimester uterine Doppler velocimetry[J]. Arch Gynecol Obstet, 2016, 294(6): 1151–1160. DOI:10.1007/s00404-016-4138-2 |
| [2] | KA H. Expression of progranulin in early and late gestation human placentas[J]. Reprod Dev Biol, 2006, 30(2): 107–113. |
| [3] | SITRAS V, PAULSSEN R H, GRONAAS H, et al. Differential placental gene expression in severe preeclampsia[J]. Placenta, 2009, 30(5): 424–433. DOI:10.1016/j.placenta.2009.01.012 |
| [4] | STUBERT J, SCHATTENBERG F, RICHTER D U, et al. Trophoblastic progranulin expression is upregulated in cases of fetal growth restriction and preeclampsia[J]. J Perinat Med, 2012, 40(5): 475–481. DOI:10.1515/jpm-2011-0277 |
| [5] | SERDAR AÇIKGÖZ A, TVTEN A, ÖNCVL M, et al. Evaluation of maternal serum progranulin levels in normotensive pregnancies, and pregnancies with early- and late-onset preeclampsia[J]. J Matern Fetal Neonatal Med, 2016, 29(16): 2658–2664. DOI:10.3109/14767058.2015.1096338 |
| [6] |
刘兴会, 王晓东, 何国琳. 子痫前期发病机制的研究现状及展望[J].
四川大学学报(医学版), 2015, 46(1): 99–103.
LIU X H, WANG X D, HE G L. Research status of the pathogenesis of pre-eclampsia[J]. J Sichuan Univ (Med Sci Edi), 2015, 46(1): 99–103. DOI:10.13464/j.scuxbyxb.2015.01.022 |
| [7] | CHEUNG S T, WONG S Y, LEUNG K L, et al. Granulin epithelin precursor overexpression promotes growth and invasion of hepatocellular carcinoma[J]. Clin Cancer Res, 2004, 10(22): 7629–7636. DOI:10.1158/1078-0432.CCR-04-0960 |
| [8] | CHAIWORAPONGSA T, CHAEMSAITHONG P, YEO L, et al. Pre-eclampsia part 1: current understanding of its pathophysiology[J]. Nat Rev Nephrol, 2014, 10(8): 466–480. DOI:10.1038/nrneph.2014.102 |
| [9] | HUNKAPILLER N M, GASPEROWICZ M, KAPIDZIC M, et al. A role for Notch signaling in trophoblast endovascular invasion and in the pathogenesis of pre-eclampsia[J]. Development, 2011, 138(14): 2987–2998. DOI:10.1242/dev.066589 |
| [10] | SHI Z, HOU W, HUA X, et al. Overexpression of calreticulin in pre-eclamptic placentas: effect on apoptosis, cell invasion and severity of pre-eclampsia[J]. Cell Biochem Biophys, 2012, 63(2): 183–189. DOI:10.1007/s12013-012-9350-5 |
| [11] | ONG C H, HE Z, KRIAZHEV L, et al. Regulation of progranulin expression in myeloid cells[J]. Am J Physiol Regul Integr Comp Physiol, 2006, 291(6): R1602–R1612. DOI:10.1152/ajpregu.00616.2005 |
| [12] | HE Z, BATEMAN A. Progranulin gene expression regulates epithelial cell growth and promotes tumor growth in vivo[J]. Cancer Res, 1999, 59(13): 3222–3229. |
| [13] | LU R, SERRERO G. Inhibition of PC cell-derived growth factor (PCDGF, epithelin/granulin precursor) expression by antisense PCDGF cDNA transfection inhibits tumorigenicity of the human breast carcinoma cell line MDA-MB-468[J]. Proc Natl Acad Sci U S A, 2000, 97(8): 3993–3998. DOI:10.1073/pnas.97.8.3993 |
| [14] | DIAZ-CUETO L, STEIN P, JACOBS A, et al. Modulation of mouse preimplantation embryo development by acrogranin (epithelin/granulin precursor)[J]. Dev Biol, 2000, 217(2): 406–418. DOI:10.1006/dbio.1999.9564 |



