2. 716000 陕西 延安,延安大学医学院:预防医学教研室
2. Department of Preventive Medicine, Medical College, Yan'an University, Yan'an, Shaanxi Province, 716000, China
宫颈癌是一种女性常见的恶性肿瘤,在发展中国家的发病率约为发达国家的6倍。早期宫颈癌经过治疗后5年内的生存率高达90%,但是由于大多数宫颈癌患者在确诊时已经处于癌症晚期,加上宫颈癌易转移、易复发,仍然严重威胁着女性的生命健康[1]。癌细胞的增殖、凋亡等与肿瘤生长有关,肿瘤细胞生物学特性的维持需要能量,肿瘤细胞以糖酵解为主要能量代谢途径[2]。整合素连接激酶(integrin-linked kinase, ILK)是一种蛋白激酶,在正常细胞中活性较低,在生长因子、整合素信号转导过程中发挥关键作用[3]。有研究表明,ILK在肿瘤组织中表达水平升高,并且与肿瘤的恶性程度和预后等有关,下调ILK表达后肿瘤细胞的生长受到抑制,凋亡增加[4]。ILK在宫颈癌组织中表达升高[5],而ILK对宫颈癌细胞增殖凋亡及糖酵解的影响尚不清楚。本研究以宫颈癌细胞为研究对象,通过siRNA下调细胞中的ILK,研究ILK在宫颈癌细胞增殖凋亡及糖酵解中的作用,为明确ILK在宫颈癌发生中的作用奠定基础。
1 材料与方法 1.1 主要材料宫颈癌细胞CaSki购自上海酶联生物;己糖激酶(hexokinase,HK)含量检测试剂盒、丙酮酸激酶(pyruvate kinase,PK)含量检测试剂盒、乳酸含量检测试剂盒购自美国Sigma公司;三磷腺苷(adenosine triphosphate, ATP)含量检测试剂盒购自北京Solarbio公司;RNA提取试剂盒购自德国QIAGEN公司;qRT-PCR试剂盒购自美国Bio-Rad公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自美国Thermo公司;Lipofectamine 2000购自美国Invitrogen公司;ILK siRNA、siRNA control购自美国Cell Signaling公司;ILK、β肌动蛋白(β-actin)引物由南京金斯瑞合成;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙啶(Propidium Iodide,PI)细胞凋亡检测试剂盒购自上海Bogoo公司;鼠抗ILK单克隆抗体购自美国Stanta Cruz公司;鼠抗β-连环蛋白(β-catenin)单克隆抗体、鼠抗c-myc单克隆抗体购自北京普利莱公司;兔抗活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3,cleaved Caspase-3)单克隆抗体、兔抗活化的含半胱氨酸的天冬氨酸蛋白水解酶9(cleaved cysteinyl aspartate specific proteinase 9,cleaved Caspase-9)单克隆抗体、兔抗β-actin单克隆抗体购自美国Cell Signaling公司;辣根过氧化物酶标记的IgG购自北京中杉金桥公司。
1.2 细胞转染宫颈癌细胞CaSki培养至对数期以后,以每孔2×105个细胞接种到6孔细胞培养板中,观察细胞浓度为70%时进行细胞转染。将细胞培养液吸除后,加入不含血清的DMEM培养液。取EP管记为A管和B管。在A管中分别添加ILK siRNA和siRNA control,加入不含血清的DMEM混合后,在室温条件下孵育5 min。在B管中添加Lipofectamine 2000和不含血清的DMEM,放置室温中孵育5 min。把A管和B管中的混合液混合后,在37℃,5% CO2培养箱中孵育4 h,更换成含有10%血清的DMEM继续培养。细胞分3组,CaSki细胞转染ILK siRNA和siRNA control分别为干扰组和阴性组,同时以未做转染的细胞作为对照组。
1.3 ILK mRNA水平检测对照组、阴性组、干扰组细胞培养48 h后,按照细胞RNA提取试剂盒提取细胞中的RNA,分光光度计检测RNA的光密度值,D(260)/D(280)比值介于1.8~ 2.0。用cDNA合成试剂盒进行反转录,qRT-PCR检测ILK mRNA水平,内参基因为β肌动蛋白(β-actin),2-△△Ct法计算目的基因的表达水平。qRT-PCR程序为:95 ℃,30 s;95 ℃,5 s;60 ℃,60 s。β-actin上游引物为5′-GAGAAGAGCTATGAGCTG-3′,下游引物5′-ATGATGGAATTGAATGTA-3′。ILK上游引物为5′-TG-AAGACACAAACAGACG-3′,下游引物5′-TCAAGGATAGGCACAATC-3′。
1.4 ILK蛋白水平检测对照组、阴性组、干扰组细胞培养48 h后,取出细胞,加入胰蛋白酶消化后,3 000×g离心5 min,把培养液上清吸除以后,加入细胞裂解液,放在冰上裂解30 min,12 000×g,4 ℃离心10 min,取上清液保存在-80 ℃。用二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒检测细胞蛋白浓度。将蛋白样品与5×Loading Buffer混合后,放在100 ℃煮沸5 min。蛋白电泳:5%的浓缩胶、10%分离胶,每个泳道添加50 μL的蛋白,在分离胶中用120 V电泳,在浓缩胶中用100 V电泳,观察溴酚蓝进入到电泳槽的底部时,关闭电源,停止电泳。转膜:将聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜放在甲醇中浸泡2 min,在转移缓冲液中浸泡10 min,200 mA转膜2 h。把PVDF膜放在5%脱脂奶粉中,室温,摇床孵育2 h。结合抗体:PVDF膜放在1 :500稀释的ILK一抗、1 :1 000稀释的β-actin一抗中,在4 ℃孵育过夜,再把膜放在1 :2 000稀释的含有辣根过氧化物标记的IgG中,室温,摇床孵育2 h。ECL发光后,Bio-Rad拍照,用Quantity one分析条带灰度值,以β-actin灰度值为内参,计算目的条带灰度值与β-actin灰度值的比值作为目的蛋白表达水平。
1.5 糖酵解相关指标测定对照组、阴性组、干扰组细胞培养48 h以后,收集各组细胞,检测PK、HK、ATP水平。同时收集各组培养液上清,检测乳酸水平。步骤均参照试剂盒说明书。
1.6 细胞增殖检测对照组、阴性组、干扰组细胞以每孔4 000个细胞接种到96孔细胞培养板中,放在37 ℃,5% CO2培养箱中孵育48 h以后,在每孔中添加20 μL的噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)溶液,在37 ℃条件下孵育4 h。把上清液吸除以后,在每孔中添加二甲基亚砜(dimethyl sulphoxide, DMSO)溶液150 μL,摇床孵育10 min,放在酶标仪上检测570 nm的光密度值[D(570)]。每组设置5个复孔,同时以不加细胞的孔为空白组,计算细胞存活率。
细胞存活率= [实验组D(570)-空白组D(570)]÷ [对照组D(570)-空白组D(570)] ×100%
1.7 细胞凋亡检测对照组、阴性组、干扰组细胞培养48 h以后,取约2×106个细胞,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)将细胞洗涤3次后,1 000×g离心10 min。加入200 μL的结合缓冲液,再加入碘化丙啶(propidium iodide,PI)和膜联蛋白V-FITC(Annexin V-FITC)各5 μL,避光混合反应后,用流式细胞仪检测细胞凋亡水平。
1.8 Cleaved Caspase-3、cleaved Caspase-9、β-catenin、c-myc蛋白水平测定对照组、阴性组、干扰组细胞培养48 h以后,收集各组细胞,Western blot检测细胞中cleaved Caspase-3、cleaved Caspase-9、β-catenin、c-myc蛋白水平,步骤同1.5。
1.9 统计学分析采用SPSS 22.0统计软件分析,数据以x±s表示,多组之间数据比较采用单因素方差分析,两两之间的比较用LSD-t检验。检验水准:α=0.05。
2 结果 2.1 各组细胞中ILK表达水平阴性组细胞中ILK mRNA和蛋白水平与对照组相比,差异无统计学意义(P>0.05)。干扰组细胞中ILK mRNA和蛋白水平较对照组显著降低(P < 0.05,图 1,表 1)。

|
| 图 1 Western blot检测各组细胞中ILK蛋白表达水平 |
| 组别 | mRNA水平 | 蛋白水平 |
| 对照组 | 1.00±0.00 | 0.75±0.05 |
| 阴性组 | 0.97±0.11 | 0.73±0.09 |
| 干扰组 | 0.32±0.02a | 0.13±0.02a |
| a:P < 0.05,与对照组比较 | ||
2.2 各组细胞中HK、PK、ATP水平及细胞分泌乳酸水平
阴性组细胞中HK、PK、ATP水平和培养液中乳酸含量与对照组相比,差异没有统计学意义(P>0.05)。干扰组细胞中HK、PK、ATP水平和培养液中乳酸含量较对照组明显降低(P < 0.05,表 2)。表明下调ILK降低宫颈癌细胞糖酵解水平。
| 组别 | HK /U·mg-1 |
PK /U·mg-1 |
ATP /mmol·L-1 |
乳酸 /mmol·L-1 |
| 对照组 | 6.31±0.53 | 0.92±0.07 | 30.98±0.32 | 18.46±0.15 |
| 阴性组 | 6.42±0.61 | 0.95±0.10 | 31.24±0.41 | 17.64±0.18 |
| 干扰组 | 4.53±0.44a | 0.54±0.06a | 22.75±0.21a | 10.77±0.13a |
| a:P < 0.05,与对照组比较 | ||||
2.3 各组细胞增殖、凋亡情况
阴性组细胞存活率、凋亡率与对照组相比,差异无统计学意义(P>0.05)。与对照组比较,干扰组细胞存活率明显降低,细胞凋亡率明显升高,差异均有统计学意义(P < 0.05, 图 2, 表 3)。表明下调ILK诱导宫颈癌细胞凋亡,抑制宫颈癌细胞增殖。
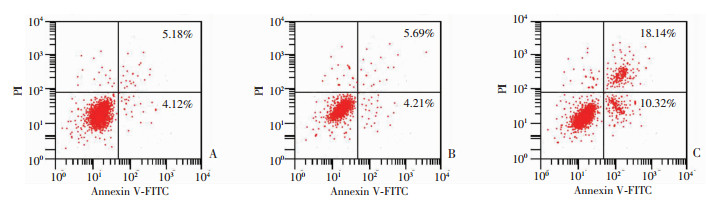
|
| A:对照组;B:阴性组;C:干扰组 图 2 流式细胞术检测各组细胞凋亡水平 |
| 组别 | 存活率/% | 凋亡率/% |
| 对照组 | 100.00±0.00 | 9.33±0.84 |
| 阴性组 | 99.81±0.89 | 9.71±0.93 |
| 干扰组 | 61.23±0.52a | 28.47±2.17a |
| a:P < 0.05,与对照组比较 | ||
2.4 各组细胞中cleaved Caspase-3、cleaved Caspase-9、β-catenin、c-myc蛋白水平
阴性组细胞中cleaved Caspase-3、cleaved Caspase-9、β-catenin、c-myc水平与对照组相比,差异无统计学意义(P>0.05)。干扰组细胞中cleaved Caspase-3、cleaved Caspase-9水平较对照组明显升高,β-catenin、c-myc水平较对照组明显降低,差异均有统计学意义(P < 0.05, 图 3, 表 4)。提示下调ILK诱导宫颈癌细胞中Caspase-3、Caspase-9活化,抑制宫颈癌细胞中β-catenin、c-myc表达。
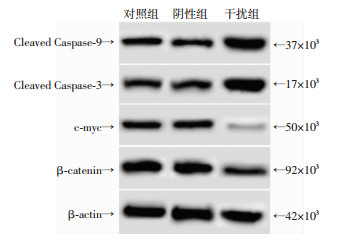
|
| 图 3 Western blot检测各组细胞中cleaved Caspase-3、cleaved Caspase-9、β-catenin、c-myc蛋白水平 |
| 组别 | cleaved Caspase-3 | cleaved Caspase-9 | β-catenin | c-myc |
| 对照组 | 0.78±0.09 | 0.86±0.05 | 1.22±0.13 | 0.74±0.06 |
| 阴性组 | 0.80±0.06 | 0.84±0.09 | 1.24±0.14 | 0.71±0.10 |
| 干扰组 | 1.41±0.12a | 1.35±0.15a | 0.63±0.05a | 0.10±0.02a |
| a:P < 0.05,与对照组比较 | ||||
3 讨论
ILK参与细胞外基质及细胞信号途径传导过程,是一种丝氨酸/苏氨酸蛋白酶,其可以作用于细胞内的多种相关蛋白,影响细胞的生长、分化等过程,在多种不同的细胞中均有表达[6-7]。目前认为,ILK过度表达似乎是恶性肿瘤的基本特征,其表达水平的高低与肿瘤的预后、病理分期等有关,ILK在膀胱癌、舌鳞癌、胶质瘤等肿瘤组织中表达异常升高,基因敲除膀胱癌、舌鳞癌、胶质瘤等肿瘤细胞中ILK后,肿瘤细胞的恶性程度降低[8-10]。朱向阳等[5]的研究发现,ILK在宫颈癌组织中的表达水平明显高于癌旁组织,并且与宫颈癌的淋巴结转移、浸润程度、分化程度等有关。本实验结果显示,ILK表达下调后的宫颈癌细胞存活率明显降低,细胞凋亡率升高,说明ILK表达下调具有抗宫颈癌的作用。
Caspase是一类与细胞凋亡有关的蛋白家族。Caspase-3是Caspase级联“瀑布”反应的凋亡执行因子,受到多种因素作用后在最后的凋亡程序中起关键作用[11]。Caspase-3在正常情况下以没有活性的酶原状态存在,在受到蛋白酶切割后活化形成cleaved Caspase-3诱导细胞凋亡,Caspase-3是凋亡的效应因子,在凋亡中发挥极其重要的作用,又称死亡蛋白酶[12-15]。Caspase-9是Caspase级联反应的起始因子,活化后可以引起并放大凋亡反应[16]。Caspase-9、Caspase-3在肿瘤组织中表达水平下降,与肿瘤细胞的凋亡有关[17]。本实验结果显示,ILK表达下调后的宫颈癌细胞中Caspase-3、Caspase-9活化水平升高,说明ILK下调可以通过促进Caspase-3、Caspase-9活化诱导宫颈癌细胞凋亡。
肿瘤细胞与正常细胞能量代谢方式不同,其无论是在缺氧还是氧气充足的情况下均以糖酵解为主要供能方式,这种供能方式又称为“有氧糖酵解”[18]。HK、PK是糖酵解中的关键限速酶,其活性的高低可以反映细胞内糖酵解的水平[19]。乳酸是糖酵解的产物之一,糖酵解水平越高,细胞分泌的乳酸水平也就越高[20]。ILK能够调控多种肿瘤细胞的生长,而肿瘤细胞的生长需要能量。本研究发现,ILK下调后的宫颈癌细胞中HK、PK活性明显降低,细胞中ATP水平也明显下降,细胞分泌的乳酸含量也明显下调,说明抑制ILK表达后可以下调宫颈癌细胞糖酵解水平,发挥抗肿瘤的作用。
肿瘤的发生和发展与细胞内多种信号通路及基因的调控有关,是一个极为复杂的过程。Wnt/β-catenin在宫颈癌组织中异常激活,抑制其激活后可以诱导肿瘤凋亡,降低肿瘤细胞的糖酵解水平,Wnt/β-catenin信号通路中β-catenin蛋白水平可以通过影响糖酵解过程中关键酶的活性调控糖酵解过程[21-23]。研究表明,ILK表达下调后可以降低β-catenin的表达水平,影响细胞分化、生长等生物学特性,ILK与Wnt/β-catenin可能具有潜在联系[23]。本研究发现,宫颈癌细胞中下调ILK表达后,细胞中的β-catenin水平表达下降,c-myc水平也下降,Wnt/β-catenin信号通路激活水平下调。这提示ILK下调可能通过抑制Wnt/ β-catenin信号通路的激活影响宫颈癌细胞的增殖、凋亡和糖酵解水平。
综上所述,ILK可能是治疗宫颈癌的潜在靶点,下调ILK表达可能通过抑制Wnt/β-catenin信号通路降低宫颈癌细胞的糖酵解水平,诱导Caspase-3、Caspase-9介导的宫颈癌细胞凋亡,从而抑制宫颈癌细胞增殖,其具体的作用机制需要在后续实验中进行验证。本实验结果明确了下调ILK对宫颈癌细胞增殖凋亡及糖酵解的影响,为研究ILK在宫颈癌发生中的作用奠定了基础,为靶向ILK治疗宫颈癌提供了参考依据。
| [1] | LIU S, SONG L, ZENG S, et al. MALAT1-miR-124-RBG2 axis is involved in growth and invasion of HR-HPV-positive cervical cancer cells[J]. Tumour Biol, 2016, 37(1): 633–640. DOI:10.1007/s13277-015-3732-4 |
| [2] | HART P C, RATTI B A, MAO M, et al. Caveolin-1 regulates cancer cell metabolism via scavenging Nrf2 and suppressing MnSOD-driven glycolysis[J]. Oncotarget, 2016, 7(1): 308–322. DOI:10.18632/oncotarget.5687 |
| [3] | GARCíA-JéREZ A, LUENGO A, CARRACEDO J, et al. Effect of uraemia on endothelial cell damage is mediated by the integrin linked kinase pathway[J]. J Physiol, 2015, 593(3): 601–618. DOI:10.1113/jphysiol.2014.283887 |
| [4] |
李胜水, 张凤梅, 李秀清, 等. ILK和E-Cad蛋白表达与食管鳞癌浸润转移的关系[J].
现代肿瘤医学, 2015, 23(6): 808–811.
LI S S, ZHANG F M, LI X Q, et al. ILK and E-Cad expression and their relation to invasion and metastases in human esophageal squamous cell carcinoma[J]. J Mod Oncol, 2015, 23(6): 808–811. DOI:10.3969/j.issn.1672-4992.2015.06.23 |
| [5] |
朱向阳, 王香花. ILK在宫颈癌组织中的表达及宫颈癌细胞侵袭能力的影响[J].
中国妇幼健康研究, 2016, 27(1): 87–89.
ZHU X Y, WANG X H. Expression of ILK in cervical cancer tissues and its influence on cervical cancer cell invasion[J]. Chin Matern Child Health Res, 2016, 27(1): 87–89. DOI:10.3969/j.issn.1673-5293.2016.01.030 |
| [6] | HAUSMANN C, TEMME A, CORDES N, et al. ILKAP, ILK and PINCH1 control cell survival of p53-wildtype glioblastoma cells after irradiation[J]. Oncotarget, 2015, 6(33): 34592–34605. DOI:10.18632/oncotarget.5423 |
| [7] | AKHTAR N, STREULI C H. An integrin-ILK-microtubule network orients cell polarity and lumen formation in glandular epithelium[J]. Nat Cell Biol, 2013, 15(1): 17–27. DOI:10.1038/ncb2646 |
| [8] | MATSUI Y, ASSI K, OGAWA O, et al. The importance of integrin-linked kinase in the regulation of bladder cancer invasion[J]. Int J Cancer, 2012, 130(3): 521–531. DOI:10.1002/ijc.26008 |
| [9] | XING Y, QI J, DENG S, et al. Small interfering RNA targeting ILK inhibits metastasis in human tongue cancer cells through repression of epithelial-to-mesenchymal transition[J]. Exp Cell Res, 2013, 319(13): 2058–2072. DOI:10.1016/j.yexcr.2013.05.014 |
| [10] | LIANG F, WANG B, BAO L, et al. Overexpression of ILK promotes temozolomide resistance in glioma cells[J]. Mol Med Rep, 2017, 15(3): 1297–1304. DOI:10.3892/mmr.2017.6157 |
| [11] | SRIVASTAVA S K, BHARDWAJ A, ARORA S, et al. MicroRNA-345 induces apoptosis in pancreatic cancer cells through potentiation of caspase-dependent and -independent pathways[J]. Br J Cancer, 2015, 113(4): 660–668. DOI:10.1038/bjc.2015.252 |
| [12] | CUI R, KIM T, FASSAN M, et al. MicroRNA-224 is implicated in lung cancer pathogenesis through targeting caspase-3 and caspase-7[J]. Oncotarget, 2015, 6(26): 21802–21815. DOI:10.18632/oncotarget.5224 |
| [13] | LIU C, VOJNOVIC D, KOCHEVAR I E, et al. UV-A irradiation activates Nrf2-regulated antioxidant defense and induces p53/Caspase3-dependent apoptosis in corneal endothelial cells[J]. Invest Ophthalmol Vis Sci, 2016, 57(4): 2319–2327. DOI:10.1167/iovs.16-19097 |
| [14] | TIAN H, ZHANG D F, ZHANG B F, et al. Melanoma differentiation associated gene-7/interleukin-24 induces Caspase-3 denitrosylation to facilitate the activation of cancer cell apoptosis[J]. J Interferon Cytokine Res, 2015, 35(3): 157–167. DOI:10.1089/jir.2014.0061 |
| [15] | DAS D, PERSAUD L, DEJOIE J, et al. Tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) activates caspases in human prostate cancer cells through sigma 1 receptor[J]. Biochem Biophys Res Commun, 2016, 470(2): 319–323. DOI:10.1016/j.bbrc.2016.01.055 |
| [16] | KANG N, CAO S J, ZHOU Y, et al. Inhibition of caspase-9 by oridonin, a diterpenoid isolated from Rabdosia rubescens, augments apoptosis in human laryngeal cancer cells[J]. Int J Oncol, 2015, 47(6): 2045–2056. DOI:10.3892/ijo.2015.3186 |
| [17] | BRENTNALL M, RODRIGUEZ-MENOCAL L, DE GUEVARA R L, et al. Caspase-9, caspase-3 and caspase-7 have distinct roles during intrinsic apoptosis[J]. BMC Cell Biol, 2013, 14(1): 32. DOI:10.1186/1471-2121-14-32 |
| [18] | LIU G, LI Y I, GAO X. Overexpression of microRNA-133b sensitizes non-small cell lung cancer cells to irradiation through the inhibition of glycolysis[J]. Oncol Lett, 2016, 11(4): 2903–2908. DOI:10.3892/ol.2016.4316 |
| [19] | DRUZHKOVA I N, SHIRMANOVA M V, LUKINA M M, et al. The metabolic interaction of cancer cells and fibroblasts - coupling between NAD(P)H and FAD, intracellular pH and hydrogen peroxide[J]. Cell Cycle, 2016, 15(9): 1257–1266. DOI:10.1080/15384101.2016.1160974 |
| [20] | LUO F, LIU X, LING M, et al. The lncRNA MALAT1, acting through HIF-1α stabilization, enhances arsenite-induced glycolysis in human hepatic L-02 cells[J]. Biochim Biophys Acta, 2016, 1862(9): 1685–1695. DOI:10.1016/j.bbadis.2016.06.004 |
| [21] | LI H, JIAO S, LI X, et al. Therapeutic effects of antibiotic drug tigecycline against cervical squamous cell carcinoma by inhibiting Wnt/β-catenin signaling[J]. Biochem Biophys Res Commun, 2015, 467(1): 14–20. DOI:10.1016/j.bbrc.2015.09.140 |
| [22] |
郑昆明, 吴刚, 秦晓明, 等. XAV939对肝癌细胞增殖及糖酵解的影响[J].
现代肿瘤医学, 2016, 24(13): 2023–2026.
ZHENG K M, WU G, QIN X M, et al. Effects of XAV939 on proliferation and glycolysis of hepatocellular carcinoma cells[J]. J Mod Oncol, 2016, 24(13): 2023–2026. DOI:10.3969/j.issn.1672-4992.2016.13.004 |
| [23] | PATE K T, STRINGARI C, SPROWL-TANIO S, et al. Wnt signaling directs a metabolic program of glycolysis and angiogenesis in colon cancer[J]. EMBO J, 2014, 33(13): 1454–1473. DOI:10.15252/embj.201488598 |
| [24] | PIAO Z, HONG C S, JUNG M R, et al. Thymosin β4 induces invasion and migration of human colorectal cancer cells through the ILK/AKT/β-catenin signaling pathway[J]. Biochem Biophys Res Commun, 2014, 452(3): 858–864. DOI:10.1016/j.bbrc.2014.09.012 |



