对于终末期肾病的患者,肾脏移植是最佳的肾脏替代疗法,对于提高患者寿命和改善生活质量有重要意义。随着慢性肾病患者增多,近10年来肾移植手术的需求也相应增加。中国肾移植科学登记系统数据中心(CSRKT)统计表明,2015年我国共完成肾移植手术7 131例,仅次于美国居世界第2位。而影响肾移植术后存活率的最重要非免疫因素则是肾脏冷缺血再灌注损伤(ischaemia reperfusion injury, IRI)。减轻肾移植冷IRI成为目前提高肾移植术后存活率的关键问题。糖原合成酶-3(glycogen synthase kinase-3)蛋白家族有GSK-3α和GSK-3β两个亚型,其中GSK-3β在肾小管上皮细胞的损伤和修复中有着不可或缺的作用[1]。研究表明,GSK-3β调控着外周组织炎症,有促进炎症反应、活化细胞白介素-1β(interleukin, IL-1β)和产生肿瘤坏死因子-α(tumor necrosis factor, TNF-α)的作用[2-3]。同时,GSK-3β也是转录核因子-κB(nuclear factor-κB, NF-κB)活化必不可少的因素[4-5]。本研究通过建立大鼠肾移植模型和改良冷缺血再灌注模型,探讨抑制GSK-3β对肾移植冷IRI的保护作用和对NF-κB活化的影响,为肾移植IRI的治疗提供理论基础。
1 材料与方法 1.1 实验分组选用雄性SD大鼠,体质量250~280 g,由重庆医科大学实验动物中心提供。提供自由饮水和摄食,术前12 h禁食不禁水。肾移植模型:将大鼠分为假手术组、肾移植组、肾移植+5 mg/kg TDZD-8组和肾移植+1 mg/kg TDZD-8组,每组6只,其中肾移植组和TDZD-8组建立肾移植模型。药物组受体大鼠在接受肾移植手术前5 min静脉注射TDZD-8,肾移植组受体大鼠在接受肾移植手术前5 min静脉注射生理盐水(溶解在10% DMSO,1 mg/kg)。冷缺血再灌注模型:将大鼠分为假手术组、冷IRI组、冷IRI+5 mg/kg TDZD-8组和冷IRI+1 mg/kg TDZD-8组,每组6只,冷IRI组和TDZD-8组建立冷IRI模型。TDZD-8组(5 mg/kg和1 mg/kg)大鼠关腹前5 min静脉注射TDZD-8,冷IRI组大鼠关腹前5 min静脉注射生理盐水(溶解在10% DMSO,1 mg/kg)。
1.2 抗体和试剂兔抗磷酸化RelA/p65(p-p65)、兔抗磷酸化GSK-3β(p-GSK-3β)、兔抗GSK-3β、兔抗RelA/p65 (p65)购自Cell Signaling Technology公司,GAPDH购自Santa Cruz公司,细胞核蛋白抽提试剂盒、BCA试剂盒、上样缓冲液、二抗(山羊抗兔)购于碧云天生物公司,ECL和免疫组化试剂盒购于北京博奥森生物公司,血清肌酐试剂盒、尿素氮试剂盒、丙二醛(malondialdehyde, MDA)试剂盒和超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购于上海信帆生物公司,TNF-α和IL-1β ELISA试剂盒购于R&D Systems公司,动物实验所用硬膜外麻醉导管购于兴华医用器材有限公司,血管夹购于上海医用器械集团有限公司。
1.3 肾移植和冷IRI动物模型构建肾移植模型:供体大鼠水合氯醛(15 mL/kg)腹腔麻醉后腹部正中切口开腹,暴露双侧肾脏,钝性分离左侧输尿管和肾动静脉。结扎左肾上腺静脉、腹主动脉和下腔静脉后,在腹主动脉(高于左肾动脉位置)做一开口插入硬膜外麻醉导管,左肾静脉下2 mm的下腔静脉处开一小口作为流出道,灌注肝素(25 U/L)乳酸林格液直至肾脏变白,取连接输尿管、肾动静脉和膀胱瓣的肾脏于装有0 ℃生理盐水的肾袋中1 h[6]。受体大鼠麻醉后腹部正中切口分离左肾动静脉,用无创血管夹夹闭腹主动脉和下腔静脉。供体肾静脉与受体肾静脉做端-端吻合,供体肾动脉与受体腹主动脉做端-侧吻合,将供体膀胱瓣吻合于受体膀胱上。肾动静脉通畅并且肾脏颜色迅速变红润和输尿管有蠕动有尿液流出作为肾移植成功的标志,关腹前切除右肾[7]。冷IRI模型:大鼠麻醉后腹部正中切口开腹,游离双侧肾脏、左肾动静脉和腹主动脉。用无创血管夹夹闭腹主动脉(上端高于右肾动脉,下端低于左肾动脉)和左肾静脉。用肝素(25 U/L)乳酸林格液以右肾动脉处作为入口,灌洗左肾(速度0.1 mL/s),并以左肾上腺静脉作为流出道。灌注完成的标志为肾脏颜色变苍白。结扎右肾动静脉和输尿管后切除右肾。取腹主动脉和下腔静脉血管夹后夹闭左肾动静脉,将左肾置于装有0 ℃生理盐水的自制肾袋,冷缺血1 h。最后松开所有血管夹,肾脏颜色迅速变红润后关腹。见图 1。

|
| A~G:大鼠肾移植模型建立过程;H~N:大鼠改良冷缺血再灌注模型建立过程 图 1 大鼠肾移植与改良冷缺血再灌注模型建立过程 |
1.4 标本采集
各组大鼠术后24 h开腹取左肾,取200 mg置于10%多聚甲醛固定后常规石蜡包埋,另200 mg置于冻存管,-80 ℃冰箱内保存用于后续检测。取下腔静脉血5 mL,用肝素抗凝后,3 000 r/min离心15 min后分离血清,装入EP管后-80 ℃冰箱冻存用于检测。
1.5 肾脏病理学检查(HE染色)包埋肾脏的蜡块做成5 μm的切片置于载玻片上。逐步脱蜡脱水后苏木精染色,脱水、透明和封片后置于光学显微镜观察肾脏组织病理改变。病变严重处用400倍高倍镜观察,并取10个高倍镜视野共100个肾小管根据Paller法进行肾小管评分[8]。
1.6 Western blot检测检测大鼠肾脏组织细胞核内p-p65、p-GSK-3β、GSK-3β、p65和GAPDH的含量。称取各组大鼠左肾冰上匀浆,按照细胞核蛋白抽提试剂盒提取细胞核蛋白,BCA法测定浓度后加入上样缓冲液煮沸。40 μg蛋白上样到聚丙烯酰胺凝胶电泳分离胶(SDS-PGEA)上进行电泳后转入PVDF膜,用5%脱脂奶粉在室温下封闭2 h,加入上述一抗(1: 1 000) 4 ℃孵育过夜。TBST洗去所有未结合的一抗后与二抗(羊抗兔,1: 5 000)室温孵育1 h。随后用ECL化学发光显影。Image pro plus 6.0软件测定每条条带光密度(IOD)值。以p-p65/总p65和p-GSK-3β/总GSK-3β来表示p-p65和p-GSK-3β的磷酸化水平。
1.7 免疫组织化学法检测肾脏组织内p-p65和p-GSK-3β的磷酸化水平肾脏切片烘干,二甲苯中脱蜡和各浓度梯度的酒精中水化,柠檬酸盐热修复后冷却30 min。按照S-P免疫组化试剂盒说明书进行相关操作,在湿暗盒内的载玻片上滴加p-GSK-3β和p-p65一抗(1: 100),阴性对照加入PBS代替一抗,4 ℃过夜。PBS冲洗后滴加二抗室温孵育30 min,PBS洗后再加辣根酶标记工作液,DAB显色。苏木精复染30 s,自来水冲洗后脱水、透明、封固和封片。用Image pro plus 6.0软件测定阳性区域的平均光密度。
1.8 血清指标检测用比色法检测血清肌酐和尿素氮浓度。根据ELISA试剂盒的说明书,加入标准品稀释、孵育和洗涤,加入酶标仪后孵育、洗涤、着色和终止反应,检测血清中TNF-α和IL-1β表达。用丙二醛(malondialdehyde, MDA)和超氧化物歧化酶(superoxide dismutase,SOD)试剂盒检测血清MDA和SOD活性。
1.9 统计学方法采用SPSS 22.0统计软件,计量资料数据以x±s表示,组间两两比较采用t检验,多组间比较采用单因素方差分析。检验水准:α=0.05。
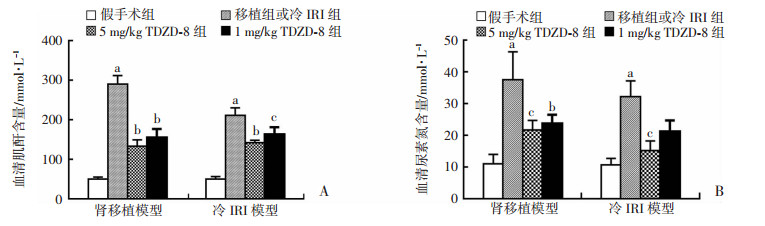
2 结果 2.1 TDZD-8对肾功能的影响与假手术组相比,肾移植组和冷IRI组血清肌酐和尿素氮浓度明显增加(P < 0.01)。在肾移植模型中,与肾移植组相比,TDZD-8组血清肌酐明显降低(P < 0.01),两治疗组间差异无统计学意义(P>0.05);1、5 mg/kg TDZD-8组尿素氮浓度降低(P < 0.05,P < 0.01),5 mg/kg TDZD-8组效果比1 mg/kg TDZD-8组更好(P < 0.05)。在冷IRI模型中,与冷IRI组相比,1、5 mg/kg TDZD-8组血清肌酐明显降低(P < 0.05,P < 0.01),两治疗组间差异有统计学意义;5 mg/kg TDZD-8组尿素氮浓度降低(P < 0.01),1 mg/kg TDZD-8组尿素氮浓度降低不明显(P>0.05)。肾移植组和冷IRI组比较,肌酐和尿素氮浓度改变差异无统计学意义(P>0.05,图 2)。
|
|
A:各组大鼠血清肌酐浓度的变化a: P < 0.01,与假手术组比较;b: P < 0.01, 与移植组或冷IRI组比较;c: P < 0.05, 与移植组或冷IRI组比较 B:各组大鼠血清尿素氮浓度的变化a: P < 0.01,与假手术组比较;b: P < 0.05, c: P < 0.01,与移植组或冷IRI组比较 图 2 各组大鼠血清肌酐和尿素氮浓度的比较 |
2.2 血清炎症因子的改变
与假手术组相比,肾移植组和冷IRI组TNF-α和IL-1β的表达明显升高(P < 0.01)。在肾移植模型中,与肾移植组相比,1、5 mg/kg TDZD-8组血清TNF-α的表达明显降低(P < 0.01),两治疗组间差异无统计学意义(P>0.05);1、5 mg/kg TDZD-8组血清IL-1β的表达降低(P < 0.05),两治疗组间差异无统计学意义(P>0.05)。在冷IRI模型中,与冷IRI组相比,1、5 mg/kg TDZD-8组血清TNF-α和IL-1β的表达降低(P < 0.05),两治疗组间差异无统计学意义(P>0.05)。肾移植组和冷IRI组比较,血清TNF-α和IL-1β表达改变差异无统计学意义(P>0.05,图 3)。

|
|
A:各组大鼠血清IL-1β浓度的变化a: P < 0.01,与假手术组比较;b: P < 0.05,与移植组或冷IRI组比较 B:各组大鼠血清TNF-α浓度的变化a: P < 0.01,与假手术组比较;b: P < 0.01,与移植组或冷IRI组比较;c: P < 0.05,与移植组或冷IRI组比较 图 3 各组大鼠血清IL-1β和TNF-α的表达 |
2.3 病理学改变和肾小管坏死评分
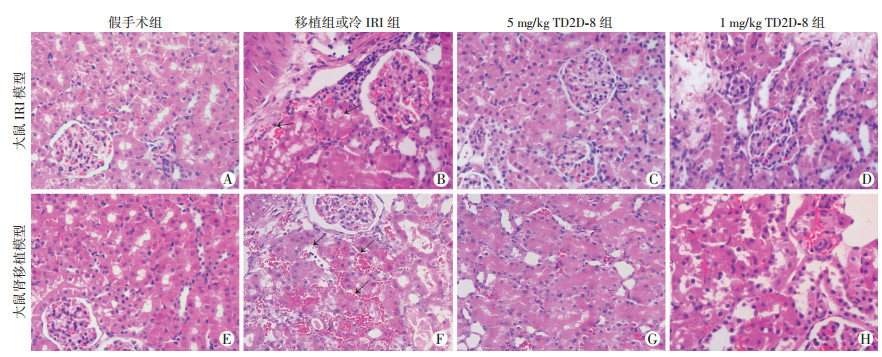
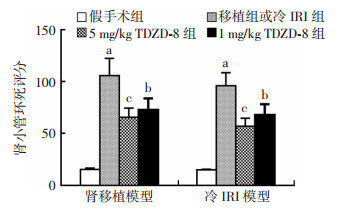
假手术组病理结果未见明显结构损伤,肾小管及肾间质结构基本正常。肾移植组和冷IRI组光镜下可见肾脏组织IRI明显,具体表现为肾小管上皮细胞肿胀、刷状缘消失、部分肾小管上皮细胞凝固性坏死脱落、肾间质充血,可见管型和间质内炎细胞浸润。用TDZD-8干预后,管型少见,间质充血明显缓解,炎细胞浸润减轻(图 4)。说明抑制GSK-3β对肾脏病理学损伤有减轻作用。相比假手术组,肾移植组和冷IRI组肾小管坏死评分明显升高(P < 0.01),1、5 mg/kg TDZD-8干预后评分明显降低(P < 0.05,P < 0.01),5 mg/kg TDZD-8组效果更好(P < 0.05)。肾移植组和冷IRI组比较评分差异无统计学意义(P>0.05,图 5)。
|
| A和E:未见明显的病理改变;B和F可见明显的出血,肾小管上皮细胞坏死,炎细胞浸润,刷状缘消失(黑色箭头所示);C、D、G、H:上述病理改变明显减少 图 4 各组大鼠肾脏缺血再灌注损伤的病理学改变(HE ×200) |
|
| a: P < 0.01,与假手术组比较;b: P < 0.05, c: P < 0.01,与移植组或冷IRI组比较 图 5 各组大鼠肾小管坏死评分 |
2.4 TDZD-8对GSK-3β的作用
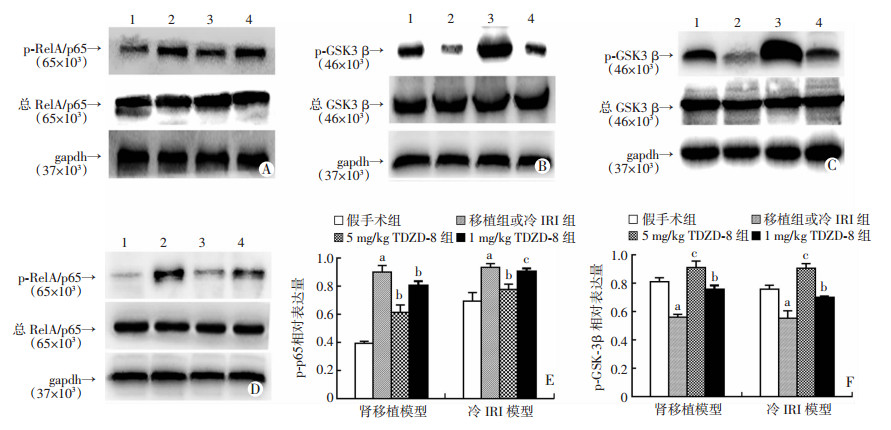
Western blot检测结果显示,与假手术组相比,肾移植组和冷IRI组GSK-3β的活性显著降低(表现为p-GSK-3β/总GSK-3β降低,P < 0.01)。与肾移植组和冷IRI组相比,1、5 mg/kg TDZD-8组GSK-3β的活性明显增高(P < 0.05,P < 0.01),5 mg/kg TDZD-8组效果更好(P < 0.01),表现为p-GSK-3β/总GSK-3β升高。各组的总GSK-3β磷酸化水平不变。肾移植组和冷IRI组GSK-3β活性改变比较差异无统计学意义(P>0.05,图 6)。
|
|
A~D:Western blot检测结果A、B:冷IRI模型各组大鼠p-p65、p-GSK-3β的表达;1:冷IRI假手术组;2:冷IRI组;3:冷IRI+TDZD-8(5 mg/kg)组;4:冷IRI+TDZD-8(1 mg/kg)组;C、D:肾移植模型各组的大鼠p-GSK-3β、p-p65的表达;1:肾移植假手术组;2:肾移植组;3:肾移植+TDZD-8(5 mg/kg)组;4,肾移植+TDZD-8(1 mg/kg)组 E:p-p65相对表达量(p-p65/总p65) a: P < 0.01,与假手术组比较;b: P < 0.01, 与移植组或冷IRI组比较;c: P < 0.05,与移植组或冷IRI组比较 F:GSK-3β活性表达(p-GSK-3β/总GSK-3β) a: P < 0.01,与假手术组比较;b: P < 0.05, c: P < 0.01,与移植组或冷IRI组比较 图 6 Western blot检测各组大鼠p-p65、p65、p-GSK-3β和GSK-3β的磷酸化水平 |
免疫组化结果显示,p-GSK-3β在假手术组表现为弱阳性,而在肾移植组和冷IRI组肾小管间质的磷酸化水平明显上调(P < 0.01)。与肾移植组相比,使用1、5 mg/kg TDZD-8干预后,p-GSK-3β磷酸化水平明显下调(P < 0.01),两个治疗组之间差异无统计学意义(P> 0.05);与冷IRI组相比,1、5 mg/kg TDZD-8组p-GSK- 3β磷酸化水平也下调(P < 0.05,P < 0.01),5 mg/kg TDZD-8组效果更好(P < 0.01)。肾移植组和冷IRI组p-GSK-3β磷酸化水平对比差异无统计学意义(P>0.05,图 7)。

|
|
A:免疫组化检测结果假手术组p-GSK-3β和p-NF-κB p65几乎无阳性表达,在肾移植组和冷IRI组中p-NF-κB p65在细胞核中和细胞质中呈阳性表现(箭头示,细胞核与细胞质被染成棕色),而在使用TDZD-8后阳性染色明显减少。在肾移植组和冷IRI组中,p-GSK-3β肾小管间质成阳性表达(箭头示,肾小管间质被染成棕色),而在使用TDZD-8后阳性染色明显减少 B:p-GSK-3β阳性染色的平均光密度a: P < 0.01,与假手术组比较;b: P < 0.01, 与移植组或冷IRI组比较;c: P < 0.05, 与移植组或冷IRI组比较 C:p-p65阳性染色的平均光密度a: P < 0.01,与假手术组比较;b: P < 0.05, c: P < 0.01, 与移植组或冷IRI组比较 图 7 免疫组化检测各组大鼠p-p65和p-GSK-3β的磷酸化水平(S-P ×200) |
2.5 TDZD-8对NF-κB P65的作用
Western blot检测结果显示,与假手术组相比,肾移植组和冷IRI组NF-κB p65活性明显增高(表现为p-p65/总p65升高,P < 0.01)。与肾移植组相比,1、5 mg/kg TDZD-8干预后NF-κB p65活性明显下降(P < 0.01),表现为p-p65/总p65下降,两治疗组之间差异无统计学意义(P>0.05);与冷IRI组相比,1、5 mg/kg TDZD-8组NF-κB p65活性下降(P < 0.05,P < 0.01),5 mg/kg TDZD-8组效果更好(P < 0.05)。各组的总p65含量不变。肾移植组和冷IRI组p65活性对比差异无统计学意义(P>0.05,图 6)。
免疫组化结果显示,假手术组p-p65几乎无阳性表达,而肾移植组和冷IRI组p-p65在肾小管细胞核有阳性表达(细胞核被染为褐色),并且细胞质有阳性表达(细胞质深染)。与假手术组相比,肾移植组和冷IRI组阳性表达明显增加(P < 0.01)。1、5 mg/kg TDZD-8干预后,肾移植组和冷IRI组p-p65阳性表达明显下降(P < 0.05,P < 0.01),5 mg/kg TDZD-8组效果更好(P < 0.05)。肾移植组和冷IRI组p-p65的阳性表达对比差异无统计学意义(P>0.05,图 7)。
2.6 SOD和MDA的改变与假手术组相比,肾移植组和冷IRI组血清MDA活性升高(P < 0.01),而1、5 mg/kg TDZD-8组MDA活性下降(P < 0.01),两治疗组之间差异无统计学意义(P>0.05)。与假手术组相比,肾移植组(P < 0.01)和冷IRI组(P < 0.05)血清SOD活性下降。使用5 mg/kg TDZD-8干预后,SOD活性升高(P < 0.05),其中1 mg/kg组SOD活性升高差异无统计学意义(P>0.05)。肾移植组和冷IRI组SOD和MDA活性改变差异无统计学意义(P>0.05,图 8)。
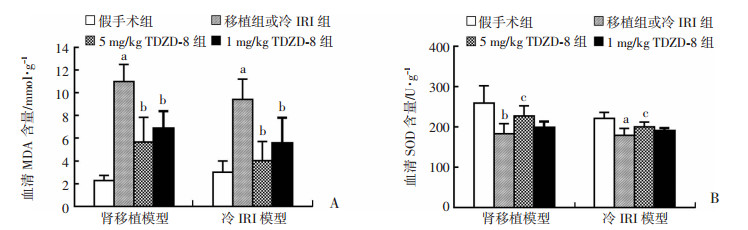
|
|
A:血清MDA活性的变化a: P < 0.01,与假手术组比较;b: P < 0.01, 与移植组或冷IRI组比较 B:血清SOD活性的变化a: P < 0.05,b: P < 0.01,与假手术组比较;c: P < 0.05,与移植组或冷IRI组比较 图 8 各组大鼠血清MDA和SOD活性比较 |
3 讨论
肾IRI进一步恶化了肾移植氧化应激状态和炎症反应。本研究建立大鼠肾移植模型和大鼠冷IRI模型分析肾脏IRI,证明在研究肾移植炎症反应和氧化应激方面,更简单的冷IRI模型能在一定程度上替代复杂和建模难度大的肾移植模型,肾移植组和冷IRI组各项指标变化差异无统计学意义(P>0.05)。影响肾移植术后肾脏损伤和存活率的因素有多种并不只有IRI,因此我们从单影响因素(通过建立大鼠冷缺血再灌注模型)和多影响因素(通过建立大鼠肾移植模型)来进行研究。
GSK-3β是丝氨酸/苏氨酸蛋白激酶,参与了多种细胞功能的调节[9-10]。研究表明,抑制GSK-3β可以降低脑血管内皮细胞的炎症反应和血清全身促炎因子(TNF-α、IL-6)水平[11];REN等[12]研究发现,通过药理抑制剂抑制GSK-3β能增加这种酶在IRI时的活性;高选择性GSK-3β抑制剂能抑制NF-κB的活化,减轻全身炎症反应和减少多器官损伤[13]。GSK-3β抑制剂TDZD-8能够显著降低肾脏、肝脏、肌肉和肺损伤,并且能抑制炎症因子的释放[14-16]。GSK-3β通过如下几个方面影响NF-κB的活性:①磷酸化NF-κB p65;②促进p50/p65易位到细胞核与DNA的结合;③磷酸化IκB;④cAMP反应元件结合蛋白(CREB)[9, 14, 17-20]。GSK-3β在正常细胞中呈活跃状态,并且通过磷酸化下游底物发挥生物学作用。当受到外部刺激时(肾移植手术和肾冷IRI手术),GSK-3β Ser9发生磷酸化而活性降低,从而改变下游底物的活性和功能。本研究证实,肾移植组和冷IRI组TDZD-8增强GSK-3β Ser9的磷酸化而使GSK-3β活性降低,并且降低NF-κB p65的磷酸化。
炎症因子作为全身炎症的标志,能进一步引起中性粒细胞和血管内皮细胞的粘附和迁徙。一些炎症因子如TNF-α、IL-1β等被发现在大鼠缺血再灌注模型中表达升高[2-3]。IL-1β可诱导中性粒细胞浸润肾组织,加重肾脏损伤。TNF-α不仅具有直接的细胞毒作用,而且能促进IL-1β和其他细胞因子的产生,从而产生放大效应,加重炎症细胞的浸润和聚集[21-22]。本研究发现,肾移植组和冷IRI组较假手术组TNF-α和IL-1β的表达明显升高,并且肌酐和尿素氮浓度升高,说明肾功能受损。而TDZD-8处理后TNF-α和IL-1β的表达明显降低,肌酐和尿素氮浓度也降低,说明抑制GSK-3β能保护肾功能,减轻肾脏损伤,发挥抗炎作用。产生上述现象的机制则可能是GSK-3β抑制剂增强GSK-3βSer9的磷酸化,从而降低NF-κB p65的磷酸化,抑制NF-κB的活性,其下游的炎症因子释放减少,病理改变减轻和肾小管坏死评分降低,最终肾脏损伤减轻。
大量氧自由基产生也是缺血再灌注后肾脏损伤的主要机制之一。人体内有产生自由基和清除自由基两套系统,它们共同维持机体氧化抗氧化平衡[23]。而大量氧自由基产生, 导致肾脏的局部清除能力下降,是再灌注后肾脏损伤的主要机制之一[24]。SOD作为自由基清除剂,能反映机体清除氧自由基的能力和肾脏抗脂质过氧化的能力;MDA的含量可以反映肾脏组织中氧自由基的含量、脂质过氧化水平和氧自由基对肾脏的损伤程度[21, 25-26]。本研究发现,抑制GSK-3β能提高SOD活性和降低MDA含量的水平,血清肌酐和尿素氮浓度与SOD活性呈负相关,而与血清MDA活性呈正相关,从而减轻肾脏组织的损伤。表现为肾功能指标好转,病理损伤减轻,并且肾小管坏死评分降低。
| [1] | FRAME S, COHEN P. GSK3 takes centre stage more than 20 years after its discovery[J]. Biochem J, 2001, 359(Pt 1): 1–16. DOI:10.1042/0264-6021:3590001 |
| [2] | WANG Y, HUANG W C, WANG C Y, et al. Inhibiting glycogen synthase kinase-3 reduces endotoxaemic acute renal failure by down-regulating inflammation and renal cell apoptosis[J]. Br J Pharmacol, 2009, 157(6): 1004–1013. DOI:10.1111/j.1476-5381.2009.00284.x |
| [3] | WANG Y, YANG R, GU J, et al. Cross talk between PI3K-AKT-GSK-3β and PP2A pathways determines tau hyperphosphorylation[J]. Neurobiol Aging, 2015, 36(1): 188–200. DOI:10.1016/j.neurobiolaging.2014.07.035 |
| [4] | DUGO L, COLLIN M, THIEMERMANN C. Glycogen synthase kinase 3beta as a target for the therapy of shock and inflammation[J]. Shock, 2007, 27(2): 113–123. DOI:10.1097/01.shk.0000238059.23837.68 |
| [5] | CAO Q, KARTHIKEYAN A, DHEEN S T, et al. Production of proinflammatory mediators in activated microglia is synergistically regulated by Notch-1, glycogen synthase kinase (GSK-3β) and NF-κB/p65 signalling[J]. PLoS ONE, 2017, 12(10): e0186764. DOI:10.1371/journal.pone.0186764 |
| [6] | SPANJOL J, CELI ĆT, JAKLJEVI ĆT, et al. Surgical technique in the rat model of kidney transplantation[J]. Coll Antropol, 2011, 35(Suppl 2): 87–90. |
| [7] | YE D, HENG B, LAI C, et al. A recommended technique of renal vein anastomosis in rat kidney transplantation for trainee[J]. Chin Med J, 2014, 127(10): 1919–1923. |
| [8] | An experimental model for assessment of renal recovery from warm ischemia[J]. Transplantation, 1983, 35(3): 198-204. DOI: 10.1097/00007890-198303000-00002. |
| [9] | VOELKL J, MIA S, MEISSNER A, et al. PKB/SGK-resistant GSK-3 signaling following unilateral ureteral obstruction[J]. Kidney Blood Press Res, 2013, 38(1): 156–164. DOI:10.1159/000355763 |
| [10] | RAMIREZ S H, FAN S, ZHANG M, et al. Inhibition of glycogen synthase kinase 3beta (GSK3beta) decreases inflammatory responses in brain endothelial cells[J]. Am J Pathol, 2010, 176(2): 881–892. DOI:10.2353/ajpath.2010.090671 |
| [11] | GUO F, JIANG T, SONG W, et al. Electroacupuncture attenuates cerebral ischemia-reperfusion injury in diabetic mice through adiponectin receptor 1-mediated phosphorylation of GSK-3β[J]. Mol Neurobiol, 2015, 51(2): 685–695. DOI:10.1007/s12035-014-8765-y |
| [12] | REN F, DUAN Z, CHENG Q, et al. Inhibition of glycogen synthase kinase 3 beta ameliorates liver ischemia reperfusion injury by way of an interleukin-10-mediated immune regulatory mechanism[J]. Hepatology, 2011, 54(2): 687–696. DOI:10.1002/hep.24419 |
| [13] | DUGO L, COLLIN M, ALLEN D A, et al. GSK-3beta inhibitors attenuate the organ injury/dysfunction caused by endotoxemia in the rat[J]. Crit Care Med, 2005, 33(9): 1903–1912. DOI:10.1097/01.CCM.0000178350.21839.44 |
| [14] | GUI B, HUA F, CHEN J, et al. Protective effects of pretreatment with oleanolic acid in rats in the acute phase of hepatic ischemia-reperfusion injury: role of the PI3K/Akt pathway[J]. Mediators Inflamm, 2014, 2014: 451826. DOI:10.1155/2014/451826 |
| [15] | MOKHTARI B, BADALZADEH R, ALIHEMMATI A, et al. Phosphorylation of GSK-3β and reduction of apoptosis as targets of troxerutin effect on reperfusion injury of diabetic myocardium[J]. Eur J Pharmacol, 2015, 765: 316–321. DOI:10.1016/j.ejphar.2015.08.056 |
| [16] | ZHANG F, PHIEL C J, SPECE L, et al. Inhibitory phosphorylation of glycogen synthase kinase-3 (GSK-3) in response to lithium. Evidence for autoregulation of GSK-3[J]. J Biol Chem, 2003, 278(35): 33067–33077. DOI:10.1074/jbc.M212635200 |
| [17] | SHIH R H, WANG C Y, YANG C M. NF-kappaB signaling pathways in neurological inflammation: a mini review[J]. Front Mol Neurosci, 2015, 8: 77. DOI:10.3389/fnmol.2015.00077 |
| [18] | MARKó L, VIGOLO E, HINZE C, et al. Tubular epithelial NF-κB activity regulates ischemic AKI[J]. J Am Soc Nephrol, 2016, 27(9): 2658–2669. DOI:10.1681/ASN.2015070748 |
| [19] | CORTÉS-VIEYRE R, BRAVO-PATIÑO A, VALDEZ-ALARCÓN J J, et al. Role of glycogen synthase kinase-3 beta in the inflammatory response caused by bacterial pathogens[J]. J Inflamm (Lond), 2012, 9(1): 23. DOI:10.1186/1476-9255-9-23 |
| [20] | ZHANG Y D, DING X J, DAI H Y, et al. SB-216763, a GSK-3β inhibitor, protects against aldosterone-induced cardiac, and renal injury by activating autophagy[J]. J Cell Biochem, 2018, 119(7): 5934–5943. DOI:10.1002/jcb.26788 |
| [21] | CHHABRA M, CONLON T M, SAEB-PARSY K, et al. BAFF and associated TNF superfamily members in renal transplantation: an end to BLySful ignorance[J]. Transplantation, 2013, 96(10): 853–859. DOI:10.1097/TP.0b013e3182997d34 |
| [22] | KOVACS K, TOTH A, DERES P, et al. Critical role of PI3-kinase/Akt activation in the PARP inhibitor induced heart function recovery during ischemia-reperfusion[J]. Biochem Pharmacol, 2006, 71(4): 441–452. DOI:10.1016/j.bcp.2005.05.036 |
| [23] | ZHAO W, GAN X, SU G, et al. The interaction between oxidative stress and mast cell activation plays a role in acute lung injuries induced by intestinal ischemia-reperfusion[J]. J Surg Res, 2014, 187(2): 542–552. DOI:10.1016/j.jss.2013.10.033 |
| [24] | HUSSEIN A M, ABD-ELKHABIR A, ABOZAHRA A, et al. Pancreatic injury secondary to renal ischemia/reperfusion (I/R) injury: possible role of oxidative stress[J]. Physiol Res, 2014, 63(1): 47–55. |
| [25] | QIAO X, LI R S, LI H, et al. Intermedin protects against renal ischemia-reperfusion injury by inhibition of oxidative stress[J]. Am J Physiol Renal Physiol, 2013, 304(1): F112–F119. DOI:10.1152/ajprenal.00054.2012 |
| [26] | LI X D, SUN G F, ZHU W B, et al. Effects of high intensity exhaustive exercise on SOD, MDA, and NO levels in rats with knee osteoarthritis[J]. Genet Mol Res, 2015, 14(4): 12367–12376. DOI:10.4238/2015.October.16.3 |



