2. 400038重庆,陆军军医大学(第三军医大学)药学与检验医学系临床微生物及免疫学教研室
2. Department of Clinical Microbiology and Immunology, Faculty of Pharmacy and Medical Laboratory Science, Army Medical University (Third Military Medical University), Chongqing, 400038, China
类鼻疽伯克霍尔德菌(Burkholderia pseudomallei)简称为类鼻疽杆菌,革兰染色阴性,不形成荚膜及芽孢,一端有3根以上鞭毛,运动活泼。主要存在水或土壤中,极易感染和传播,主要引起以肺炎和内脏多发性脓肿为特点的类鼻疽病[1-2]。随着环境和气候造成的病原菌扩散和人类活动加剧带来的影响,全球范围的类鼻疽病例逐渐增多,我国的海南、广东等地正是类鼻疽感染的重灾区[3-4]。该病与其他疾病的临床症状极易混淆,临床诊断和治疗都比较困难,死亡率高达40%,研究类鼻疽杆菌的致病机制对其防控具有十分重要的意义[5-6]。
众所周知,细菌的分泌系统在其致病过程中发挥着重要作用,如Ⅲ型分泌系统(type 3 secretion system,T3SS)包括多种与致病相关的复杂分子装置和重要的毒力因子。类鼻疽杆菌的Ⅲ型分泌系统被称为“分子注射器”,其编码基因位置基因簇包括T3SS-1(BPSS 1390-1408)、T3SS-2(BPSS1613-1629)和T3SS-3(BPSS 1520-1554)[7],其中BPSS1617的功能目前尚不清楚。因此本研究尝试重组表达该蛋白并制备其特异性多克隆抗体,分析该蛋白在细菌中的定位,为研究BPSS1617的生物学功能奠定基础。
1 材料与方法 1.1 材料 1.1.1 质粒和菌株pET-22b表达载体、大肠埃希菌BL21(DE3)、类鼻疽杆菌BPC006菌株,人肺癌上皮细胞A549,由陆军军医大学(第三军医大学)药学与检验医学系临床微生物及免疫学教研室保存。
1.1.2 试剂细菌DNA基因组提取试剂盒、DNA胶回收试剂盒、质粒提取试剂盒、氨苄霉素购自北京天根;DNA聚合酶、DNA连接酶、BamHⅠ和XhoⅠ限制性内切酶、DNA Marker、蛋白Marker购自大连TaKaRa公司;4%多聚甲醛、TritonX-100、尿素,HRP标记山羊抗兔IgG抗体购自北京中杉金桥公司;驴抗兔荧光标记二抗Alexa Fluor 594、DMEM培养基、胎牛血清、牛血清蛋白BSA购自Thermo Fisher;参照文献[8]配置缓冲液A、缓冲液B、缓冲液Ⅰ、缓冲液Ⅱ、缓冲液Ⅲ。
1.1.3 实验动物新西兰大白兔2只,雌性,4周龄,1.0 ~1.2 kg,购自第三军医大学实验动物中心。
1.2 方法 1.2.1 PCR引物的设计和合成根据GenBank公布的BPC006菌株的BPSS1617基因序列及质粒pET-22b多克隆位点序列设计PCR引物,BPSS1617基因扩增的上游引物P1:5′-CGCGGATCCATGGTTCAGTTTAACGACATC-3′,(BamHⅠ);下游引物P2:5′-CCG-CTCGAGTCAGGAATAGGTCAGCACGAG-3′,(XhoⅠ)。P1和P2的5′端分别引入BamHⅠ和XhoⅠ酶切位点(划线部分)和保护碱基,由Invitrogen公司合成引物序列。
1.2.2 pET-22b-BPSS1617表达载体的构建以BPC006菌株的基因组为模板,对目的基因BPSS1617(870bp)进行PCR扩增。并将扩增得到的BPSS1617片段和pET-22b质粒同时进行BamHⅠ/XhoⅠ双酶切,使用DNA连接酶将酶切片段和载体于16 ℃连接过夜。转化到E. coli BL21(DE3)感受态细胞内,然后涂布在氨苄抗性的LB平板上,37 ℃培养24 h,将阳性单克隆转接于氨苄抗性LB液体培养基中,37 ℃振荡过夜培养,提取细菌质粒后进行BamHⅠ/XhoⅠ双酶切,并对酶切验证正确的重组质粒进行DNA测序。
1.2.3 重组BPSS1617蛋白的表达检测阳性重组大肠杆菌BL21(DE3)在37 ℃培养至D(600)为0.6~0.8,接着加入IPTG至终浓度为0.1 mmol/L,并在不同温度(37、25、16 ℃)和不同诱导时间(3、5、16 h)进行培养,通过超声破碎菌体,4 ℃、12 000 r/min离心20 min分别收集上清和沉淀,采用SDS-PAGE检测目的蛋白表达情况。
1.2.4 包涵体蛋白的溶解和复性离心收集重组大肠杆菌培养物,缓冲液A漂洗细菌沉淀,然后用缓冲液B重悬菌体,200 W超声破碎,离心收集包涵体沉淀,并依次使用缓冲液Ⅰ、缓冲液Ⅱ、缓冲液Ⅲ分别超声洗涤1次,1 500 r/min离心30 min,再收集包涵体沉淀。用终浓度为8 mol/L的尿素缓冲液室温放置30 min后振荡2 h,然后6 000 r/min离心30 min吸取上清。再将溶解后的蛋白质适当稀释并装进透析袋中,依次放入到6、48、28 mol/L尿素以及PBS溶液中分别透析2 h,最后将透析袋里的溶液于12 000 r/min离心2 min后留取上清。
1.2.5 抗BPSS1617蛋白多克隆抗体的制备及效价测定用等体积弗氏完全佐剂将400 μg重组BPSS1617蛋白充分乳化,皮下多点注射免疫新西兰大白兔,按照每7 d免疫1次,共免疫3次,最后1次加强免疫后14 d时,心脏取血,离心分离血清,-80 ℃保存。抗体效价检测:使用重组BPSS1617蛋白作为抗原包被酶标板(0.4 μg/孔),5%脱脂奶粉进行封闭,将倍比释液(1 :10 000~1 :1 280 000)的兔抗血清加入酶标板,37 ℃孵育30 min,加入HRP标记的山羊抗兔IgG作为二抗,并以未免疫的家兔血清作为阴性对照,抗体滴度检测的阳性结果判断标准为:样品/阴性对照(吸光度A)≥2.1。
1.2.6 Western blot验证抗体特异性将目的蛋白电泳后条带转移至聚偏二氟乙烯(PVDF)薄膜上,将制备的抗血清以1 :5 000稀释度进行孵育,以HRP标记的山羊抗兔IgG抗体作为二抗检测BPSS1617蛋白及类鼻疽杆菌全菌蛋白,同时设置牛血清蛋白BSA作为阴性对照。
1.2.7 免疫荧光检测类鼻疽杆菌BPSS1617蛋白在12孔细胞培养皿中放入细胞爬片,接种人肺癌上皮细胞A549,37 ℃,5% CO2条件下培养至密度为70%~80%,用类鼻疽杆菌以感染复数MOI=10感染细胞2 h后,弃取培养基,用PBS缓冲液清洗细胞3次,加入含终浓度为200 ng/mL卡那霉素的DMEM培养基,继续培养4 h,随后4%多聚甲醛固定细胞30 min,再用0.3% Triton X-100透膜5 min,加入1 :200稀释的BPSS1617多克隆抗体孵育1 h,将驴抗兔荧光标记二抗Alexa Fluor 594以1 :1 000稀释后避光孵育1 h,最后用1 :1 000稀释的DAPI避光孵育10 min并用抗荧光淬灭剂进行封片,4 ℃湿盒内避光保存至后续激光共聚焦镜观察时使用。
1.2.8 BPSS1617蛋白的亚细胞定位培养类鼻疽杆菌至光密度值为0.8~1.0,在4 ℃、12 000 r/min离心15 min收集菌体,冰上200 W超声破碎细菌10 min,4 ℃、14 000 r/min离心45 min后取上清液。上清液4 ℃、20 000 r/min离心1 h,分离获得细胞壁组分沉淀;再将上清4 ℃、100 000 r/min离心4 h,获得细胞膜组分沉淀,溶液上清则为胞质组分。Western blot检测各组分中BPSS1617蛋白含量。
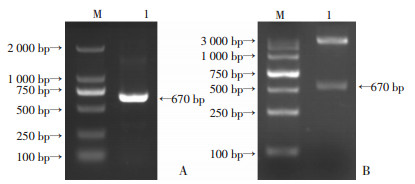
2 结果 2.1 BPSS1617基因的扩增及原核表达载体pET-22b-BPSS1617的构建以BPC006菌株全基因组DNA为模板,经PCR扩增得到670 bp目的基因BPSS1617(图 1A),重组质粒pET-22b-BPSS1617经BamHⅠ/XhoⅠ双酶切鉴定目的片段与理论大小一致(图 1B),经测序后验证目的片段无突变。
|
| A:PCR扩增BPSS1617 M:DNA相对分子量;1:BPSS1617基因扩增产物;B:pET-22b-BPSS1617重组质粒双酶切鉴定M:DNA相对分子量;1:pET-22b-BPSS1617 BamHⅠ/XhoⅠ双酶切 图 1 BPSS1617基因扩增产物和pET-22b-BPSS1617载体鉴定 |
2.2 BPSS1617蛋白的诱导表达
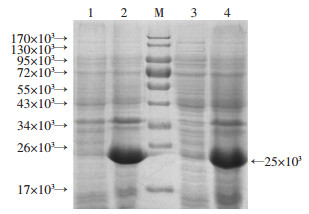
阳性重组子25 ℃,经IPTG诱导5 h,与未诱导菌相比在相对分子量为25×103位置均增加了1条蛋白条带,与BPSS1617预期蛋白分子量一致,目的蛋白表达量达50.1%,但主要为包涵体形式(图 2)。
|
| M:蛋白相对分子量;1:未诱导;2:诱导5 h;3:诱导5 h上清;4:诱导5 h沉淀 图 2 重组蛋白的表达鉴定 |
2.3 重组蛋白的纯化
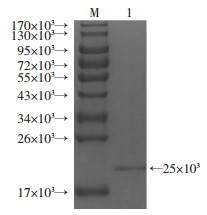
1L阳性工程菌经过25 ℃,IPTG诱导5 h,离心获得2.1 g菌体,通过超声破碎、离心纯化包涵体BPSS1617,经过变性复性,获得了纯度为95.5%的可溶性BPSS1617蛋白(图 3)。
|
| M:蛋白相对分子量;1:BPSS1617复性可溶重组蛋白 图 3 重组蛋白包涵体复性纯化 |
2.4 多克隆抗体的特异性检测
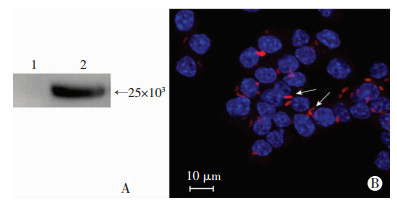
BPSS1617重组蛋白免疫新西兰大白兔35 d后收集血清,ELISA检测血清抗体效价达1 :1 280 000。以BPSS1617蛋白为抗原制备的抗血清作为一抗,以HRP标记的山羊抗兔IgG抗体作为二抗,对BPSS1617蛋白进行Western blot检测,在25×103出现特异性印迹条带(图 4A)。免疫荧光实验结果显示类鼻疽杆菌结合BPSS1617多克隆抗体后菌体呈现红色荧光而大肠埃希菌结合其多抗没有产生相应的荧光(图 4B),由此说明BPSS1617多克隆抗体是针对类鼻疽杆菌的特异性多抗。
|
| A:Western blot检测BPSS1617多克隆抗体特异性1:牛血清蛋白BSA;2:BPSS1617蛋白;B:类鼻疽杆菌免疫荧光染色(×400,箭头所示为类鼻疽杆菌) 图 4 BPSS1617多克隆抗体特异性鉴定 |
2.5 蛋白质亚细胞定位
Western blot检测类鼻疽杆菌细胞壁、细胞膜、细胞质各组分中BPSS1617蛋白含量,分析BPSS1617蛋白在类鼻疽杆菌中的亚细胞定位,结果如图 5。发现BPSS1617主要定位于胞质,细胞壁中也少量分布。
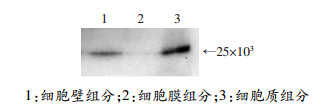
|
| 图 5 Western blot检测BPSS1617蛋白亚细胞定位 |
3 讨论
类鼻疽杆菌主要是热带地区土壤和死水中的常驻菌,特别多见于稻田中[9]。中国类鼻疽疫源地主要分布于海南、广东、广西等南部边缘热带和亚热带地区,1991年中国首次由广东湛江报道了4例类鼻疽患者,此后也从海南、广东和广西的水样中分离到类鼻疽杆菌[6]。类鼻疽一般呈散发,无明显的季节性,全年均可发生;任何年龄人群均可患此病,性别分布差异无统计学意义。从目前报道的临床病例来看,该病的临床表现复杂多样,致病菌对多种常用抗生素耐药,因此该病的临床诊断和治疗十分棘手[10]。近年来,全球学者对该病的致病机制和特点进行了深入研究,已确认了类鼻疽杆菌的一些毒力因子,如荚膜多糖、脂多糖、菌毛和分泌系统等[11]。类鼻疽杆菌的Ⅲ型分泌系统在侵袭宿主细胞,促进胞内增殖和毒力发挥过程中具有重要作用[7, 12-14],并由T3SS-1、T3SS-2和T3SS-3三个基因簇组成。每个基因簇通常由结构组分、分子伴侣和效应蛋白构成,共同组装成类似“分子注射器”的装置,通过将该装置插入宿主细胞膜中,把细菌效应蛋白递送到宿主细胞胞质溶胶中发挥作用[15]。类鼻疽杆菌的T3SS-3与沙门氏菌(Salmonella)和志贺氏菌(Shigella)的inv/mxi/spa T3SS非常相似[16],并且在类鼻疽杆菌动物感染模型中发挥重要作用。而T3SS-1和T3SS-2与植物病原菌青枯雷尔氏菌(Ralstonia solanacearum)和黄单胞菌属(Xanthomonas)的T3SS密切相关[17],因此作为一种土壤腐生菌,表明类鼻疽杆菌也是一种潜在的植物病原菌。
研究表明T3SS-1和T3SS-2,在类鼻疽杆菌感染番茄植株过程中扮演关键作用[18],能够促进其在植物体宿主中的适应能力,从而在植物和动物之间的造成感染和播散,但其发挥的功能和具有机制需要进一步研究。类鼻疽杆菌的BPSS1617蛋白是由T3SS-2基因簇编码的效应蛋白,但具体功能未知。本研究成功扩增该基因并构建了pET-22b-BPSS1617重组质粒,重组质粒转化到E.coli宿主菌BL21(DE3)后经IPTG诱导表达、纯化,最终得到分子量为25×103的高纯度目的BPSS1617蛋白。然后我们应用纯化的BPSS1617蛋白免疫家兔制备多克隆抗体,兔抗血清ELISA效价均高达1 :1 280 000,并能与目的蛋白发生特异性抗原抗体反应。最后我们通过分析蛋白质亚细胞组分和多克隆抗体的结合情况来定位BPSS1617蛋白,结果显示BPSS1617蛋白主要存在于类鼻疽杆菌的胞质中,少量存在于细胞壁上,以上研究工作为进一步深入研究其在类鼻疽杆菌感染植物体宿主过程中的功能和机制奠定基础。
| [1] | LIMMATHUROTSAKUL D, GOLDING N, DANCE D A, et al. Predicted global distribution of Burkholderia pseudomallei and burden of melioidosis[J]. Nat Microbiol, 2016, 1: 15008. DOI:10.1038/nmicrobiol.2015.8 |
| [2] | WIERSINGA W J, VAN DER POLL T, WHITE N J, et al. Melioidosis: insights into the pathogenicity of Burkholderia pseudomallei[J]. Nat Rev Microbiol, 2006, 4(4): 272–282. DOI:10.1038/nrmicro1385 |
| [3] |
毛旭虎. 加强类鼻疽的研究[J].
第三军医大学学报, 2011, 33(13): 1315–1317.
MAO X H. Progress on melioidosis[J]. J Third Mil Med Univ, 2011, 33(13): 1315–1317. |
| [4] |
吴华, 王旭明, 黄东良. 海南类鼻疽的流行病学特点和临床特点调查研究[J].
中国全科医学, 2013, 16(8): 923–926.
WU H, WANG X M, HUANG D L. Epidemiological and clinical features of melioidosis in Hainan[J]. Chin Gen Prac, 2013, 16(8): 923–926. DOI:10.3969/j.issn.1007-9572.2013.08.027 |
| [5] | KUNDANGAR R S, BHAT S N, MOHANTY S P. Melioidosis mimicking tubercular cold abscess[J]. BMJ Case Rep, 2017, 2017: pii:bcr-2017–221787. DOI:10.1136/bcr-2017-221787 |
| [6] | FANG Y, CHEN H, LI Y L, et al. Melioidosis in Hainan, China: a retrospective study[J]. Trans R Soc Trop Med Hyg, 2015, 109(10): 636–642. DOI:10.1093/trstmh/trv065 |
| [7] | VANDER BROEK C W, STEVENS J M. Type Ⅲ secretion in the melioidosis pathogen Burkholderia pseudomallei[J]. Front Cell Infect Microbiol, 2017, 7: 255. DOI:10.3389/fcimb.2017.00255 |
| [8] |
胡艺, 胡志强, 马腾飞, 等. 类鼻疽杆菌Ⅲ型分泌系统BPSS1395蛋白表达及其抗体制备与鉴定[J].
第三军医大学学报, 2017, 39(10): 941–945.
HU Y, HU Z Q, MA T F, et al. Expression and identification of recombinant Burkholderia pseudomallei type Ⅲ secretion system BPSS1395 protein and preparation of its polyclonal antibodies[J]. J Third Mil Med Univ, 2017, 39(10): 941–945. DOI:10.16016/j.1000-5404.201611152 |
| [9] | CURRIE B J. Melioidosis: evolving concepts in epidemiology, pathogenesis, and treatment[J]. Semin Respir Crit Care Med, 2015, 36(1): 111–125. DOI:10.1055/s-0034-1398389 |
| [10] | HEMARAJATA P, BAGHDADI J D, HOFFMAN R, et al. Burkholderia pseudomallei: challenges for the clinical microbiology laboratory[J]. J Clin Microbiol, 2016, 54(12): 2866–2873. DOI:10.1128/JCM.01636-16 |
| [11] | STONE J K, DESHAZER D, BRETT P J, et al. Melioidosis: molecular aspects of pathogenesis[J]. Expert Rev Anti Infect Ther, 2014, 12(12): 1487–1499. DOI:10.1586/14787210.2014.970634 |
| [12] | JOOMPA P, PONNIKORN S, ROYTRAKUL S, et al. Sittiruk roytrakul, 3 investigation of host-pathogen interaction between Burkholderia pseudomallei and autophagy-related protein LC3 using hydrophobic chromatography-based technique[J]. Cell Biosci, 2017, 7(1): 45. DOI:10.1186/s13578-017-0172-4 |
| [13] | KANG W T, VELLASAMY K M, RAJAMANI L, et al. Burkholderia pseudomallei type Ⅲ secreted protein BipC: role in actin modulation and translocation activities required for the bacterial intracellular lifecycle[J]. Peer J, 2016, 4(12): e2532. DOI:10.7717/peerj.2532 |
| [14] | VANDER BROEK C W, ZAINAL ABIDIN N, STEVENS J M. BipC, a predicted Burkholderia pseudomallei type 3 secretion system translocator protein with actin binding activity[J]. Front Cell Infect Microbiol, 2017, 7: 333. DOI:10.3389/fcimb.2017.00333 |
| [15] | DU J, REEVES A Z, KLEIN J A, et al. The type Ⅲ secretion system apparatus determines the intracellular niche of bacterial pathogens[J]. Proc Natl Acad Sci USA, 2016, 113(17): 4794–4799. DOI:10.1073/pnas.1520699113 |
| [16] | Stevens M P, Wood M W, Taylor L A, et al. An inv/axi-spa-like type Ⅲ protein secretion system in Burkholderia pseudomallei modulates intracellular behaviour of the pathogen[J]. Mol Microbiol, 2002, 46(3): 649–659. DOI:10.1046/j.1365-2958.2002.03190.x |
| [17] | WINSTANLEY C, HALES B A, HART C A. Evidence for the presence in Burkholderia pseudomallei of a type Ⅲ secretion system-associated gene cluster[J]. J Med Microbiol, 1999, 48(7): 649–656. DOI:10.1099/00222615-48-7-649 |
| [18] | LEE Y H, CHEN Y, OUYANG X, et al. Identification of tomato plant as a novel host model for Burkholderia pseudomallei[J]. BMC Microbiol, 2010, 10: 28. DOI:10.1186/1471-2180-10-28 |



