2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系临床血液学教研室
2. Department of Clinical Hematology, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
肌卫星细胞(muscle satellite cells,MSC)是骨骼肌组织内最主要的干细胞成分,因其位于肌纤维细胞膜和基底膜之间而得名,它不仅负责肌组织的生后生长发育,更是骨骼肌损伤再生的主要细胞来源[1-2];正常生理情况下MSC多处于静息状态,在损伤等病理生理刺激下可迅速活化为具有增殖能力的成肌细胞并进一步分化[3-4];近几年基于组织学和损伤模型等工作,研究表明在肌肉老化进程中,肌卫星细胞数量逐渐下降,同时骨骼肌损伤后再生修复能力显著减退[5-6],但由于方法学等原因,对老化过程中MSC数量的改变尚有争议,对老年MSC成肌分化能力无直接检测报道。
快速高效地获取高纯度的肌卫星细胞是研究其增殖分化及调控机制的重要前提。近年伴随流式细胞分选技术进步特别是对MSC表面标志分子认识的深入,陆续有报道可通过多重免疫荧光标记离散的肌组织细胞以快速获取MSC,其中对肌卫星细胞阳性标记的选择多采用CXCR4, β1-integrin或M-cadherin, ɑ7-integrin等[7-10], 然而多种阳性标记的选择可能改变干细胞性状并干扰其增殖分化过程。因此,本研究综合文献报道,利用流式细胞分选技术(fluorescence-activated cell sorting, FACS)并选用CD45-/CD31-/Sca1-/α7-integrin+三阴一阳的分选方案分离小鼠骨骼肌卫星细胞并对分选细胞进行诱导分化培养,同时比较了青年、成年和老年小鼠骨骼肌组织中静止肌卫星细胞数量和成肌分化能力的差异。
1 材料与方法 1.1 实验材料 1.1.1 实验动物雄性C57BL/6小鼠36只购于苏州工业园区爱尔麦特科技有限公司,其中青年鼠12只(YN组,6周龄),其体质量为(18.7±3.0)g;成年鼠12只(AN组,12月龄),其体质量为(26.0±3.2) g;老年鼠12只(ON组,17月龄),其体质量为(30.5±0.4)g [合格证号:SCXK(苏)2014-0007]。自由饮水、进食,饲养温度21~24℃,相对湿度45%~55%,明暗周期12 h。适应性喂养1周后,用于实验。为提高原代卫星细胞产量,本研究将2只小鼠作为1个样本提取卫星细胞[11-12],最终各组小鼠样本量均为6。
1.1.2 实验材料使用的血清、酶、抗体等有:胎牛血清(Gibco),马血清(HyClone),DMEM高糖培养基(HyClone),胶原酶Collagenase Ⅱ(Worthington),分散酶Dispase(Life Technologies),青链霉素混合液(索莱宝),Alexa Fluor 405抗小鼠α7-integrin抗体(RD),AlexaFluor488抗小鼠CD45抗体,Alexa Fluor 488抗小鼠CD31抗体(Biolegend),抗小鼠Sca-1藻红蛋白(eBioscience),抗小鼠Pax7(DSHB),α平滑肌肌动蛋白Desmin(北京博奥森),胚胎肌球蛋白重链eMHC(DSHB),山羊抗小鼠TRITC标记二抗、羊抗兔FITC标记二抗(武汉博士德),40 μm细胞滤网(BD)。
1.2 实验方法 1.2.1 小鼠骨骼肌组织的消化分离参考等LIU等[13]及JOE等[14]的方法,颈椎脱臼处死小鼠,在70%的酒精中浸泡5 min;无菌条件下取小鼠双后肢腓肠肌等肌肉,PBS冲洗,去除纤维及结缔组织;将肌肉机械剪碎后,置于700~800 U/mL Colleagese Ⅱ中,37 ℃水浴振荡消化1 h;加入PBS混匀,500×g,4 ℃离心5 min,弃上清;依次加入预先配好的Collegenase Ⅱ与Dispase各2 mL,37℃水浴荡消化30min后再次加入PBS,充分混匀并离心,小心吸出上清至10 mL;过40 μm细胞筛,得到骨骼肌组织单细胞悬液。
1.2.2 离散肌组织细胞染色在上述骨骼肌单细胞悬液中依次加入CD31-FITC,CD45-FITC(1 :200),sca-1-Pecy7(1 :100),ɑ7-Integrin-PE(1 :50)抗体,冰上避光孵育40 min,加入500 μL流式缓冲液终止染色,迅速离心弃上清后,用100 μL流式缓冲液重悬细胞,通过细胞滤网后进行流式细胞分选。
1.2.3 流式细胞仪分选及计数本实验所用的流式细胞仪为BD FACS AriaTM Ⅲ。流式细胞分选仪调试参数后,根据骨骼肌卫星细胞的形态确定其在流式细胞仪中的大小以及颗粒度等特征,限定分选条件。首先在FSC /SSC散点图中设门圈活细胞群,排除凋亡细胞和碎片。然后按照CD45-/CD31-/Sca-1-/ɑ7-Integrin+方案获取目标细胞,每组小鼠分选结束后记录细胞数量。
1.2.4 分选的卫星细胞Pax7等免疫荧光染色鉴定将分选的细胞接种到Ⅰ型胶原包被细胞爬片上,待细胞贴壁后进行免疫荧光染色鉴定。细胞经PBS清洗3次,加4%多聚甲醛固定15 min,用含0.25% Triton通透15 min,PBS洗涤3次;5%的胎牛血清37 ℃封闭30 min,分别加入鼠抗PAX7(1 :20),或兔抗Desmin(1 :100),4 ℃过夜。PBS洗涤3次,加入的FITC或TRITC标记二抗(1 :100),室温避光孵育1 h,PBS漂洗后加入DAPI,荧光显微镜下观察。
1.2.5 成肌诱导分化培养及eMHC染色将分选的细胞置于Ⅰ型鼠尾胶原包被过的24孔板中进行增殖培养,待细胞增殖生长至70%后将培养基更换分化培养基,进行成肌诱导分化培养;观察肌卫星细胞分化及肌管形成。诱导培养5 d后,用1 :1的丙酮-甲醇溶液固定并漂洗后行eMHC(1 :50)免疫荧光染色,同时用DAPI对核进行衬染。
1.2.6 成肌细胞融合指数分析将来自成年和老年的eMHC和DAPI的拍照图片用Image Pro-Plus 6.0软件进行重叠(即“Imerge”),成肌细胞融合指数计算方法为:成肌细胞融合指数=含2细胞核以上细胞数/所有细胞数目,计算高倍5~6张图片的成肌细胞融合指数并分类计算中(>5核)、大(>10核)肌管比例。
1.2.7 分选的肌卫星细胞数量统计分析使用Graphpad 6.0版软件对所有数据进行统计学分析处理,数据以x±s表示,组间比较使用t检验。检验水准:α=0.05。
2 结果 2.1 FACS分选小鼠肌卫星细胞抗小鼠CD45/CD31占据异硫氰酸荧光素(fluorescein isolhiocyanate,FITC)通道,目的细胞阴性表达;抗小鼠Sca-1占据藻红蛋白花青苷7(phycoerythrin cyanin7,peCy7)通道,目的细胞阴性表达;抗小鼠ɑ7-Integrin占据藻红蛋白(phycoerythrin,PE)通道,目的细胞呈阳性表达。具体分群见图 1。
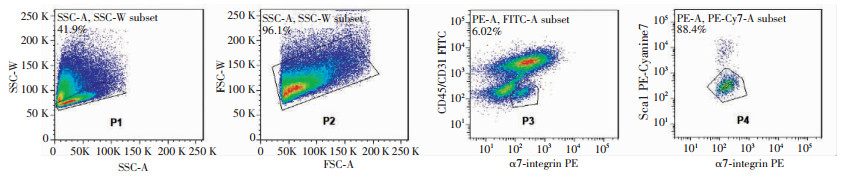
|
| P1和P2是在FSC /SSC散点图中设门圈活细胞群,排除凋亡细胞和碎片;P3黑框内细胞群是表面标记为CD45-/CD31-/ɑ7-integrin+的细胞,P4黑框内的细胞群是在P3基础上选取的表面标记为Sca-1-/ɑ7-integrin+细胞群即静止肌卫星细胞 图 1 肌卫星细胞细胞流式分选策略结果 |
2.2 骨骼肌卫星细胞的免疫荧光鉴定
Pax7蛋白为肌卫星细胞特有的转录因子,定位于胞核,是目前用于识别或鉴定静止卫星细胞最可靠的指标。分选的细胞经贴壁后行Pax7荧光染色同时以DAPI标记细胞核,Pax7在细胞核中阳性表达。证明分选出的细胞为肌卫星细胞,见图 2。

|
| Dapi为分选细胞的细胞核染色;Pax7、Desmin均为卫星细胞特异标记蛋白免疫荧光染色;Merge为Dapi与Pax7以及Desmin的融合图像 图 2 卫星细胞Pax7及Desmin染色鉴定结果 |
中间丝蛋白Desmin是肌原性前体细胞标志分子。本研究发现Desmin在细胞胞浆中阳性表达,可进一步确认分选出的细胞为肌卫星细胞,见图 2。
2.3 肌卫星细胞成肌诱导分化培养及免疫荧光鉴定分选的肌卫星细胞在增殖培养基中培养1 d后细胞完全贴壁,细胞生长状态良好,其中少量细胞开始分化(图 3A);第3天更换分化培养基,2 d后由肌卫星细胞增殖分化而来的成肌细胞进一步分化,细胞相互融合(图 3B);分化培养4~5 d后,大量肌管形成,生长状态良好,并排列成束,部分肌管可观察到自发性跳动(图 3C)。

|
| 分选的肌卫星细胞增殖培养1 d;b:卫星细胞分化培养3 d;c:卫星细胞分化培养4~5 d;Dapi:诱导分化后的肌管细胞核染色;eMHC:诱导分化的肌管胚胎肌球蛋白重链荧光染色;Merge:Dapi与eMHC叠加后形成的融合图像 图 3 肌卫星细胞成肌管诱导分化培养及eMHC染色结果 |
胚胎肌球蛋白重链(embryonic myosin,eMHC)是新生肌纤维特有的结构蛋白,分化培养至肌管形成后行eMHC免疫荧光染色,同时行DAPI染色细胞核,呈eMHC阳性表达且可见多核肌纤维,见图 3。
2.4 不同年龄小鼠骨骼肌卫星细胞数量比较应用上述方法,分选了来自青年、成年和老年小鼠骨骼肌的静止肌卫星细胞,并计数了单位质量骨骼肌组织内卫星细胞数量,结果显示:青年,成年到老年小鼠骨骼肌组织中静止卫星细胞数量呈现逐步下降的趋势,统计分析见表 1。
| 组别 | 双侧后肢肌肉湿质量/g | 骨骼肌卫星细胞数/万 | 肌肉卫星细胞数/万·g-1 |
| 年轻组 | 1.12±0.04 | 33.86±3.47a | 29.85±2.00a |
| 成年组 | 2.89±0.40 | 16.23±2.10 | 8.76±1.78 |
| 老年组 | 3.20±0.17 | 5.53±0.56a | 1.94±0.05a |
| a:P < 0.05, 与成年组比较 | |||
2.5 老年小鼠骨骼肌卫星细胞分化能力改变
成肌细胞融合形成肌管后行MHC和DAPI染色,照片重叠后情况如图 3所示。成肌细胞融合指数定义为:成肌细胞融合指数=含2细胞核以上细胞数/所有细胞数目,常作为衡量成肌细胞分化融合形成肌管能力的指标。统计分析结果显示老年,成年小鼠骨骼肌卫星细胞的肌管融合指数及5、10核以上中大肌管比例,老年组,成年组卫星细胞的肌管融合指数分别为(20.3±1.1)%,(45.7±2.6)%;5核、10核以上中大肌管比例:老年组(9.6±0.3)%,(1.2±0.2)%,成年组(15.5±1.4)%,(5.6±0.6)%。
3 讨论FACS被认为是一种强大而可靠的细胞分离方法,可从新鲜离散的混合组织细胞中分离获取目标细胞。在本研究中,我们应用流式细胞技术,依据细胞表面标记来分选静止肌卫星细胞;所用的细胞表面标记包括ɑ7-Integrin、CD31,CD45以及Sca1[14]。选用CD45,CD31和Sca-1作为肌卫星细胞阴性排除标记,其中CD31是内皮细胞的标记物[15],CD45是血源性细胞的标记,Sca-1则是内皮细胞和间质细胞的共同标志物[16];这3组标志物可将离散骨骼肌细胞群体内的血细胞以及成纤维细胞等非肌原性细胞排除在外。ɑ7-intergrin主要表达于静止卫星细胞,其阳性细胞具有很强的生肌活性,在损伤等刺激后可被迅速激活并有效地进行肌纤维损伤后的修复再生[14, 17]。通过表面标记CD45-/ CD31-/Sca-1-/ ɑ7-intergrin+细胞分选方案,我们在数小时内获取了高纯度的静止卫星细胞,分选所得的细胞约占所有单核细胞的2%~3%。分选细胞通过肌原性标志分子Pax7、Desmin鉴定得到确认,Pax7蛋白是维持肌卫星细胞干细胞属性的特有转录因子,是目前用于识别或鉴定静止卫星细胞最可靠的指标[18],中间丝蛋白Desmin也是肌原性前体细胞标志分子,并为肌卫星细胞所特有[19-20]。本研究中分选的细胞95%以上细胞呈Pax7、Desmin阳性表达。胚胎肌球蛋白重链(embryonic myosin,eMHC)是新生肌纤维特有的结构蛋白[21-22],经过肌管分化的功能实验,分选细胞表现了良好的肌原性分化能力,可分化形成典型的肌管结构,并表达eMHC蛋白。无菌条件下分选的ɑ7-intergrin+细胞群体能进一步培养并呈现良好活性,也说明能用于相关的干细胞增殖分化研究。与传统的MSC分离方法相比,FACS可快速、高效,高纯度的获取静止卫星细胞。传统差速贴壁法或单肌纤维培养法细胞获取MSC不仅周期较长,更不适用于静止卫星细胞的分离。差速贴壁法是基于激活的卫星细胞(成肌细胞)与成纤维细胞之间的粘附差异,逐步排除群体内的成纤维细胞[23],单根肌纤维培养过程中常伴有卫星细胞的活化以及其他组织细胞的出现[24]。故这些方法主要用于激活的卫星细胞或成肌细胞的分离,不能获取静止卫星细胞。
肌卫星细胞是骨骼肌最主要的干细胞,具有增殖分化以及自我更新等潜能,出生后至成年,由于骨骼肌仍处于生长发育期,骨骼肌内MSC数量较多,功能活跃,在成年有报道占全部肌肉细胞的2%~5%[25]。伴随年龄的增长,肌肉中静止卫星细胞的功能和数量逐渐下降。本研究利用免疫荧光等技术对不同年龄段小鼠静止卫星细胞进行了分离,并对不同鼠龄小鼠静止卫星细胞数量以及老年小鼠肌管融合水平进行了统计分析。实验结果显示静止卫星细胞数量在青年,成年及老年小鼠中呈现明显的下降趋势,此项研究结果与文献[26-27]研究结果基本一致,此外,与成年小鼠相比,老年小鼠来源的骨骼肌卫星细胞肌管融合指数以及大肌管比例明显下降,其差异有统计学意义。
综上所述,本研究通过FACS技术结合多重免疫荧光标记(CD45-/ CD31-/Sca-1-/ ɑ7-intergrin+)对静止卫星细胞成功高效地分离及体外诱导分化培养与传统细胞分离方法及双阳性卫星细胞标记流式分选方案相比,大大减小了细胞分离纯化过程中体外环境对干细胞微环境的影响,同时一种阳性标记物的选择也大幅度减小了多重染色标记对卫星细胞成肌管分化的影响。然而,流式细胞技术也有其局限性,其分选的纯度会受很多因素影响,分选纯度是受多种因素制约的,纯度不会达到100%[28]。因此还需对分选的细胞进行纯化处理,从而为卫星细胞代谢机制的研究提供良好的细胞基础。
| [1] | DUMONT N A, BENTZINGER C F, SINCENNES M C, et al. Satellite cells and skeletal muscle regeneration[J]. Compr Physiol, 2015, 5(3): 1027–1059. DOI:10.1002/cphy.c140068 |
| [2] | PETRALIA R S, MATTSON M P, YAO P J. Aging and longevity in the simplest animals and the quest for immortality[J]. Ageing Res Rev, 2014, 16: 66–82. DOI:10.1016/j.arr.2014.05.003 |
| [3] | SO W K, CHEUNG T H. Molecular regulation of cellular quie- scence: a perspective from adult stem cells and its niches[J]. Methods Mol Biol, 2018, 1686: 1–25. DOI:10.1007/978-1-4939-7371-2_1 |
| [4] | LIU L, RANDO T A. Manifestations and mechanisms of stem cell aging[J]. J Cell Biol, 2011, 193(2): 257–266. DOI:10.1083/jcb.201010131 |
| [5] | FISHER A L. Of worms and women: sarcopenia and its role in disability and mortality[J]. J Am Geriatr Soc, 2004, 52(7): 1185–1190. DOI:10.1111/j.1532-5415.2004.52320.x |
| [6] | SOUSA-VICTOR P, GUTARRA S, GARC A-PRAT L, et al. Geriatric muscle stem cells switch reversible quiescence into senescence[J]. Nature, 2014, 506(7488): 316–321. DOI:10.1038/nature13013 |
| [7] | PASUT A, OLEYNIK P, RUDNICKI M A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry[J]. Methods Mol Biol, 2012, 798: 53–64. DOI:10.1007/978-1-61779-343-1_3 |
| [8] | GROMOVA A, TIERNEY M T, SACCO A. FACS-based sate-llite cell isolation from mouse hind limb muscles[J]. Bio Protoc, 2015, 5(16): pii: e1558. |
| [9] | MOZZETTA C. Isolation and culture of muscle stem cells[J]. Methods Mol Biol, 2016, 1480: 311–322. DOI:10.1007/978-1-4939-6380-5_27 |
| [10] | LATROCHE C, WEISS-GAYET M, GITIAUX C, et al. Cell sorting of various cell types from mouse and human skeletal muscle[J]. Methods, 2018, 134-135: 50–55. DOI:10.1016/j.ymeth.2017.12.013 |
| [11] |
薄海, 王逊, 陈啟祥, 等. 耐力运动促进骨骼肌卫星细胞线粒体能量代谢及其对成肌分化的影响[J].
中国运动医学杂志, 2012, 31(5): 402–408, 426.
BO H, WANG X, CHEN Q X, et al. Endurance exercise promotes mitochondrial bioenergetic metabolism in muscle satellite cells and its effect on the myogenic differentiation[J]. Chin J Sports Med, 2012, 31(5): 402–408, 426. DOI:10.16038/j.1000-6710.2012.05.007 |
| [12] | MOTOHASHI N, ASAKURA Y, ASAKURA A. Isolation, culture, and transplantation of muscle satellite cells[J]. J Vis Exp, 2014(86). DOI:10.3791/50846 |
| [13] | LIU L, CHEUNG T H, CHARVILLE G W, et al. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting[J]. Nat Protoc, 2015, 10(10): 1612–1624. DOI:10.1038/nprot.2015.110 |
| [14] | JOE A W, YI L, NATARAJAN A, et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis[J]. Nat Cell Biol, 2010, 12(2): 153–163. DOI:10.1038/ncb2015 |
| [15] | CASTIGLIONI A, HETTMER S, LYNES M D. Isolation of progenitors that exhibit myogenic/osteogenic bipotency in vitro by fluorescence-activated cell sorting from human fetal muscle[J]. Stem Cell Reports, 2014, 14, 2(1): 92–106. DOI:10.1016/j.stemcr.2013.12.006 |
| [16] | ASAKURA A, SEALE P, GIRGIS-GABARDO A, et al. Myogenic specification of side population cells in skeletal muscle[J]. J Cell Biol, 2002, 159(1): 123–134. DOI:10.1083/jcb.200202092 |
| [17] | MOTOHASHI N, ASAKURA Y, ASAKURA A. Isolation, culture, and transplantation of muscle satellite cells[J]. J Vis Exp, 2014(86). DOI:10.3791/50846. |
| [18] | SEALE P, SABOURIN L A, GIRGIS-GABARDO A, et al. Pax7 is required for the specification of myogenic satellite cells[J]. Cell, 2000, 102(6): 777–786. DOI:10.1016/s0092-8674(00)00066-0 |
| [19] | TRAPECAR M, KELC R, GRADISNIK L, et al. Myogenic progenitors and imaging single-cell flow analysis: a model to study commitment of adult muscle stem cells[J]. J Muscle Res Cell Motil, 2014, 35(5-6): 249–257. DOI:10.1007/s10974-014-9398-5 |
| [20] | BOCKHOLD K J, ROSENBLATT J D, PARTRIDGE T A. Aging normal and dystrophic mouse muscle: analysis of myogenicity in cultures of living single fibers[J]. Muscle Nerve, 1998, 21(2): 173–183. DOI:10.1002/(sici)1097-4598(199802)21:2<173::aid-mus4>3.3.co;2-t |
| [21] | GIZAK A, WROBEL E, MORACZEWSKI J, et al. Changes in subcellular localization of fructose 1, 6-bisphosphatase during differentiation of isolated muscle satellite cells[J]. FEBS Lett, 2006, 580(17): 4042–4046. DOI:10.1016/j.febslet.2006.06.042 |
| [22] | ZAMMIT P S, GOLDING J P, NAGATA Y, et al. Muscle satellite cells adopt divergent fates: a mechanism for self-renewal[J]. J Cell Biol, 2004, 166(3): 347–357. DOI:10.1083/jcb.200312007 |
| [23] | SABOURIN L A, GIRGIS-GABARDO A, SEALE P, et al. Reduced differentiation potential of primary MyoD-/- myogenic cells derived from adult skeletal muscle[J]. J Cell Biol, 1999, 144(4): 631–643. DOI:10.1083/jcb.144.4.631 |
| [24] | ARCHACKA K, POZZOBON M, REPELE A, et al. Cultur-ing muscle fibres in hanging drop: a novel approach to solve an old problem[J]. Biol Cell, 2014, 106(2): 72–82. DOI:10.1111/boc.201300028 |
| [25] | BRACK A S, RANDO T A. Tissue-specific stem cells: lessons from the skeletal muscle satellite cell[J]. Cell Stem Cell, 2012, 10(5): 504–514. DOI:10.1016/j.stem.2012.04.001 |
| [26] | JONES D L, RANDO T A. Emerging models and paradigms for stem cell ageing[J]. Nat Cell Biol, 2011, 13(5): 506–512. DOI:10.1038/ncb0511-506 |
| [27] | BIAN A, NEYRA J A, ZHAN M, et al. Klotho, stem cells, and aging[J]. Clin Interv Aging, 2015, 10: 1233–1243. DOI:10.2147/CIA.S84978 |
| [28] | FORD L B, HANSELL C A, NIBBS R J. Using fluorescent chemokine uptake to detect chemokine receptors by fluorescent activated cell sorting[J]. Methods Mol Biol, 2013, 1013: 203–214. DOI:10.1007/978-1-62703-426-5_13 |



