2. 100050 北京,中国疾病预防控制中心职业卫生与中毒控制所化学污染与健康安全重点实验室;
3. 510080 广州,广州市环境污染与健康风险评价重点实验室;
4. 266021 山东 青岛,青岛大学公共卫生学院
2. Key Laboratory of Chemical Safety and Health, National Institute of Occupational Health and Poison Control, Chinese Center for Disease Control and Prevention, Beijing, 100050;
3. Guangzhou Key Laboratory of Environmental Pollution and Health Risk Assessment, Guangzhou, Guangdong Province, 510080;
4. School of Public Health, Qingdao University, Qingdao, Shandong Province, 266021, China
炭黑颗粒是大气细颗粒物的重要组分之一,其污染所致健康问题已日益严峻。肺脏是颗粒物暴露最直接的靶点,纳米级颗粒易通过呼吸道各级屏障深达肺泡,诱导肺功能损伤。以往研究提示颗粒物的毒作用机制主要涉及炎症反应[1],且由于颗粒物粒径大小和暴露途径的差异其所致生物学效应也有较大区别。动物实验[2-4]和体外研究证实[5-6],纳米级炭黑颗粒暴露可诱导持续的炎症反应。但也有研究表明[7-9],气管滴注或短时间吸入炭黑未诱导动物急性期症状和炎症反应的发生。课题组前期发现,长期暴露于高浓度、单纯炭黑可导致工人肺功能下降,诱导循环系统炎性细胞因子水平[10]和嗜酸性粒细胞百分比增加[11],推测外周血中炎性细胞因子和嗜酸性粒细胞可作为高浓度炭黑暴露所致肺部炎症反应的早期敏感标志物。课题组进一步应用动式吸入染毒方式将小鼠暴露于高浓度(30 mg/m3)纳米级炭黑气溶胶,发现颗粒物沉积于肺组织中,可诱导肺组织的炎性改变,且血清和肺组织中炎性因子水平均显著高于对照组[10, 12]。但是,未明确吸入低浓度炭黑颗粒能否诱导急性期症状及炎症反应,也未探讨肺组织和外周血炎性改变的相关性。
为了研究低浓度纯炭黑颗粒暴露所致肺脏毒性,本研究选取乙炔炭黑(粒径30~50 nm,纯度99.7%以上),通过建立低浓度纳米级炭黑气溶胶小鼠吸入模型,检测炭黑颗粒在肺脏的沉积、肺脏的病理组织学及超微结构改变、肺组织及外周血中急性期蛋白[C-反应蛋白(c-reactive protein, CRP)、血清淀粉样蛋白A(serum amyloid A protein, SAA)]、炎性细胞因子[白介素-1β(interleukin-1β, IL-1β)、白介素-6(interleukin-6, IL-6)、白介素-8(interleukin-8, IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α)]、及免疫细胞(单核/巨噬细胞、淋巴细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)等,探讨反复吸入低浓度纯纳米级炭黑对肺和外周血炎性水平的影响,并验证外周血中炎性生物标志物反映肺组织炎性损伤的准确性。
1 材料与方法 1.1 材料 1.1.1 仪器气溶胶发生装置及吸入染毒柜系中国北京慧荣和科技发展有限公司产品; 粒径谱仪系美国TSI公司产品;切片机系德国Leica公司产品;显微镜系日本Nikon公司产品;透射电镜系德国Leica公司产品;流式细胞仪系美国BD公司产品;血细胞分析仪系日本SYSMEX公司产品;酶标仪系美国BioTek公司产品;甩片机系美国Thermo公司产品。
1.1.2 试剂所用试剂为:炭黑颗粒(和兴化学工业有限公司,中国);IL-1β、IL-6、IL-8、TNF-α多因子检测试剂盒(BD公司,美国);急性期蛋白CRP和SAA酶联免疫检测试剂盒(RD公司,美国);Diff Quik染色液(北京普博斯生物有限公司,中国);其余均为国产生化试剂。
1.2 方法 1.2.1 实验动物分组选取72只8周龄、体质量20~25 g、健康雄性SPF级C57BL/6小鼠[购自北京斯贝福实验动物科技有限公司,合格证号:SCXK(京)2011-0004]。所有动物购入后在SPF级动物房内适应1周,除染毒外其余时间小鼠可自由饮食饮水。饲养条件为温度22~26 ℃、湿度45%~55%、明暗光照12 h/12 h。按体质量用区组随机化将小鼠分为对照组、7 d染毒组、14 d染毒组、14 d染毒恢复组,对照组36只,而其余每组各12只。称量小鼠体质量,并密切观察小鼠的行为活动及精神状态。末次染毒24 h或恢复14 d后,每组取8只鼠,取血后进行急性期蛋白、炎性细胞因子及免疫细胞检测;选小鼠左肺行支气管肺泡灌洗,收集灌洗液进行急性期反应蛋白、炎性细胞因子、及免疫细胞的检测;解剖取小鼠右肺,称重后进行肺组织匀浆急性期蛋白及炎性细胞因子的检测。每组取3只鼠行全身灌注固定,解剖取肺进行病理组织学检查及病理损伤评分。每组取1只鼠行肺局部灌注,电镜观察肺组织超微结构。
1.2.2 动式吸入染毒、及炭黑气溶胶浓度和粒径监测将炭黑颗粒加入气溶胶发生装置,开启染毒通风及配气系统并与发生器连接,调控发生器面板参数(气体流量为30 L/min、电刷转速为1 000 r/min、进样速度为0.03 mm/min),待气溶胶浓度稳定后将小鼠置于柜中开始吸入染毒。每天染毒6 h(8:00-14:00),连续染毒7 d和14 d,对照组给予相同时间的过滤空气,而恢复组于染毒14 d后静养14 d。染毒结束后,关闭气溶胶发生系统停止吸入染毒,打开柜门后取出动物。吸入染毒14 d内,每天每隔30 min用称重法测定染毒柜内炭黑颗粒的浓度。用TSI公司3938粒径谱仪监测颗粒物的粒径分布,通过测量在加速气流中不同大小粒子通过检测区域的飞行时间来测量粒子的空气动力学粒径,其测量范围为2.5~1 000 nm,总共167个通道,采样流量设为5.0 L/min。
1.2.3 血常规分析及血清收集小鼠麻醉后行腹主动脉采血,抗凝血混匀后行血常规分析免疫细胞的变化;不抗凝血于37 ℃静置1 h后,1 500 r/min,离心10 min,收集上层血清,分别用于急性期蛋白及细胞因子的检测。
1.2.4 ELISA法检测血清CRP和SAA水平① 加样:每孔加入预先稀释的血清样本和标准品,阴性对照孔不加样本及酶标试剂,封板,室温孵育2 h;②洗涤:弃掉孔内液体,每孔加洗涤液,重复洗3次,每次1 min;②加酶:每孔加入CRP或SAA结合物,封板,室温孵育2 h;④洗涤:同上;⑤显色:每孔加入底物液,于室温下避光孵育30 min;⑥终止:每孔加入终止液,终止反应;⑦测定:终止后30 min内,用酶标仪在450 nm波长条件下检测光密度值D(450),根据标准品各孔吸光度值绘制标准曲线,并计算各样本浓度值。
1.2.5 液态悬浮芯片法检测血清细胞因子① 加捕获微球:加入4种细胞因子混合的捕获微球,涡旋混匀;②加样:加入预先准备的标准品和样品,室温孵育1 h;③加PE标记抗体:加入预先稀释的PE标记抗体,轻柔混匀后室温孵育2 h;④洗涤:加入洗涤液清洗样本;⑤测定:重悬后行流式细胞仪检测。
1.2.6 支气管肺泡灌洗液的收集及检测小鼠麻醉后,选左肺行支气管肺泡灌洗术,用PBS反复灌洗3次,将回收的灌洗液于1 500 r/min,离心10 min,收集上清后用于急性期蛋白和细胞因子水平的检测。余下的细胞沉淀重悬,甩片后晾干,用Diff Quik A、B、C染色液依次染色,并依据BOURDON等[13]方法对肺泡灌洗液中的免疫细胞进行分类和计数。
1.2.7 肺组织匀浆急性期蛋白、及炎性细胞因子的测定解剖取右侧肺脏,称质量后计算肺脏器系数;将肺组织制备成10%组织悬液,通过测定蛋白浓度以标定组织匀浆中急性期蛋白及细胞因子的含量。
1.2.8 肺组织病理学观察每组3只小鼠麻醉后行全身灌注和固定,解剖取肺脏,经脱水、透明后制成石蜡组织块,由专业技师进行切片及HE染色,并由病理科医生观察肺脏组织学变化。医生对研究分组情况未知,切片采用流水编号,每张片子镜下观察6个视野,对肺损伤的病变程度进行评分。
1.2.9 肺组织超微结构观察每组1只小鼠麻醉后行肺局部灌注,制成体积约1 mm3组织块,于4 ℃保存和固定。肺组织块经漂洗、固定、染色、脱水、切片、再染色后,用透射电镜观察肺组织超微结构。
1.3 统计学方法采用SPSS 20.0软件分析数据。所有数据均符合正态分布,采用x±s表示,且各组数据满足方差齐性结果,两组比较采用t检验,相关分析采用Pearson相关分析。统计学检验均采用双侧检验。检验水准:α=0.05。
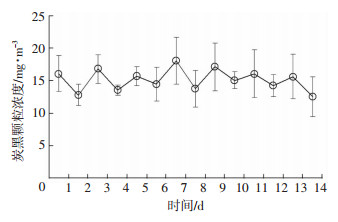
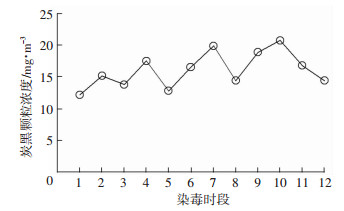
2 结果 2.1 染毒装置内的外暴露评价染毒14 d及染毒每天12个时间点,炭黑气溶胶的浓度波动较小,染毒14 d浓度为(15.16±1.66)mg/m3(图 1),染毒第1天浓度为(16.09±2.77)mg/m3(图 2),说明吸入染毒系统炭黑颗粒的浓度具有较好的稳定性和可重复性。用粒径谱仪监测染毒柜内炭黑颗粒的粒径分布,结果显示颗粒的粒径分布较稳定,其中83.66%颗粒物粒径小于400 nm,仅1.28%颗粒物粒径大于800 nm。
|
| 图 1 染毒14 d染毒装置内炭黑气溶胶浓度的动态变化 |
|
| 1、2、3、4、5、6、7、8、9、10、11、12分别代表采样时间段8:00-8:30、8:30-9:00、9:00-9:30、9:30-10:00、10:00-10:30、10:30-11:00、11:00-11:30、11:30-12:00、12:00-12:30、12:30-13:00、13:00-13:30、13:30-14:00 图 2 染毒第1天不同时段染毒装置内炭黑气溶胶浓度的动态变化 |
2.2 炭黑暴露对小鼠一般状况、体质量及肺脏器系数的影响
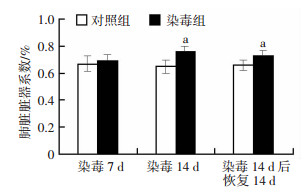
小鼠吸入炭黑气溶胶7、14 d后,行为活动度略降低,饮食饮水量也轻微下降,精神状态稍差。而恢复组小鼠活动度和饮食饮水量均恢复正常,精神状态良好。染毒7、14 d及恢复期,小鼠体质量与对照组相比差异均无统计学意义。由图 3可见,染毒7 d组小鼠肺脏器系数与对照组相比差异无统计学意义,而染毒14 d组肺脏器系数(0.76±0.04)%显著大于对照组(0.65± 0.05)%(P < 0.05),表明随着染毒时间增加小鼠肺质量增加,而在恢复期小鼠肺脏器系数(0.73±0.04)%仍大于对照组(0.66± 0.04)%,差异有统计学意义(P < 0.05),说明炭黑颗粒对肺脏的损伤是不可逆的。
|
| a:P < 0.05,与对照组比较 图 3 纳米级炭黑暴露对小鼠肺脏器系数的影响 |
2.3 炭黑暴露对小鼠肺脏及外周血急性期反应蛋白及炎性细胞因子的影响
由表 1可见,染毒7、14 d组小鼠肺组织匀浆中CRP浓度分别比对照组升高了0.43、0.52倍,SAA浓度分别比对照组升高了0.31、0.47倍,IL-6浓度分别比对照组升高了2.27、3.84倍,IL-8浓度分别比对照组升高了0.67、1.37倍,TNF-α浓度分别比对照组升高了1.10、1.48倍,上述指标的变化差异均有统计学意义(P < 0.05),且这些指标在肺泡灌洗液和血清中也有类似改变。然而,IL-1β水平暴露组与对照组相比差异无统计学意义。恢复组小鼠肺组织匀浆及灌洗液中CRP、SAA、IL-6、IL-8水平均有所下降,但仍高于对照组(P < 0.05),而血清中仅IL-6和IL-8水平高于对照组(P < 0.05)。
| 指标 | 染毒7 d | 染毒14 d | 染毒14 d后恢复14 d | ||||||||
| 对照组 | 染毒组 | P | 对照组 | 染毒组 | P | 对照组 | 染毒组 | P | |||
| 肺组织匀浆/pg·mg-1 | |||||||||||
| CRP | 6.92±0.69 | 9.93±1.06 | < 0.001 | 6.93±0.90 | 10.53±1.05 | < 0.001 | 6.96±0.95 | 8.09±1.14 | 0.049 | ||
| SAA | 8.50±1.50 | 11.16±1.51 | < 0.003 | 8.46±1.23 | 12.40±1.64 | < 0.001 | 8.40±1.19 | 11.35±1.85 | 0.002 | ||
| IL-1β | 10.29±2.03 | 11.97±2.35 | 0.147 | 10.85±1.89 | 12.84±2.33 | 0.081 | 10.88±2.32 | 11.89±2.56 | 0.425 | ||
| IL-6 | 2.06±0.54 | 6.73±2.49 | < 0.001 | 2.12±0.62 | 10.26±4.40 | < 0.001 | 2.19±0.65 | 5.86±2.27 | 0.001 | ||
| IL-8 | 25.60±7.53 | 42.65±9.55 | 0.001 | 24.26±7.73 | 57.50±15.66 | < 0.001 | 23.86±9.03 | 41.21±14.18 | 0.011 | ||
| TNF-α | 0.80±0.24 | 1.68±0.36 | < 0.001 | 0.84±0.23 | 2.08±0.59 | < 0.001 | 0.93±0.29 | 1.49±0.46 | 0.125 | ||
| 支气管肺泡灌洗液/pg·mL-1 | |||||||||||
| CRP | 5.06±0.71 | 7.72±1.09 | < 0.001 | 5.00±0.79 | 8.03±1.15 | < 0.001 | 5.02±0.76 | 6.95±1.00 | 0.001 | ||
| SAA | 3.97±1.06 | 5.87±1.66 | 0.016 | 3.95±1.09 | 6.63±1.68 | 0.002 | 3.90±0.99 | 5.51±1.42 | 0.020 | ||
| IL-1β | 0.57±0.16 | 0.75±0.19 | 0.062 | 0.55±0.15 | 0.78±0.23 | 0.080 | 0.56±0.14 | 0.64±0.17 | 0.315 | ||
| IL-6 | 2.12±0.57 | 4.36±1.28 | < 0.001 | 2.23±0.59 | 6.10±2.05 | < 0.001 | 2.25±0.69 | 4.11±1.38 | 0.004 | ||
| IL-8 | 2.11±0.71 | 4.38±0.86 | < 0.001 | 2.23±0.67 | 5.16±0.97 | < 0.001 | 2.13±0.70 | 4.24±0.92 | < 0.001 | ||
| TNF-α | 1.91±0.44 | 3.87±0.96 | < 0.001 | 1.97±0.44 | 5.16±1.22 | < 0.001 | 2.09±0.70 | 2.68±0.80 | 0.140 | ||
| 血清 | |||||||||||
| CRP/μg·mL-1 | 8.54±0.83 | 11.51±1.30 | < 0.001 | 8.69±0.90 | 13.03±1.38 | < 0.001 | 8.63±0.68 | 9.59±1.01 | 0.078 | ||
| SAA/ng·mL-1 | 12.68±1.99 | 16.17±2.49 | 0.008 | 12.77±2.21 | 19.03±2.76 | < 0.001 | 12.75±2.09 | 14.04±1.96 | 0.224 | ||
| IL-1β /pg·mL-1 | 2.56±0.93 | 3.05±0.88 | 0.298 | 2.63±1.04 | 3.13±1.17 | 0.378 | 2.61±0.98 | 2.79±0.97 | 0.718 | ||
| IL-6/pg·mL-1 | 17.81±4.70 | 36.54±6.93 | < 0.001 | 19.01±5.25 | 51.42±13.92 | < 0.001 | 19.17±5.91 | 33.09±10.15 | 0.005 | ||
| IL-8/pg·mL-1 | 89.06±15.44 | 190.72±53.03 | < 0.001 | 90.31±13.12 | 243.43±87.11 | < 0.001 | 91.79±15.95 | 171.82±58.29 | 0.002 | ||
| TNF-α/pg·mL-1 | 12.03±3.65 | 19.09±3.87 | 0.002 | 13.05±3.78 | 22.75±4.15 | < 0.001 | 13.54±3.52 | 16.73±3.45 | 0.089 | ||
相关分析结果显示,CRP、SAA、IL-6、IL-8、TNF-α在肺组织匀浆和血清中相关系数r分别为0.890、0.811、0.879、0.765、0.865,在肺泡灌洗液和血清中相关系数r分别为0.821、0.841、0.787、0.846,0.841,在肺组织匀浆和肺泡灌洗液中相关系数r分别0.856、0.956、0.984、0.962、0.985,以上结果说明肺泡灌洗液和肺组织匀浆炎性指标的变化具有较好的一致性,且外周血中急性期蛋白及炎性细胞因子的变化可以较好地反映肺的炎性改变。
2.4 炭黑暴露对小鼠肺泡灌洗液及外周血中免疫细胞的影响由表 2可见,染毒7、14 d组小鼠肺泡灌洗液中嗜中性粒细胞百分比分别比对照组升高了2.10、2.33倍,嗜酸性粒细胞百分比分别比对照组升高了1.89、1.64倍,巨噬细胞百分比分别比对照组降低了6%和8%,且上述指标的变化差异均有统计学意义(P < 0.05),而淋巴细胞和嗜碱性粒细胞百分比未见明显变化,且在血液中这些免疫细胞也有类似改变。恢复期灌洗液中嗜中性粒细胞和嗜酸性粒细胞百分比有所降低,仍高于对照组(P < 0.05),巨噬细胞百分比仍低于对照组(P < 0.05),而外周血中仅嗜酸性粒细胞百分比高于对照组(P < 0.05)。
| 指标 | 染毒7 d | 染毒14 d | 染毒14 d后恢复14 d | ||||||||
| 对照组 | 染毒组 | P | 对照组 | 染毒组 | P | 对照组 | 染毒组 | P | |||
| 肺泡灌洗液细胞学分析 | |||||||||||
| 巨噬细胞(%) | 86.31±1.12 | 80.84±0.73 | 0.002 | 85.94±1.91 | 79.03±0.55 | 0.004 | 84.93±0.97 | 81.66±0.39 | 0.006 | ||
| 淋巴细胞(%) | 10.44±0.87 | 10.76±1.93 | 0.806 | 10.04±1.16 | 10.71±1.58 | 0.581 | 10.54±0.88 | 10.71±1.09 | 0.841 | ||
| 嗜中性粒细胞(%) | 1.65±0.25 | 5.11±1.43 | 0.015 | 1.72±0.39 | 5.73±1.25 | 0.006 | 1.80±0.62 | 3.75±0.49 | 0.013 | ||
| 嗜酸性粒细胞(%) | 0.70±0.23 | 2.02±0.45 | 0.011 | 0.89±0.20 | 2.35±0.53 | 0.011 | 0.75±0.13 | 1.69±0.43 | 0.024 | ||
| 嗜碱性粒细胞(%) | 0.00±0.00 | 0.06±0.11 | 0.374 | 0.00±0.00 | 0.06±0.11 | 0.374 | 0.00±0.00 | 0.07±0.11 | 0.374 | ||
| 血细胞分析 | |||||||||||
| 单核细胞(%) | 2.49±0.48 | 1.63±0.16 | 0.044 | 2.19±0.29 | 1.61±0.61 | 0.040 | 2.08±0.32 | 1.84±0.20 | 0.341 | ||
| 淋巴细胞(%) | 74.70±1.43 | 72.59±1.48 | 0.151 | 74.35±1.96 | 70.48±2.17 | 0.083 | 74.27±1.78 | 73.14±2.03 | 0.511 | ||
| 嗜中性粒细胞(%) | 21.54±1.05 | 24.08±1.75 | 0.098 | 22.50±2.16 | 25.82±2.05 | 0.126 | 22.71±2.14 | 23.19±1.92 | 0.788 | ||
| 嗜酸性粒细胞(%) | 0.62±0.25 | 1.68±0.14 | 0.003 | 0.58±0.12 | 1.97±0.16 | 0.001 | 0.56±0.20 | 1.62±0.25 | 0.005 | ||
| 嗜碱性粒细胞(%) | 0.02±0.02 | 0.02±0.01 | 1.000 | 0.03±0.01 | 0.03±0.01 | 0.725 | 0.03±0.01 | 0.03±0.02 | 1.000 | ||
相关分析结果显示,单核/巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞在肺泡灌洗液和外周血的相关系数r分别为0.665、0.673、0.886,以上结果说明肺泡灌洗液和外周血中单核/巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞的变化具有较好的一致性。
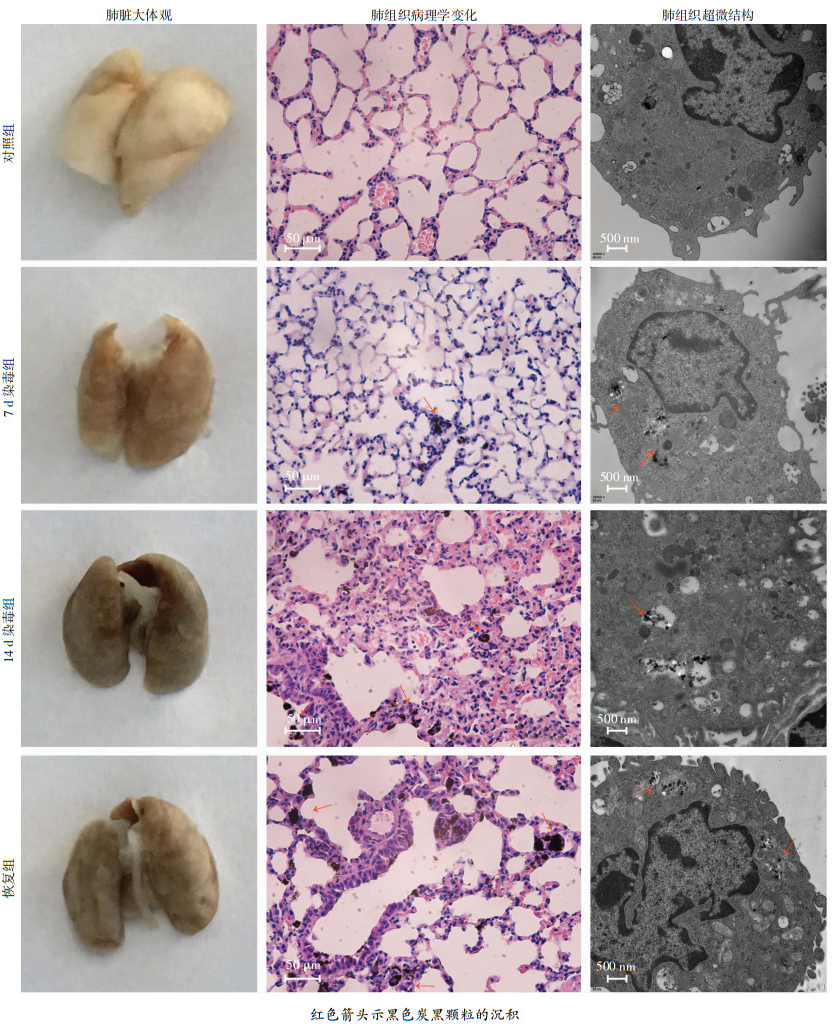
2.5 炭黑暴露对小鼠肺脏组织结构及超微结构的影响炭黑吸入染毒不同时间阶段小鼠肺组织的外观发生较为显著改变(图 4),肉眼可见对照肺组织呈白色,染毒肺组织呈灰黑色,随着染毒时间的延长,肺组织黑色逐渐加深,说明随染毒时间增加,吸入炭黑量增多,炭黑颗粒在肺组织中的沉积增多。镜下可见对照组细支气管管壁结构完整,肺泡分布均匀,管腔内无渗出物;7 d染毒组肺组织中可见细支气管腔及肺泡腔内有少量黑色颗粒物沉积,肺泡腔和肺间隔中可见少量吞噬黑色颗粒的巨噬细胞;14 d染毒组小鼠细支气管壁及肺泡壁结构紊乱,肺泡腔和肺间隔可见较多黑色颗粒和吞噬黑色颗粒的巨噬细胞,肺间隔增厚,毛细血管充血,炎性细胞浸润等病理变化,说明吸入炭黑能诱导小鼠肺组织损伤。恢复组小鼠病变程度与14 d染毒组相似,仍观察到支气管腔和肺泡腔有炭黑颗粒分布及炎性细胞浸润,说明吸入炭黑颗粒致肺组织的损伤是不可逆的,也可能是损伤修复时间较长,造成持续的损伤(图 4)。根据肺损伤病理评分标准,7、14 d染毒组及恢复组小鼠肺组织损伤病理评分分别为(3.63±1.13)、(6.83±1.22)、(5.78±1.06)分,明显高于相应对照组[(1.53±0.65)、(1.27±0.73)、(1.46±0.87)分,P < 0.05],说明随染毒时间延长,肺损伤程度加重,且恢复期肺损伤评分未见明显下降。
|
| 红色箭头示黑色炭黑颗粒的沉积 图 4 纳米级炭黑暴露对小鼠肺脏组织结构及超微结构的影响 |
电镜结果显示,对照组肺巨噬细胞内可见初级溶酶体,染毒及恢复组肺巨噬细胞中可见较多初级和次级溶酶体,且在次级溶酶体内存在一些不溶的黑色颗粒,其电子密度与炭黑颗粒一致(图 4)。
3 讨论炭黑颗粒在空气中以单体和聚集体形式存在,其粒径大小可影响其在肺内的沉积部位。颗粒物粒径越小,越易沉降在器官内,比表面积越大,越易造成器官损伤[14]。相对于微米级颗粒,纳米级炭黑颗粒更易诱导细胞毒性和炎症反应,并导致单核细胞吞噬能力下降[15]。本研究将小鼠吸入暴露于15.16 mg/m3纳米级炭黑气溶胶(粒径30~50 nm)7 d,尽管小鼠肺质量及脏器系数未见显著变化,随着染毒时间延长,染毒14 d甚至恢复期小鼠肺脏脏器系数显著高于对照组,提示炭黑颗粒进入肺组织的速率超过了其排出速率,即小鼠肺巨噬细胞吞噬能力下降,不能及时将炭黑颗粒从肺组织中排出也不能被分解,而沉积在肺组织中。从病理学结果也看出,7、14 d染毒小鼠肺组织分布有黑色颗粒,多数沉积在细支气管中,部分沉积于肺泡中,电镜也证实在肺巨噬细胞内可见黑色颗粒。恢复组小鼠肺组织及吞噬细胞内仍存在黑色颗粒,说明吸入炭黑颗粒14 d后短时间(14 d)内不能从肺部清除出去,这些沉积在肺组织中的炭黑颗粒也形成了对肺组织的刺激和炎性损伤的基础。
虽然颗粒物导致健康损害的机制仍不清楚,但持续性炎症反应在其中起着重要作用。炎症反应是机体对各种有害刺激所产生的一种以防御为主的病理反应,包括细胞因子、趋化因子等的产生和释放。这些信号分子使肺上皮细胞和免疫细胞相互作用,引起一系列病理生理反应。此外,急性期蛋白的升高可能与炎症及损伤范围有关。为研究炎性因子与肺部炭黑沉积的关系,本研究应用动式吸入方式将小鼠暴露于纳米级炭黑气溶胶,病理结果已证实炭黑颗粒沉积于肺组织中,可诱导肺组织结构改变及炎性细胞浸润,对外周血和肺组织中细胞因子水平的检测结果表明,吸入炭黑后IL-6、IL-8、TNF-α水平在肺组织匀浆、肺泡灌洗液和血清中均显著升高。一些动物实验和体外研究支持暴露炭黑颗粒可以诱发炎症反应。研究发现,将大鼠暴露15.6 mg/m3炭黑颗粒后,其血清和肺组织中IL-6水平显著升高,病理学也证实肺部有轻度炎症表现,可能是由于炭黑粒径较大,其损伤效应较轻微[3]。VESTERDAL等[4]给小鼠气管滴注24 h后,发现肺组织中多种细胞因子水平升高。STOEGER等[16]也发现,暴露于超细炭黑颗粒24 h后,肺泡灌洗液中IL-1β水平呈剂量依赖性升高,但本研究未发现IL-1β的变化。TOTLANDSDAL等[5]研究表明,超细炭黑颗粒可以诱导IL-6表达和释放。体外研究表明[6],13 nm炭黑颗粒可上调IL-6和TNF-α的表达。KIM等[17]体外研究证实,炭黑颗粒可上调IL-8表达。本研究也发现,吸入炭黑后肺组织及灌洗液中急性期蛋白表达量增加,嗜中性粒细胞比例升高,这与BOURDON等[13]、HUSAIN等[18]气管滴注炭黑颗粒所致肺泡灌洗液结果相一致。通常,正常肺泡灌洗液中吞噬细胞百分比高于85%,淋巴细胞百分比低于12%,嗜酸性粒细胞百分比低于1%,本研究免疫细胞分析结果显示炭黑气溶胶暴露后肺泡灌洗液中除嗜中性粒细胞外,嗜酸性粒细胞数目也明显增加,且嗜酸性粒细胞比例高于正常值(1%),说明这2种细胞均参与炭黑诱导的肺组织炎性损伤过程。此外,本研究也发现,染毒小鼠肺泡灌洗液中巨噬细胞百分比明显低于正常值(85%),BOURDON等[13]气管滴注炭黑后肺泡灌洗液中巨噬细胞比例也低于对照组,推测炭黑颗粒沉积可能会降低巨噬细胞的数量及功能。
然而,也有一些动物实验存相反的结论。研究表明[8],大鼠吸入炭黑颗粒(粒径83.3~87.9 nm)4周,既没有肺部炎症因子的释放,也未观察到肺部毒性的发生,病理也证实炭黑颗粒未诱导呼吸系统炎症反应的发生。另一项研究表明[9],大鼠短时间吸入浓度为10 mg/m3的纳米级炭黑并未观察到IL-6、IL-8、TNF-α等细胞因子的变化。这些生物学效应的差异与炭黑颗粒的纯度、粒径、暴露途径、暴露剂量、暴露时间、及研究对象等多种因素有关。此外,在恢复期,染毒组小鼠肺组织炎性水平有所降低,但是CRP、SAA、IL-6、IL-8及嗜酸性粒细胞比例均明显高于对照组,提示炭黑停止暴露后,由于颗粒物不能排除和降解,其所致肺组织的炎性损伤仍然存在。本研究也证实外周血和肺的炎性指标的变化具有较好的相关性,进而明确外周血中急性期蛋白(CRP、SAA)、炎性细胞因子(IL-6、IL-8、TNF-α)及嗜酸性粒细胞可间接作为炭黑所致肺部炎症反应的早期敏感性标志物。
依据前期作业人群现场炭黑暴露浓度设计动物的吸入暴露剂量,高浓度组为工人暴露浓度的2倍,其可以导致肺组织炎性反应,低浓度组接近作业人群的暴露浓度。本实验结果证实,反复吸入低浓度纳米级炭黑气溶胶后,小鼠肺组织出现了炭黑颗粒沉积及炎性损伤,且肺泡灌洗液炎性因子也发生显著改变。根据剂量累积计算连续接触90 d纳米级炭黑颗粒的有害作用浓度为2.52 mg/m3,考虑到外推的安全系数,说明我国目前职业接触炭黑粉尘的加权平均容许浓度(4 mg/m3)会对呼吸系统造成损伤。此外,本研究采用全身吸入暴露技术,可以较为真实地模拟人类的实际暴露途径,但是无法避免动物经口摄入染毒过程中毛发上沾染的炭黑颗粒,而造成动物二次暴露,使结果可能产生右偏。
综上,本研究探讨反复吸入15.16 mg/m3炭黑气溶胶对小鼠肺组织和外周血炎性水平的影响及相关性,结果显示15.16 mg/m3炭黑可以诱导小鼠肺组织的炎性损伤,以及循环系统炎症反应,炭黑吸入后小鼠外周血中炎性生物标志物(CRP、SAA、IL-6、IL-8、TNF-α、嗜酸性粒细胞)的变化可以准确地反映肺的炎性损伤。
| [1] | HUSSAIN S, SANGTIAN S, ANDERSON S M, et al. Inflammasome activation in airway epithelial cells after multi-walled carbon nanotube exposure mediates a profibrotic response in lung fibroblasts[J]. Part Fibre Toxicol, 2014, 11(1): 28. DOI:10.1186/1743-8977-11-28 |
| [2] | DELFINO R J, SIOUTAS C, MALIK S. Potential role of ultrafine particles in associations between airborne particle mass and cardiovascular health[J]. Environ Health Perspect, 2005, 113(8): 934–946. DOI:10.1289/ehp.7938 |
| [3] | NIWA Y, HIURA Y, SAWAMURA H, et al. Inhalation exposure to carbon black induces inflammatory response in rats[J]. Circ J, 2008, 72(1): 144–149. DOI:10.1253/circj.72.144 |
| [4] | VESTERDAL L K, FOLKMANN J K, JACOBSEN N R, et al. Pulmonary exposure to carbon black nanoparticles and vascular effects[J]. Part Fibre Toxicol, 2010, 7(1): 33. DOI:10.1186/1743-8977-7-33 |
| [5] | TOTLANDSDAL A I, REFSNES M, LÅG M. Mechanisms involved in ultrafine carbon black-induced release of IL-6 from primary rat epithelial lung cells[J]. Toxicol In Vitro, 2010, 24(1): 10–20. DOI:10.1016/j.tiv.2009.09.016 |
| [6] | VAL S, HUSSAIN S, BOLAND S, et al. Carbon black and titanium dioxide nanoparticles induce pro-inflammatory responses in bronchial epithelial cells: need for multiparametric evaluation due to adsorption artifacts[J]. Inhal Toxicol, 2009, 21(Suppl 1): 115–122. DOI:10.1080/08958370902942533 |
| [7] | TOTSUKA Y, HIGUCHI T, IMAI T, et al. Genotoxicity of nano/microparticles in in vitro micronuclei, in vivo comet and mutation assay systems[J]. Part Fibre Toxicol, 2009, 6(1): 23. DOI:10.1186/1743-8977-6-23 |
| [8] | KIM J K, KANG M G, CHO H W, et al. Effect of nano-sized carbon black particles on lung and circulatory system by inhalation exposure in rats[J]. Saf Health Work, 2011, 2(3): 282–289. DOI:10.5491/SHAW.2011.2.3.282 |
| [9] | MA-HOCK L, STRAUSS V, TREUMANN S, et al. Comparative inhalation toxicity of multi-wall carbon nanotubes, graphene, graphite nanoplatelets and low surface carbon black[J]. Part Fibre Toxicol, 2013, 10(1): 23. DOI:10.1186/1743-8977-10-23 |
| [10] | ZHANG R, DAI Y, ZHANG X, et al. Reduced pulmonary function and increased pro-inflammatory cytokines in nanoscale carbon black-exposed workers[J]. Part Fibre Toxicol, 2014, 11(1): 73. DOI:10.1186/s12989-014-0073-1 |
| [11] | DAI Y, NIU Y, DUAN H, et al. Effects of occupational exposure to carbon black on peripheral white blood cell counts and lymphocyte subsets[J]. Environ Mol Mutagen, 2016, 57(8): 615–622. DOI:10.1002/em.22036 |
| [12] |
李园园, 高峰, 解秋艳, 等. 吸入染毒纳米级炭黑气溶胶致小鼠肺炎性损伤的研究[J].
中华预防医学杂志, 2014, 48(12): 1098–1103.
LI Y Y, GAO F, XIE Q Y, et al. Study on the pulmonary inflammatory effects induced by inhalation exposure to nanoscale carbon black aerosol in mice[J]. Chin J Prev Med, 2014, 48(12): 1098–1103. DOI:10.3760/cma.j.issn.0253-9624.2014.12.016 |
| [13] | BOURDON J A, SABER A T, JACOBSEN N R, et al. Carbon black nanoparticle instillation induces sustained inflammation and genotoxicity in mouse lung and liver[J]. Part Fibre Toxicol, 2012, 9(1): 5. DOI:10.1186/1743-8977-9-5 |
| [14] | FRAMPTON M W. Systemic and cardiovascular effects of airway injury and inflammation: ultrafine particle exposure in humans[J]. Environ Health Perspect, 2001, 109(Suppl 4): 529–532. DOI:10.2307/3454664 |
| [15] | SAHU D, KANNAN G M, VIJAYARAGHAVAN R. Carbon black particle exhibits size dependent toxicity in human monocytes[J]. Int J Inflam, 2014, 2014: 827019. DOI:10.1155/2014/827019 |
| [16] | STOEGER T, REINHARD C, TAKENAKA S, et al. Instillation of six different ultrafine carbon particles indicates a surface area threshold dose for acute lung inflammation in mice[J]. Environ Health Perspect, 2006, 114(3): 328–333. DOI:10.1289/ehp.8266 |
| [17] | KIM Y M, REED W, LENZ A G, et al. Ultrafine carbon particles induce interleukin-8 gene transcription and p38 MAPK activation in normal human bronchial epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 288(3): 432–441. DOI:10.1152/ajplung.00285.2004 |
| [18] | HUSAIN M, KYJOVSKA Z O, BOURDON-LACOMBE J, et al. Carbon black nanoparticles induce biphasic gene expression changes associated with inflammatory responses in the lungs of C57BL/6 mice following a single intratracheal instillation[J]. Toxicol Appl Pharmacol, 2015, 289(3): 573–588. DOI:10.1016/j.taap.2015.11.003 |



