2. 610083 成都,成都军区总医院全军普通外科中心
2. PLA Center of General Surgery, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China
肝脏部分切除术是治疗肝脏肿瘤的唯一、有效的治疗方式[1-2],但是残余肝脏体积不足(future liver remnant, FLR)一直是大量患者无法接受根治性肝切除的重要原因[2]。联合肝脏分隔和门静脉结扎二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)是新兴的手术方式,其包括一期门静脉结扎和肝脏原位离断术以及二期肝脏部分切除术。ALPPS术后短时间内刺激残余肝脏快速生长[3-4],从而使以往因残余肝脏体积不足而失去手术机会的患者有了根治性切除肿瘤的可能性,但是对于其促使肝脏再生的机制尚不明确[5-6]。
干细胞在肝脏损伤与再生中起到了关键的作用。在肝脏慢性损伤或者肝细胞的再生能力受到限制时,干细胞能够分化为胆管内皮细胞和肝细胞,参与肝脏的再生[7]。SHAFRITZ等[8]的研究指出肝脏卵原细胞能够在肝脏切除2/3的情况下分化为肝脏细胞参与再生。此外,骨髓来源的干细胞也能够参与肝脏的再生[9]。在众多来源的干细胞中,骨髓来源的肝血窦内皮祖细胞(bone marrow progenitor cells of liver sinusoidal endothelial,BM SPCs)被认为是肝脏细胞生长因子(hepatocyte growth factor,HGF)的重要来源之一[10]。而HGF是被广泛承认的一种与肝脏再生息息相关的生长因子[11-12]。因此我们推测BM SPCs和HGF可能在ALPPS术后肝脏的快速再生中发挥重要的作用。本研究通过建立ALPPS动物实验模型,研究BM SPCs和HGF是否参与了ALPPS术后肝再生的过程。
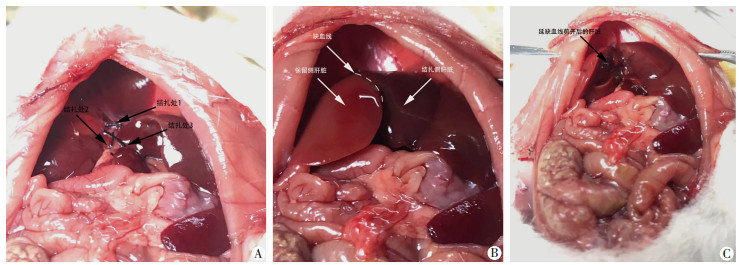
1 材料与方法 1.1 动物分组及模型制备72只健康SPF级雄性成年大鼠购自成都达硕生物科技有限公司,体质量180~220 g,饲养在恒温、恒湿的动物房中,12 h白昼交替,提供标准饲料与清水自由饮食。按随机数字法表将大鼠分为3组:ALPPS组、PVL组、假手术(Sham)组,每组24只。每组内按距手术时间分为1、2、4、7 d 5个时相点,每个时相点6只。实验所需的所有外科器材由成都军区总医院所提供。大鼠术前12 h禁食水,所有动物麻醉采用专用小动物麻醉机,快速诱导麻醉后,给予3%的异氟烷+混合空气持续吸入,流速0.6 L/min持续麻醉直至手术结束。实验所涉及的所有成年大鼠在手术过程中由腹正中切口开腹进入腹腔。Sham组:仅游离出门静脉分支不结扎即关腹;PVL组:分离出供应中叶左支的门静脉支(结扎处1)、左外叶(结扎处2)、尾状叶与右外叶(结扎处3),分别用4-0丝线依次结扎,之后即关腹;ALPPS组:在PVL手术的基础上,沿着大鼠肝脏左中叶和右中叶之间的缺血线剪开,之后关腹(图 1)。定时观察各组大鼠情况,继续饲养,随时自由食用标准饲料与清水。
|
| A:开腹后分离出左外叶、右外叶、中叶左支的门静脉支和尾状叶支并进行结扎;B:结扎后中叶立刻出现明显的缺血线;C:沿缺血线将肝脏切开 图 1 ALPPS手术过程 |
1.2 主要试剂
小鼠抗大鼠Ki-67单克隆抗体购自美国Abcam公司,小鼠抗大鼠CD133单克隆抗体购自美国R&D Systems公司,山羊抗大鼠CD31 CD45抗体购自美国R&D Systems公司,山羊抗小鼠荧光二抗Alexa fluor 594、山羊抗兔荧光二抗Alexa fluor 488、大鼠HGF试剂盒(ELISA)购自美国eBioscience公司,免疫组化试剂盒、DAB显色试剂均购自北京索莱宝科技有限公司,倒置荧光显微镜为日本Olympus公司产品,小动物麻醉机购自深圳市瑞沃德生命科技有限公司。
1.3 肝脏生长情况检测3组分别于术后1、2、4、7 d各取材6只,统计术前、术后大鼠肝右中叶质量与大鼠体质量比,计算各时点大鼠右中叶体质量比变化。
1.4 HE染色和免疫组化实验光学显微镜观察取各时相点肝保留侧肝叶的肝脏组织,用10 %甲醛固定,常规石蜡包埋切片,HE染色观察肝脏病理结构的改变、Ki-67染色观察肝脏增生情况。
1.5 大鼠肝脏功能检测抽取大鼠下腔静脉血液,血清收集后采用全自动生化仪检测谷丙转氨酶、谷草转氨酶、总胆汁酸浓度,大鼠ELISA试剂盒检测血清中HGF水平。
1.6 BM SPCs表面抗原检测取ALPPS组大鼠肝中叶结扎侧与保留侧肝脏组织,冰冻切片,免疫荧光染色观察BM SPCs表面抗原,CD133、CD45和CD133、CD31双染。
1.7 实时定量PCR实验取ALPPS组大鼠肝中叶结扎侧与保留侧肝脏组织,采用实时定量PCR检测HGF的表达,采用大连宝生物工程有限公司的SYBR Premix Ex TaqTMⅡ实时定量PCR试剂盒进行定量分析,使用Bio-Rad Cfx 96实时定量PCR仪检测HGF引物序列。HGF上游引物序列:5′-ACCCTGGTGTTTCACAAGCA-3′,下游引物序列:5′-GCAAGAATTTGTGCCGGTGT-3′。每孔按照20 μL体系加样:4 μL模板cDNA, 0.8 μL前引物(10 μmol/L), 0.8 μL后引物(10 μmol/L), 10 μL SYBR Premix Ex TaqTM Ⅱ,4.4 μL无菌水。每个样品重复3次。扩增反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火18 s,72 ℃延伸15 s,39个循环。采集熔解曲线荧光信号。实验数据采用相对定量法分析。
1.8 统计学分析采用SPSS 17.0统计软件,实验数据以x±s表示,对同一天的ALPPS组、PVL组和Sham组的肝功指标、实时定量PCR结果、ELISA实验结果进行Student-t检验,对同一组不同天数的上述实验指标进行单因素方差分析。检验水准:α=0.05。
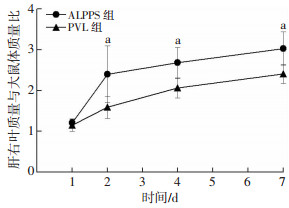
2 结果 2.1 各组ALPPS术后各时间点肝右叶质量与大鼠体质量比的变化ALPPS术后4、7 d大鼠肝右叶质量与大鼠体质量比显著高于PVL组(P<0.05,图 2)。
|
| a: P<0.05, 与PVL组比较 图 2 各组术后各时间点大鼠肝右叶质量与大鼠体质量比的变化 |
2.2 各组肝细胞损伤、肝脏合成功能和肝脏再生水平
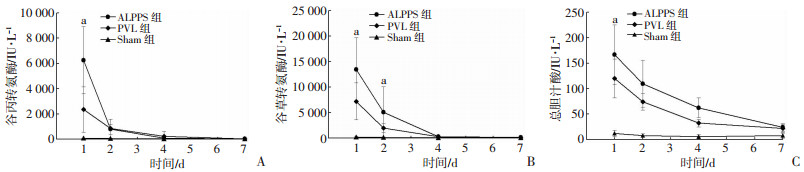
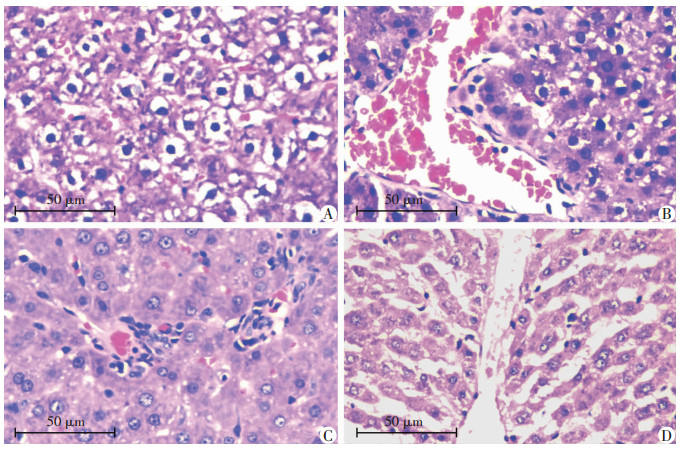
ALPPS组与PVL组、Sham组相比,术后第1天谷丙转氨酶、谷草转氨酶与总胆汁酸显著升高(P<0.05),从第2天开始回归正常水平。第3天后3组之间并没有明显的区别(P>0.05,图 3)。HE染色结果显示,ALPPS组肝脏坏死区域明显大于另外两组(图 4)。
|
| a: P<0.05, 与PVL、Sham组比较A:谷丙转氨酶;B:谷草转氨酶;C:总胆汁酸 图 3 各组术后各时间点肝脏功能变化情况 |
|
| A:ALPPS组保留侧;B:PVL组;C:Sham组;D:ALPPS组结扎侧 图 4 HE染色观察术后第2天肝脏组织病理学变化(LM) |
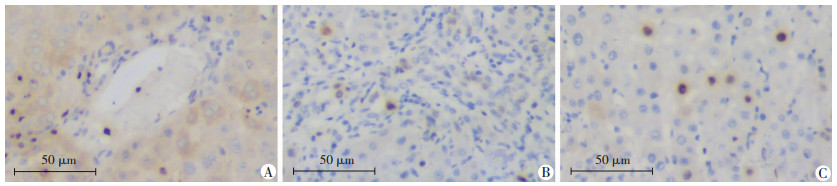
Ki-67染色结果显示,ALPPS组术后第2、4天比PVL组有更多的分裂中的细胞,ALPPS组中第2天[(73.10±3.26)% vs (51.12±7.07)%]及其第4天[(65.50±3.62)% vs (43.21±2.93)%]Ki-67染色呈阳性的细胞率明显大于PVL组(P<0.05,图 5)。
|
| A:ALPPS组保留侧; B:PVL组; C:Sham组 图 5 免疫组化法检测肝脏术后第4天Ki-67表达含量(SABC) |
2.3 各组血清中HGF水平的变化
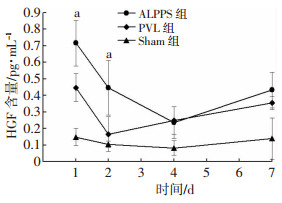
HGF在术后1 d显著升高,2 d开始稍有下降,于术后第7天后反而有所回升,其中ALPPS组在术后1、2 d显著高于PVL组(P<0.05,图 6)。
|
| a: P<0.05, 与PVL、Sham组比较 图 6 ELISA检测各组血清HGF指标变化情况 |
2.4 各组BM SPCs表面抗原检测
免疫荧光实验结果显示,在ALPPS组结扎侧CD133、CD45和CD133、CD31双染均阳性,而ALPPS组中保留侧、PVL组可见少量阳性细胞,Sham组中双染均阴性(图 7)。

|
| A:ALPPS手术组结扎侧CD133与CD45双染;B:ALPPS手术组结扎侧CD133与CD31双染;C:ALPPS组结扎侧与保留侧、PVL组与Sham组BM SPCs表面抗原表达对比 图 7 免疫荧光观察肝脏BM SPCs表面抗原的表达情况(倒置荧光显微镜) |
2.5 结扎侧与保留侧肝脏组织HGF mRNA检测
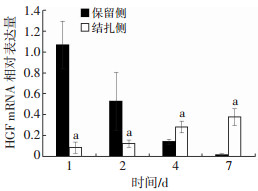
保留侧HGF的mRNA在术后第1天显著高于结扎侧,随后从2 d开始下降,而结扎侧从术后第1天开始HGF mRNA分泌量逐渐上升(图 8)。
|
| a: P<0.05, 与保留侧比较 图 8 实时定量PCR检测术后肝脏结扎侧与保留侧HGF mRNA含量 |
3 讨论
肝切除术是目前治疗肝脏肿瘤最有效的方式,然而过小的残余肝体积会导致“肝脏切除术后肝衰竭”“小肝综合征”[13-14]等一系列并发症,影响肝脏再生。传统PVL等刺激肝脏再生的方式刺激肝脏生长的能力有限,通常需要6~8周才能使患者的肝脏有足够的体积耐受部分肝脏切除术,导致限期手术患者失去手术机会[14-15]。
ALPPS手术因其能够刺激残余肝脏体积快速生长受到了国内外肝脏外科的广泛关注,但是ALPPS手术也存在着很多的不足:一方面ALPPS手术后并发症居高不下(有研究表明ALPPS手术后肿瘤复发与术后胆道狭窄发生的概率可能增加[16-17]);另一方面,初期ALPPS手术后病死率较高[18-19]。此外,虽然有研究认为HGF等炎性因子的大量释放参与了ALPPS第一步手术后的肝脏再生过程[15],但是ALPPS促进再生机制仍不十分明确[20-21]。
干细胞在经典的肝脏再生途径中占有重要地位。已有研究证实BM SPCs是HGF主要来源,在肝脏再生过程中具有重要的意义[22-23]。因此,我们猜测BM SPCs在ALPPS第1步手术后富集到大鼠肝脏并通过分泌HGF来刺激肝脏再生。本研究通过建立SD大鼠的ALPPS模型,发现术后结扎侧肝脏坏死、萎缩,保留侧肝脏增生,术后ALPPS保留侧肝脏大鼠体质量比高于PVL组。Ki-67作为一种增殖细胞核相关抗原,与细胞有丝分裂密切相关,表达范围覆盖除G0期以外各增殖期细胞,可以较好地反映细胞处于增殖状态[24-25]。在本研究发现ALPPS组比PVL组有更多的Ki-67阳性细胞,而Sham组尚未发现Ki-67阳性细胞,结合ALPPS组保留侧肝脏体质量比的结果来看,说明ALPPS手术比PVL手术更能促进肝脏的再生。ALPPS组术后肝脏功能指标于第4天与PVL组比较,差异无统计学意义,说明该手术模型安全、可行。
已有研究证实BM SPCs不但可参与肝脏再生,而且是HGF的重要来源[22-23]。BM SPCs的表面抗原是CD133、CD31、CD45[22],因此我们用CD133、CD45及其CD133、CD31双染阳性代表BM SPCs。本研究发现,ALPPS术后结扎侧有大量的BM SPCs存在,而保留侧、PVL组和Sham组并没有发现BM SPCs,可能原因是ALPPS手术仅结扎了肝脏的门静脉分支,而并没有结扎大鼠肝脏的肝动脉,因此BM SPCs可以通过血液循环到达肝脏损伤更重的结扎侧。ELISA实验结果表明,血液中HGF表达量在术后第1天达到最高值随后开始下降,于术后第4天开始有缓慢的回升。ALPPS手术组术后第1天结扎侧的HGF mRNA远远低于保留侧,可能是因为在ALPPS术的早期,肝脏急性损伤等多种因素导致肝脏Kupffer细胞、内皮细胞和成纤维细胞等释放HGF。另一方面,结扎侧肝组织血管的损伤一直处于较高的水平,细胞功能障碍;而保留侧损伤较轻,刺激HGF表达的作用强,因此在术后的早期保留侧肝脏中HGF mRNA水平高于结扎侧。术后4~7 d,因为大量的BM SPCs被招募富集在结扎侧肝脏并且分泌HGF,而此时保留侧的炎症损伤逐渐减轻,血液中的HGF能够维持再生修复,所以保留侧HGF mRNA水平逐渐降低。故实时定量PCR实验结果显示结扎侧HGF mRNA含量随着时间的推移而上升,并且最终超越了保留侧HGF mRNA的水平。术后4~7 d结扎侧肝脏分泌的HGF较其他组升高,其可通过循环等途径进入保留侧肝脏从而参与肝脏再生。既往研究已证实BM SPCs是HGF的重要来源,据此我们推测,结扎侧大量出现的BM SPCs大量分泌HGF,可能是ALPPS术后肝脏快速再生原因重要因素。
本实验成功建立了ALPPS手术大鼠模型,并证明其可以作为一种理想的研究肝再生动物实验模型。我们通过检测肝再生过程中肝脏损伤程度、肝细胞增殖、HGF的水平变化和BM SPCs的归巢情况,初步证明了BM SPCs参与了ALPPS术后肝脏的快速再生,为利用干细胞治疗而促进肝脏快速再生进行了有益探索。本实验有一定的局限性,大鼠和人类疾病模型存在一定差异,且本实验中大鼠模型为正常肝脏再生,不能完全代表人类肝脏病理条件下的再生,有待进一步研究。
| [1] | CLAVIEN P A, PETROWSKY H, DEOLIVEIRA M L, et al. Strategies for safer liver surgery and partial liver transplantation[J]. N Engl J Med, 2007, 356(15): 1545–1559. DOI:10.1056/NEJMra065156 |
| [2] | ROBLES R, PARRILLA P, LÓPEZ-CONESA A, et al. Tourniquet modification of the associating liver partition and portal ligation for staged hepatectomy procedure[J]. Br J Surg, 2014, 101(9): 1129–1134. DOI:10.1002/bjs.9547 |
| [3] | KIKUCHI Y, HIROSHIMA Y, MATSUO K, et al. Impact of associating liver partition and portal vein occlusion for staged hepatectomy on tumor growth in a mouse model of liver metastasis[J]. Eur J Surg Oncol, 2018, 44(1): 130–138. DOI:10.1016/j.ejso.2017.11.007 |
| [4] | SHENG R F, YANG L, JIN K P, et al. Assessment of liver regeneration after associating liver partition and portal vein ligation for staged hepatectomy: a comparative study with portal vein ligation[J]. HPB (Oxford), 2018, 20(4): 305–312. DOI:10.1016/j.hpb.2017.09.004 |
| [5] | DE SANTIBAÑES E, CLAVIEN P A. Playing Play-Doh to prevent postoperative liver failure: the "ALPPS" approach[J]. Ann Surg, 2012, 255(3): 415–417. DOI:10.1097/SLA.0b013e318248577d |
| [6] | SHAFRITZ D A, OERTEL M. Model systems and experimental conditions that lead to effective repopulation of the liver by transplanted cells[J]. Int J Biochem Cell Biol, 2011, 43(2): 198–213. DOI:10.1016/j.biocel.2010.01.013 |
| [7] | LIU W H, SONG F Q, REN L N, et al. The multiple functional roles of mesenchymal stem cells in participating in treating liver diseases[J]. J Cell Mol Med, 2015, 19(3): 511–520. DOI:10.1111/jcmm.12482 |
| [8] | DELEVE L D. Liver sinusoidal endothelial cells and liver regeneration[J]. J Clin Invest, 2013, 123(5): 1861–1866. DOI:10.1172/jci66025 |
| [9] | ADAMEK B, ZALEWSKAZIOB M, STRZELCZYK J K, et al. Hepatocyte growth factor and epidermal growth factor activity during later stages of rat liver regeneration upon interferon α-2b influence[J]. Clin Exp Hepatol, 2017, 3(1): 9–15. |
| [10] | SAKAMOTO K, KHAI N C, WANG Y, et al. Heparin-binding epidermal growth factor-like growth factor and hepatocyte growth factor inhibit cholestatic liver injury in mice through different mechanisms[J]. Inter J Mol Med, 2016, 38(6): 1673–1682. DOI:10.3892/ijmm.2016.2784 |
| [11] | SCHADDE E, ARDILES V, SLANKAMENAC K, et al. ALPPS offers a better chance of complete resection in patients with primarily unresectable liver tumors compared with conventional-staged hepatectomies: results of a multicenter analysis[J]. World J Surg, 2014, 38(6): 1510–1519. DOI:10.1007/s00268-014-2513-3 |
| [12] | NARITA M, OUSSOULTZOGLOU E, JAECK D, et al. Two-stage hepatectomy for multiple bilobar colorectal liver metastases[J]. Br J Surg, 2011, 98(10): 1463–1475. DOI:10.1002/bjs.7580 |
| [13] | SHI H, YANG G, ZHENG T, et al. A preliminary study of ALPPS procedure in a rat model[J]. Sci Rep, 2015, 5: 17567. DOI:10.1038/srep17567 |
| [14] | TROJA A, KHATIB-CHAHIDI K, EL-SOURANI N, et al. ALPPS and similar resection procedures in treating extensive hepatic metastases: our own experiences and critical discussion[J]. Int J Surg, 2014, 12(9): 1020–1022. DOI:10.1016/j.ijsu.2014.07.006 |
| [15] | SANJEEVI S, SPARRELID E, GILG S, et al. High incidence of biliary stricture after associating liver partition and portal vein ligation for staged hepatectomy[J]. ANZ J Surg, 2017: 1–5. DOI:10.1111/ans.14252 |
| [16] | TRUANT S, SCATTON O, DOKMAK S, et al. Associating liver partition and portal vein ligation for staged hepatectomy (ALPPS): impact of the inter-stages course on morbi-mortality and implications for management[J]. Eur J Surg Oncol, 2015, 41(5): 674–682. DOI:10.1016/j.ejso.2015.01.004 |
| [17] | NADALIN S, CAPOBIANCO I, LI J, et al. Indications and limits for associating liver partition and portal vein ligation for staged hepatectomy (ALPPS). Lessons learned from 15 cases at a single centre[J]. Z Gastroenterol, 2014, 52(1): 35–42. DOI:10.1055/s-0033-1356364 |
| [18] | SCHLEGEL A, LESURTEL M, MELLOUL E, et al. ALPPS: from human to mice highlighting accelerated and novel mechanisms of liver regeneration[J]. Ann Surg, 2014, 260(5): 839–846. DOI:10.1097/SLA.0000000000000949 |
| [19] | YAO L, LI C, GE X, et al. Establishment of a rat model of portal vein ligation combined with in situ splitting[J]. PLoS ONE, 2014, 9(8): e105511. DOI:10.1371/journal.pone.0105511 |
| [20] | WANG L, WANG X, WANG L, et al. Hepatic vascular endothelial growth factor regulates recruitment of rat liver sinusoidal endothelial cell progenitor cells[J]. Gastroenterology, 2012, 143(6): 1555–1563. DOI:10.1053/j.gastro.2012.08.008 |
| [21] | WANG L, WANG X, XIE G, et al. Liver sinusoidal endothelial cell progenitor cells promote liver regeneration in rats[J]. J Clin Invest, 2012, 122(4): 1567–1573. DOI:10.1172/JCI58789 |
| [22] | GERLACH C, SAKKAB D Y, SCHOLZEN T, et al. Ki-67 expression during rat liver regeneration after partial hepatectomy[J]. Hepatology, 1997, 26(3): 573–578. DOI:10.1002/hep.510260307 |
| [23] | BROWN D C, GATTER K C. Monoclonal antibody Ki-67: its use in histopathology[J]. Histopathology, 1990, 17(6): 489–503. DOI:10.1111/j.1365-2559.1990.tb00788.x |



