变应性鼻炎(allergic rhinitis,AR)又称过敏性鼻炎,是机体直接或间接暴露接触过敏原后,由IgE介导的一种非感染的慢性鼻部炎症疾病[1]。近年来,随空气环境污染加剧,呼吸系统疾病患病率逐年上升,AR已成为主要呼吸道慢性炎性疾病之一。此外,有研究表明AR与哮喘关系密切,是哮喘控制不良的危险因素之一[1-2],可对人们生活质量造成严重影响。因此,对AR病机制的深入研究尤为重要。
AR属Ⅰ型变态反应,Th1/Th2失衡是疾病发生、发展的关键环节[3-4]。AR发生、发展过程与细胞因子关系密切,IL-4作为Th2主要分子已经被大多数研究所关注。此外,IL-13也是Th1/Th2失衡过程中的关键分子,但鲜有人在AR中进行深入研究[5]。IL-4及IL-13分别在细胞膜与其受体激活后,磷酸化JAK进而使STAT6磷酸化,p-STAT6进入细胞核后,调控其相关靶基因,增强GATA3等基因的表达,从而促进Th2的生成[6]。有研究表明IL-4及IL-13同时受STAT6调控,因此AR疾病发生、发展可能与IL-4/IL-13/STAT6通路情况相关[7-8]。针对AR的疾病特点,目前治疗方案主要包括回避变应原、服用抗组胺类药物、局部应用糖皮质激素、免疫治疗等,但其中具体机制仍需进一步阐明[4]。既往研究提示,AR患者中多种细胞因子水平升高,布地奈德治疗后细胞因子可逐渐恢复,但其具体分子机制并未完成阐明[4]。因此,本研究从IL-4/IL-13/STAT6通路出发,采用AR模型大鼠,分析布地奈德治疗前后通路分子在血清、肺泡灌洗液以及局部黏膜的改变情况,并结合鼻中隔黏膜组织HE染色及透射电镜等形态学分析,探讨布地奈德治疗对鼻黏膜超微结构重塑的影响效应,进而进一步阐明其在AR治疗中的作用机制。
1 材料与方法 1.1 实验动物及主要试剂本研究实验动物由陆军军医大学实验动物中心提供,动物使用许可证号批号:SYXK(渝)20170002。102只健康清洁成年SD大鼠(SPF级),雌雄各半,体质量170~200 g,由陆军军医大学(第三军医大学)实验动物中心SPF动物房提供及饲养。采用随机数字表法分为3组:空白组、AR-PBS组、AR-布地奈德组,每组34只。卵清蛋白(ovalbumin, OVA)(Ⅴ级,美国Sigma公司),布地奈德(倍受您,6 mL :7.68 mg,健乔信元公司),大鼠IgE酶联免疫吸附实验(ELISA)试剂盒,大鼠组胺His ELISA试剂盒(武汉伊莱瑞特公司),大鼠白细胞介素液相芯片试剂盒(美国eBioscince公司)。
1.2 AR大鼠模型建模AR-PBS组、AR-布地奈德组为建模组,采用卵清蛋白致敏的方法建模,SD大鼠给予1 mL PBS,加入3 mg OVA及30 mg氢氧化铝腹腔注射,隔日1次,共7次。局部激发方法为采用2% OVA溶液双侧鼻孔滴鼻,每侧50 μL,1次/d,连续7 d。维持激发方法为隔日给予2% OVA溶液,双侧鼻孔滴鼻1次,每侧50 μL。空白组大鼠操作参照建模组进行,所用药物试剂均以等量PBS替代。
1.2.1 布地奈德干预建模组大鼠建模成功后,采用布地奈德干预,同时设置PBS干预进行对照。AR-布地奈德组给予每只大鼠双侧布地奈德药物滴鼻,每次每侧50 μL,1次/d。药物干预期间,空白组、AR-PBS组均给予等量PBS滴鼻。遇维持激发当日,布地奈德或PBS治疗不中断。维持激发后,间隔2 h以上给药。
1.2.2 行为学评价根据赵秀杰等[12]制定的动物模型评分标准,在给药后30 min内观察大鼠鼻痒、喷嚏、流涕等表现,用1~3分评级,总分在5分以上建模成功。鼻痒:轻擦鼻几次为1分,短时连续抓挠鼻、面为2分,抓挠鼻、面不止,到处擦磨为3分;喷嚏:1~3个为1分,4~10个为2分,11个以上为3分;流涕:流到鼻前孔为1分,超过鼻前孔为2分,流涕满面为3分。
1.3 标本制备获取肺泡灌洗液、静脉血清以及鼻黏膜组织。具体方法为建模结束后,分别从空白组、AR-PBS组、AR-布地奈德组中随机抽取大鼠各17只。4%水合氯醛麻醉后气管插管,4 mL无菌PBS灌入肺部冲洗2次取肺灌洗液,开腹暴露下腔静脉,取静脉血,同时解剖大鼠,留取鼻中隔黏膜组织。标本4 ℃环境静置30 min后,肺泡液1 500 r/min离心10 min,血液3 000 r/min离心10 min,分别取上清及血清分装EP管。给药治疗7 d后3组大鼠各取17只,重复上述步骤进行标本制备。
1.4 His、IgE及白介素检测方法血清IgE采用大鼠IgE ELISA试剂盒,血清组胺采用大鼠组胺His ELISA试剂盒进行检测,具体步骤参照试剂盒说明书。血清及肺泡灌洗液IL-4及IL-13采用大鼠白细胞介素液相芯片试剂盒进行检测,具体步骤参照试剂盒操作说明。
1.5 STAT6基因表达检测在mRNA水平及蛋白水平检测大鼠鼻黏膜STAT6基因表达情况。分别提取大鼠鼻中隔黏膜总RNA及总蛋白。RNA采用RNAiso Plus试剂盒提取,按反转录试剂盒说明书将RNA反转录为cDNA进行下一步定量PCR检测。STAT6定量引物为正向:5′-CCCTTGGTGGTCATCGTTCAT-3′,反向:5′-GTTCTGGT-AGCAGTCCCCG-3′。GAPDH定量PCR引物为正向:5′-TACCCACGGCAAGTTCAA-3′,反向:5′-GCCAGTA-GACTCCACGACAT-3′。Western blot检测大鼠鼻中隔黏膜总STAT6、磷酸化STAT6(p-STAT6)蛋白表达情况,采用全蛋白提取试剂盒提取组织总蛋白,测定蛋白浓度。SDS-PAGE电泳、转膜、封闭,STAT6及p-STAT6单克隆抗体(1 :1 000)孵育过夜,二抗(1 :4 000)孵育1 h,内参采用GAPDH,同步操作,曝光显影。
1.6 电镜观察在标本制备过程中,每组选取大鼠3只,取其鼻中隔黏膜,2 min内将鼻黏膜标本置入2.5%戊二醛液中,4 ℃冰箱过夜固定,送本校中心实验室行透射电子显微镜观察并照相。
1.7 统计学分析计量资料以x±s表示,采用SPSS 23.0统计软件进行单因素方差分析,组间比较采用LSD-t检验。检验水准:α=0.05。
2 结果 2.1 行为学建模评估大鼠经过基础致敏和局部激发后,均出现不同程度的抓鼻、喷嚏、流涕等症状,叠加评分均超过5分,AR大鼠模型造模成功。空白组偶见抓鼻现象,叠加评分均<5分。AR-布地奈德组经过7 d治疗后,叠加评分<5分。但AR-PBS组经PBS治疗7 d后无明显好转,叠加评分>5分。
2.2 布地奈德对AR大鼠血清His、IgE、IL-4及IL-13含量的影响建模结束时,建模组大鼠血清His及IgE含量增高,均显著高于空白组(P < 0.01)。AR-布地奈德组采用布地奈德治疗7 d后,血清His和IgE含量显著降低,治疗前后差异具有统计学意义(P < 0.01)。AR-PBS组采用PBS治疗7 d后,血清His和IgE含量差异无统计学意义(P=0.65)。治疗7 d结束时,AR-布地奈德组血清His、IgE显著低于AR-PBS组,但略高于空白组(表 1)。
| 组别 | His/μg·L-1 | IgE/μg·L-1 | IL-4/pg·L-1 | IL-13/pg·L-1 | |||||||
| 建模结束 | 治疗结束 | 建模结束 | 治疗结束 | 建模结束 | 治疗结束 | 建模结束 | 治疗结束 | ||||
| 空白组 | 15.07±4.85 | 15.02±3.55 | 3.63±0.76 | 3.77±0.71 | 28.90±3.75 | 28.75±3.96 | 18.54±3.53 | 18.98±4.71 | |||
| AR-PBS组 | 23.83±7.88 | 23.08±5.61 | 5.58±1.54 | 5.34±0.99 | 58.08±4.54 | 58.58±4.92 | 36.27±4.21 | 37.82±3.59 | |||
| AR-布地奈德组 | 23.89±4.22 | 19.53±3.73ab | 5.55±1.03 | 4.24±0.42ab | 59.88±5.67 | 30.58±3.89ab | 37.23±3.51 | 20.57±3.22ab | |||
| a: P<0.01, 与建模结束比较;b: P<0.01, 与AR-PBS治疗组比较 | |||||||||||
建模结束时,建模组大鼠血清IL-4、IL-13含量均显著高于空白组(P < 0.01)。给药干预后7d后,AR-布地奈德组大鼠血清IL-4、IL-13含量显著低于建模结束时含量(P < 0.01)。而AR-PBS组给予PBS治疗7 d结束时,血清IL-4及IL-13浓度与建模结束时差异无统计学意义。治疗7 d结束时,AR-布地奈德组IL-4及IL-13显著低于AR-PBS组,但略高于空白组(表 1)。
2.3 布地奈德对AR大鼠肺泡灌洗液IL-4、IL-13含量的影响建模组大鼠建模结束时,肺泡灌洗液IL-4、IL-13含量均显著高于空白组(P < 0.01)。AR-布地奈德组大鼠治疗7 d后,血清IL-4、IL-13含量显著低于该组建模结束时浓度(P < 0.01)。AR-PBS组大鼠给予PBS治疗7 d结束时,肺泡灌洗液IL-4及IL-13较该组建模结束时浓度无明显改变。治疗7 d结束时,AR-布地奈德组肺泡灌洗液IL-4及IL-13显著低于AR-PBS组,但略高于空白组(表 2)。
| 组别 | IL-4 | IL-13 | |||
| 建模结束 | 治疗结束 | 建模结束 | 治疗结束 | ||
| 空白组 | 9.90±3.45 | 9.38±1.96 | 10.77±2.43 | 11.58±1.84 | |
| AR-PBS组 | 15.08±3.64 | 14.85±3.75 | 16.18±5.10 | 14.82±2.52 | |
| AR-布地奈德组 | 15.88±2.67 | 10.55±2.83ab | 16.48±2.64 | 11.70±1.14ab | |
| a: P<0.01, 与建模结束比较;b: P<0.01, 与AR-PBS治疗组比较 | |||||
2.4 布地奈德对AR大鼠鼻黏膜STAT6基因表达的影响
建模组大鼠给予布地奈德或PBS治疗,以及空白组大鼠给予PBS治疗7 d结束时,分析各组大鼠鼻中隔黏膜STAT6 mRNA及蛋白表达情况。定量PCR结果显示,建模结束时,建模组大鼠STAT6基因表达显著高于空白组(P < 0.01)。给予治疗7 d结束时,AR-PBS组STAT6基因表达与建模结束时差异无统计学意义,AR-布地奈德组大鼠STAT6基因表达较该组建模结束时显著性下调(P < 0.01)。治疗结束时Western blot检测结果进一步证实,AR-PBS组STAT6、p-STAT6蛋白显著上调,AR-布地奈德组STAT6及p-STAT6均较AR-PBS组下调,但是略高于空白组,3组灰度值比较差异具有统计学意义(P < 0.01,图 1)。

|
| A:建模结束及治疗结束时STAT6定量PCR检测结果a:P < 0.01,与治疗结束比较;B:Western blot检测治疗结束时鼻黏膜STAT6、p-STAT6蛋白表达1:空白组; 2: AR-布地奈德组; 3: AR-PBS组 图 1 建模结束及治疗结束时各组大鼠鼻黏膜STAT6、p-STAT6表达 |
2.5 鼻中隔黏膜HE染色及透射电镜结果
HE染色结果显示,空白组为正常黏膜组织,可见纤毛丰富。AR-PBS组采用PBS治疗7 d,大鼠黏膜纤毛明显脱落减少,杯状细胞增生明显,血管扩张充血,腺体增生,该形态与AR建模成功时相当。AR-布地奈德组治疗7 d,纤毛增多,杯状细胞较前减少,血管扩张减少(图 2)。
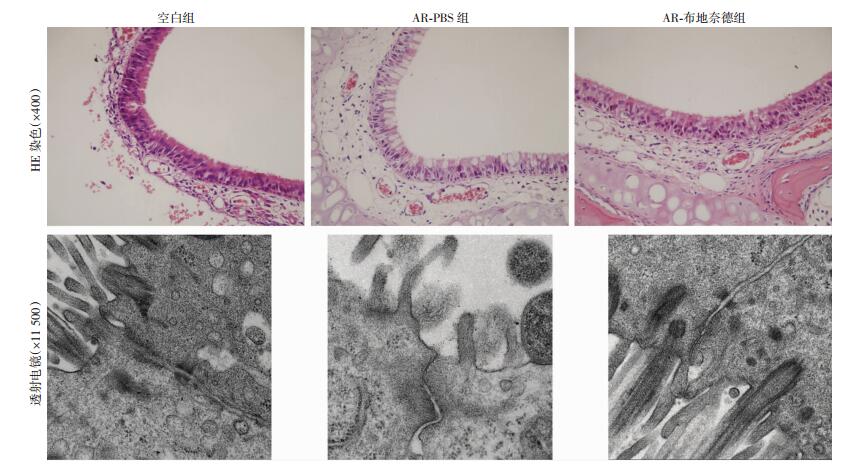
|
| 图 2 治疗后7 d各组大鼠鼻黏膜组织HE染色结果与透射电镜观察 |
透射电镜观察治疗后7 d大鼠细胞超微结构,空白组中纤毛丰富,AR-PBS组纤毛脱落,AR-布地奈德组中纤毛恢复。各组细胞间隙无水肿,但AR-PBS组细胞间隙线弯曲,提示细胞可能有皱缩(图 2)。
3 讨论变应性鼻炎发病的核心机制是Th1和Th2免疫反应失衡,以鼻腔黏膜Th2免疫反应为主的过敏性炎症反应逐渐引起人们重视。在该过程中,细胞因子白介素作为免疫反应过程中的重要分子,发挥着重要的调节作用[9]。本研究基于AR模型大鼠,实验初始采用大鼠白细胞介素液相芯片试剂盒对IL-4、IL-5、IL-6、IL-10、IL-13及IL-17A进行分析,发现细胞因子IL-4及IL-13表达差异有统计学意义。有研究表明IL-17在AR患者中表达升高[10],但本研究在AR大鼠模型中未发现明显变化。IL-4及IL-13作为AR中最为重要的参与因子,影响范围广泛,本研究发现AR大鼠血液及肺泡灌洗液均较正常大鼠显著升高,这些结果说明AR不仅影响呼吸道局部,还可引起全身性的反应。此外,有临床研究表明在AR患者中IL-4、IL-13血清浓度较正常个体增高,提示IL-4及IL-13可能是AR的一个参考指标。结合我们动物实验结果及临床研究发现,在众多细胞因子中,IL-4与IL-13变化最为稳定,可能是不同种属间反映AR较为恒定的分子标记。既往研究中,IL-4在刺激B细胞合成IgE方面起调节作用,决定Th2细胞亚群定型,促进Th2分化发育,诱导Th2细胞因子产生,同时还抑制Th1效应,阻碍Th1细胞因子形成,进而造成Th1和Th2免疫反应的失衡。IL-13在B细胞增殖分化和分泌免疫球蛋白中发挥作用,起到延长嗜酸性粒细胞生存期,诱导表达嗜酸性粒细胞趋化因子的作用,这些结果均表明IL-4及IL-13是Th1和Th2免疫反应失衡的因子[11]。本研究从动物层面的角度发现IL-4及IL-13较为稳定增高于AR模型鼠,其可以作为AR疾病进程,是反映Th1/Th2免疫失衡的一个重要参考指标。IL-4及IL-13在AR患者及模型鼠中同时升高,为究其原因,本研究采用生物信息学分析,推测其与IL-4/IL-13/STAT6信号通路相关。有研究表明STAT6在Th2分化中起关键作用,而且是Th2分化的特异性转录因子,可促进Th2细胞增殖和产生IL-4、IL-13等Th2细胞因子,但其在AR中的疾病机制并未完全阐明。本研究发现,AR模型鼠建模成功后,在IL-4、IL-13升高的同时,鼻黏膜局部STAT6表达也显著增高,其p-STAT6具有同样趋势,这说明STAT6与IL-4及IL-13一起,共同参与疾病病程。综合既往文献报道及本研究发现,白介素IL-4/IL-13可能激活JAK通路,进一步磷酸化STAT6,而p-STAT6进一步激活其下游靶基因GATA-3,使得细胞向Th2分化,导致免疫失衡,这些结果提示该信号通路是药物治疗的重要干预通路。为深入探索IL-4/IL-13 /STAT6信号通路与AR关系,本研究采用目前一线治疗药物布地奈德加以干预。结果证实在用药7 d后,血清His、IgE、IL-4、IL-13以及肺泡灌洗液相关细胞因子指标均有明显好转,并且STAT6以及p-STAT6蛋白水平也下调明显,说明布地奈德对该通路影响效应显著,活化的信号转导分子p-STAT6受到抑制。
为进一步阐明布地奈德治疗AR大鼠机制,本研究采用透射电镜分析AR大鼠鼻中隔黏膜超微结构,结果提示,布地奈德可以重塑鼻中隔黏膜,AR大鼠治疗后,炎症及纤毛都获得了一定程度的改善。此外,在对动物的观察过程中,发现布地奈德可以缓解喘息反应,该结果表明布地奈德作为鼻用糖皮质激素不单能够有效抑制AR的免疫反应,也能减轻AR引起哮喘的炎症反应,这进一步对布地奈德治疗AR引起的哮喘奠定了理论基础[1, 4]。此外,本研究采用AR模型大鼠进行实验,筛选的细胞因子IL-4和IL-13指标较为稳定,可运用于AR大鼠建模评估,为模型评价提供了重要的参考数据。但是,由于实验设计的局限,本研究仅针对鼻黏膜总细胞进行分析,并未进一步探讨其具体细胞亚群参与AR发生,仍需深入研究。
综上,本研究在AR大鼠模型上证实了IL-4/IL-13 /STAT6通路是参与AR发生、发展的重要信号通路,同时也是布地奈德干预的关键通路,这为了解AR发病机制及治疗机制提供重要参考,同时也为AR大鼠模型的评估提示重要实验依据。
| [1] | DYKEWICZ M S, WALLACE D V, BAROODY F, et al. Treatment of seasonal allergic rhinitis: an evidence-based focused 2017 guideline update[J]. Ann Allergy Asthma Immunol, 2017, 119(6): 489–511. DOI:10.1016/j.anai.2017.08.012 |
| [2] | RANGAMUWA K B, YOUNG A C, THIEN F. An epidemic of thunderstorm asthma in melbourne 2016: asthma, rhinitis, and other previous allergies[J]. Asia Pac Allergy, 2017, 7(4): 193–198. DOI:10.5415/apallergy.2017.7.4.193 |
| [3] | YU S, HAN B, LIU S, et al. Derp1-modified dendritic cells attenuate allergic inflammation by regulating the development of T helper type1(Th1)/Th2 cells and regulatory T cells in a murine model of allergic rhinitis[J]. Mol Immunol, 2017, 90: 172–181. DOI:10.1016/j.molimm.2017.07.015 |
| [4] | MAY J R, DOLEN W K. Management of allergic rhinitis: a review for the community pharmacist[J]. Clin Ther, 2017, 39(12): 2410–2419. DOI:10.1016/j.clinthera.2017.10.006 |
| [5] | LEE H J, KIM B, IM N R, et al. Decreased expression of E-cadherin and ZO-1 in the nasal mucosa of patients with allergic rhinitis: altered regulation of E-cadherin by IL-4, IL-5, and TNF-alpha[J]. Am J Rhinol Allergy, 2016, 30(3): 173–178. DOI:10.2500/ajra.2016.30.4295 |
| [6] | BARIK S, MILLER M M, CATTIN-ROY A N, et al. IL-4/IL-13 signaling inhibits the potential of early thymic progenitors to commit to the T cell lineage[J]. J Immunol, 2017, 199(8): 2767–2776. DOI:10.4049/jimmunol.1700498 |
| [7] | SUN L, REN X, WANG I C, et al. The FOXM1 inhibitor RCM-1 suppresses goblet cell metaplasia and prevents IL-13 and STAT6 signaling in allergen-exposed mice[J]. Sci Signal, 2017, 10(475): eaai8583. DOI:10.1126/scisignal.aai8583 |
| [8] | HOSOYA K, SATOH T, YAMAMOTO Y, et al. Gene silencing of STAT6 with siRNA ameliorates contact hypersensitivity and allergic rhinitis[J]. Allergy, 2011, 66(1): 124–131. DOI:10.1111/j.1398-9995.2010.02440.x |
| [9] | RICCIO A M, TOSCA M A, COSENTINO C, et al. Cytokine pattern in allergic and non-allergic chronic rhinosinusitis in asthmatic children[J]. Clin Exp Allergy, 2002, 32(3): 422–426. DOI:10.1046/j.1365-2222.2002.01315.x |
| [10] | GHARIB ALY M A, EL TABBAKH M T, HEISSAM W F, et al. The study of a possible correlation between serum levels of interleukin 17 and clinical severity in patients with allergic rhinitis[J]. Allergy Rhinol (Providence), 2017, 8(3): e126–e131. DOI:10.2500/ar.2017.8.0207 |
| [11] | PARULEKAR A D, KAO C C, DIAMANT Z, et al. Targeting the interleukin-4 and interleukin-13 pathways in severe asthma: current knowledge and future needs[J]. Curr Opin Pulm Med, 2018, 24(1): 50–55. DOI:10.1097/MCP.0000000000000436 |
| [12] |
赵秀杰, 董震, 杨占泉, 等. 鼻超敏反应实验模型的建立[J].
中华耳鼻咽喉科杂志, 1993, 28(1): 17–18.
ZHAO X J, DONG Z, YANG Z Q, et al. Establishment of experimental model of nasal hypersensitivity[J]. Chin J Otorhinolaryngol Head Neck Surg, 1993, 28(1): 17–18. |



