冠状动脉粥样硬化是糖尿病常见的并发症,是其致死、致残的重要病因。由于冠状动脉粥样硬化早期缺乏特征性表现,漏诊率较高,因此需要特异性强、敏感性高、检测方便的指标来早期诊断并及时干预。近年来研究表明脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2, Lp-PLA2)作为一种特异性的血管炎症标志物可促进冠状动脉粥样斑块的形成[1-2],糖化血红蛋白(HbA1c)是临床广泛应用的反映血糖控制的指标,但二者对早期诊断糖尿病患者冠脉狭窄程度的价值尚不清楚。本研究拟探讨循环Lp-PLA2、HbA1c水平的联合检测对预测糖尿病患者冠状动脉狭窄程度的临床价值。
1 资料与方法 1.1 一般资料收集2017年7月至2017年12月陆军军医大学(第三军医大学)第二附属医院心血管内科拟诊冠心病住院患者241例,其中男性167例,女性74例,年龄(64.0±11.3)岁,纳入标准:①冠心病组、冠心病合并糖尿病组冠状动脉造影至少有1支血管狭窄程度﹥50%,糖尿病组及正常对照组冠脉造影证实冠脉无病变;②年龄﹥16岁。排除标准:所有研究对象排除心脏瓣膜病、心肌病、恶性肿瘤、感染等相关疾病。所有入组的研究对象及直系亲属均知情同意并自愿参加本试验;本研究通过我院医学伦理委员会审查(2018-01-05);所有入组对象完善病史采集、超声心动图、冠状动脉造影等检查;按冠脉狭窄程度及糖尿病病史分为冠心病组(42例)、糖尿病组(34例)、糖尿病合并冠心病组(127例)、正常对照组(38例)。按超声心动图LVEF结果分为LVEF<50%组(91例)和LVEF≥50%组(150例)。
1.2 方法采集空腹血完善尿素氮(BUN)、肌酐(Cr)、空腹血糖(FPG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、甘油三酯(TG)、脂蛋白A(LPa)、载脂蛋白A1(APOA1)、载脂蛋白B(APOB)、载脂蛋白E(APOE)、C反应蛋白(CRP)、BNP等生化检查,采用化学发光法检测循环HbA1c水平,采用酶联免疫吸附试验(ELISA)(天津康尔克生物科技公司检测试剂)检测循环Lp-PLA2浓度,冠状动脉造影采用数字减影心血管造影机经桡动脉或股动脉途径行选择性冠状动脉造影,造影结果以左冠状动脉前降支、回旋支、左冠状动脉主干和右冠状动脉的任何一处血管狭窄且狭窄率超过50%即确诊为冠心病,冠脉狭窄程度评估采用Gensini积分评价(表 1);糖尿病诊断标准按《中国2型糖尿病防治指南2013版》执行,具体如下:典型糖尿病症状(如多食、多饮、多尿、体质量下降)加上:①随机血糖监测或静脉血浆葡萄糖水平≥11.1 mmol/L;②空腹静脉血浆葡萄糖水平≥7.0 mmol/L;③葡萄糖负荷后2h静脉血浆葡萄糖水平≥11.1 mmol/L,无糖尿病症状者需改日重复检查(空腹状态检查指至少8 h没有进食热量;随机血糖指不考虑上次用餐时间,1 d中任意时间的血糖,不能用来诊断空腹血糖受损或糖耐量异常)。
| 冠状动脉分段 | 权重系数 | 冠状动脉狭窄程度(%) | 权重系数 |
| 第2对角支 | 0.5 | 0~25 | 1 |
| 右冠状动脉近段、中段、远段,后降支,前降支远段,第一对角支,钝缘支,左心室后侧支 | 1.0 | 26~49 | 2 |
| 50~74 | 4 | ||
| 前降支中段,回旋支远段 | 1.5 | 75~89 | 8 |
| 前降支近段,回旋支近段 | 2.5 | 90~99 | 16 |
| 左主干 | 5.0 | 100 | 32 |
1.3 统计学方法
采用SPSS 17.0统计软件对数据进行统计分析。计量资料用x±s表示,采用独立样本t检验进行两组间的比较,采用ANVOA方差分析进行多组比较,组间比较采用LSD检验。计数资料采用绝对数(百分比)表示,假设检验采用χ2检验。两变量间相关性使用Pearson检验。计量资料相关性采用多元线性回归分析相关性,线性回归分析中膨胀因子小于2排除自变量共线性。危险因素采用多元Logistic回归分析。检验水准:α=0.05。
2 结果 2.1 各组研究对象一般资料比较各组之间在性别、年龄、吸烟、饮酒、糖尿病病程、高血压病史、心率、血管紧张素转换酶抑制剂(ACEI)服用史、β受体阻滞剂服用史、钙离子通道阻滞剂(CCB)服用史等方面差异有统计学意义(P < 0.05), 而在体质指数(BMI)、高脂血症史、收缩压、舒张压等方面差异无统计学意义(P>0.05,表 2)。
| 组别 | n | 男性/例(%) | 年龄/岁 | BMI/kg·m-2 | 吸烟/例(%) | 饮酒/例(%) | 糖尿病病程/年 | 高血压病史/例(%) | 心率/min | 收缩压/mmHg | 舒张压/mmHg | ACEI服用史/例(%) | β受体阻滞剂服用史/例 | CCB服用史/例 | 高脂血症史/例(%) |
| 正常对照组 | 38 | 18(47.37) | 56.44±10.83 | 24.67±3.31 | 9(23.68) | 7(18.42) | 0.00±0.00 | 15(39.47) | 73.21±8.17 | 126.42±13.16 | 73.63±10.41 | 22(57.89) | 17(44.74) | 11(28.95) | 11(28.95) |
| 冠心病组 | 42 | 34(80.95)a | 60.50±11.96 | 24.68±3.58 | 26(61.90)a | 12(28.57) | 0.00±0.00 | 29(69.05)a | 79.60±13.64 | 129.71±19.12 | 79.38±12.89 | 39(92.86)a | 27(64.29) | 21(50.00) | 10(23.81) |
| 糖尿病组 | 34 | 17(50.00) | 67.32±12.12b | 25.33±2.98 | 10(29.4)b | 9(26.47) | 8.90±7.13 | 27(79.41)a | 80.68±15.26 | 134.82±18.42 | 75.9±13.80 | 24(70.59)b | 28(82.35)a | 19(55.88)a | 4(11.76) |
| 糖尿病合并冠心病组 | 127 | 98(77.17) | 63.28±10.58a | 24.70±3.10 | 73(57.5)ac | 58(45.67)ab | 5.98±5.80bc | 77(60.63)ac | 75.98±11.57 | 130.60±19.19 | 75.22±11.79 | 98(77.17)ab | 108(85.04)ab | 37(29.13)bc | 33(25.98) |
| P值 | < 0.01 | < 0.01 | 0.76 | < 0.01 | 0.01 | < 0.01 | < 0.01 | 0.02 | 0.47 | 0.07 | < 0.01 | < 0.01 | 0.01 | 0.31 | |
| a:P < 0.05,与正常对照组比较;b: P < 0.05,与冠心病组比较;c:P < 0.05,与糖尿病组比较 | |||||||||||||||
各组之间Lp-PLA2、HbA1c、Gensini积分等相关指标比较见表 3,各组之间在左室舒张末期内径、LVEF、Gensini积分、尿素氮、空腹血糖、尿素氮等方面比较差异有统计学意义(P < 0.05),其中Lp-PLA2水平在糖尿病合并冠心病组、冠心病组明显高于糖尿病组和正常对照组(P < 0.05);HbA1c水平在糖尿病合并冠心病组、糖尿病组明显高于冠心病组和正常对照组(P < 0.05);冠脉狭窄程度(Gensini积分)在糖尿病合并冠心病组、冠心病组明显高于糖尿病组和正常对照组(P < 0.05);冠状动脉狭窄支数在糖尿病合并冠心病组、冠心病组明显高于糖尿病组和正常对照组(P < 0.05)。运用Pearson相关性分析比较Lp-PLA2、HbA1c之间差异无统计学意义(P>0.05)。
| 组别 | n | 左室舒张末期 内径/mm |
LVEF(%) | Gensini积分 /分 |
eGFR /mL·min-1·1.73 m-2 |
尿素氮 /mmol·L-1 |
肌酐 /μmol·L-1 |
空腹血糖 /mmol·L-1 |
TC /mmol·L-1 |
TG /mmol·L-1 |
HDL /mmol·L-1 |
LDL/mmol·L-1 | Lpa/mg·L-1 | APOA1/g·L-1 | APOB/g·L-1 | APOE/mg·dL-1 | CRP/mg·L-1 | BNP/ng·mL-1 | HbA1c(%) | Lp-PLA2/mmol·L-1 | 冠脉病变支数/支 |
| 正常对照组 | 38 | 45.04±5.26 | 63.72±6.33 | 0.00±0.00 | 95.01±17.29 | 4.97±1.42 | 66.91±17.88 | 4.82±0.63 | 3.94±1.06 | 1.63±1.45 | 1.11±0.32 | 2.43±0.73 | 154.84±188.04 | 1.29±0.26 | 0.77±0.22 | 2.97±0.90 | 7.24±9.73 | 74.80±133.31 | 5.89±0.77 | 113.02±49.52 | 0.00±0.00 |
| 冠心病组 | 42 | 48.55±8.11a | 55.84±12.94a | 59.38±39.20a | 86.33±17.17 | 5.48±1.86 | 79.76±19.91 | 4.98±1.00 | 4.00±1.49 | 1.66±1.08 | 0.96±0.22 | 2.52±1.11 | 300.90±305.96 | 1.19±0.21 | 0.81±0.31 | 2.82±0.80 | 17.31±30.63 | 233.73±363.03 | 6.11±0.61 | 161.47±80.19a | 2.07±0.87a |
| 糖尿病组 | 34 | 46.18±4.76 | 58.71±10.69 | 0.00±0.00 | 83.71±21.37 | 6.15±1.77a | 75.21±27.08 | 7.27±4.00ab | 3.58±0.89 | 1.64±1.16 | 1.00±0.27 | 2.32±0.69 | 213.03±300.90 | 1.17±0.24 | 0.76±0.22 | 3.32±1.75 | 6.88±6.14 | 203.93±310.74 | 7.97±1.68ab | 118.44±48.74b | 0.00±0.00b |
| 糖尿病合并冠心病组 | 127 | 47.88±6.42a | 55.99±11.63a | 65.86±46.62ac | 87.60±18.27 | 6.13±2.58a | 82.73±81.04 | 7.88±3.41ab | 3.84±1.06 | 1.94±1.96 | 0.99±0.27 | 2.28±0.73 | 249.88±324.18 | 1.23±0.24 | 0.77±0.21 | 3.01±1.23 | 17.02±34.90 | 262.76±500.11 | 7.91±1.49ab | 140.06±68.42a | 2.10±1.02ac |
| P值 | 0.04 | < 0.01 | < 0.01 | 0.05 | 0.02 | 0.55 | < 0.01 | 0.43 | 0.60 | 0.06 | 0.34 | 0.16 | 0.11 | 0.76 | 0.35 | 0.11 | 0.11 | < 0.01 | < 0.01 | < 0.01 | |
| a:P < 0.05,与正常对照组比较;b: P < 0.05,与冠心病组比较;c: P < 0.05,与糖尿病组比较 | |||||||||||||||||||||
多元线性回归分析Lp-PLA2水平与冠脉狭窄程度(Gensini积分)正相关(r=0.189, P < 0.01, 图 1A);HbA1c水平与冠脉狭窄程度(Gensini积分)正相关(r=0.138, P < 0.05, 图 1B)。Logistic多元回归分析Lp-PLA2、HbA1c水平为冠状动脉狭窄程度的独立危险因素(OR值:1.012,0.097,P < 0.05, 表 4)。
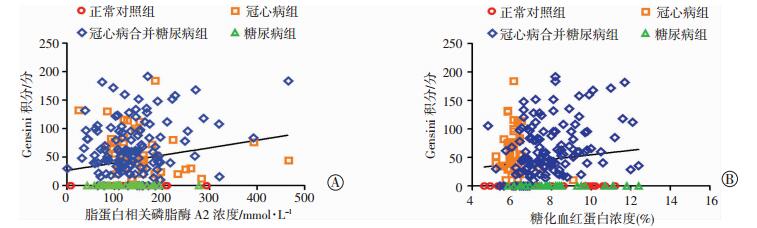
|
| A: r=0.189,P < 0.01; B: r=0.138,P < 0.05 图 1 脂蛋白相关磷脂酶浓度(A)、糖化血红蛋白(B)浓度与Gensini积分的相关性分析 |
| 临床特征 | B | SE | Wald | P值 | OR | 95%CI |
| HbA1c浓度 | -2.335 | 0.367 | 40.421 | < 0.001 | 0.097 | 0.047~0.199 |
| Lp-PLA2浓度 | 0.012 | 0.004 | 9.250 | 0.002 | 1.012 | 1.004~1.020 |
| 性别 | 1.401 | 0.674 | 4.320 | 0.038 | 4.057 | 1.083~15.199 |
| 年龄 | -0.047 | 0.023 | 4.072 | 0.044 | 0.954 | 0.911~0.999 |
| 吸烟 | 1.179 | 0.726 | 2.639 | 0.104 | 3.253 | 0.784~13.499 |
| 饮酒 | -0.624 | 0.663 | 0.888 | 0.346 | 0.536 | 0.146~1.963 |
| TC(mmol/L) | 1.787 | 0.663 | 7.274 | 0.007 | 5.971 | 1.630~21.876 |
| TG (mmol/L) | 0.129 | 0.239 | 0.293 | 0.588 | 1.138 | 0.713~1.817 |
| LDL(mol/L) | -2.409 | 0.855 | 7.941 | 0.005 | 0.090 | 0.017~0.480 |
| LPa(mg/L) | 0.001 | 0.001 | 2.060 | 0.151 | 1.001 | 1.000~1.003 |
2.2 LVEF < 50%组和LVEF≥50%组Lp-PLA2、HbA1c的比较
LVEF<50%组Lp-PLA2水平高于LVEF≥50%组(P < 0.05)。两组间HbA1c水平比较差异无统计学意义(P>0.05)。线性回归分析Lp-PLA2水平与LVEF呈负相关(r=0.219, P < 0.001, 表 5)。
| 组别 | n | HbA1c(%) | Lp-PLA2/mmol·L-1 |
| LVEF<50%组 | 91 | 7.64±1.65 | 155.01±85.44 |
| LVEF≥50%组 | 150 | 7.64±1.54 | 128.74±56.36a |
| P值 | 0.31 | 0.01 | |
| a:P < 0.05,与LVEF < 50%组比较 | |||
3 讨论
糖尿病常常导致冠状动脉粥样硬化,患者早期病情隐匿,存在较高的漏诊率。病情较严重的患者即使接受了最优的药物治疗,仍存在高病死和高致残率的风险。因此早期识别糖尿病患者的冠状动脉粥样硬化,寻找有效的预测指标,早期给予规范化治疗将有益于改善患者预后。
动脉粥样硬化是血管炎性反应过程。传统的炎症标志物,如白细胞计数、C反应蛋白等对冠心病患者危险分层价值有限,且缺乏特异性。Lp-PLA2是一种具有血管特异性的炎症标志物,参与动脉粥样硬化进程,国内外诸多研究显示Lp-PLA2活性和水平升高可预测冠心病心血管事件风险增加[1-3]。BALLANTYNE等[4]研究发现Lp-PLA2水平和冠心病心血管事件呈正相关,是预测冠状动脉事件的独立预测因子,其特异性优于高敏C反应蛋白(HS-CRP)。有研究观察了社区普通老年人群,平均随访16年,发现Lp-PLA2水平与年龄、BMI、LDL、CRP呈明显正相关,Lp-PLA2水平升高者发生心梗、心绞痛,冠脉血运重建的比率更高,且独立于其他危险因素[5]。YANG等[6]针对中国人的研究亦发现冠脉狭窄患者循环Lp-PLA2较冠脉正常患者高。但也有不同的研究结果,BENDERLY等[7]研究发现Lp-PLA2活性在预测冠心病患者心血管事件方面与传统危险因素相比并没有优越性。本研究选取糖尿病合并冠心病人群为研究对象,并与单纯冠心病、单纯糖尿病及正常对照人群比较,进一步证实了糖尿病患者血清Lp-PLA2水平与冠状动脉狭窄程度(Gensini积分)呈正相关,且Lp-PLA2水平越高冠状动脉狭窄支数越多,Lp-PLA2是糖尿病患者冠状动脉狭窄的独立危险因素,在糖尿病患者中检测Lp-PLA2水平对预测冠状动脉狭窄程度有较好的应用价值。
左心室射血分数(left ventricular ejection fraction, LVEF)反映左心室的泵血效率,受到众多的生理因素(体温、甲状腺功能等)和病理因素(心肌缺血缺氧、心律失常、心肌纤维化等)的影响,LVEF是评价患者心功能的重要指标,亦是判断患者远期预后的独立危险因子。本研究发现LVEF降低的患者Lp-PLA2水平较LVEF正常者明显升高,推测该现象可能与LVEF降低的患者冠脉病变更严重有关,Lp-PLA2水平可能有预测左心收缩功能的价值。
Lp-PLA2的水平与糖尿病的关系,目前研究很少且结果有争议。ARSENAULT等[8]研究发现接受他汀治疗的新发糖尿病患者,初始的循环Lp-PLA2水平更低,与糖尿病的发生呈负相关,由此推测低Lp-PLA2水平预示他汀治疗后的新发糖尿病风险更大。MAYER等[9]报道对于稳定性冠心病患者,Lp-PLA2与空腹葡萄糖水平呈负相关。GARG等[10]报道糖尿病患者Lp-PLA 2活性增加,与空腹血糖呈明显正相关。有研究观察青年糖尿病患者,血糖水平升高与Lp-PLA2活性呈负相关[11]。研究表明糖尿病患者Lp-PLA2与心-踝血管指数呈明显的正相关,提示Lp-PLA2可预测动脉血管阻力[12]。本研究发现糖尿病合并冠心病患者Lp-PLA2水平与冠脉狭窄程度(Gensini积分)正相关,但是糖尿病及合并冠心病患者循环Lp-PLA2与HbA1c水平没有相关性,因此Lp-PLA2水平并不能反应患者的血糖控制水平。
HbA1c是反应糖尿病患者近期血糖控制水平的常用临床指标,其与动脉粥样硬化的关系仍不明确且仅限于小样本研究。JIANG等[13]报道对于糖耐量异常和糖尿病患者Gensini评分与餐后血糖呈正相关。ERTEM等[14]报道单纯急性心梗患者HbA1c水平与Gensini评分无明显关系。本研究发现冠心病合并糖尿病患者HbA1c水平与冠脉狭窄程度(Gensini积分)正相关,因此HbA1c为糖尿病合并冠心病患者冠状动脉狭窄程度的独立危险因素。
高Lp-PLA2水平患者更易发生不良心血管事件,因此降低Lp-PLA2水平和活性可能改善冠心病患者预后。WHITE等[15]研究发现普伐他汀降低Lp-PLA2活性达16%,1年随访无心血管事件的患者Lp-PLA2降低幅度较大,独立于LDL水平的变化。SCHAEFER等[16]报道冠心病患者阿托伐他汀治疗36周后,Lp-PLA2水平降低26%,比氟伐他汀、洛伐他汀和辛伐他汀更有效。因此他汀类药物改善冠心病患者预后的部分机制是通过降低Lp-PLA2的水平和活性实现的。达普拉缔(Darapladib)是口服的选择性Lp-PLA2酶抑制剂,但在STABILITY等[17]研究和O'DONOGHUE等[18]的研究中,达普拉缔(Darapladib)均未能降低冠心病患者终点事件风险。由此可见,Lp-PLA2可能仅仅是个风险预测因子,而不是理想的治疗靶点。
综上所述,本研究通过检测糖尿病合并冠心病、单纯冠心病、单纯糖尿病及健康人群循环Lp-PLA2和HbA1c水平,发现糖尿病合并冠心病患者循环Lp-PLA2、HbA1c水平明显升高,与冠状动脉狭窄程度正相关,二者联合检测对预测糖尿病患者冠脉病变程度有较好的临床应用价值。
本研究的不足之处为单中心研究,病例数有限,今后拟扩大样本量深入探讨Lp-PLA2与冠脉病变程度及不同合并症之间的相关性。
| [1] | SOFOGIANNI A, ALKAGIET S, TZIOMALOS K. Lipoprotein-associated phospholipase A2 and coronary heart disease[J]. Curr Pharm Des, 2018, 10. DOI:10.2174/1381612824666180111110550.[Epubaheadofprint |
| [2] | GARG P K, MCCLELLAND R L, JENNY N S, et al. Lipoprotein-associated phospholipase A2 and risk of incident cardiovascular disease in a multi-ethnic cohort: The multi ethnic study of atherosclerosis[J]. Atherosclerosis, 2015, 241(1): 176–182. DOI:10.1016/j.atherosclerosis.2015.05.006 |
| [3] | LI D, ZHAO L, YU J, et al. Lipoprotein-associated phospholipase A2 in coronary heart disease: review and meta-analysis[J]. Clin Chim Acta, 2017, 465: 22–29. DOI:10.1016/j.cca.2016.12.006 |
| [4] | BALLANTYNE C M, HOOGEVEEN R C, BANG H, et al. Lipoprotein-associated phospholipase A2, high-sensitivity C-reactive protein, and risk for incident coronary heart disease in middle-aged men and women in the atherosclerosis risk in communities (ARIC) study[J]. Circulation, 2004, 109(7): 837–842. DOI:10.1161/01.CIR.0000116763.91992.F1 |
| [5] | DANIELS L B, LAUGHLIN G A, SARNO M J, et al. Lipoprotein-associated phospholipase A2 is an independent predictor of incident coronary heart disease in an apparently healthy older population: the Rancho Bernardo Study[J]. J Am Coll Cardiol, 2008, 51(9): 913–919. DOI:10.1016/j.jacc.2007.10.048 |
| [6] | YANG L, LIU Y, WANG S, et al. Association between Lp-PLA2 and coronary heart disease in Chinese patients[J]. J Int Med Res, 2017, 45(1): 159–169. DOI:10.1177/0300060516678145 |
| [7] | BENDERLY M, SAPIR B, KALTER-LEIBOVICI O, et al. Lipoprotein-associated phospholipase A2, and subsequent cardiovascular events and mortality among patients with coronary heart disease[J]. Biomarkers, 2017, 22(3-4): 219–224. DOI:10.3109/1354750X.2016.1171910 |
| [8] | ARSENAULT B J, KOHLI P, LAMBERT G, et al. Emerging cardiovascular disease biomarkers and incident diabetes mellitus risk in statin-treated patients with coronary artery disease (from the treating to new targets[TNT] study)[J]. Am J Cardiol, 2016, 118(4): 494–498. DOI:10.1016/j.amjcard.2016.05.044 |
| [9] | MAYER O J R, SEIDLEROVá J, FILIPOVSKY J, et al. Unexpected inverse relationship between impaired glucose metabolism and lipoprotein-associated phospholipase A2 activity in patients with stable vascular disease[J]. Eur J Intern Med, 2014, 25(6): 556–560. DOI:10.1016/j.ejim.2014.05.010 |
| [10] | GARG S, MADHU S V, SUNEJA S. Lipoprotein associated phospholipase A2 activity & its correlation with oxidized LDL & glycaemic status in early stages of type-2 diabetes mellitus[J]. Indian J Med Res, 2015, 141(1): 107–114. DOI:10.4103/0971-5916.154512 |
| [11] | SEYFARTH J, REINEHR T, HOYER A, et al. Lipoprotein-associated phospholipase A2 activity in obese adolescents with and without type 2 diabetes[J]. J Inherit Metab Dis, 2018, 41(1): 73–79. DOI:10.1007/s10545-017-0100-0 |
| [12] | Kotani K. Plasma lipoprotein-associated phospholipase A2 levels correlated with the cardio-ankle vascular index in long-term type 2 diabetes mellitus patients[J]. Int J Mol Sci, 2016, 17(5): pii: E634. DOI:10.3390/ijms17050634 |
| [13] | JIANG J, ZHAO L, LIN L, et al. Postprandial blood glucose outweighs fasting blood glucose and HbA1c in screening coronary heart disease[J]. Sci Rep, 2017, 7(1): 14212. DOI:10.1038/s41598-017-14152-y |
| [14] | ERTEM A G, BAǦBANCI H, KILIÇH, et al. Relationship between HbA1c levels and coronary artery severity in nondiabetic acute coronary syndrome patients[J]. Turk Kardiyol Dern Ars, 2013, 41(5): 389–395. DOI:10.5543/tkda.2013.95666 |
| [15] | WHITE H D, SIMES J, STEWART R A, et al. Changes in lipoprotein-associated phospholipase A2 activity predict coronary events and partly account for the treatment effect of pravastatin: results from the long-term intervention with pravastatin in ischemic disease study[J]. J Am Heart Assoc, 2013, 2(5): e000360. DOI:10.1161/JAHA.113.000360 |
| [16] | SCHAEFER E J, MCNAMARA J R, ASZTALOS B F, et al. Effects of atorvastatin versus other statins on fasting and postprandial C-reactive protein and lipoprotein-associated phospholipase A2 in patients with coronary heart disease versus control subjects[J]. Am J Cardiol, 2005, 95(9): 1025–1032. DOI:10.1016/j.amjcard.2005.01.023 |
| [17] | STABILITY INVESTIGATORS, WHITE H D, HELD C, et al. Darapladib for preventing ischemic events in stable coronary heart disease[J]. N Engl J Med, 2014, 370(18): 1702–1711. DOI:10.1056/NEJMoa1315878 |
| [18] | O'DONOGHUE M L, BRAUNWALD E, WHITE H D, et al. Effect of darapladib on major coronary events after an acute coronary syndrome: the SOLID-TIMI 52 randomized clinical trial[J]. JAMA, 2014, 312(10): 1006–1015. DOI:10.1001/jama.2014.11061 |



