2. 400030重庆,重庆市沙坪坝区人民医院检验科
2. Department of Clinical Laboratory, People's Hospital of Shapingba District, Chongqing, 400030, China
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)是治疗恶性血液系统疾病的重要方法,目前已广泛应用于临床。移植术后可能出现疾病复发、移植物抗宿主病(graft-versus-host disease, GVHD)、肝静脉闭塞病(veno occlusive disease, VOD)、出血性膀胱炎(hemorrhagic cystitis, HC)等并发症。随着对疾病认识的加深和提前干预,上述并发症的发生率及严重程度均有所下降,而移植后植入不良成为主要并发症之一[1],现已受到人们的高度重视。临床上影响移植术后植入状态的因素很多,如GVHD、巨细胞病毒(cytomegalovirus, CMV)感染、基质损伤等,很多学者认为基质细胞损伤是影响植入的重要因素[2],并采用体外培养、流式细胞术检测等方法进行了研究。本研究探讨allo-HSCT后植入不良的发生率及对患者预后的影响,以及移植后植入不良患者骨髓基质细胞(bone marrow stromal cells, BMSCs)上黏附分子相关抗原的表达情况。
1 材料与方法 1.1 植入不良定义allo-HSCT后植入不良(poor graft function, PGF)虽然受到较多关注,但目前标准尚不统一。国内外许多专家对其有不同定义[3-5]。我们结合文献与临床的易操作性,将PGF定义为:异基因造血干细胞移植造血重建且+28 d后,完全供者嵌合、无严重GVHD及疾病复发,骨髓增生程度活跃及以下,并符合下列标准之一或以上,持续时间超过3 d:ANC≤0.5×109/L、血小板≤20×109/L、血红蛋白≤70 g/L(因ABO血型不合移植可能会引起allo-HSCT后纯红再障[6],因而单一血红蛋白减低者须排除ABO血型不合)。
1.2 患者资料与分组收集陆军军医大学(第三军医大学)第二附属医院血液科2016年行allo-HSCT患者118例,其中男:女= 75: 43,年龄1~61岁,中位年龄26岁。所有患者符合前述定义者纳入植入不良(PGF)组,不符合者纳入植入良好(good graft function, GGF)组,两组患者在年龄、原发病、干细胞来源、HLA配型、性别匹配、ABO血型匹配等方面差异均无统计学意义(P > 0.05),基本资料见表 1。统计截止时间为2017年9月。
| 项目a | PGF组(n=47) | GGF组(n=71) | P值 |
| 年龄(中位数) | 28 | 25 | > 0.05 |
| 性别(男:女) | 35: 12 | 40: 31 | < 0.05 |
| 原发病 | > 0.05 | ||
| AML | 21 | 35 | |
| ALL/LBL | 8 | 12 | |
| MDS | 4 | 5 | |
| AA | 7 | 13 | |
| CML | 3 | 1 | |
| T-LBL | 2 | 2 | |
| 噬血细胞综合征 | 1 | 0 | |
| MAL | 1 | 2 | |
| ALK-ALCL | 0 | 1 | |
| 干细胞来源 | > 0.05 | ||
| 外周血 | 16 | 27 | |
| 外周血+骨髓 | 31 | 44 | |
| HLA配型 | > 0.05 | ||
| 全相合 | 14 | 27 | |
| 不全相合 | 33 | 44 | |
| 性别匹配 | > 0.05 | ||
| F to M | 9 | 15 | |
| F to F | 5 | 8 | |
| M to F | 9 | 21 | |
| M to M | 17 | 24 | |
| 非血缘(骨髓来源性别不明) | 7 | 3 | |
| ABO血型匹配 | > 0.05 | ||
| 血型相合 | 27 | 42 | |
| 血型不合 | 20 | 29 | |
| a:年龄项数据单位为岁,其余项数据为例数;F:女性;M:男性 | |||
1.3 试验分组及患者资料
根据上述定义选取28例患者作为植入不良组(研究组),另选取27例植入良好组作为对照组。两组患者在性别、年龄、原发病、移植前骨髓增生程度、移植后GVHD发生率方面比较差异均无统计学意义,在移植后CMV感染方面比较差异有统计学意义(P < 0.01)。如某项指标两组比较差异有统计学意义,则针对该项指标设置正常对照组。患者基本资料见表 2。
| 项目a | 研究组(n=28) | 对照组(n=27) | P值 |
| 性别(男:女) | 20: 8 | 14: 13 | 0.171 |
| 年龄[中位数(范围)] | 28(3~49) | 28(7~58) | 0.586 |
| 原发病 | 0.316 | ||
| ALL | 7 | 5 | |
| AML | 13 | 17 | |
| CML | 4 | 0 | |
| MAL | 0 | 1 | |
| MDS | 2 | 3 | |
| T-LBL | 1 | 1 | |
| 噬血细胞综合征 | 1 | 0 | |
| 骨髓增生程度 | 0.940 | ||
| 增生减低 | 3 | 3 | |
| 增生活跃 | 4 | 3 | |
| 增生明显活跃 | 19 | 20 | |
| 增生极度活跃 | 2 | 1 | |
| CMV感染 | 19 | 5 | < 0.001 |
| 1~2级GVHD | 5 | 5 | 1.000 |
| a:年龄项数据单位为岁,其余项数据为例数 | |||
1.4 检测时间点
患者均选择移植术前最后1次骨髓病理活检作为检测时间点,时间跨度为-83~-10d,中位时间为-21 d。
1.5 试验方法及抗体选择蜡块包埋标本连续切片2.5 μm,防脱捞片,60 ℃烤2 h,环保脱蜡液脱蜡,梯度酒精复水,柠檬酸高压抗原修复,3% H2O2 20 min灭活内源性过氧化物酶,小牛血清封闭,加一抗4 ℃过夜孵育,PBS液洗6 min×3次,加二抗室温孵育20 min,PBS液洗6 min×3次,镜下观察DAB显色,PBS冲洗终止,苏木精复染胞核,盐酸酒精分化,1%碳酸锂返蓝,梯度酒精脱水,中性树胶封片,显微镜观察。以PBS液替代一抗作阴性对照。
免疫组化抗体CD44、CD105、CD29、CD90、ICAM-1、VCAM-1,稀释倍数1: 500,购自Abcam公司。二抗、DAB显色试剂盒、柠檬酸抗原修复液均购自福州迈新生物技术有限公司,环保脱蜡液、乙醇、3% H2O2、枸橼酸钠等由我院药剂科提供。切片机,包埋机购自德国徕卡公司。显微镜为奥林巴斯产BX53。
1.6 免疫组化结果定量读取应用高清晰图像采集系统拍摄所有标本免疫组化照片后使用Image-Pro Plus(IPP)6.0软件对所有照片进行计算机分析。本试验所用样本的免疫组化染色均保持完全一致的试验条件,并在同参数条件下行显微摄影,所有照片一次性拍摄完成。拍摄完成的照片使用IPP软件分析,测量照片中阳性部分的累积光密度(integrated optical density,IOD)。
1.7 统计学分析采用SPSS 19.0统计软件进行分析。两组患者间性别、原发病、干细胞来源、HLA配型、性别匹配、ABO血型匹配、移植前是否缓解、移植前骨髓增生程度等临床资料的比较采用χ2检验。将上述可能影响患者生存的因素作为变量纳入Cox回归,采用逐步前进法进行多因素分析。移植后出现植入不良的细胞系数量(0、1、2、3系)对患者生存的影响采用χ2检验及K-M生存函数分析。两组患者间复发率及病死率比较采用χ2检验。两组CD44、CD105、CD29、CD90、ICAM-1、VCAM-1免疫组化染色的IOD值比较采用秩和检验。检验水准:α=0.05。
2 结果 2.1 临床资料植入不良的PGF组患者复发率(22.7%)与病死率(46.6%)均显著高于植入良好的GGF组(7.4%,14.5%,P < 0.05)。
PGF组与GGF组间在年龄、原发病、干细胞来源、HLA配型、性别匹配、ABO血型匹配、移植前骨髓增生程度等因素差异均无统计学意义(P > 0.05), 而PGF组移植后CMV感染率显著高于GGF组,PGF组移植前缓解率显著低于GGF组,差异有统计学意义(P < 0.05)。经Cox回归分析发现,allo-HSCT后出现PGF的患者生存率明显低于未出现患者(P < 0.05,HR=3.598)。
allo-HSCT后PGF组患者可出现1系[血红蛋白(H)/血小板(P)/中性粒细胞绝对值(A)]、2系(H+P/H+A/A+P)、3系(H+P+A)血细胞减少,而GGF组患者则有0系减少,两组患者经χ2检验及K-M生存函数分析发现,0系减少与1、2、3系减少患者间在生存率上差异有统计学意义(P < 0.05),而1、2、3系减少之间却对生存率没有影响(P > 0.05)。移植后出现植入不良的血细胞系数量对生存影响见图 1。
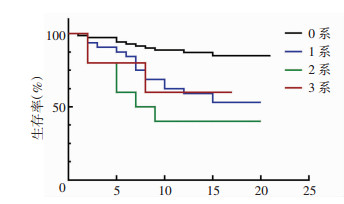
|
| 0系:未出现血细胞减少;1系:出现1系[血红蛋白(H)/血小板(P)/中性粒细胞绝对值(A)]血细胞减少;2系:出现2系(H+P/H+A/A+P)血细胞减少;3系:出现3系(H+P+A)血细胞减少 图 1 移植后出现植入不良的血细胞系数量对生存的影响 |
2.2 免疫组化染色结果
结果见图 2。经IPP软件测量,CD105 IOD值[M(Q)]为研究组32 569.7(26 824.9),对照组14 091.1(5 694.1),研究组明显高于对照组(P < 0.05)。针对CD105设正常对照组,其IOD值[M(Q)]为2 367.5(1 454.2),研究组及对照组CD105 IOD值均显著高于正常对照组(P < 0.05)。而研究组与对照组CD44、CD29、ICAM-1、VCAM-1 IOD值[M(Q)]分别为11 476.2 (4 770.5) vs 6 499.0(3 276.1)、9 450.5(6 666.8) vs 7 284.8(4 159.5)、1 061.6(1 014.2) vs 469.7 (372.9)、69 258.3(46 892.7) vs 51 024.7(38 621.5),差异均无统计学意义(P > 0.05)。
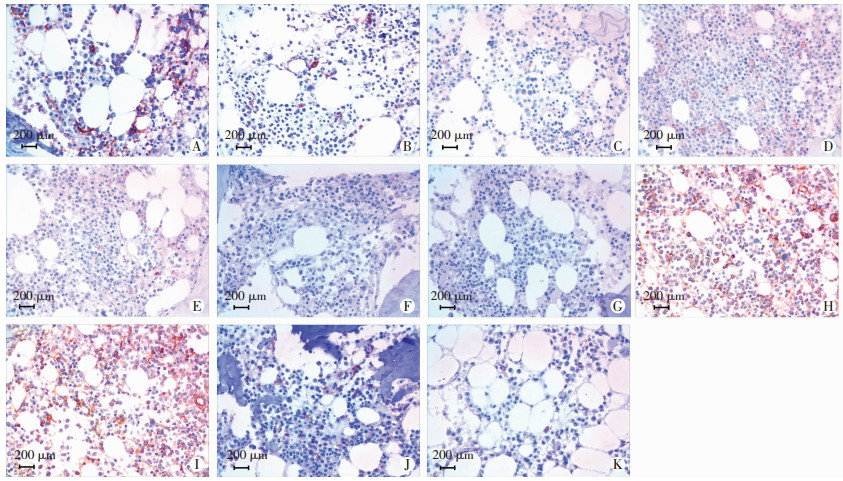
|
| A:研究组CD105;B:对照组CD105;C:正常对照组CD105;D:对照组CD29;E:研究组CD29;F:研究组ICAM-1;G:对照组ICAM-1;H:研究组VCAM-1;I:对照组ICAM-1;J:研究组CD44;K:对照组CD44 图 2 各组标本免疫组化染色结果(S-P) |
3 讨论
异基因造血干细胞移植是治疗恶性血液系统疾病的重要方法,目前已得到广泛应用。但人们也逐渐认识到allo-HSCT后可能出现诸多并发症,干细胞移植后植入不良是其中较为严重的致死性并发症之一[1]。
allo-HSCT后PGF发生率较高,达5%~27%[7]。我科2016年行allo-HSCT的患者共118例,移植后出现1系减低的患者占26.3%(31/118),出现2系减低的占9.3%(11/118),出现3系减低的占4.2%(5/118),共有39.8%(47/118)的患者出现PGF,发生率略高于文献报道,可能与我们目前采用的PGF定义扩大范围有关。
PGF的诊断十分重要,以我科标准进行分组后统计,PGF组移植后复发率及病死率均明显高于GGF组,且经Cox回归分析结果显示,患者allo-HSCT后出现PGF是影响其生存率的独立危险因素。
但PGF的诊断目前国内外尚无统一标准,如STASIA[8]、HAEN等[3]均独立对其进行了定义。本研究结果显示,移植后出现1系[血红蛋白(H)≤70 g/L/血小板(P)≤20×109/L中性粒细胞绝对值(A)≤0.5×109/L]、2系(H+P/H+A/A+P)、3系(H+P+A)血细胞减少的患者在生存率上与未出现血细胞减低的患者比较差异均有统计学意义(P < 0.05),后者明显高于前者,而出现1、2、3系血细胞减低的患者之间比较差异却无统计学意义。因此,我们倾向于将1、2、3系血细胞减低均纳入PGF的定义标准中来,以便更好预测患者预后。
异基因造血干细胞移植后出现植入不良与许多因素相关,如GVHD、CD34+细胞数、病毒感染等,其中骨髓基质细胞损伤也是重要因素之一。文献[2]报道间充质干细胞输注可以促进患者造血重建,但具体机制值得深入研究。
骨髓基质细胞(BMSCs)是骨髓间充质干细胞、成/破骨细胞、脂肪细胞、成纤维细胞、血管内皮细胞等一类细胞的总称,通常认为BMSCs没有特异性标记物,而是表达CD29、CD44、CD49、CD90、CD105、CD106、ICAM-1等分子[9-11]。本研究选择的CD44、CD29、ICAM-1、VCAM-1均为BMSCs分泌的黏附分子,可以介导造血细胞间或造血细胞与基质细胞的连接,但经统计学处理结果显示,上述分子在研究组与对照组间差异并无统计学意义。
FONSATTI等[12]描述CD105是表达在血管内皮细胞膜上的糖蛋白,相对分子质量约为68 051。它在恶性肿瘤的新生血管及高度增生的血管内皮细胞上高表达。更有研究表明,肿瘤相关微血管常强表达CD105,而泛血管标记CD31、CD34、Ⅷ-RA却不表达或弱表达[13-14]。本试验结果证实,研究组在异基因造血干细胞移植前的骨髓病理切片中CD105表达明显高于对照组。这是否意味着研究组患者的骨髓基质细胞受到来自肿瘤细胞的影响会生成更多的微血管?间充质干细胞输注改善患者造血重建时间的机制是否包括提前修复CD105+的微血管?这些都有待进一步研究。且本试验结果显示,正常对照组内CD105的表达明显低于研究组与对照组,提示随着CD105表达的增高,即肿瘤相关微血管的增多,发生干细胞移植后植入不良的风险也会随之增高。
总之,患者allo-HSCT后出现植入不良是影响其预后的重要危险因素,与PGF相关的影响因素很多,如移植物的质量[15]、ABO血型匹配[16]、病毒感染、GVHD、造血微环境受损[17]、患者营养状态[18]等。骨髓基质细胞的数量及相关黏附分子的表达在异基因造血干细胞移植后造血重建中起着非常重要的作用,CD105在移植前即在继发性植入不良患者骨髓中高表达,提示这可能是预测继发性植入不良的一个新靶点。
| [1] |
王莹, 樊星, 王苓, 等. 异基因造血干细胞移植后死亡原因分析[J].
内科理论与实践, 2014, 9(4): 270–273.
WANG Y, FAN X, WANG L, et al. Analysis of the causes of death after allogeneic hematopoietic stem cell transplantation[J]. J Intern Med Concepts Pract, 2014, 9(4): 270–273. DOI:10.3969/j.issn.1673-6087.2014.04.008 |
| [2] |
马俐君, 胡晓霞, 周虹, 等. 间充质干细胞与人脐血CD34+细胞共移植对NOD/SCID小鼠造血重建的影响[J].
中华血液学杂志, 2008, 29(10): 684–688.
MA L J, HU X X, ZHOU H, et al. Study on hematopoiesis reconstitution by co-transplant of human bone marrow mesenchymal stem cells and umbilical cord blood CD34+ cells at different ratios in NOD/SCID mice[J]. Chin J Hematol, 2008, 29(10): 684–688. DOI:10.3321/j.issn:0253-2727.2008.10.009 |
| [3] | HAEN S P, SCHUMM M, FAUL C, et al. Poor graft function can be durably and safely improved by CD34+-selected stem cell boosts after allogeneic unrelated matched or mismatched hematopoietic cell transplantation[J]. J Cancer Res Clin Oncol, 2015, 141(12): 2241–2251. DOI:10.1007/s00432-015-2027-x |
| [4] | MASOURIDI-LEVRAT S, SIMONETTA F, CHALANDON Y. Immunological basis of bone marrow failure after allogeneic hematopoietic stem cell transplantation[J]. Front Immunol, 2016, 7(4): 362. DOI:10.3389/fimmu.2016.00362 |
| [5] | KONG Y, WANG Y T, HU Y, et al. The bone marrow micro environment is similarly impaired in allogeneic hematopoietic stem cell transplantation patients with early and late poor graft function[J]. Bone Marrow Transplant, 2016, 51(2): 249–255. DOI:10.1038/bmt.2015.229 |
| [6] | SNELL M, CHAU C, HENDRIX D, et al. Lack of iso-hemagglutinin production following minor ABO incompatible unrelated HLA mismatched umbilical cord blood transplantation[J]. Bone Marrow Transplant, 2006, 38(2): 135–140. DOI:10.1038/sj.bmt.1705409 |
| [7] | KONG Y, CHANG Y J, WANG Y Z, et al. Association of an impaired bone marrow microenvironment with secondary poor graft function after allogeneic hematopoietic stem cell transplantation[J]. Biol Blood Marrow Transplant, 2013, 19(10): 1465–1473. DOI:10.1016/j.bbmt.2013.07.014 |
| [8] | STASIA A, GHISO A, GALAVERNA F, et al. CD34 selected cells for the treatment of poor graft function after allogeneic stem cell transplantation[J]. Biol Blood Marrow Transplant, 2014, 20(9): 1440–1443. DOI:10.1016/j.bbmt.2014.05.016 |
| [9] |
李明辉, 田丁, 刘聪燕, 等. 人骨髓间充质干细胞的培养及研究[J].
首都医科大学学报, 2005, 26(2): 183–186.
LI M H, TIAN D, LIU C Y, et al. Culture of human bone marrow mesenchymal stem cells[J]. J Capital Med Univ, 2005, 26(2): 183–186. DOI:10.3969/j.issn.1006-7795.2005.02.023 |
| [10] |
李梅, 朱艳华, 张瑜, 等. CD105的研究现状[J].
现代医药卫生, 2004, 20(21): 2255–2256.
LI M, ZHU Y H, ZHANG Y, et al. Research status of CD105[J]. Mod Med Health, 2004, 20(21): 2255–2256. DOI:10.3969/j.issn.1009-5519.2004.21.041 |
| [11] |
常城, 陈幸华, 孔佩艳, 等. 全反式维甲酸对外周血干细胞移植患者骨髓基质细胞黏附分子表达及黏附力的影响[J].
中国实验血液学杂志, 2006, 14(4): 768–772.
CHANG C, CHEN X H, KONG P Y, et al. In vitro effect of all-trans retinoic acid on cell adhesion molecule expression and adhesion capacity of bone marrow stromal cells in patients received peripheral blood stem cell transplantation[J]. J Exp Hematol, 2006, 14(4): 768–772. DOI:10.3969/j.issn.1009-2137.2006.04.030 |
| [12] | FONSATTI E, DEL VECCHIO L, ALTOMONTE M, et al. Endoglin: an accessory component of the TGF-beta-binding receptor-complex with diagnostic, prognostic, and bioimmunotherapeutic potential in human malignancies[J]. J Cell Physiol, 2001, 188(1): 1–7. DOI:10.1002/jcp.1095 |
| [13] | WANG J M, KUMAR S, PYE D, et al. Breast carcinoma: comparative study of tumor vasculature using two endothelial cell markers[J]. J Natl Cancer Inst, 1994, 86(5): 386–388. DOI:10.1093/jnci/86.5.386 |
| [14] | AKAGI K, IKEDA Y, SUMIYOSHI Y, et al. Estimation of angiogenesis with anti-CD105 immunostaining in the process of colorectal cancer development[J]. Surgery, 2002, 131(1suppl): S109–S113. DOI:10.1067/msy.2002.119361 |
| [15] |
王晓宁, 张梅, 贺鹏程, 等. 异基因造血干细胞移植中回输造血干细胞的量和回输时受者白细胞数与疾病预后关系分析[J].
中国实验血液学杂志, 2013, 21(6): 1530–1534.
WANG X N, ZHANG M, HE P C, et al. Relation of reinfused hematopoietic stem cell volume and recipient's leukocyte count at reinfusion with prognosis of disease in allo-hematopoietic stem cell transplantation[J]. J Exp Hematol, 2013, 21(6): 1530–1534. DOI:10.7534/j.issn.1009-2137.2013.06.031 |
| [16] |
蔡雪娇, 孙岚, 谢作听, 等. ABO血型不合对清髓异基因造血干细胞移植造血重建的影响[J].
中华移植杂志:电子版, 2012, 6(4): 250–253.
CAI X J, SUN L, XIE Z T, et al. Effect of ABO-incompatible myeloablative allogeneic hematopoietic stem cell transplantation on hematopoietic engraftment[J]. Chin J Transplant (Electronic Edition), 2012, 6(4): 250–253. DOI:10.3877/cma.j.issn.1647-3903.2012.04.004 |
| [17] |
宋国梁, 潘彬, 齐昆明, 等. HSCT联合不同剂量内皮祖细胞输注对小鼠造血重建的影响[J].
中华器官移植杂志, 2011, 32(11): 688–692.
SONG G L, PAN B, QI K M, et al. Effects of endothelial progenitor cell combined with allogeneic bone marrow transplantation on hematopoietic reconstitution in mice[J]. Chin J Organ Transplant, 2011, 32(11): 688–692. DOI:10.3760/cma.j.issn.0254-1785.2011.11.012 |
| [18] |
杨贞, 吴德沛, 徐杨, 等. 造血干细胞移植前营养状态与造血重建的关系[J].
中华血液学杂志, 2012, 33(6): 496–498.
YANG Z, WU D P, XU Y, et al. Relationship between nutritional status and hematopoietic reconstitution before transplantation of hematopoietic stem cells[J]. Chin J Hematol, 2012, 33(6): 496–498. DOI:10.3760/cma.j.issn.0253-2727.2012.06.019 |



