2. 450042 郑州,河南省人民医院内分泌科
2. Department of Endocrinology, Henan Provincial People's Hospital, Zhengzhou, Henan Province, 450042, China
糖尿病肾病(diabetic nephropathy, DN)是糖尿病(diabetes mellitus,DM)最主要的一种微血管并发症,也是西方发达国家终末期肾衰竭(endstagerenaldisease, ESRD)的首要病因[1]。2010年我国流行病学调查资料显示,成人DM的患病率为11.6%[2]。资料显示,30%以上的DM患者在病程10~20年时会发展为临床DN[3]。DN的发病机制尚不清楚,至今缺乏有效的治疗和延缓进展的措施,除降糖治疗以外,只能针对相关危险因素如高血压、高血脂等进行治疗,即使是目前循证医学证实最有效的药物肾素血管紧张素系统抑制剂(renin-angiotensin-systeminhibitors, RASI)[4-5], 其效果也多是减少蛋白尿,延缓肾功能下降速率,且存在升高血钾和引起急性肾损伤等的高风险,临床应用不便。本课题组前期研究发现,内质网应激介导炎症级联反应是DN的重要发病机制,使用调控内质网应激的分子伴侣可以有效减少DN大鼠尿蛋白排泄量,证明调控内质网应激可能是开发治疗DN的重要药物靶标[6]。
熊胆是我国的传统珍稀药材,历史达3 000余年,被广泛应用于内分泌系统、心血管系统、消化系统、肿瘤等病证的治疗。熊去氧胆酸(ursodeoxycholic acid,UDCA)是熊胆发挥药理作用的主要成分。近年研究发现UDCA是一种天然的帮助内质网蛋白质折叠的分子伴侣,可以有效调控内质网应激能力,包括既减轻内质网应激偶联的炎症和凋亡信号激活,又增加XBP1通路-胰岛素代谢信号的有效传递[7-10]。本研究拟观察UDCA治疗DN Ⅲ期患者的临床疗效,为寻找新的治疗DN手段提供线索。
1 资料与方法 1.1 研究对象 1.1.1 患者纳入标准① 参照美国糖尿病协会(American Diabetes Association,ADA)和美国肾脏基金会(National Kidney Foundation,NKF)DN诊断标准, 明确诊断为DN Ⅲ期[尿白蛋白排出率(urinary albumin excretion, UAE)为20~200 μg/min和/或尿蛋白/肌酐比值(albumin to creatinine ratio, ACR)为30~300 mg/g];②年龄30~70岁、性别不限;③血压、血脂易于控制在正常范围;④患者同意,并签署知情同意书。
1.1.2 排除标准① 对UDCA过敏;②合并有心脑肝以及造血系统等疾病;③妊娠及哺乳期患者;④急性胆囊炎和胆管炎、胆道阻塞(胆囊管、胆总管)患者;⑤慢性腹泻患者。
1.1.3 中止标准① 严重违反试验方案用药者;②失访或自行退出试验者;③患者试验期间妊娠。
1.2 研究方法 1.2.1 患者分组及治疗采用随机序列软件产生50个随机序列数,然后按患者就诊顺序,依次从前至后取用随机序列数,以奇数者入试验组、偶数者入对照组的随机分组方法将入选的DN患者分为2组:①厄贝沙坦组(阳性对照组),患者口服厄贝沙坦片150 mg(商品名:安博维,赛诺菲制药有限公司生产,规格:片剂,150 mg/片),1次/d,晨服;②UDCA组,患者晨间饭后口服熊去氧胆酸胶囊250 mg(四川科瑞德制药有限公司生产,规格:胶囊剂,250 mg/粒),1次/d。本研究采用UDCA的口服剂量为最低剂量。本研究中使用药品及其公司与本研究无利益冲突。在观察期间,2组患者均坚持既往的基础治疗:①降糖药(口服或胰岛素治疗),使血糖控制在正常范围(空腹血糖≤6.1 mmol/L,餐后血糖≤11.1 mmol/L);②降压药,合并高血压病患者,均采用硝苯地平控释片治疗,血压控制在140/90 mmHg以内;③扩血管药物(主要是硝酸酯类);④抗凝药(阿司匹林或氢氯比格雷);⑤β受体阻滞剂。观察时间为12个月。
1.2.2 随访流程按统一纳入标准选择50例患者,但因为种种原因,如其他疾病、配合不良、不良反应较为严重、生活环境变化巨大、失访等,有10例退出,最后有40例纳入本研究,其中厄贝沙坦组20例,UDCA组20例。随机试验流程见图 1。入选40例患者,全部按要求用药并完成12个月随访干预。
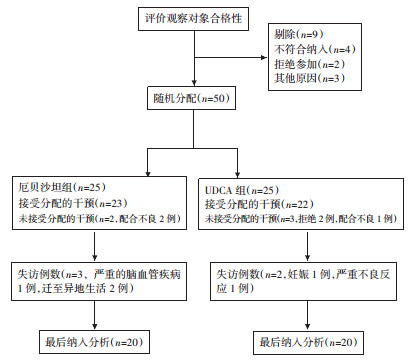
|
| 图 1 随机试验流程 |
1.2.3 观察指标
在治疗前和治疗后3、6、9、12个月,分别检测尿微量白蛋白、白蛋白/肌酐值、空腹血糖、餐后2 h血糖、肝肾功、血脂、肝酶谱、血常规、血钾,并根据MDRD简化公式[11]计算肾小球滤过率(eGFR)、血液中炎症细胞因子C-反应蛋白(C-reactive protein,CRP)、白介素-6(IL-6)、肿瘤坏死因子(TNF-α)。每次随访时记录患者可能存在的不良反应。
1.2.4 血尿标本留取方法按标准方法留取晨7点起止的24 h尿液,二甲苯为防腐剂,测量24 h尿容积,混匀后取3 mL标本送检;随机尿,取当日晨尿送检;血标本收集,按各血液指标标本抗凝要求,留取随访当日晨间空腹血送检。
1.2.5 生化指标检测方法① 尿蛋白/肌酐值测定:用免疫比浊法检测尿微量白蛋白(mALB),用酶法测定尿肌酐,根据尿ALB浓度、尿肌酐,计算蛋白肌酐比值。②血常规采用全自动血球计数仪检测,CRP采用免疫比浊法测定,血浆IL-6、TNF-α采用酶联免疫吸附法测定,血白蛋白采用溴甲酚绿法测定,血肌酐、血脂均采用酶法检测,谷丙转氨酶、谷草转氨酶均采用速率法分析,空腹血糖、餐后2 h血糖均采用GOD-PAP法检测。
1.3 统计学分析采用SPSS 18.0统计软件,统计数据呈正态分布,计量资料以x±s表示,行t检验,计数资料采用χ2检验。采用队列研究模式,以厄贝沙坦治疗为阳性对照组,观察UDCA治疗对降低DN患者尿白蛋白漏出是否有效,即非劣效性研究。检验水准α=0.05。
2 结果 2.1 两组患者基线资料比较两组患者在年龄、性别构成、糖尿病病程、初始UAE水平、eGFR水平等基线数据方面,差异无统计学意义(P>0.05,表 1),具有可比性。
| 组别 | n | 年龄/岁 | 性别(男/女) | 糖尿病病程/年 | 尿蛋白/肌酐值/mg·g-1 | eGFR/mL·min-1·1.73m-2 |
| 厄贝沙坦组 | 20 | 44.2±13.4 | 12/8 | 12.1±10.4 | 57.24±24.46 | 98.36±17.57 |
| UDCA组 | 20 | 44.6±12.9 | 13/7 | 12.9±9.5 | 53.05±18.50 | 94.23±26.65 |
2.2 厄贝沙坦和UDCA治疗对DN患者尿白蛋白漏出和肾功能的保护效应
厄贝沙坦治疗12个月后尿蛋白/肌酐值下降14.94%,血肌酐下降7.73%,血白蛋白上升13.38%,eGFR治疗后增加8.64%,各项指标治疗前后差异均有统计学意义(P < 0.05,表 2)。
| 时间 | 尿蛋白/肌酐值/mg·g-1 | 血肌酐/μmol·L-1 | 血白蛋白/g·L-1 | eGFR/mL·min-1·1.73 m-2 |
| 治疗前 | ||||
| 厄贝沙坦组 | 57.24±24.46 | 69.85±8.20 | 34.00±3.74 | 98.36±17.57 |
| UDCA组 | 53.05±18.50 | 73.85±10.79 | 36.60±4.38 | 94.23±26.65 |
| 治疗后3个月 | ||||
| 厄贝沙坦组 | 54.81±22.97a | 69.10±9.70 | 35.25±3.84a | 99.33±19.57 |
| UDCA组 | 52.47±17.38 | 73.15±11.54 | 37.05±4.70a | 95.21±26.86 |
| 治疗后6个月 | ||||
| 厄贝沙坦组 | 52.56±22.41a | 67.85±9.18 | 36.60±4.36a | 102.84±22.69 |
| UDCA组 | 51.72±16.88 | 71.50±11.53 | 37.40±4.94a | 98.29±28.09 |
| 治疗后9个月 | ||||
| 厄贝沙坦组 | 51.04±22.30a | 65.50±8.68a | 37.05±4.90a | 104.70±21.18a |
| UDCA组 | 50.09±15.43a | 70.95±11.61a | 38.60±5.16a | 98.70±25.75 |
| 治疗后12个月 | ||||
| 厄贝沙坦组 | 48.69±21.95a | 64.45±8.70a | 38.55±4.88a | 106.86±23.99a |
| UDCA组 | 47.54±12.34a | 69.35±10.94a | 40.05±4.74a | 101.21±26.76a |
| a:P < 0.05,与同组治疗前比较 | ||||
UDCA治疗12个月后尿蛋白/肌酐值下降10.39%,血白蛋白上升13.38%,血肌酐下降6.49%,血白蛋白上升9.43%,eGFR治疗后增加7.41%,各项指标治疗前后差异均有统计学意义(P < 0.05)。
将两组同时间点各项指标进行比较,包括尿蛋白/肌酐值、血浆白蛋白绝对值、eGFR各项指标,差异均无统计学意义(P>0.05)。提示UDCA治疗DN患者具有与厄贝沙坦等效的降低尿蛋白漏出和保护肾功能延缓肾功能下降的效果。
2.3 厄贝沙坦和UDCA治疗对DN患者肝功能、血常规的影响厄贝沙坦组治疗后血液白细胞总数(WBC)、血钾有轻度升高,而红细胞总数(RBC)有轻度降低,但在正常范围。与治疗前比较,UDCA组治疗后血液WBC、血钾有轻度升高,差异有统计学意义(P < 0.05)。两组患者治疗前后谷丙转氨酶、谷草转氨酶均未见显著性变化。见表 3。
| 组别 | WBC/×109·L-1 | RBC/×1012·L-1 | HB/g·L-1 | PLT/×109·L-1 | 谷丙转氨酶/U·L-1 | 谷草转氨酶/U·L-1 | 血钾/mmol·L-1 |
| 厄贝沙坦组 | |||||||
| 治疗前 | 5.77±0.83 | 4.09±0.61 | 139.07±21.76 | 234.45±46.51 | 28.75±8.12 | 29.90±6.96 | 4.32±0.51 |
| 治疗后 | 6.93±0.85a | 3.98±0.67a | 136.72±22.06 | 232.60±38.52 | 28.10±7.04 | 31.70±7.09 | 4.43±0.50a |
| UDCA组 | |||||||
| 治疗前 | 6.18±0.86 | 4.12±0.62 | 140.10±26.08 | 228.70±34.53 | 32.50±8.39 | 31.35±8.77 | 4.02±0.48 |
| 治疗后 | 6.79±1.15a | 4.06±0.62 | 138.10±24.35a | 227.05±32.85 | 29.80±6.87 | 29.05±6.56 | 4.06±0.44a |
| a:P < 0.05,与同组治疗前比较 | |||||||
2.4 UDCA治疗不良反应情况
本研究过程中,UDCA治疗患者未见心悸、胸痛、头晕目眩等明显心脑血管不适。仅在治疗初始阶段2例患者出现轻度腹泻,但经对症治疗后均能消失,继续坚持治疗。
2.5 厄贝沙坦和UDCA治疗对DN患者炎症细胞因子清除效应两组治疗前后血浆中炎症细胞因子均明显下降,其中,厄贝沙坦组CRP含量降低13.7%,IL-6降低8.7%,TNF降低15.9%,UDCA组CRP含量降低16.2%,IL-6降低14.1%,TNF-α降低16.8%,差异均有统计学意义(P < 0.05,表 4)。提示UDCA具有与厄贝沙坦等效的清除患者体内炎症细胞因子的效果。
| 组别 | n | CRP/mg·L-1 | IL-6/ng·L-1 | TNF-α/ng·L-1 |
| 厄贝沙坦组 | 20 | |||
| 治疗前 | 6.50±2.24 | 12.26±2.44 | 41.56±12.55 | |
| 治疗后 | 5.61±2.08a | 11.19±2.09a | 34.97±10.98a | |
| UDCA组 | 20 | |||
| 治疗前 | 5.98±1.30 | 12.38±2.19 | 37.54±10.84 | |
| 治疗后 | 5.01±1.40a | 10.64±1.79a | 31.22±9.52a | |
| a: P < 0.05,与组内治疗前比较 | ||||
3 讨论
DN的发病率在逐年增加,目前已是肾衰竭透析患者的主要致病因素。1型糖尿病的肾病发生率约为40%,2型糖尿病的肾病发生率约为20%,常发生在糖尿病起病后5~10年。目前一般认为DN的影响因素主要有:①血流动力学异常;②持续高血糖造成的代谢异常(包括形成晚期糖基化终末产物,促进细胞外基质增加,促进动脉硬化;多元醇路激活,造成细胞高渗、水肿,细胞破坏,组织损伤;蛋白激酶C信号传导通路激活,生长转化因子β1、血管内皮生长因子和血管活性激素造成细胞外基质形成及血管收缩,通透性增加,产生蛋白尿);③高血糖的直接影响;④遗传因素和环境因素[12]。
近年,内质网应激通过偶联的炎症信号通路激活参与DN肾小球硬化(系膜细胞向增殖表型转化、系膜基质大量合成积聚)的发病机制受到广泛关注[13-14],也发现内质网应激通路基因突变患者合并典型的肾小球和小管病变[15]。DM患者胰岛素信号异常与内质网应激导致通路XBP1功能受损两者是一条信号链上的节点,是DN足细胞破坏的主要环节[16],同时内质网应激(endoplasmic reticulum stress,ERS)过度促使肾小管上皮细胞老化加速[17]。本课题组从2005年开始,专注探索细胞内质网应激偶联细胞内炎症信号分子通路在细胞表型转化中的作用,从细胞模型和动物模型均证明高糖通过诱导内质网应激介导系膜细胞增殖表型和肾小球硬化,应用分子伴侣药物4-苯丁酸钠、甜菜碱治疗db/db小鼠,不仅可显著抑制小鼠肾小球系膜细胞内质网应激及其偶联的炎症信号激活、TGF-β1和MCP-1为代表的细胞炎症因子表达,还明显抑制系膜细胞增殖、系膜基质的合成,减轻尿蛋白的漏出[6]。跟炎症反应类似,内质网应激本身是对内环境暂时紊乱的一个生理反应,只是反应强度失控导致了持续性细胞病理改变以至器官疾病形成。研究发现ARB类药物具有降低CRP、IL-1、IL-6的作用[11]。同时,单核细胞趋化蛋白-1(MCP-1)在肾组织的表达引起的单核/巨噬细胞(MO/Mφ)的浸润与糖尿病的肾脏病变密不可分, ARB类药物通过抑制MCP-1的表达, 减少MO/Mφ浸润, 通过影响转录因子NF-κB抑制IL-1、IL-6、TNF等细胞因子的分泌,明显改善肾功能, 延缓DN的发生发展[18]。本研究还发现,给予DN患者以最小剂量UDCA治疗后,患者血液中炎症细胞因子(CRP、TNF-α、IL-6)含量减少,抑制DN患者肾脏炎症反应的发生,同时减轻了尿蛋白的漏出,从临床层面进一步支持了调控内质网应激可能是临床治疗DN的潜在干预靶点。
UDCA是熊胆发挥药理作用的主要成分。近年在细胞和动物模型研究均证明,UDCA可有效修复糖尿病时胰岛功能,减轻胰岛素抵抗,显著抑制高糖诱导的系膜细胞表型转化、足细胞和小管细胞凋亡、肾小球硬化、尿蛋白漏出[6, 9]。研究表明,UDCA可以抑制DN模型小鼠的调控肾小球和肾小管内质网应激的关键标志物的活性,也可以抑制氧化和减轻脂质介导的内质网应激,从而通过抑制内质网应激改善DN的疾病状态[19-20]。在人类糖尿病治疗中,初步发现UDCA可明显提高肝脏和肌肉细胞的胰岛素敏感性[21]。并且,在韩国等进行的Ⅱ期临床治疗研究,证明UDCA治疗肌萎缩侧索硬化症和淀粉样变性安全有效[22]。
结合DN的发病机制[23]和UDCA的药理作用,从理论上推断UDCA对DN治疗有效。本研究应用UDCA对2型糖尿病合并微量白蛋白尿的患者进行为期12个月的治疗随访,设立对照组和治疗组,观察治疗过程中尿蛋白/肌酐值、eGFR的变化及治疗前后相关血液学指标的改变,初步探讨UDCA对DN的治疗作用及可能机制。研究发现,早期DN患者应用UDCA 6个月后尿蛋白/肌酐值显著下降,9个月后eGFR开始增加;治疗3个月后,厄贝沙坦组尿蛋白/肌酐值下降,6个月后eGFR开始增加;两组间比较,差异无统计学意义。说明UDCA具有与RASI相同的临床疗效,且无较多明显不良反应。
综上所述,本研究表明厄贝沙坦及UDCA可以延缓2型糖尿病合并微量白蛋白尿患者的病情,改善患者临床症状。但由于本研究为单中心研究,随访时间相对较短,总体样本量不足,样本类型也较为单一,为更加明确UDCA的药理作用对于DN患者的治疗机制,未来仍需要多中心、大样本的研究加以验证。
| [1] |
杨刚, 范秋灵, 刘晓丹, 等. 蛋白质组学及其在糖尿病肾病中的应用[J].
实用医学杂志, 2011, 27(10): 1892–1893.
YANG G, FAN Q L, LIU X D, et al. Proteomics and its application in diabetic nephropathy[J]. J Pract Med, 2011, 27(10): 1892–1893. DOI:10.3969/j.issn.1006-5725.2011.10.083 |
| [2] | GRAY S P, COOPER M E. Diabetic nephropathy in 2010: Alleviating the burden of diabetic nephropathy[J]. Nat Rev Nephrol, 2011, 7(2): 71–73. DOI:10.1038/nrneph.2010.176 |
| [3] | XU Y, WANG L, HE J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9): 948–959. DOI:10.1001/jama.2013.168118 |
| [4] | SONG M K, DAVIES N M, ROUFOGALIS B D, et al. Management of cardiorenal metabolic syndrome in diabetes mellitus: a phytotherapeutic perspective[J]. J Diabetes Res, 2014, 2014: 313718. DOI:10.1155/2014/313718 |
| [5] | ROSCIONI S S, HEERSPINK H J, DEZEEUW D. The effect of RAAS blockade on the progression of diabetic nephropathy[J]. Nat Rev Nephrol, 2014, 10(2): 77–87. DOI:10.1038/nrneph.2013.251 |
| [6] |
陈吉刚, 庞琦, 曾薇, 等. 甜菜碱对糖尿病肾病小鼠的治疗作用及其机制[J].
第三军医大学学报, 2012, 34(11): 1040–1043.
CHEN J G, PANG Q, ZEGN W, et al. Therapeutic effect of betaine on diabetic nephropathy in db/db mice[J]. J Third Mil Med Univ, 2012, 34(11): 1040–1043. |
| [7] | LIU J, YANG J R, CHEN X M, et al. Impact of ER stress-regulated ATF4/p16 signaling on the premature senescence of renal tubular epithelial cells in diabetic nephropathy[J]. Am J Physiol Cell Physiol, 2015, 308(8): C621–C630. DOI:10.1152/ajpcell.00096.2014 |
| [8] | LI J, WANG J J, ZHANG S X. Preconditioning with endoplasmic reticulum stress mitigates retinal endothelial inflammation via activation of x-box binding protein 1[J]. J Biol Chem, 2010, 286(6): 4912–4921. DOI:10.1074/jbc.m110.199729 |
| [9] | GAO X, FU L, XIAOM, et al. The nephroprotective effect of tauroursodeoxycholic acid on ischaemia/reperfusion-induced acute kidney injury by inhibiting endoplasmic reticulum stress[J]. Basic Clin Pharmacol Toxicol, 2012, 111(1): 14–23. DOI:10.1111/j.1742-7843.2011.00854.x |
| [10] | TANG C H, RANATUNGA S, KRISS C L, et al. Inhibition of ER stress-associated IRE-1/XBP-1 pathway reduces leukemic cell survival[J]. J Clin Invest, 2014, 124(6): 2585–2598. DOI:10.1172/JCI73448 |
| [11] |
吴丽婷, 刘梦琼. 胱抑素C联合eGFR-MDRD诊断早期DN的研究[J].
中国免疫学杂志, 2015, 31(10): 1394–1396, 1399.
WU L T, LIU M Q. Studies of cystatin C joint eGFR-MDRD for diagnosis of early DN[J]. Chin J Immunol, 2015, 31(10): 1394–1396, 1399. DOI:10.3969/j.issn.1000-484X.2015.10.021 |
| [12] | PALMER S C, MAVRIDIS D, NAVARESE E, et al. Comparative efficacy and safety of blood pressure-lowering agents in adults with diabetes and kidney disease: a network meta-analysis[J]. Lancet, 2015, 385(9982): 2047–2056. DOI:10.1016/S0140-6736(14)62459-4 |
| [13] | HOTAMISLIGIL G S. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease[J]. Cell, 2010, 140(6): 900–917. DOI:10.1016/j.cell.2010.02.034 |
| [14] | CUNARD R. Endoplasmic reticulum stress in the diabetic kidney, the good, the bad and the ugly[J]. J Clin Med, 2015, 4(4): 715–740. DOI:10.3390/jcm4040715 |
| [15] | DELEPINE M, NICOLINO M, BARRETT T, et al. EIF2AK3, encoding translation initiation factor 2-α kinase 3, is mutated in patients with Wolcott-Rallison syndrome[J]. Nat Genet, 2000, 25(4): 406–409. DOI:10.1038/78085 |
| [16] | MADHUSUDHAN T, WANG H, DONG W, et al. Defective podocyte insulin signalling through p85-XBP1 promotes ATF6-dependent maladaptive ER-stress response in diabetic nephropathy[J]. Nat Commun, 2015, 6: 6496. DOI:10.1038/ncomms7496 |
| [17] | RUILOPE L M, MALACCO E, KHDER Y, et al. Efficacy and tolerability of combination therapy with valsartan plus hydrochlorothiazide compared with amlodipine monotherapy in hypertensive patients with other cardiovascular risk factors:The VAST study[J]. Clin Ther, 2005, 27(5): 578–588. DOI:10.1016/j.clinthera.2005.05.006 |
| [18] |
黄欣, 许冬梅. 肾病药物治疗学[M]. 北京: 化学工业出版社, 2010: 209-210.
HUANG X, XU D M. Nephrotictherapy[M]. Beijing: Chemical Industry Press, 2010: 209-210. |
| [19] |
吴泽成, 刘慎微. 缬沙坦对2型糖尿病模型大鼠肾组织巨噬细胞浸润的影响[J].
医药导报, 2008, 27(3): 268–271.
WU Z C, LIU S W. Effect of valsartan on macrophage infiltration in renal tissue of type 2 diabetic rats[J]. Herald Med, 2008, 27(3): 268–271. DOI:10.3870/j.issn.1004-0781.2008.03.007 |
| [20] | CAO A, WANG L, CHEN X, et al. Ursodeoxycholicacid ameliorated diabetic nephropathy by attenuating hyperglycemia-mediated oxidative stress[J]. Biol Pharm Bull, 2016, 39(8): 1300–1308. DOI:10.1248/bpb.b16-00094 |
| [21] | VANG S, LONGLEY K, STEER C J, et al. The unexpected uses of urso-and tauroursodeoxycholicacid in the treatment of non-liver diseases[J]. Glob Adv Health Med, 2014, 3(3): 58–69. DOI:10.7453/gahmj.2014.017 |
| [22] | MIN J H, HONG Y H, SUNG J J, et al. Oral solubilized ursodeoxycholic acid therapy in amyotrophic lateral sclerosis: a randomized cross-over trial[J]. J Korean Med Sci, 2012, 27(2): 200–206. DOI:10.3346/jkms.2012.27.2.200 |
| [23] | PARVING H H, CHATURVEDI N, VIBERTI G, et al. Does microalbuminuria predict diabetic nephropathy[J]. Diabetes Care, 2002, 25(2): 406–407. DOI:10.2337/diacare.25.2.406 |



