动脉粥样硬化(atherosclerosis,AS)是一种发生在血管壁的慢性炎症性疾病,以血管壁脂质沉积、炎症细胞聚集为特征。多项研究发现动脉粥样硬化斑块内有病理性新生血管形成[1-2],而新生血管参与了易损斑块的形成和发展,促进粥样硬化病变的发展,甚至诱发斑块内出血和斑块破裂及其并发症的发生。目前病理性血管新生被认为是斑块破裂最有力的独立预测因子[3]。7-二氟亚甲基-5, 4'-二甲烷氧基异黄酮(7-difluoromethoxy-5, 4'-dimethoxygenistein,DFMG)是本课题组以金雀异黄素为先导物设计合成的新型衍生物。体外研究发现DFMG具有血管内皮保护作用,在动脉粥样硬化的发展过程中具有预防和治疗的作用[4],体内研究显示DFMG具有防止血管内膜过度增生及抗AS的作用[5]。本研究通过观察DFMG对动脉粥样硬化小鼠血管新生的影响,进一步探讨DFMG抗动脉粥样硬化的作用机制。
1 材料与方法 1.1 材料DFMG(自主合成,纯度>99%,分子式C18H14O5F2,相对分子质量348,性状为淡黄色晶体粉末);二甲基亚砜(DMSO)购自北京索莱宝公司;TLR4、VEGF、vWF抗体购自武汉三鹰Proteintech公司;GAPDH抗体购自康为公司;山羊抗鼠二抗及山羊抗兔二抗、PV9001、PV9002、山羊血清封闭液及DAB染色液均购自北京中杉金桥公司;Masson染色试剂盒购自北京索莱宝公司。
1.2 实验动物20只8周SPF级ApoE-/-小鼠,5只8周龄具有相同遗传背景非转基因小鼠SPF级C57 BL/6小鼠均由武汉大学模式动物协同创新中心馈赠;饲养环境温度为(22±2)℃,湿度为50%~60%。采用人工控制室内照明,保持12 h光照(8:00~20:00)和黑暗(20:00~次日8:00)交替循环。
1.3 方法 1.3.1 AS模型小鼠造模及分组AS小鼠造模根据本课题组前期实验研究方法制备[4]。20只8周龄ApoE-/-动脉粥样硬化模型小鼠分成4组:DMFG组、洛伐他汀组、溶剂组和模型组,均采用高脂饲料(购自湖南斯莱克景达动物公司,含10%猪油、蛋黄粉10%、2%胆固醇、0.2%胆酸)饲养,高脂饲养的同时连续灌胃16周,DFMG组、洛伐他汀组、溶剂组分别采用DFMG[10 mg/(kg·d)]、洛伐他汀[5 mg/(kg·d)]和DMSO[10 mg/(kg·d)]灌胃,模型组不灌胃。另取5只C57BL/6小鼠作为空白组,采用常规饮食。
1.3.2 小鼠血清学指标浓度检测血脂取小鼠血液标本1~1.5 mL,置于离心管中,静置1 h后,离心15 min(4 ℃,2 000 r/min)。全自动生化分析仪检测各组小鼠血清血脂水平变化。
1.3.3 小鼠胸主动脉石蜡切片HE染色取小鼠胸主动脉放入4%甲醛溶液中固定,石蜡包埋后制成4 μm切片,常规脱蜡水化,分别经苏木精-伊红(HE)染色,分化脱水,二甲苯透明风干后中性树胶封片,在显微镜下拍照观察各脏器组织病理情况,使用Image-Pro Plus 7.0软件测量斑块直径与主动脉内径的比值。
1.3.4 主动脉大体油红O染色取小鼠主动脉,用蒸馏水冲洗,70%异丙醇快速冲洗,油红O工作液浸泡30 min,然后再用70%异丙醇冲洗10 s,蒸馏水冲洗。在显微镜下观察主动脉上脂质斑块,用Image-Pro Plus 7.0软件分析脂质斑块分布情况,以像素(pixels)表示。
1.3.5 小鼠胸主动脉免疫组化小鼠主动脉石蜡切片常规脱蜡水化,EDTA(pH9.0)高压抗原修复,3%过氧化氢溶液消除内源性过氧化物酶活性,山羊血清封闭抗原,加一抗(vWF、VEGF),二抗分别孵育,DAB显色,蒸馏水洗,双标免疫组化在此步骤后用100 ℃ PBS灭活残留的HRP酶[6],继续孵育第二标抗体(TLR4),最后用Ni-DAB染色,其余步骤均与单标免疫组化一致,最后苏木精核染,脱水、透明、封固。用Vectra图像采集系统进行拍照,Inform软件进行图片分析计算蛋白表达量[7]。
1.3.6 小鼠胸主动脉病理组织切片Masson染色切片脱蜡至水,按照说明书操作,分别用试剂A-F染色分化后,中性树胶封固。拍照后用Inform软件进行图片分析计算胶原纤维显色情况。
1.3.7 Western blot检测TLR4蛋白的表达收集小鼠主动脉血管组织蛋白,加入蛋白上样缓冲液(5×)变性,配制SDS-PAGE凝胶,每孔蛋白上样量约为40 μg,开始电泳,待溴酚蓝到达胶的底端处附近即可停止电泳,转膜并封闭。随后,参照抗体说明书进行一抗(TLR4稀释比例1: 1 000;GAPDH稀释比例1: 5 000)和二抗(稀释比例1: 10 000)的孵育。最后用ECL类试剂和显影仪来检测蛋白。用Image J软件测定光密度值分析TLR4的蛋白相对表达量。
1.4 统计学方法采用SPSS 16.0统计软件。计量资料以x±s表示,两组间比较采用独立t检验,多组间比较采用多因素方差分析,两变量采用Pearson直线相关分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 高脂饲养ApoE-/-小鼠构建动脉粥样硬化动物模型的鉴定HE染色显示高脂喂养的4组小鼠胸主动脉均有脂质斑块形成,其表层有厚薄不一的纤维帽,其下见散在泡沫细胞,深层为一些坏死物质、沉积脂质和胆固醇结晶裂隙,空白组C57小鼠胸主动脉未见脂质斑块形成(图 1)。油红O染色显示高脂喂养的4组小鼠胸主动脉斑块内见显著的脂质浸润(图 1)。表明动脉粥样硬化模型ApoE-/-小鼠造模成功。
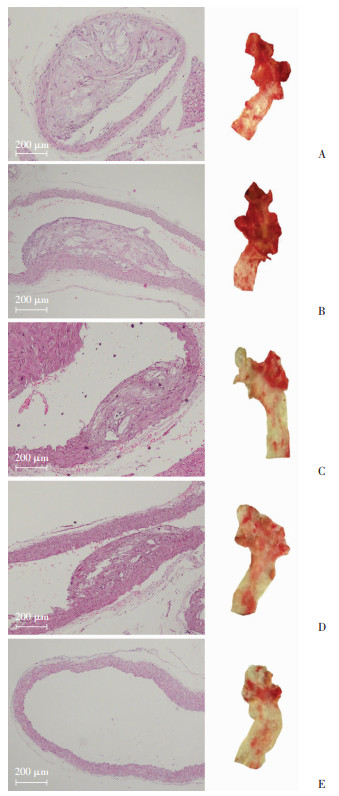
|
| A:模型组;B:溶剂组;C:DFMG组;D:洛伐他汀组;E:空白组 图 1 HE染色(左)和油红O染色(右)观察各组小鼠胸主动脉形态 |
2.2 DFMG对AS小鼠血脂水平的影响
高脂喂饲小鼠16周后,检测小鼠血浆血脂水平,与模型组小鼠比较,DFMG组和洛伐他汀组小鼠血浆血脂LDL、VLDL、TG、CHOL水平低(P < 0.05),HDL水平高(P < 0.05);DFMG组和洛伐他汀组比较血脂水平差异无统计学意义。结果见表 1。
| 组别 | HDL/mmol·L-1 | LDL/mmol·L-1 | TG/mmol·L-1 | CHOL/mmol·L-1 | VLDL/g | 体质量/g |
| 空白组 | 2.25±0.35 | 0.78±0.13 | 0.25±0.05 | 12.85±0.91 | 25.18±0.89 | 24.23±1.02 |
| 模型组 | 2.11±0.05a | 6.25±0.41a | 1.72±0.11a | 19.56±1.34a | 28.94±0.51a | 27.18±1.21a |
| 溶剂组 | 2.08±0.23b | 3.83±0.31b | 1.78±0.13b | 13.96±0.39b | 27.26±0.84b | 26.32±1.11b |
| 洛伐他汀组 | 2.34±0.31b | 4.15±1.51b | 1.32±0.16b | 14.56±0.55b | 25.16±0.56b | 25.98±1.32b |
| DFMG组 | 2.29±0.30b | 3.72±0.58b | 1.30±0.31b | 13.52±0.90b | 23.54±1.20b | 25.55±1.28b |
| a:P < 0.05,与空白组比较;b:P < 0.05,与模型组比较 | ||||||
2.3 DFMG对AS小鼠脂质斑块形成的影响
HE染色显示DFMG组较模型组小鼠斑块范围明显缩小,用Image-pro软件测量小鼠胸血管内径与主动脉斑块比值,结果亦显示,DFMG组与洛伐他汀组较模型组斑块与血管内径比值均变小(P < 0.05),DFMG组和洛伐他汀组比较差异无统计学意义(图 2A)。油红O染色显示模型组、溶剂组小鼠主动脉后壁及其分支开口处可见显著的脂质浸润,DFMG组较模型组油红O染色范围减小(295.01±42.43,594.44±189.44;P < 0.05),DFMG组和洛伐他汀组比较无统计学差异(图 2B)。
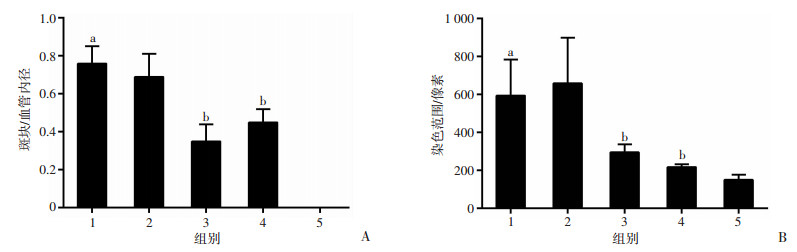
|
| 1:模型组;2:溶剂组;3:DFMG组;4:洛伐他汀组;5:空白组;a:P < 0.05,与空白组比较;b:P < 0.05,与模型组比较A:斑块与血管内径比值;B:油红O染色范围 图 2 各组小鼠脂质斑块的比较 |
2.4 DFMG对AS小鼠胸主动脉血管新生的影响
小鼠胸主动脉石蜡切片免疫组化,DFMG组较模型组vWF、VEGF蛋白表达量显著降低(vWF:0.083± 0.033 vs 0.176±0.021,P < 0.05;VEGF:76.41±24.50 vs 147.99±38.04,P < 0.05);DFMG组和洛伐他汀组比较差异均无统计学意义(图 3、4)。
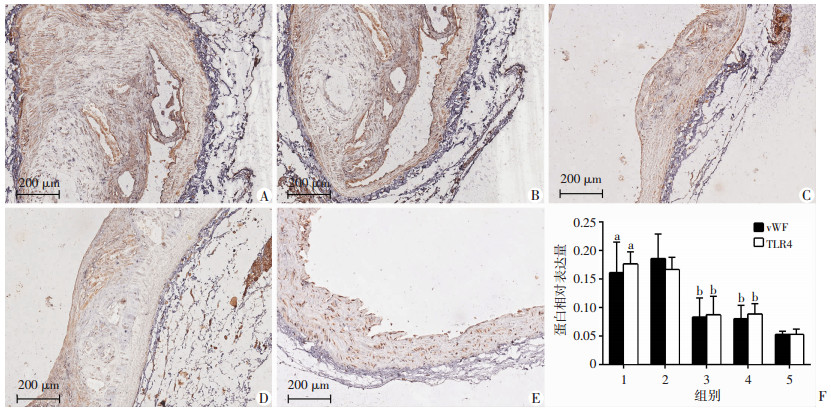
|
| A~E:分别为模型组、溶剂组、DFMG组、洛伐他汀组及空白组免疫组化染色(S-P);F:蛋白相对表达1:模型组;2:溶剂组;3:DFMG组;4:洛伐他汀组;5:空白组;a:P < 0.05,与空白组比较;b:P < 0.05,与模型组比较 图 3 小鼠胸主动脉vWF/TLR4双标免疫组化染色观察 |
|
| A~E:分别为模型组、溶剂组、DFMG组、洛伐他汀组及空白组免疫组化染色(S-P);F:蛋白相对表达1:模型组;2:溶剂组;3:DFMG组;4:洛伐他汀组;5:空白组;a:P < 0.05,与空白组比较;b:P < 0.05,与模型组比较 图 4 小鼠胸主动脉VEGF免疫组化染色观察 |
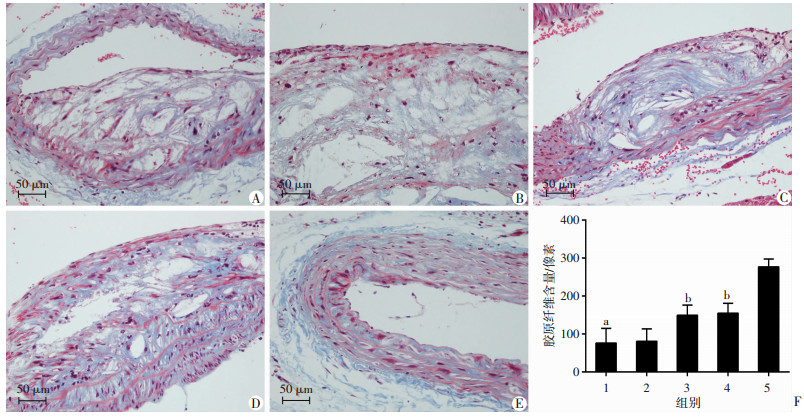
2.5 DFMG对AS小鼠动脉粥样硬化斑块稳定性的影响
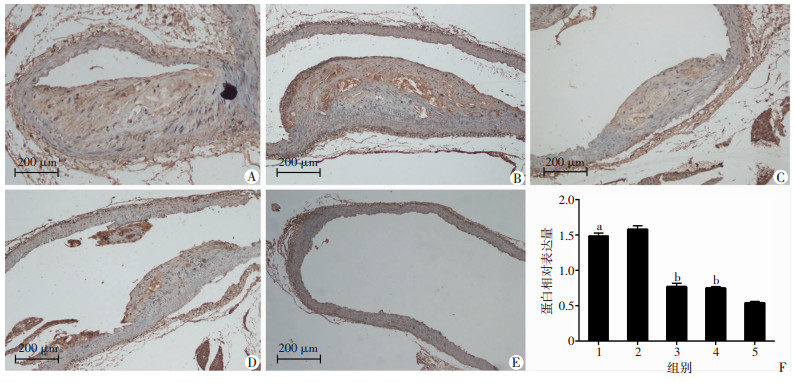
小鼠胸主动脉Masson染色显示,模型组和溶剂组小鼠动脉粥样硬化斑块胶原纤维排列紊乱稀疏,DFMG组较模型组胶原纤维含量增多(149.87±26.79 vs 76.45±38.56,P < 0.05),DFMG组和洛伐他汀组比较胶原纤维含量差异无统计学意义(图 5)。
|
| A~E:分别为模型组、溶剂组、DFMG组、洛伐他汀组及空白组Masson染色;F:胶原纤维含量1:模型组;2:溶剂组;3:DFMG组;4:洛伐他汀组;5:空白组;a:P < 0.05,与空白组比较;b:P < 0.05,与模型组比较 图 5 Masson染色观察各组小鼠胸主动脉形态及胶原纤维含量 |
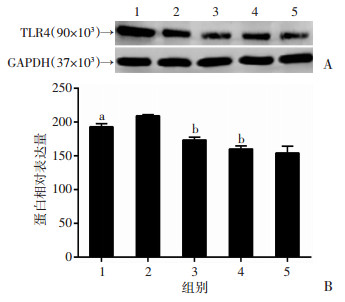
2.6 DFMG对AS小鼠胸主动脉TLR4表达的影响
小鼠胸主动脉石蜡切片免疫组化双标显示,DFMG组较模型组TLR4蛋白表达量明显降低(0.087±0.032 vs 0.176±0.021,P < 0.05,图 3)。Western blot检测结果显示,DFMG组较模型组TLR4蛋白表达量降低(173.59±3.92 vs 193.08±4.51,P < 0.05,图 6)。
|
| 1:模型组;2:溶剂组;3:DFMG组;4:洛伐他汀组;5:空白组;a:P < 0.05,与空白组比较;b:P < 0.05,与模型组比较;A:Western blot检测结果;B:半定量分析结果 图 6 Western blot检测各组小鼠胸主动脉TLR4蛋白的表达 |
2.7 小鼠主动脉血管新生与TLR4表达相关性分析
小鼠主动脉vWF、TLR4蛋白表达线性相关性分析显示,vWF与TLR4蛋白表达相关性呈正相关(R2=0.571,P < 0.05)。
3 讨论本研究结果显示,APOE-/-小鼠经高脂喂养16周后,与普通C57小鼠(空白组)比较,血浆血脂水平显著升高,组织切片油红O染色和HE染色结果显示小鼠主动脉壁上有明显的动脉粥样硬化斑块形成,且合并大量的脂质浸润,而空白组小鼠主动脉壁上未见斑块形成,说明APOE-/-小鼠成功构建动脉粥样硬化动物模型。这个实验动物模型是研究药物抗动脉粥样硬化机制的基础,亦是目前通用AS药理学研究平台[8]。本实验采用一线抗AS药物洛伐他汀作为阳性对照药物,在药物干预AS小鼠后发现,DFMG组和洛伐他汀组较模型组小鼠血清学血脂水平均明显下降,表明DFMG具有与一线抗AS药物洛伐他汀一致的作用,能调节AS小鼠血脂水平,预防AS进程的发生、发展。
本研究在动脉粥样硬化模型ApoE-/-小鼠中证实了AS斑块处存在明显血管新生,DFMG能降低AS病灶处血管新生。大量研究表明,血管新生参与了动脉粥样硬化易损斑块的形成和发展[1]。目前评估血管新生的指标主要有血管内皮生长因子(vascular endothelia growth factor,VEGF)和血管性血友病因子(vonWillebrand factor, vWF)[9-10]。VEGF在血管新生过程中发挥着重要的作用[11],灭活vWF及阻止vWF与血小板结合均可延缓动脉粥样硬化斑块的形成[12]。本实验采用免疫组化染色,以VEGF和vWF为一抗,检测小鼠胸主动脉血管新生情况,结果发现在ApoE-/-小鼠AS斑块处存在明显血管新生。与空白组小鼠比较,模型组小鼠胸主动脉处VEGF和vWF明显高表达,尤其是在有粥样斑块处。而在用药物干预后,与模型组小鼠比较,DFMG组和洛伐他汀组小鼠胸主动脉斑块处VEGF和vWF表达均降低,说明DFMG可以降低动脉粥样斑块血管新生。
本研究通过Masson染色进一步检测AS小鼠胸主动脉胶原纤维的含量来观察DFMG对AS斑块稳定性的作用。胶原纤维是动脉粥样硬化病变中斑块修复进程中的重要参与者,其结构和含量对动脉粥样硬化斑块的稳定性至关重要[13]。本研究结果显示,模型组小鼠胶原纤维分布杂乱稀疏,其含量较空白组明显降低,说明血管新生促进动脉粥样硬化斑块的不稳定性。在用药物干预AS小鼠后,DFMG组和洛伐他汀组小鼠较模型组小鼠主动脉壁上脂质斑块减小,斑块内胶原纤维含量增高,说明DFMG具有增加斑块内胶原纤维含量,减轻小鼠动脉粥样硬化脂质斑块形成,维持保护斑块稳定性的作用。抑制AS斑块内血管新生是稳定斑块、防止斑块破裂的重要手段[14]。DFMG能降低AS病灶处的血管新生,进而维护了斑块的稳定性。
本研究还发现,DFMG组TLR4及vWF蛋白表达低于模型组,而且vWF蛋白的表达与TLR4蛋白表达呈直线正相关。TLR4是介导内毒素/脂多糖(lipopo-lysaccharide, LPS)应答的最主要受体,几乎分布于所有的细胞系,主要表达在参与宿主防御功能的细胞上。TLR4在血管新生的发生、发展中亦发挥着重要作用[15]。有研究显示洛伐他汀能通过抑制TLR4信号通路发挥抗AS的作用,并且可以干扰血管新生的进展[16]。本实验结果亦显示DFMG的降脂作用、减少血管新生和抑制TLR4表达的效果与洛伐他汀基本一致。因此,我们推测DFMG降低AS小鼠血管新生可能与TLR4信号通路有密切相关性。
综上所述,DFMG可以抑制血管新生维持AS斑块稳定性,其抗AS血管新生机制可能与调控TLR4信号通路相关;同时也充分彰显了DFMG作为临床抗AS新候选化合药物的潜能,但其直接证据还需要进一步的研究证实。
| [1] | TENG Z, SADAT U, BROWN A J, et al. Plaque hemorrhage in carotid artery disease: pathogenesis, clinical and biomechanical considerations[J]. J Biomech, 2014, 47(4): 847–858. DOI:10.1016/j.jbiomech.2014.01.013 |
| [2] | DE VRIES M R, QUAX P H. Plaque angiogenesis and its relation to inflammation and atherosclerotic plaque destabilization[J]. Curr Opin Lipidol, 2016, 27(5): 499–506. DOI:10.1097/MOL.0000000000000339 |
| [3] | WANG Y, QIU J, LUO S, et al. High shear stress induces atherosclerotic vulnerable plaque formation through angiogenesis[J]. Rengen Biomater, 2016, 3(4): 257–267. DOI:10.1093/rb/rbw021 |
| [4] | ZHANG Y, LI L, YOU J, et al. Effect of 7-difluoromethyl-5, 4'-dimethoxygenistein on aorta atherosclerosis in hyperlipidemia ApoE-/- mice induced by a cholesterol-rich diet[J]. Drug Des Devel Ther, 2013, 7(8): 233–242. DOI:10.2147/DDDT.S37512 |
| [5] | CONG L, YANG S, ZHANG Y, et al. DFMG attenuates the activation of macrophages induced by co-culture with LPC-injured HUVE-12 cells via the TLR4/MyD88/NF-κB signaling pathway[J]. Int J Mol Med, 2018, 41(5): 2619–2628. DOI:10.3892/ijmm.2018.3511 |
| [6] |
崔白苹, 高璀乡, 熊存全, 等. 一种简便、可靠的免疫组化双重标记新方法[J].
中国药理学通报, 2015, 31(3): 436–442.
CUI B P, GAO C X, XIONG C Q, et al. A simple and reliable method for double labeling immunohistochemistry[J]. Chin Pharmacol Bull, 2015, 31(3): 436–442. DOI:10.3969/j.issn.1001-1978.2015.03.028 |
| [7] | HUANG W, HENNRICK K, DREW S. A colorful future of quantitative pathology: validation of Vectra technology using chromogenic multiplexed immunohistochemistry and prostate tissue microarrays[J]. Hum Pathol, 2013, 44(1): 29–38. DOI:10.1016/j.humpath.2012.05.009 |
| [8] | LEE Y T, LAXTON V, LIN H Y, et al. Animal models of atherosclerosis[J]. Eur J Pharmacol, 2017, 6(3): 259–266. DOI:10.1161/ATVBAHA.111.237693 |
| [9] | SHIBUYA M. Vascular endothelial growth factor and its receptor system: physiological functions in angiogenesis and pathological roles in various diseases[J]. J Biochem, 2013, 153(1): 13–19. DOI:10.1093/jb/mvs136 |
| [10] | REZZOLA S, BELLERI M, GARIANO G, et al. In vitro and ex vivo retina angiogenesis assays[J]. Angiogenesis, 2014, 17(3): 429–442. DOI:10.1007/s10456-013-9398-x |
| [11] | QUITTETMS, TOUZANIO, SINDJI L, et al. Effects of mesenchymal stem cell therapy, in association with pharmacologically active microcarriers releasing VEGF, in an ischaemic stroke model in the rat[J]. Acta Biomater, 2015, 15: 77–88. DOI:10.1016/j.actbio.2014.12.017 |
| [12] | MONTORO-GARCÍA S, SHANTSILA E, LIP G Y. Potential value of targeting von Willebrand factor in atherosclerotic cardiovascular disease[J]. Expert Opin Ther Targets, 2014, 18(1): 43–53. DOI:10.1517/14728222.2013.840585 |
| [13] | SHAMI A, GONÇALVES I, HULTGÅRDH-NILSSON A. Collagen and related extracellular matrix proteins in atherosclerotic plaque development[J]. Curr Opin Lipidol, 2014, 25(5): 394–399. DOI:10.1097/MOL.0000000000000112 |
| [14] | NICCOLI G, CIN D, SCALONE G, et al. Lipoprotein (a) is related to coronary atherosclerotic burden and a vulnerable plaque phenotype in angiographically obstructive coronary artery disease[J]. Atherosclerosis, 2016, 246: 214–220. DOI:10.1016/j.atherosclerosis.2016.01.020 |
| [15] | SUN Y, WU C, MA J, et al. Toll-like receptor 4 promotes angiogenesis in pancreatic cancer via PI3K/AKT signaling[J]. Exp Cell Res, 2016, 347(2): 274–282. DOI:10.1016/j.yexcr.2016.07.009 |
| [16] | EL-AZAB M F, HAZEM R M, MOUSTAFA Y M. Role of simvastatin and/or antioxidant vitamins in therapeutic angiogenesis in experimental diabetic hindlimb ischemia: effects on capillary density, angiogenesis markers, and oxidative stress[J]. Eur J Pharmacol, 2012, 690(1/3): 31–41. DOI:10.1016/j.ejphar.2012.06.002 |



