原发性肝癌(hepatocellular carcinoma, HCC)是发病率及病死率较高的恶性肿瘤之一。我国每年约有38.3万人死于肝癌,占全球肝癌死亡病例数的51%[1]。肝癌因为其起病隐匿、进展快、愈后差等特点,常规治疗效果往往不尽人意。脊柱为肝癌常见远处转移的器官之一,而肝癌导致的椎体转移多为溶骨性,给患者带来痛苦的同时严重影响患者脊柱的正常功能状态[2]。对于单发的椎体转移可行外科手术、外放疗等治疗,对于多发椎体转移,因为脊髓耐受剂量的限制,局部治疗剂量无法提高,易复发。近年来随着介入治疗技术的发展,放射性粒子植入局部治疗肿瘤在临床应用范围不断扩展,本研究旨在讨论125 Ⅰ粒子植入术治疗肝细胞癌椎体转移的效果及安全性。
1 资料与方法 1.1 一般资料收集2009年12月至2016年6月本科收治的肝癌椎体转移患者16例共23处椎体转移病灶临床及影像资料,原发肿瘤均为肝细胞癌,转移据ECT、CT、MRI、PET/CT或经皮穿刺活检等诊断。其中男性14例,女性2例,年龄(48.4±10.8)岁,16例患者转移病灶中累及胸椎13个,腰椎6个,颈椎4个。患者术前腰背部均有不同程度疼痛,部分患者存在神经功能损伤。纳入标准:①不能手术或不愿手术或不愿外放射治疗者;②不能耐受多部位外放射治疗或外放射治疗后复发者;③无严重心肺功能、肝肾功能及凝血功能异常;④患者预计生存时间大于3个月。排除标准:①恶病质,一般情况差,不能耐受粒子治疗者;②已行索拉菲尼治疗者。患者均签署知情同意书,本研究通过陆军军医大学(第三军医大学)第一附属医院医学伦理委员会审批(2017-39)。
1.2 仪器设备采用德国Siemens公司Somatom Plus 4螺旋CT或上海联影公司16排螺旋CT引导125 Ⅰ粒子(北京智博高科生物技术有限公司)植入,125 Ⅰ粒子活度为0.8 mCi(1 Ci=3.7×1010Bq),穿刺针为18 G核素组织间植入针(上海埃斯埃医械塑料制品有限公司),对于骨皮质完整的病灶,采用13 G COOK骨穿针辅助穿刺,三维治疗计划系统(treatment planning system,TPS)采用北京由天航科霖科技发展有限公司提供的系统。
1.3 方法 1.3.1 术前准备患者术前常规完善心电图、三大常规、凝血功能、肝肾功能及输血前检查,对病变部位进行CT和/或MR检查后,采用TPS勾画治疗靶区(图 1A),测定靶体积,按12 000 cGy处方剂量制定治疗计划,绘制等剂量曲线,再根据等剂量曲线修改和完善计划。
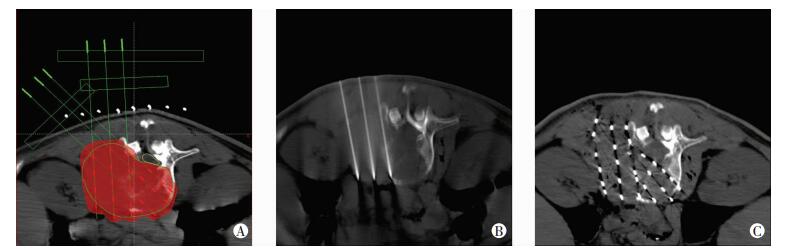
|
| A:术前TPS计划;B:术中按计划插入核素组织间植入针;C:术后剂量验证 图 1 常规手术流程 |
1.3.2 手术过程
根据病灶位置和术前计划,选取适当体位,胸椎、腰椎一般采用俯卧位,颈椎根据病灶情况适当选择体位。术前先行CT扫描确定病灶位置,体表定位准确后选择适当的穿刺点及穿刺路径,2%盐酸利多卡因局麻后,在CT引导下按照TPS计划将核素组织间植入针分层植入病灶内,然后按术前计划沿核素组织间植入针向病灶内植入125 Ⅰ粒子,粒子间距0.5~1.0 cm(图 1B)。对于骨皮质完整的病灶,采用核素组织间植入针直接穿刺难度大,有时甚至无法突破骨皮质,可使用共轴针法植入粒子,即先将13G骨穿针沿计划针道穿破骨皮质到病灶边缘建立通道,再将核素组织间植入针沿骨穿针穿刺至病灶内。手术完成后立即行螺旋CT扫描,查看粒子分布情况,明确有无出血、气胸等并发症,并用TPS进行术后验证(图 1C),查看靶区剂量分布情况,决定是否补种粒子。
1.3.3 疗效评价分别于术后1、3个月随访1次,此后每3个月随访1次,截止时间为术后12个月。随访时复查CT、MR或ECT,评价肿瘤情况,并记录疼痛评分、功能状态评分及并发症情况。采用NRS评估疼痛,分为0~10级,0级为无痛,1~3级为轻度疼痛,4~6级为中度疼痛,7~10级为重度疼痛,疼痛大于3级需临床干预;通过KPS将体力状况评为0~100分,得分越高,健康状况越好,越能忍受治疗给身体带来的副作用,因而也就有可能接受彻底的治疗。得分越低,健康状况越差,若低于60分,许多有效的抗肿瘤治疗就无法实施;以ASIA残损分级评价患者神经功能,A级:骶段(S4~S5椎体水平)无任何感觉或运动功能保留;B级:损伤平面以下包括骶段(S4~S5椎体水平)有感觉但无运动功能;C级:损伤平面以下存在运动功能,大部分关键肌肌力 < 3级;D级:损伤平面以下存在运动功能,大部分关键肌肌力≥3级;E级:正常。根据美国德州大学MD安德森癌症中心(The University of Texas MD Anderson Cancer Center,MDA criteria)评价骨转移瘤疗效,为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)[3]。肿瘤局部控制率为CR+PR+SD所占比例。
1.4 统计学分析采用SPSS 22.0统计软件,数据以x±s表示,采用Kaplan-Meier方法绘制生存曲线,正态性数据采用配对t检验,非正态性数据采用Wilcoxon秩和检验。检验水准:α=0.05。
2 结果 2.1 手术情况患者均顺利完成手术,治疗靶区共23个,处方剂量12 000 cGy,靶区体积(GTV)为(22.9±21.4)cc,植入粒子数为24(5, 50)粒,粒子活度0.8 mCi(1Ci=3.7×1010 Bq),术前靶区D90(12 399.7±837.4)cGy,术后验证靶区D90(10 506.2±427.1)cGy,术前椎管D90 (3 305.9±1 432.1)cGy,术后验证椎管D90 (3 195.3±1 493.2)cGy。术后复查CT提示粒子分布均匀。
2.2 疼痛控制情况所有患者术前有不同程度疼痛,NRS评分为3.4,大多数患者术后疼痛明显缓解,术后3个月NRS评分1.8,其中3例患者术后疼痛减术前稍增加或未缓解,术后复查CT或MR提示局部肿瘤进展,予以补种粒子后疼痛明显缓解。术前、术后3个月随访时患者NRS评分比较差异有统计学意义(P < 0.01),此后疼痛情况随访结果与术后3个月一致。
2.3 功能改善情况术前KPS评分为66.9,术后患者功能均有不同程度改善,术后3个月KPS评分为77.5,差异有统计学意义(P < 0.01)。术前及术后3个月ASIA分级见表 1,术前有5例患者出现脊髓功能不完全性损伤,术后3个月仅有2例患者存在脊髓功能不完全性损伤,神经功能恢复率60%(3/5),此后随访结果与术后3个月一致。
2.4 局部肿瘤控制及患者生存情况
16例患者共23个椎体进行了125 Ⅰ粒子植入术,术后3个月复查影像与术前比较见图 2。评价疗效:CR 6例,PR 6例,PD 3例,SD 1例,局部控制率93.75% (15/16),其中1例患者在术后3个月补种粒子后局部肿瘤得到控制。患者中位生存时间为中位生存时间为8个月,术后3、6、12个月生存率分别为100%、56.2%、12.5%,生存曲线见图 3。
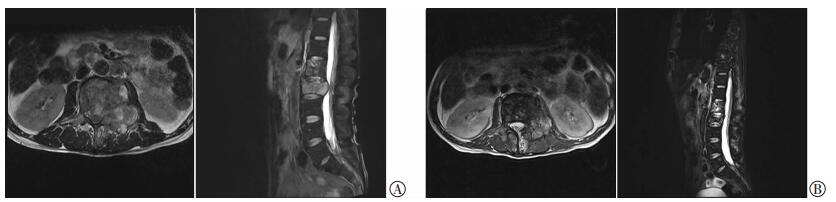
|
| 左侧为横断位;右侧为矢状位A:患者术前磁共振图像,腰1、2椎体骨质破坏,脊髓受压;B:术后3个月复查,脊髓压迫解除 图 2 125 Ⅰ粒子植入术前、术后磁共振表现 |

|
| 图 3 患者生存曲线分析 |
3 讨论
脊柱为肝癌较易发生转移的器官,最常见的表现为局部疼痛、功能障碍,严重者发生硬膜外脊髓压迫导致瘫痪。椎体继发恶性肿瘤虽不会直接导致患者死亡,但可导致患者生活质量急剧下降、瘫痪,其危害比原发性癌症更为严重,给家庭和社会带来沉重的负担[4]。椎体转移癌治疗原则是缓解患者症状、改善患者行动能力,提高患者的生存质量。部分患者应用止痛药物仍无法控制疼痛,并且长期口服止痛药会带来一系列副作用[5]。
大多数肝细胞癌患者对化疗不敏感,若发生脊柱转移,能选择的治疗方案为靶向治疗、外放疗及手术治疗,总体来说,疗效欠佳。索拉非尼仍为目前晚期肝癌靶向治疗的一线药物,但有效率低,而且一旦耐药,将无更好的药物选择[6]。目前对于脊柱转移癌常用的治疗方法为外放疗,对于椎体破坏导致的疼痛有效率可达70%~90%[7]。因病灶临近脊髓,放疗剂量过大会损伤脊髓、引起放疗毒性反应,而剂量过小又不能有效杀灭肿瘤,肿瘤易复发,而且目前针对骨转移的放射治疗方法及剂量尚无统一标准[8],单独放疗很难达到减压或稳定目的。普遍认为患者至少有3个月生存预期才建议手术,且截瘫超过24 h是一个排除标准。由于较为严格的入选标准,手术仅适用于10%~15%的患者,并且手术容易引起包括脊髓或脊髓根部损伤,广泛出血、感染和硬脑膜撕裂等在内的并发症[9-10]。
125 Ⅰ粒子近距离治疗肿瘤是近20年发展起来的肿瘤局部微创治疗新技术[11]。作为低能量核素,125 Ⅰ粒子的组织半值层(half value-layer,HVL)为1.7 cm,剂量可以随距离的增加而迅速下降。具有肿瘤局部剂量分布高,周围正常组织剂量陡降的物理学特性,可在有效杀灭肿瘤细胞的同时保护周围正常组织[12],可用于临近危险器官肿瘤的局部治疗。根据肿瘤放射性粒子治疗规范,未经放射治疗者推荐处方剂量为120~160 Gy[13]。因肿瘤临近脊髓,本研究选用处方剂量为120 Gy。对于术后进展患者,重新验证计划后立即补种粒子可控制局部肿瘤继续进展。125 Ⅰ粒子植入术对骨转移瘤的疼痛控制早已得到临床证实[14-16]。本研究术前、术后患者NRS评分差异有统计学意义(P < 0.01),且大多数患者术后1个月疼痛已有明显缓解,表明125 Ⅰ粒子植入术对于肝细胞癌椎体转移有确切的止痛效果。脊柱转移患者肿瘤往往不局限于间室内,容易向后生长突破硬膜囊形成硬膜外脊髓压迫症[17],引起神经功能障碍,若不及时解除脊髓压迫,会造成患者截瘫。125 Ⅰ粒子植入后对肿瘤进行持续照射,肿瘤缩小的同时解除了对脊髓的压迫。本研究中神经功能恢复率60%(3/5),其中2例患者因椎体出现压缩性骨折神经功能未见明显改善,可见对于存在椎体塌陷风险的患者单纯行125Ⅰ粒子植入并不一定能完全缓解神经功能状态[18]。因为125 Ⅰ粒子只能杀灭肿瘤,不能增
强椎体稳定性,此时需要联合椎体成形术增强椎体稳定性,避免椎体塌陷[19]。本组研究16例患者共23个椎体术后3个月随访局部控制率93.75% (15/16),其中1例患者于术后3个月补种粒子后肿瘤得到控制,且直到随访期终止,仍未见局部肿瘤复发,且所有患者在术中及术后均无严重并发症发生,表明125 Ⅰ粒子植入术治疗肝细胞癌椎体转移安全、有效。本组患者术后3、6、12个月生存率分别为100%、56.2%、12.5%,死亡原因分别为全身多发转移所致器官衰竭、肝衰竭、肿瘤破裂出血。125 Ⅰ粒子植入术属于肿瘤局部治疗,只能控制局部肿瘤进展,不能控制患者全身状况,若患者全身状况或肝内原发病灶控制不佳,仍不能有效提高患者生存时间,所以针对肝细胞癌椎体转移患者,仍应在加强局部治疗的同时行全身治疗。
综上所述,CT引导下125 Ⅰ粒子植入术治疗肝细胞癌椎体转移,能明显缓解疼痛,改善神经功能状态,且患者耐受性好,并发症少,可接受反复多次手术治疗,是一种安全、有效的局部治疗方法。
| [1] |
吕桂帅, 陈磊, 王红阳. 我国肝癌研究的现状与前景[J].
生命科学, 2015, 27(3): 237–248.
LYU G S, CHEN L, WANG H Y. Research progress and prospect of liver cancer in China[J]. Chin Bull Life Sci, 2015, 27(3): 237–248. DOI:10.13376/j.cbls/2015034 |
| [2] | GOODWIN C R, YANAMADALA V, RUIZ-VALLS A, et al. A systematic review of metastatic hepatocellular carcinoma to the spine[J]. World Neurosurg, 2016, 91: 510–517. DOI:10.1016/j.wneu.2016.04.026 |
| [3] | COSTELLOE C M, CHUANG H H, MADEWELL J E, et al. Cancer response criteria and bone metastases: RECIST 1.1, MDA and PERCIST[J]. J Cancer, 2010, 1: 80–92. DOI:10.7150/jca.1.80 |
| [4] | NATER A, SAHGAL A, FEHLINGS M. Management—spinal metastases[J]. Handb Clin Neurol, 2018, 149: 239–255. DOI:10.1016/B978-0-12-811161-1.00016-5 |
| [5] | OVERCASH J, HANES D, BIRKHIMER D, et al. Pain intensity and pain management of hospitalized patients with cancer: an opportunity for improvement[J]. Clin J Oncol Nurs, 2013, 17(4): 365–368. DOI:10.1188/13.CJON.365-368 |
| [6] |
李晨曦. 晚期肝癌患者对索拉非尼耐药机制的研究进展[J].
解放军医学院学报, 2017, 38(4): 381–384.
LI C X. Mechanism of sorafenib resistance in hepatocellular carcinoma[J]. Acad J PLA Postgraduate Med School, 2017, 38(4): 381–384. DOI:10.3969/j.issn.2095-5227.2017.04.025 |
| [7] | LUTZ S, BALBONI T, JONES J, et al. Palliative radiation therapy for bone metastases: update of an ASTRO evidence-based guideline[J]. Pract Radiat Oncol, 2017, 7(1): 4–12. DOI:10.1016/j.prro.2016.08.001 |
| [8] | POTTERS L, MORGENSTERN C, CALUGARU E, et al. 12-year outcomes following permanent prostate brachytherapy in patients with clinically localized prostate cancer[J]. J Urol, 2008, 179(5 Suppl): S20–S24. DOI:10.1016/j.juro.2008.03.133 |
| [9] | FEHLINGS M G, NATER A, TETREAULT L, et al. Survival and clinical outcomes in surgically treated patients with metastatic epidural spinal cord compression: results of the prospective multicenter AOSpine study[J]. J Clin Oncol, 2016, 34(3): 268–276. DOI:10.1200/JCO.2015.61.9338 |
| [10] | QURAISHI N A, AREALIS G, SALEM K M, et al. The surgical management of metastatic spinal tumors based on an epidural spinal cord compression (ESCC) scale[J]. Spine J, 2015, 15(8): 1738–1743. DOI:10.1016/j.spinee.2015.03.040 |
| [11] |
伍星星, 王文军. 125 Ⅰ放射性粒子在脊柱肿瘤中的应用研究现状[J].
中国矫形外科杂志, 2015, 23: 1396–1399.
WU X X, WANG W J. Situation of application of radioiodine-125 seeds in the spinal tumors[J]. Orthopedic J China, 2015, 23: 1396–1399. DOI:10.3977/j.issn.1005-8478.2015.15.13 |
| [12] | BLASKO J C, MATE T, SYLVESTER J E, et al. Brachytherapy for carcinoma of the prostate: techniques, patient selection, and clinical outcomes[J]. Semin Radiat Oncol, 2002, 12(1): 81–94. DOI:10.1053/srao.2002.28667 |
| [13] |
王俊杰, 张福君. 肿瘤放射性粒子治疗规范[M]. 北京: 人民卫生出版社, 2016: 143.
WANG J J, ZHAN F J. Standard for radioactive seed implantation therapy tumor[M]. Beijing: People's Medical Publishing House, 2016: 143. |
| [14] |
李锦新, 张启周, 栗国梁. 125 Ⅰ放射性粒子植入治疗骨转移瘤的临床观察[J].
影像诊断与介入放射学, 2011, 20(1): 55–57.
LI J X, ZHANG Q Z, LI G L. Clinical application of permanent implantation of iodine 125 seeds for osseous metastases[J]. Diag Imag Interv Radiol, 2011, 20(1): 55–57. DOI:10.3969/issn.1005-8001.2011.01.014 |
| [15] |
徐绍年, 李福生, 杜振广. 125 Ⅰ粒子组织间植入治疗骨转移瘤的临床研究[J].
中国骨肿瘤骨病, 2011, 10(4): 338–342.
XU S N, LI F S, DU Z G. Interstitial 125Ⅰ seeds implantation in the treatment of osseous metastasis[J]. Chin J Bone Tumor Bone Dis, 2011, 10(4): 338–342. DOI:10.3969/j.issn.1671-1971.2011.04.003 |
| [16] | YANG Z, TAN J, ZHAO R, et al. Clinical investigations on the spinal osteoblastic metastasis treated by combination of percutaneous vertebroplasty and (125)I seeds implantation versus radiotherapy[J]. Cancer Biother Radiopharm, 2013, 28(1): 58–64. DOI:10.1089/cbr.2012.1204 |
| [17] | TSUZUKI S, PARK S H, EBER M R, et al. Skeletal complications in cancer patients with bone metastases[J]. Int J Urol, 2016, 23(10): 825–832. DOI:10.1111/iju.13170 |
| [18] | WANG S, SHI G, MENG X. Clinical curative effect of percutaneous vertebroplasty combined with 125Ⅰ-seed implantation in treating spinal metastatic tumor[J]. Pak J Pharm Sci, 2015, 28(3 Suppl): 1039–1042. |
| [19] |
程琳, 何闯, 刘云, 等. 放射性125 Ⅰ粒子联合经皮椎体成形术治疗椎体转移瘤的应用研究进展[J].
局解手术学杂志, 2017, 26(7): 535–538.
CHENG L, HE C, LIU Y, et al. Progress on application of 125 Ⅰ seeds and percutaneous vertebraplasty for vertebral metastases[J]. J Reg Anat Oper Surg, 2017, 26(7): 535–538. DOI:10.11659/jjssx.03E017089 |



