静电纺丝技术制备的微观下为丝状的电纺纤维膜直径在几纳米到几微米之间,具有极高的孔隙率[1],从而能够最大程度的模拟细胞外基质的结构,有利于细胞的黏附、分化、增殖及分泌细胞外基质等[2]。在作为细胞生长支架的生物材料逐渐被机体降解吸收的同时,细胞不断增殖、分化形成形态、功能方面与相应组织、器官一致的新组织,从而达到修复创伤和重建功能的目的[3]。其在生物医学工程领域有较为广泛的应用[4]。
最近有研究者采用静电纺丝的方法制备微观下为串珠状的纤维膜并将其作为载体,令人耳目一新[5-6]。高分子有机溶液通过泰勒锥拉制成“串珠状”结构,当表面能足够高的时候,高表面积的“串珠”可迅速在气体氛围中挥发有机溶剂,形成串珠状纤维膜[7]。但目前尚没有研究表明串珠状的电纺纤维膜也能模拟细胞外基质的结构。
静电纺丝制备的丝状纤维膜和串珠状纤维膜对骨缺损修复的效果哪种更好有待研究。本文旨在制备微观下不同形态的电纺纤维膜并比较其亲水性、降解速度和对成骨细胞增殖分化的影响,以评估其对骨缺损修复的效果。
1 材料和方法 1.1 主要材料和仪器聚己内酯(Sigma公司;相对分子质量=80 000);丙酮(川东化工;相对分子质量58.08);茜素红(Solar bio); CCK-8(东仁化学科技);青霉素-链霉素(Hyclone)。细胞(取自SD乳鼠颅顶骨);胎牛血清(Excell Bio);ALP试剂盒(碧云天);总RNA快速提取试剂盒离心柱型(BioTeke);PrimeScript TM RT试剂盒(TaKaRa,大连中国);磁力搅拌器(予华仪器有限公司);万分之一电子天平秤(托利多有限公司);电纺丝仪器(永康乐业);SEM(S-3400N-Ⅱ, Hitachi); 倒置相差显微镜(Nikon, 日本);可视接触角测试系统(DSA100,Siber Hegner)。
1.2 实验方法 1.2.1 电纺溶液制备将PCL溶于丙酮,得到质量分数为15%和10%,8% 3种溶液,用磁力搅拌器恒温搅拌,直至PCL完全溶解,溶液澄清。
1.2.2 电纺在室温下,将所配置的溶液分别装入5 mL的注射管中,均采用21号不锈钢钝性针头,针头距铝箔纸12 cm进行纺丝。针头与高压直流电源的正极相连接,铝箔纸作为接受屏幕采用10 cm×15 cm的尺寸并与高压直流电源的负极相连接。15%的溶液在正15 kV(未给与负电极电压)的高压电场中,以3 mL/h的推注速度电纺40 min。10%的溶液在15 kV,-5 kV的高压电场中,以3 mL/h的推注速度电纺40 min。8%的溶液在10 kV,-5 kV的高压电场中,以3 mL/h的推注速度电纺40 min。铝箔纸上覆盖的载玻片(10 mm×10 mm)收集3 min,所得样品即可用于倒置相差显微镜下观察其形态。铝箔纸上收集到的电纺纤维膜用于接触角实验,扫描电镜观察,降解实验,细胞增殖实验,ALP活性实验和qRT-PCR实验。
1.2.3 倒置相差显微镜观察不同浓度组的电纺溶液在电纺过程中,通过载玻片覆盖在铝箔纸上在纺丝3 min时即可收集到能在倒置相差显微镜中观察到的薄膜。通过倒置相差显微镜放大100倍观察其微观形态。
1.2.4 扫描电子显微镜观察所收集的不同组的电纺纤维膜喷金后,在加速高压20 kV下放大500倍观察其微观形态。
1.2.5 接触角测试常温下,用蒸馏水滴在各组纤维膜上,用可视接触角测试系统测量其表面接触角,每组测量6次,取其平均值。
1.2.6 体外降解分析15%、10%、8%组的PCL纳米纤维膜(20 mm×20 mm)放入盛有4 mL PBS的小瓶中,置于37 ℃恒温水浴箱中。在不同时间点(20、40、60、90 d),取出膜用蒸馏时冲洗,然后放入真空干燥炉,常温下干燥24 h,万分之一电子天平分别称重。当天称质量为Wt,初始质量为W0,计算每次溶蚀的质量比(失重率)。
失重率=(W0-Wt)/W0×100%每组设3个样本进行检测,取其平均值。
1.2.7 细胞增殖实验接种前,用紫外线照射电纺纤维膜正反面各2 h后把电纺纤维膜放入24孔板。MC3T3-E1成骨细胞培养在含10%胎牛血清和1%青霉素/链霉素的α MEM培养液中,当细胞铺满培养板底部80%~90%时,用胰酶分离下来,配成细胞悬液,以2 ×104 /cm2的密度接种在膜上,并设置一不含膜的对照组。将胞/膜复合体和对照组培养在37 ℃, 5% CO2,95%湿度的细胞培养箱中,每3天换一次液。分别在第1、3、7天,以每100 μL培养液加入10 μL CCK-8试剂的比例,给待测样品中加入CCK-8试剂,在37 ℃培养箱内培养3 h后,每个样本吸取100 μL液体加入96孔板中,用酶标仪在450 nm波长下测得吸光值,测3次取平均值。
1.2.8 ALP活性检测成骨细胞分化能力细胞接种后的第4、7、10、18天,去除原培养基,PBS冲洗胞/膜复合体3遍,孔板中每孔加入体积分数1%Triton X-100 300 μL,37 ℃孵育30 min,收集液体。采用ALP检测试剂盒,按说明加入试剂和待测样品,37 ℃摇床孵育30 min,NaOH 100 μL终止反应,用酶标仪测其在405 nm处的吸光度值,样本吸光度值在ALP标准曲线上读取活性值(U/L),每个时间点每组检测4孔。
1.2.9 qRT-PCR检测成骨细胞相关基因的表达3组不同的PCL电纺纤维膜在紫外灯下正反面各光照2 h后分别铺于6孔板底部,细胞以每孔1×105个接种于6孔板的膜上。在37 ℃孵箱里培养,每3天换液。7 d后弃去培养基,PBS清洗胞/膜复合体3遍,采用高纯总RNA快速提取试剂盒离心柱型抽提细胞总RNA,检测基因浓度及完整性,提取的RNA经PrimeScript TM RT reagent Kit逆转录反应合成相应cDNA。实时定量PCR以SYBR@ PreMix ExTaq TM试剂盒的使用说明在CFX96 TM Real-time PCR Detection System进行检测。以β-actin为管家基因,配制real-time PCR 20 μL反应体系,进行qRT-PCR检测小鼠的RUNX2基因,测3次取平均值, 引物序列:β-actin,上游5′-AGATTACTGCTCTGGCTCCTAGC-3′,下游5′-ACTCATCGTACTCCTGCTTGCT-3′;Runx2:上游5′-AGATTACTGCTCTGGCTCCTAGC-3′,下游5′-TCGTTG-AACCTGGCTACTTGG-3′。
1.3 统计学分析计量资料数据以x±s表示。采用GraphPad 5.0软件作图,SPSS 19.0统计软件进行数据分析。两组比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准:α=0.05。
2 结果 2.1 倒置相差显微镜观察结果载玻片上收集的纤维膜在倒置显微镜下放大100倍观察,15%PCL组呈现出多方向交错排列的丝状,各丝直径大小不一,丝之间孔隙较大。每一条丝自身呈现粗细不均匀的线状,无串珠、条带,图 1A。10%PCL组呈多方向交错排列的丝状,丝上有少量串珠排列,串珠大小不一,分布不均匀,其丝的直径较15%组更小、粗细更均匀,丝之间的孔隙较小, 图 1B。8%PCL组呈多方向交错排列的大量串珠状,串珠大小不一,分布不均匀,其丝的直径较10%组更小、粗细更均匀,丝之间的孔隙更小, 图 1C。
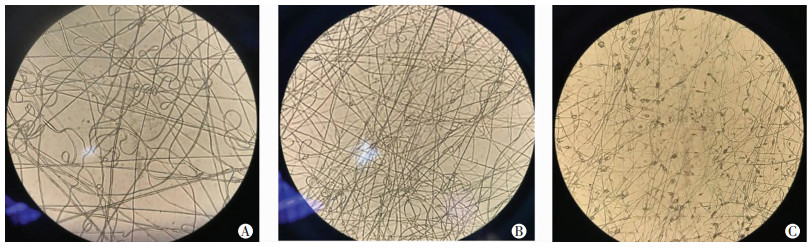
|
| A:15%组纤维形态; B:10%组纤维形态; C:8%组纤维形态 图 1 3组电纺纤维膜的倒置显微镜观察(×100) |
2.2 扫描电子显微镜观察结果
15%组在15 kV正电压场,3 mL/h的推注速度下制备出的电纺纤维膜在电镜放大500倍下呈多方向交错排列的丝状,各丝的直径不一,每1条丝自身粗细不一,丝表面未发现串珠和条带,比较光滑,无明显缺陷,丝与丝之间的孔隙较大,Image J分析图像表明纤维直径分布在338~3 144 nm之间,平均直径1 747 nm,图 2A。10%组在10 kV,-5 kV电压场,3 mL/h的推注速度下制造出来的电纺纤维膜在电镜放大500倍下为带少量串珠的丝状,丝连接串珠的头尾两端,各串珠的大小不一,间距不等,分布不太均匀,丝之间的孔隙较小,Image J分析图像表明纤维直径在239~2 138 nm之间,平均直径1 010 nm,平均每一个视野下串珠少于50个, 图 2B。8%组在10 kV,-5 kV的电压场,3 mL/h的推注速度下制备出的电纺纤维膜在电镜500倍下呈大量串珠状,串珠大小不一,分布不均,直径更小的纤维连接着各串珠,其间的孔隙小,Image J分析图像表明纤维直径在160~537 nm之间,平均直径470 nm,平均每一个视野下串珠多于200个, 图 2C。

|
| A: 15%组电纺纤维膜; B: 10%组的电纺纤维膜; C: 8%组电纺纤维膜 图 2 3组电纺纤维膜的电子显微镜观察(×500) |
2.3 3组电纺纤维膜接触角测试结果
不同组的纤维膜分别测6次取其平均值,15%组纤维膜的接触角为(142.900±2.032)°,10%组纤维膜的接触角为(142.633±2.142)°,8%组纤维膜的接触角为(143.850±1.310)°,结果表明微观下不同形态的电纺纤维膜其亲水性没有明显的差异(P>0.05)。
2.4 3组电纺纤维膜体外降解分析结果在90 d的降解周期里,15%,10%,8%组PCL电纺纤维膜丧失的质量分别为13.3%,17.2%,19.5%。15%组PCL降解的速度较10%组慢,10%组较8%组PCL慢,差异具有统计学意义(P<0.05,图 3)。
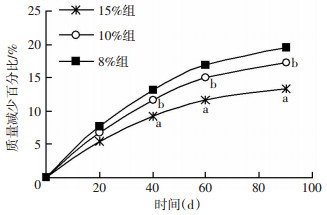
|
| a: P<0.05,与10%组和8%组比较;b: P<0.05,与8%组比较 图 3 3组电纺纤维膜的体外降解实验 |
2.5 细胞增殖实验对比结果
在1、3、7 d,所有组数据都随时间增加而增大。表明PCL电纺纤维膜材料无细胞毒性,且不同形态电纺纤维膜对细胞增殖的影响无明显差异(P>0.05,表 1)。
| 组别 | 第1天 | 第3天 | 第7天 |
| 对照组 | 0.231±0.024 | 0.523±0.009 | 1.134±0.010 |
| 15%组 | 0.225±0.008 | 0.560±0.071 | 1.168±0.041 |
| 10%组 | 0.224±0.005 | 0.522±0.019 | 1.068±0.024 |
| 8%组 | 0.237±0.004 | 0.554±0.014 | 1.112±0.110 |
2.6 ALP活性实验结果
各组的ALP活性值都随时间增加而增大,成骨细胞分化的程度:纯丝组(15%组)>少量串珠组(10%组)>大量串珠组(8%组)(P<0.05,表 2)。
| 组别 | 第4天 | 第7天 | 第10天 | 第18天 |
| 15%组 | 0.341±0.007a | 0.516±0.064a | 0.742±0.013a | 0.991±0.028a |
| 10%组 | 0.310±0.012b | 0.460±0.010b | 0.700±0.018b | 0.854±0.011b |
| 8%组 | 0.253±0.006 | 0.350±0.023 | 0.640±0.034 | 0.785±0.017 |
| a: P<0.05, 与10%组和8%组比较;b: P<0.05, 与8%组比较 | ||||
2.7 qRT-PCR实验结果
接种7 d后,15%组RUNX2相对表达量为(1.003± 0.097),10%组为(0.733±0.001), 8%组为(0.596±0.042)。成骨细胞分化的程度:纯丝组>少量串珠组>大量串珠组(P<0.05)。
3 讨论静电纺丝技术制备的纤维材料和纤维网多有良好的机械和生物性能[8]。聚己内酯(Polycaprolactone,PCL)是常见的人工合成的安全无毒的聚酯类生物高分子材料[9]。其生物降解性、力学性能、生物相容性均良好且具有形状记忆效应[10],在GBR成骨[11]、搭载生物活性因子[12]、骨转移组织工程[13]和血管支架[14]等有较高的临床应用价值。
本实验制备出了不同形态的纤维膜,接触角测试结果表明其亲水性并没有显著差异。可能是由于虽然微观下各种纤维膜的形态不同,但是纤维膜本身的化学键没有改变,所以其亲水性并没有显著差异。
体外降解实验表明含有串珠状的PCL电纺纤维膜较纯丝状的电纺纤维膜降解较快,且串珠越多降解速度越快。这是由于串珠增多时,连接串珠之间丝的直径减小,其有更大的比表面积和水渗透性使降解速度加快。同时随着串珠增多,膜的断裂伸长率、极限强度、和弹性模量随之减少也加快膜的降解[15]。
细胞增殖实验表明PCL电纺纤维膜无细胞毒性[16],且丝状、含有少量串珠的丝状、大量串珠状电纺纤维膜对成骨细胞增殖的影响没有明显差异。可能是细胞较易在高比表面积的和孔隙率大的支架上生长,微观为丝状的纤维膜其纤维丝之间间距相对较大提供了较大的孔隙率适合细胞的生长;但孔隙率小的含有串珠状的纤维膜其随着纤维直径的缩小,具有较大的比表面积[8],也为细胞生长提供了有利条件。两种因素综合,使得细胞在微观下为丝状、含有少量串珠的丝状以及大量串珠状的纤维膜上的增殖没有明显差异。
ALP活性实验以及PCR实验表明成骨细胞分化的程度:纯丝组>少量串珠组>大量串珠组。可能是微观下丝状纤维膜的结构更好的模拟了细胞外基质,利于支持和引导细胞行为[17-18]。其高孔隙率及孔径更有利于支架与环境之间的营养交换和新陈代谢,为成骨细胞分化提供了更多的结构空间。少量串珠组较大量串珠组也具有更高的的孔隙率和孔径,更利于成骨细胞的分化。
综上所述,微观下为丝状的纤维膜和含有少量串珠的丝状纤维膜以及大量串珠状的纤维膜在亲水性和对成骨细胞增殖的影响没有明显区别。串珠增多时,连接串珠之间丝的直径减小,断裂伸长率、极限强度、和弹性模量随之减少,其有更大的比表面积和水渗透性使大量串珠状具有更快的降解速度。由于其丝状纤维膜高孔隙率且较好地模拟了细胞外基质的结构使其更有利于成骨细胞的分化。本文初步探讨了不同形态的纤维膜的亲水性、降解和对成骨细胞增殖和分化的影响,有待进一步细胞实验、动物实验以评价不同形态的电纺纤维膜对骨缺损的修复效果。
| [1] | NGUYEN D N, CLASEN C, VAN DEN MOOTER G. Pharmaceutical applications of electrospraying[J]. J Pharm Sci, 2016, 105(9): 2601–2620. DOI:10.1016/j.xphs.2016.04.024 |
| [2] | WANG X, DING B, LI B. Biomimetic electrospun nanofibrous structures for tissue engineering[J]. Mater Today (Kidlington), 2013, 16(6): 229–241. DOI:10.1016/j.mattod.2013.06.005 |
| [3] | BRAGHIROLLI D I, STEFFENS D, PRANKE P. Electrospinning for regenerative medicine: a review of the main topics[J]. Drug Discov Today, 2014, 19(6): 743–753. DOI:10.1016/j.drudis.2014.03.024 |
| [4] |
纪徐源. 浅谈静电纺丝技术在组织工程中的应用[J].
科技展望, 2016, 26(11): 168.
JI X Y. Application of electrostatic spinning technology in tissue engineering[J]. Technol Outlook, 2016, 26(11): 168. DOI:10.3969/j.issn.1672-8289.2016.11.150 |
| [5] | YAO S, YANG Y, WANG X, et al. Fabrication and characterization of aligned fibrin nanofiber hydrogel loaded with PLGA microspheres[J]. Macromol Res, 2017, 25(6): 528–533. DOI:10.1007/s13233-017-5121-x |
| [6] |
王浩, 郭珩, 刘影, 等. 十六烷基磷脂酰胆碱复合聚ε-己内酯电纺微球的制备及表征[J].
辽宁医学院学报, 2015, 36(2): 1–4.
WANG H, GUO H, LIU Y, et al. The preparation and characterization of hexadecyl phosphatidyl choline compound and its microspheres[J]. J Liaoning Med Coll, 2015, 36(2): 1–4. |
| [7] |
张金宁, 宋明玉, 何慢, 等. 多孔超细醋酸纤维/涤纶非织造布复合滤材的制备及性能[J].
高分子材料科学与工程, 2017, 33(2): 117–122.
ZHANG J N, SONG M Y, HE M, et al. Preparation and properties of porous superfine acetate/polyester nonwovens composite filter material[J]. Sci Eng Polymer Materi, 2017, 33(2): 117–122. DOI:10.16865/j.cnki.1000-7555.2017.02.022 |
| [8] | NIRMALA R, NAVAMATHAVAN R, PARK S J, et al. Recent progress on the fabrication of ultrafine polyamide-6 based nanofibers via electrospinning: a topical review[J]. Nano-Micro Letters, 2014, 6(2). DOI:10.5101/nml.v6i2.p89-107 |
| [9] |
杨延慧, 严涵, 康晓梅, 等. 聚己内酯的应用研究进展[J].
化工新型材料, 2011, 39(12): 13–15.
YANG Y H, YAN H, KANG X M, et al. Progress in the application of polycaprolactone[J]. Chem New Mater, 2011, 39(12): 13–15. DOI:10.3969/j.issn.1006-3536.2011.12.004 |
| [10] |
朱文超, 崔海坡, 郭丹一, 等. 形状记忆聚合物特性及在生物医学领域应用中的优势[J].
中国组织工程研究, 2014, 18(47): 7677–7682.
ZHU W C, CUI H P, GUO D Y, et al. The characteristics of shape memory polymer and its advantages in biomedical applications[J]. Chin Tissue Eng Res, 2014, 18(47): 7677–7682. DOI:10.3969/j |
| [11] |
邓霞, 白石. 电纺聚己内酯引导骨再生膜的仿生矿化研究[J].
华西口腔医学杂志, 2016, 34(6): 570–574.
DENG X, BAI S. Study on the biomimetic mineralization of electrospun polycaprolactone guided bone regeneration membrane[J]. J Huaxi Oral Med, 2016, 34(6): 570–574. DOI:10.7518/hxkq.2016.06.004 |
| [12] | BRIGGS T, ARINZEH T L. Examining the formulation of emulsion electrospinning for improving the release of bioactive proteins from electrospun fibers[J]. J Biomed Mater Res Part A, 2014(3): 674–684. DOI:10.1002/jbm.a.34730 |
| [13] | XUE-NING C, HONG-SONG F, HONG-JUN W. Effect of phase composition of calcium phosphate(CaP) on bioactivity of osteon-like composite scaffolds[J]. J Inorganic Mater, 2016, 31(1): 107. DOI:10.15541/jim20150366 |
| [14] |
赵亮, 陈红丽, 王勉, 等. 蛛丝蛋白复合材料小直径血管支架的体内降解及体外生物相容性的研究[J].
中国生物医学工程学报, 2016, 35(1): 88–95.
ZHAO L, CHEN H L, WANG M, et al. Study on the degradation and in vitro biocompatibility of small diameter vascular stents with spider silk protein composites[J]. J Chin Biomed Eng, 2016, 35(1): 88–95. DOI:10.3969/j.issn.0258-8021.2016.01.011 |
| [15] |
陈桂香, 黄飞燕. 不同共聚比例的PLGA静电纺丝膜的结构与性能[J].
合成纤维, 2017, 46(1): 34–36.
CHEN G X, HUANG F Y. The structure and properties of PLGA electrostatic spinning film with different copolymerization ratio[J]. Synthetic Fiber, 2017, 46(1): 34–36. DOI:10.16090/j.cnki.hcxw.2017.01.014 |
| [16] | TSIAPLA A R, KARAGKIOZAKI V, PAPPA F, et al. Drug delivery nanoplatform for orthopaedic-associated infections[J]. Mater Today Proc, 2017, 4(7): 6880–6888. DOI:10.1016/j.matpr.2017.07.017 |
| [17] | CHEN N, TIAN L, HE L, et al. Nanobiomaterials for neural regeneration[J]. Neural Regen Res, 2016, 11(9): 1372–1374. DOI:10.4103/1673-5374.191195 |



