2. 056001 河北 邯郸,解放军第285医院药剂科
2. Department of Pharmacy, No. 285 Hospital of PLA, Handan, Hebei Province, 056001, China
泮托拉唑是继奥美拉唑、兰索拉唑之后的新一代质子泵抑制剂(proton pump inhibitor, PPI),是消化性溃疡病的一线治疗药物。泮托拉唑能特异性地抑制壁细胞顶端膜构成的分泌性微管和胞质内的管状泡上H+/K+-ATP酶,引起该酶不可逆性的抑制,从而有效地抑制胃酸的分泌[1],临床用于消化性溃疡及其出血、反流性食管炎、胃泌素瘤等疾病的治疗[2]。泮托拉唑在体内主要由肝脏P450酶CYP2C19和CYP3A4代谢[3],极少量由CYP2D6代谢,与其他药物配伍用时,具有药物间相互作用小的优点,无致突变、致癌和致畸作用[1]。由于其口服生物利用度较低,临床以注射用泮托拉唑较为常见。临床所用泮托拉唑为外消旋体混合物,其中左旋异构体与右旋异构体比例为1: 1,左旋为其主要活性成分,而右旋基本无活性[4]。有关注射用泮托拉唑钠人体静脉滴注药动学研究虽已有相关报道[5],但不同剂量注射用泮托拉唑钠在志愿者体内的药代动力学和药效学参数之间的量效相关性国内尚未报道,其相关数据结果大都来源于国外白种人群。且在临床工作中出现了多例药品不良反应事件,甚至发生过严重的不良反应。为确定该药在中国人群用药剂量的安全性和合理性,本研究采用高效液相质谱联用法测定健康人群血浆中左旋泮托拉唑的含量,并监测给药后24 h健康受试者胃内pH,研究中国健康人群药动学及药效学特征,从而为临床精准用药提供参考数据。
1 材料与方法 1.1 仪器液相色谱系统:岛津液相色谱系统(包括LC-30AD液相色谱泵,DGU-20A5R脱气机,SIL-30AC自动进样器,CTO-20A柱温箱);MS/MS系统:Triple Quad 5500型三重四极杆串联质谱仪,配备大气压化学电离源(APCI源),均购自加拿大Sciex公司。
1.2 药品与试剂注射用泮托拉唑钠,英文名:Pantoprazole Sodium for injection,商品名:潘妥洛克,规格40 mg/支,生产厂家:Takeda GmbH,批号:310267;左旋泮托拉唑对照品购自珠海赛隆药业医药研发中心(批号20160726-2,含量98.8%);内标:S-(-)-泮托拉唑-d6购自加拿大TLC公司(批号1653-016A3,含量99.9%);乙腈、甲醇(色谱纯)购自美国Sigma公司;醋酸铵(色谱纯)购自美国ROE公司;去离子水由Millipore超纯水仪制备。
1.3 试验方法 1.3.1 受试者的选择选择20名健康志愿者,男女各半,年龄(24.40±3.03)岁,身高(1.65±0.08)m,体质量(56.85±6.08)kg,体质量指数(20.79±1.48)kg/m2。试验前进行体格检查,血尿便常规、肝肾功能、心率、血压和心电图等检查均正常;试验者无心、肝、肾、消化道和血液系统等严重疾病史,无精神病史及吸毒史;筛选前3个月未参加药物临床试验及近期无生育计划者,无药物过敏史;无吸烟、嗜酒及经常用药史;血妊娠(育龄期女性)检查阴性,幽门螺杆菌感染(13C呼气试验)阴性。2周内未服用任何可能影响本品吸收、代谢的药物。试验期间统一清淡饮食,不使用除试验制剂以外的任何药物,不接受烟、酒及含咖啡的饮料,避免剧烈运动。试验者试验前签署知情同意书,本试验方案经陆军军医大学第一附属医院医学伦理委员会审核批准[2016年伦审药第(46)号]。
1.3.2 试验方案采用单中心、随机、开放、平行对照试验,筛选20名健康受试者,采用男女分层区组随机化方法分为2组,每组10名,男女各半。于正式给药前3 d入住Ⅰ期临床试验病房,给药前一晚禁食过夜(禁食时间不少于8 h)。试验者分别于第1天和第5天禁食早餐,室温条件下给予注射用泮托拉唑钠(40 mg,每12小时1次)和80 mg,每12小时1次静脉滴注。用100 mL 0.9%氯化钠注射液溶解,滴注时间控制在0.5 h。首次用药前及每次用药结束后,分别在半小时内测量生命体征(体温、脉搏、呼吸、血压),受试者将在第1天和第5天首次给药前(0 min)和给药后10、20、30(滴注结束即刻)、35、45、60、90 min,2、3、4、5、6、8、12 h采集血样本4 mL,置于肝素抗凝的试管中,3 500 r/min离心5 min,分离上层血浆,后转运至-70 ℃左右的低温冰箱保存至样品分析。第2、3、4天给药前从静脉采血4 mL以测定谷浓度。受试者分别于第1天和第5天给药前将校正后的胃内pH测定仪导管从鼻腔插入,按pH梯度法,置电极于食管下括约肌下方5~8 cm处并固定导管,从用药开始,连续记录胃内24 h pH值,于24 h后取出pH导管。
1.3.3 色谱条件和质谱条件色谱条件:分析柱为Lux cellulose-4柱(250 mm×4.6 mm I.D, 5 μm, 美国Phenomenex公司);预柱为Lux cellulose-4保护柱(4.0 mm×3.0 mm I.D, 美国Phenomenex公司);流动相为10 mmol/L醋酸铵水溶液:乙腈=10: 90(体积比);流速1.3 mL/min,柱后分流,0.4 mL/min进入质谱;进样量为2.00 μL;自动进样器:室温;柱温:40 ℃。
质谱条件:离子源为加拿大Sciex APCI离子源;雾化电流:3.0 μA;离子源温度:550 ℃;离子源气体:55 psi;扫描方式:MRM;碰撞气压力:6 psi;去簇电压:50 V;扫描时间:400 ms;用于定量分析离子对:泮托拉唑m/z 384.1→200.1,碰撞能量18 eV,泮托拉唑-d6 m/z 390.2→206.0,碰撞能量18 eV。
1.4 对照品和内标溶液的配制 1.4.1 对照品溶液的配制分别取左旋泮托拉唑钠对照品适量,精密称定,以甲醇:水(1: 1,体积比)为溶剂,定量配制成含左旋泮托拉唑钠300.00、240.00、150.00、60.00、15.00、3.00、0.75、0.30 μg/mL的标准溶液。
1.4.2 内标液的配制精密称量内标化合物S-(-)-泮托拉唑-d6 7.93×103 mg,根据化学纯度折算系数0.992,校正后溶于甲醇得到最终浓度为787 μg/mL的内标储备液。
1.5 血浆样本的处理向96孔板中加入50.0 μL血浆样品,500 μL内标溶液(S-(-)-泮托拉唑-d6的浓度为0.05 μg/mL),涡流2 min,4 ℃离心10 min(4 500 r/min),取2.00 μL上清液进行LC-MS/MS分析。
1.6 胃内24 h的pH监测受试者晨起空腹进行胃内插管,仪器使用OrionⅡ便携式pH测量系统,电极使用前在中性缓冲液中至少浸泡10 min,再用pH 7.3和pH 1.0的标准液,校正电极。将校正后的pH导管从鼻腔插入,按pH梯度法,置电极于食管下括约肌下方5~8 cm处并固定导管。从用药开始,连续记录胃内24 h pH值,禁食早餐。首次给药开始后2 h方可饮水,每次饮水不超过100 mL,每次间隔超过30 min,首次给药开始后4 h进食午餐,10 h后进食晚餐,检查于次日晨满24 h时结束,移去电极。
1.7 方法学确证 1.7.1 专属性取6名受试者的空白血样,以及空白血样加入对照品和志愿者服药后血样经LC-MS/MS方法分析测定得到色谱图,其中加入对照品左旋泮托拉唑后左旋泮托拉唑保留时间为3.71 min,内标S-(-)-泮托拉唑-d6保留时间为3.68 min,峰形良好,基线平稳,血浆内源性物质及其他杂质不干扰内标和样品的测定。
1.7.2 标准曲线与定量下限取含左旋泮托拉唑钠对照品的工作溶液20.0 μL加入380 μL人空白血浆,获得S-(-)-泮托拉唑浓度为0.015 0、0.037 5、0.150、0.750、3.00、7.50、12.0和15.0μg/mL的标准曲线样品。按“1.5”中的方法操作,记录S-(-)-泮托拉唑面积和内标色谱峰面积,以峰面积比对浓度用加权(W=1/x2)最小二乘法进行回归运算,求得直线回归方程y=2.23x+0.000 657, r=0.999 7, LC-MS/MS方法中S-(-)-泮托拉唑标准曲线线性范围为0.0150~ 15.0 μg/mL,线性关系良好,最低定量限浓度为0.0150 μg/mL。
1.7.3 精密度与绝对回收率采用人空白血浆配制成低、中、高3个质量浓度(0.045、2.25和11.5 μg/mL)的血浆样品,按“1.5”中的方法操作,每一质量浓度进行6样本分析。同时另外取人空白血浆50 μL,加入乙腈500 μL,涡流混合1 min后,离心5 min后取上清液,另取相应浓度的质控溶液和内标溶液经氮气吹干,加入上述上清液,涡流混匀后进样分析,获得相应峰面积。用提取后的色谱峰面积与未经提取获得的色谱峰面积之比得S-(-)-泮托拉唑的绝对回收率,均值为106%、105%、105%,内标S-(-)-泮托拉唑-d6的绝对回收率均值为106%;高、中、低3种浓度的批内和批间精密度均小于15.0%,LLOQ浓度的批内和批间精密度均小于《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》规定的20%。
1.7.4 基质效应分别取6个不同来源空白血浆和一份溶血空白血浆50 μL,加入乙腈500 μL,涡流混合1 min后,离心5 min取上清液,另取相应浓度的质控溶液(0.045和11.5 μg/mL)和内标溶液经氮气吹干,加入上述上清液,涡流混匀后进样分析,获得相应峰面积(A),同时另取水50 μL代替空白血浆,按上述方法处理后得到相应峰面积(B)。以每一种浓度两种处理方法的峰面积比值计算基质效应。按公式(A)/(B)×100%计算所得基质效应因子MF,同法处理内标所得基质效应因子MF,所得内标归一化S-(-)-泮托拉唑基质因子均值分别为102%和103%;血浆中S-(-)-泮托拉唑和内标S-(-)-泮托拉唑-d6的内标归一化基质效应因子的变异系数为1.6%和1.7%。
1.7.5 稳定性考察S-(-)-泮托拉唑全血样本在分离前室温放置2 h稳定(%CV为1.0和4.0);血浆样本在室温放置24 h稳定(%CV为2.4和2.2),-70 ℃冰冻90 d稳定(%CV为5.7和5.9),-20 ℃冰冻30 d(%CV为0.9和0.5)稳定,反复冻融5次稳定(%CV为1.4和2.1);待测工作溶液在室温放置24 h稳定(%CV为2.4和2.5),4 ℃放置6 d稳定(%CV为2.6和1.0),方法学确证结果显示,该方法符合生物样本分析要求。
1.7.6 数据处理采用WinNonlin 6.4软件用非房室模型计算药动学参数,由MMS软件记录并直接获得给药前后各时间段的胃内pH值数据,两组间比较采用独立样本t检验;其他分析及作图采用SAS 9.3软件,双侧检验,检验水准:α=0.05。
2 结果 2.1 平均血药浓度-时间曲线20名健康受试者分别多剂量注射40、80 mg泮托拉唑钠(每日2次,5 d),第1、5天的平均血药浓度-时间曲线见图 1。40 mg和80 mg 2个剂量组的达峰时间和消除半衰期相近,AUC(0-t)、Cmax与剂量呈线性相关,在人体内符合线性药代动力学特征。
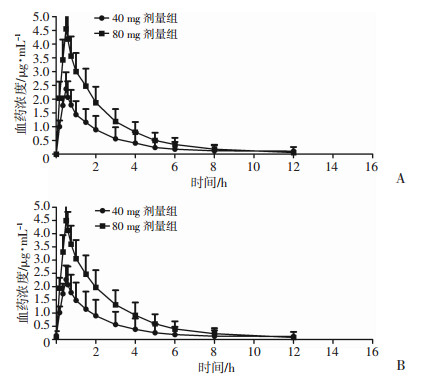
|
| A:第1天;B:第5天 图 1 20名健康受试者多剂量注射40、80 mg泮托拉唑钠后第1、5天平均血药浓度-时间曲线(n=10,x±s) |
2.2 药动学参数
采用WinNonlin 6.4软件用非房室模型计算药动学参数,20名健康受试者多次静脉滴注注射用泮托拉唑钠的主要药动学参数见表 1。80 mg剂量组在第1天和第5天的Cmax是20 mg的1.92、1.96倍,AUC(0-t)为2.05、2.14倍,AUC(0-∞)分别是2.00、2.09倍,随给药剂量增加,Cmax和AUC呈正比增加。多剂量给药后体内无蓄积。
| 组别 | Cmax/μg·mL-1 | AUC(0-t)/μg·h·mL-1 | AUC(0-∞)/ μg·h·mL-1 | t1/2/h | Tmax/h | Vz/×104mL | MRT0-∞/h | CLz/×103mL·h-1 | MRT0-t/h | Rac/% |
| 第1天 | ||||||||||
| 40 mg剂量组 | 2.37±0.61 | 4.96±3.26 | 5.17±3.68 | 1.67±0.76 | 0.50±0.01 | 1.01±0.17 | 2.10±1.04 | 4.88±1.85 | 1.84±0.72 | |
| 80 mg剂量组 | 4.56±0.89 | 10.16±3.16 | 10.34±3.35 | 1.75±0.57 | 0.53±0.08 | 0.99±0.16 | 2.24±0.82 | 4.31±1.59 | 2.08±0.60 | |
| 第5天 | ||||||||||
| 40 mg剂量组 | 2.30±0.62 | 5.02±3.85 | 5.26±4.35 | 1.72±0.78 | 0.52±0.04 | 1.08±0.21 | 0.98±0.10 | |||
| 80 mg剂量组 | 4.50±0.71 | 10.75±3.82 | 10.98±4.10 | 1.80±0.64 | 0.50±0.00 | 0.99±0.18 | 1.05±0.09 |
2.3 药效学
由MMS软件记录并直接获得给药前后各时间段的胃内pH值数据,20名健康受试者多次静脉滴注注射用泮托拉唑钠后胃内24 h pH监测结果见图 2,用药第1天和第5天24 h中pH > 4和pH > 6时间比例见表 2,用药第1天和第5天胃内pH的平均值和中位值见表 3。结果显示2个剂量组用药后胃内pH值均维持在较高水平,其中80 mg剂量组疗效优于40 mg剂量组。
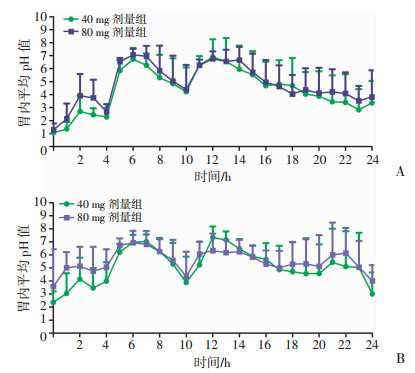
|
| A:第1天;B:第5天 图 2 健康受试者静脉滴注注射用泮托拉唑钠后第1、5天胃内24 h pH值(n=10,x±s) |
| 组别 | 用药第1天 | 用药第5天 | |||
| TpH > 4 | TpH > 6 | TpH > 4 | TpH > 6 | ||
| 40 mg剂量组 | 38.6±20.9 | 25.5±20.6 | 69.6±15.4 | 48.3±13.7 | |
| 80 mg剂量组 | 46.9±16.5 | 32.7±7.9 | 80.2±16.6 | 49.7±15.7 | |
| 组别 | 用药第1天 | 用药第5天 | |||
| x±s | 中位值 | x±s | 中位值 | ||
| 40 mg剂量组 | 4.52±0.86 | 4.81 | 5.22±0.77 | 4.93 | |
| 80 mg剂量组 | 4.92±0.60 | 5.14 | 5.60±0.85 | 5.80 | |
2.4 安全性评价
整个研究过程无受试者因不良反应终止试验。本研究中40 mg剂量组共有6例受试者发生8例不良事件,不良事件发生率为60.0%,分别为心电图改变、尿隐血阳性、ALT和AST轻微升高;80 mg剂量组共有6例受试者发生10例不良事件,不良事件发生率为60.0%,分别为ALT和AST轻微升高、白细胞降低、总胆固醇和甘油三酯轻微升高。所有受试者未经任何处置,试验结束1周内复查均自行恢复,提示所有不良事件均为一过性,受试者均能耐受。
3 讨论本研究参照文献[6-9]报道方法,采用人血浆中左旋泮托拉唑的LC-MS/MS测定方法,特异性、标准曲线、定量限、精密度、准确度、样品稳定性及回收率等均符合生物样本测定的要求。本生物分析方法采用乙腈蛋白沉淀法对样品进行前处理,具有线性范围广,灵敏度高,操作简便,准确快速,结果回收率高,无明显的基质干扰等特点。
20名健康受试者静脉滴注注射用泮托拉唑钠后,40 mg和80 mg 2个剂量组的达峰时间和消除半衰期相近,AUC(0-t)、Cmax与剂量呈线性相关,在人体内符合线性药代动力学特征,多次连续给药后,Rac(%)约等于1,表明注射用泮托拉唑钠在体内基本无蓄积。国外文献[10]报道,在36名健康成年受试者静脉注射泮托拉唑钠40 mg后Tmax和T1/2接近中国受试者的一半,Cmax在第1天和第5天分别为中国受试者的2.23倍和2.16倍。在国外另一项研究中,12名健康受试者分别静脉滴注注射用泮托拉唑钠40 mg和80 mg,胃内pH值均在1 h内达到高峰期[11],而本研究中pH高峰期出现在给药2 h后,考虑到泮托拉唑在体内代谢主要受到肝药酶P450 2C19的影响,而CYP2C19存在遗传多态性[12],药物在体内代谢不仅存在个体差异,还存在种族差异[13-14]。这可能是造成国内外该药物在受试者体内药动学和药效学差异的重要原因。
健康受试者给予注射用泮托拉唑钠后胃内pH均显著升高,以用药后第1、5天胃内24 h pH > 4和pH > 6时间比例和第1、5天胃内pH的平均值和中位值作为药效评价指标,随着剂量增加,抑制胃酸分泌的效果存在增强的趋势,而且80 mg剂量组明显优于40 mg剂量组。
国外研究显示[15],在治疗消化性溃疡并出血时,大剂量静脉使用PPI可迅速提高胃内pH至6.0以上,尤其对内镜下有高危出血表现的患者,但中国人体平均体质量及体表面积较西方人小,药物代谢基因型分布亦与西方人不同,本研究与国内学者所做研究[16-17]结论一致。80 mg剂量组较40 mg剂量组泮托拉唑更快速、有效达到抑制胃酸分泌的效果,结合受试者所发生不良反应均可耐受,且为一过性,建议临床医师使用80 mg每12小时1次剂量。
本研究的不足在于样本量较少。为进一步探讨基因多态性对药物在体内代谢的影响,后续我们将继续研究CYP2C19遗传多态性对质子泵抑制剂在国内健康人群体内代谢的影响。
| [1] |
隋淼, 王晓波, 袭荣刚, 等. 泮托拉唑钠在健康人体内的相对生物利用度及生物等效性研究[J].
中国医药导报, 2013, 10(9): 9–11, 14.
SUI M, WANG X B, XI R G, et al. Pharmacokinetics and relative bioavailability and bioequialence of Pantoprazole Sodium Enteric-Coated Tablet in healthy volunteer[J]. China Med Herald, 2013, 10(9): 9–11, 14. DOI:10.3969/j.issn.1673-7210.2013.09.004 |
| [2] |
孙培红, 鲁云兰. 质子泵抑制剂的药理作用及临床应用[J].
中国医院用药评价与分析, 2003, 3(3): 180–184.
SUN P H, LU Y L. Pharmacological action and clinical application of proton pump inhibitors[J]. Eval Analy Drug-Use Hosp China, 2003, 3(3): 180–184. DOI:10.3969/j.issn.1672-2124.2003.03.017 |
| [3] |
陈尚君, 刘冰熔. 泮托拉唑对CYP2C19强代谢型消化性溃疡药动学的影响研究[J].
临床合理用药, 2012, 5(7C): 13–14.
CHEN S J, LIU B R. The effects of pantoprazole on pharmacokinetic of CYP2C19 EMs peptic ulcer[J]. Clin Rational Drug Use, 2012, 5(7C): 13–14. |
| [4] |
谭玉娟, 马玉奎, 方超. 左旋泮托拉唑钠对幽门结扎大鼠胃溃疡模型的治疗作用[J].
中国比较医学杂志, 2015, 25(8): 54–57.
TAN Y J, MA Y K, FANG C. Protective effects of left-handed pantoprazole sodium on the rat model of gastric ulcer generated by pyloric ligation[J]. Chin J Comparative Med, 2015, 25(8): 54–57. DOI:10.3969/j.issn.1671.7856.2015.008.011 |
| [5] | ZHAN X B, GUO X R, LI Z S, et al. Inhibitory effects of intravenous lansoprazole 30 mg and pantoprazole 40 mg twice daily on intragastric acidity in healthy Chinese volunteers: a randomized, open-labeled, two-way crossover study[J]. Med Sci Monit, 2012, 18(2): CR125–CR130. |
| [6] |
高成璐, 张新峰, 沈晓红, 等. LC-MS/MS法测定人血浆中泮托拉唑浓度与人体药动学研究[J].
中国临床药学杂志, 2015, 24(4): 227–231.
GAO C L, ZHANG X F, SHEN X H, et al. LC-MS/MS determination of pantoprazole in human plasma and clinical pharmacokinetic study[J]. Chin J Clin Pharm, 2015, 24(4): 227–231. DOI:10.19577/j.cnki.issn10074406.2015.04.004 |
| [7] |
刘朋, 黄建权, 陈頔, 等. 液质联用测定人血浆中泮托拉唑的浓度[J].
中国药学杂志, 2013, 48(8): 633–635.
LIU P, HUANG J Q, CHEN D, et al. Determination of pantoprazole in human plasma by LC-MS/MS[J]. Chin Pharm J, 2013, 48(8): 633–635. DOI:10.11669/cpj.2013.08.013 |
| [8] |
华雯妍, 张全英, 周文佳, 等. 液相色谱-质谱联用法测定人血浆泮托拉唑药物浓度及应用[J].
中国药学杂志, 2014, 49(2): 143–146.
HUA W Y, ZHANG Q Y, ZHOU W J, et al. LC-MS/MS determination of pantoprazole in human plasma and its application[J]. Chin Pharm J, 2014, 49(2): 143–146. DOI:10.11669/cpj.2014.02.015 |
| [9] | JIAO H, LI Y, SUN L, et al. A chiral LC-MS/MS method for the enantioselective determination of R-(+)- and S-(-)-pantoprazole in human plasma and its application to a pharmacokinetic study of S-(-)-pantoprazole sodium injection[J]. Biomed Chromatogr, 2017, 31(10): e3980. DOI:10.1002/bmc.3980 |
| [10] | TÄUBEL J J, SHARMA V K, CHIU Y L, et al. A comparison of simplified lansoprazole suspension administered nasogastrically and pantoprazole administered intravenously: effects on 24-h intragastricpH[J]. Aliment Pharmacol Ther, 2001, 15(11): 1807–1817. DOI:10.1046/j.1365-2036.2001.01098.x |
| [11] | VAN RENSBURG C J, CHEER S. Pantoprazole for the treatment of peptic ulcer bleeding and prevention of rebleeding[J]. Clin Med Insights Gastroenterol, 2012, 5: 51–60. DOI:10.4137/CGast.S9893 |
| [12] | SHIN J M, KIM N. Pharmacokinetics and pharmacodynamics of the proton pump inhibitors[J]. J Neurogastroenterol Motil, 2013, 19(1): 25–35. DOI:10.5056/jnm.2013.19.1.25 |
| [13] | XIAO Z S, GOLDSTEIN J A, XIE H G, et al. Differences in the incidence of the CYP2C19 polymorphism affecting the S-mephenytoin phenotype in Chinese Han and Bai populations and identification of a new rare CYP2C19 mutant allele[J]. J Pharmacol Exp Ther, 1997, 281(1): 604–609. |
| [14] | OATES N S, SHAH R R, IDLE J R, et al. Influence of oxidation polymorphism on phenformin kinetics and dynamics[J]. Clin Pharmacol Ther, 1983, 34(6): 827–834. DOI:10.1038/clpt.1983.257 |
| [15] | VAN RENSBURG C J, HARTMANN M, THORPE A, et al. Intragastric pH during continuous infusion with pantoprazole in patients with bleeding peptic ulcer[J]. Am J Gastroenterol, 2003, 98(12): 2635–2641. DOI:10.1111/j.1572-0241.2003.08723.x |
| [16] |
翟丽华, 王启仪, 沙卫红, 等. 不同剂量泮托拉唑对消化性溃疡并出血高危患者胃内pH的影响[J].
新医学, 2015, 46(4): 254–258.
ZHAI L H, WANG Q Y, SHA W H, et al. Effect of different doses of pantoprazole on intra-gastric pH in patients with a high risk of peptic ulcer bleeding[J]. New Med, 2015, 46(4): 254–258. DOI:10.3969/g.issn.0253-9802.2015.04.011 |
| [17] |
魏向利, 淡春英. 不同剂量泮托拉唑治疗急性非静脉曲张性上消化道出血效果观察[J].
临床医学研究与实践, 2016, 1(22): 86–87.
WEI X L, DAN C Y. Clinical effect of different dose of pantoprazole in the treatment of acute nonvariceal upper gastrointestinal bleeding[J]. Clin Res Pract, 2016, 1(22): 86–87. |



