2. 400010 重庆,重庆医科大学附属第二医院:妇产科
2. Department of Gynecology and Obstetrics, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China
脑出血(intracerebral hemorrhage, ICH)占所有脑卒中患者的10%~15%[1], 具有高发病率和高死亡率的特点, 约40%的患者在发病1个月内死亡, 是住院患者死亡的主要原因之一[2]。在临床实践中, 积极针对原发损伤的治疗(早期清除血肿和防止血肿扩大)并不能改善脑出血的预后[3]。因此, 我们将研究重点放在脑出血的继发性损伤(血脑屏障的破坏、脑水肿、氧化应激、炎症反应), 希望能找到新的治疗方法改善脑出血的预后[4]。越来越多的研究证实炎症反应在血脑屏障破坏、脑水肿、氧化应激等继发性损伤中发挥关键作用, 减轻炎症反应能改善脑出血的预后[5]。同时, 有研究表明, 脑中的小胶质细胞是最早与脑血肿成分起反应的炎症细胞, 正是由于小胶质的激活, 分泌大量的趋化因子、炎症因子、蛋白酶以及其他细胞毒性产物, 介导了炎症级联反应[6]。近年研究发现小胶质细胞的激活不仅有介导炎症级联反应的M1型(经典激活), 还有抑制炎症具有保护作用的M2型激活(替代激活)[7]。CD4+CD25+Foxp3+ 调节性T淋巴细胞(Tregs)具有免疫抑制功能, 可以分泌IL-10、TGF-β等多种抑炎因子, 在多个实验中被证明具有抑制炎症改善预后的作用[8-10]。本研究观察在Treg细胞的作用下, 脑组织小胶质细胞的极化情况, 进一步研究Tregs诱导小胶质细胞M2型极化可能的信号通路, 阐述其可能的内在机制。
1 材料与方法 1.1 材料及主要试剂成年雄性C57BL/6小鼠120只, 体质量18~22 g, 由重庆医科大学实验动物中心提供, 符合国家级动物标准。小鼠小胶质细胞系BV2细胞由中国医学科学院基础医学研究所基础医学细胞中心提供, CD4+CD25+T细胞免疫磁珠分选试剂盒购自德国美天旎生物技术有限公司, 胎牛血清、胰酶、DMEM高糖细胞培养液购自美国Gibco公司, IL-10抗体购自美国eBioscience公司, LPS、IL-4购自中国碧云天公司, CD16抗体购自美国BD公司, CD206抗体购自美国R&D公司, STAT1抗体、STAT3抗体、p-STAT3抗体购自美国CST公司, IL-6 ELISA Kit、TNF-α ELISA Kit、IL-10 ELISA Kit、TGF-β ELISA Kit购自美国Proteintech公司, TRNzol总RNA提取试剂、反转录试剂盒及荧光定量PCR试剂盒购自日本TaKaRa公司, 所有PCR引物购自中国上海生工公司。
1.2 ICH模型构建将20只C57BL/6小鼠随机, 按体质量编号后, 采用随机数字表法分为ICH Tregs治疗组、ICH对照组和假手术Tregs治疗组、假手术对照组, 每组5只。选取术后4 d作为观察点[11]。用水合氯醛(4 mg/kg)将C57BL/6小鼠腹腔麻醉后固定于立体定向仪, 注意保暖。用眼科剪剪去小鼠头顶毛发, 碘伏消毒后切1条长约0.5 cm的正中切口, 用镊子分离露骨表面筋膜并暴露颅骨及骨缝。用磨钻于前囟签0.8 mm, 右侧旁开2.5 mm处钻一小孔, 以此作为进针点[12]。用20 μL微量上样器取小鼠尾静脉未抗凝自体血20 μL并固定于立体定向仪。从进针点缓慢进针, 深度约为3.5 mm, 以1 μL/min的速度缓慢向基底节注射。注射完成后留置10 min退针2 mm并继续留置10 min, 而后完全退出。用骨蜡封闭小孔, 缝合皮肤, 完全苏醒后放回笼盒。使用生理盐水并采用相同方法制备假手术组。术后24 h, 用CD4+CD25+T细胞免疫磁珠分选试剂盒分选Tregs, 尾静脉注射0.2 mL(约1×106个细胞)Tregs, 对照组注射0.2 mL生理盐水。
1.3 神经功能缺损评分使用Clark评分法[13]进行神经功能评分。包括身体对称性(0~4分)、步态(0~4分)、攀爬(0~4分)、转圈试验(0~4分)、前肢对称性(0~4分)。小鼠所得分数越大神经功能缺损越重。由两名经过培训的实验员在不知道分组的情况下进行评分。
1.4 脑含水量评估处死小鼠后剪开颅骨, 分离并取出脑组织置于事先称质量并编号的锡箔纸上, 分别用电子天平称质量, 此为湿质量。然后, 将脑组织置于100 ℃烤箱中干燥24 h, 取出称量作为干质量。脑含水量的公式:脑含水量=(湿质量-干质量)/湿质量×100%。
1.5 血肿体积评估采用冰冻切片计算法[14]评估血肿体积。将小鼠脑组织灌注固定后, 用冰冻切片机以100 μm的厚度连续切片。用相机拍摄所有有血肿的切片, 并用Image-Pro Plus计算每张切片的血肿面积。按照如下公式计算血肿体积:血肿体积=每张切片血肿面积×0.1 mm×层数。
1.6 免疫荧光染色脑组织灌注固定后, 4%多聚甲醛4 ℃过夜, 分别用15%和30%的蔗糖溶液梯度脱水。OCT包埋剂包埋后置于冰冻切片机以8 μm的厚度连续切片, 切好后储存于-20 ℃冰箱备用。取出切片, 室温复温5 min, PBS清洗5 min, 5%驴血清封闭30 min, 一抗(CD16/32 1 :50, CD206 1 :50)4 ℃孵育过夜, PBS清洗3次×5 min, 对应的荧光二抗(1 :50), 避光室温孵育1 h, PBS清洗3次×5 min, 抗荧光淬灭剂封片, 于激光共聚焦显微镜下观察及采图。使用Image-Pro Plus对荧光图中M1型和M2型计数, 计算M2型占总小胶质细胞百分比。
1.7 细胞培养BV2细胞置于Transwell 6孔板下室, 按分组情况加入IL-10抗体(10 μg/mL)中和IL-10, 经LPS/IL-4刺激6 h后按照CD4+CD25+T细胞免疫磁珠分选试剂盒说明书操作步骤分选Tregs, 将Tregs细胞置于上室, 与下室的BV2细胞共培养72 h。
1.8 ELISA检测取Transwell 6孔板下室的上清和血肿周围组织匀浆离心(4 ℃, 12 000×g, 离心10 min)后的上清, 按照ELISA试剂盒的操作步骤测定共培养细胞和脑组织中IL-6、TNF-α、IL-10、TGF-β的表达。
1.9 实时荧光定量PCR按照说明书的操作步骤使用TRIzol试剂分别提取血肿周围组织和BV2细胞内的总RNA; 所得RNA通过分光光度计检测浓度; 使用TaKaRa反转录试剂盒和PCR仪进行反转录, 按产品说明书步骤进行; 反转录后所得cDNA使用SYBR®-Green和荧光定量PCR检测系统进行qRT-PCR检测, 以GAPDH为内参。相关引物信息见表 1。
| 引物名称 | 上游引物序列 | 下游引物序列 | 片段大小(bp) |
| CCL3 | 5′-ATGCAAGTTCAGCTGCCTGC-3′ | 5′-ATGCCGTGGATGAACTGAGG-3′ | 141 |
| iNOS | 5′-AATGGCAACATCAGGTCGGCCATCACT-3′ | 5′-GCTGTGTGTCACAGAAGTCTCGAACTC-3′ | 370 |
| Arg1 | 5′-GAACACGGCAGTGGCTTTAAC-3′ | 5′-TGCTTAGTTCTGTCTGCTTTGC-3′ | 155 |
| Ym1 | 5′-AGAAGGGAGTTTCAAACCTGGT-3′ | 5′-GTCTTGCTCATGTGTGTAAGTGA-3′ | 109 |
| GAPDH | 5′-CACCCACTCCTCCACCTTTG-3′ | 5′-CCACCACCCTGTTGCTGTAG-3′ | 220 |
1.10 Western blot检测
BV2小胶质细胞与Tregs共培养后, 提取BV2细胞总蛋白, 经BCA法测定蛋白浓度。按50 μg/孔上样进行电泳、转膜。所得条带经5% BSA封闭60 min, 分别加入STAT3抗体(1 :1 000)、p-STAT3抗体(1 :1 000)、TGF-β(1 :1 000)、β-actin抗体(1 :5 000)4 ℃过夜孵育, PBST清洗3遍×5 min, 分别加入对应的二抗(1 :1 000浓度稀释)37 ℃孵育1 h, PBST清洗3遍×5 min, ECL化学发光显影。
1.11 统计学分析应用SPSS 17.0统计软件, 数据以x±s表示, 进行正态性、方差齐性检验, 两组间比较应用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 Tregs减轻脑出血炎症损伤与对照组相比, Tregs能明显降低神经功能缺损评分, ICH后脑组织的含水量减少, 差异有统计学意义(P < 0.05, 图 1A、B)。Tregs治疗组能明显减少ICH的血肿量(图 1C~E)。这说明Tregs能减轻ICH后的炎症损伤。

|
|
1:对照组; 2:Tregs治疗组; a:P < 0.05, 与对照组比较;
A:小鼠神经功能缺损评分; B:脑组织含水量; C:血肿体积; D:小鼠头部MRI(相同处理的不同样本); E:脑组织切片(相同处理的不同样本) 图 1 Tregs减轻脑出血术后4 d炎症损伤 |
2.2 Tregs诱导血肿周围脑组织中小胶质细胞/巨噬细胞M2型极化
过继性转输Tregs后血肿周围脑组织中CD206表达升高, CD16/32表达降低(P < 0.05, 图 2A、B)。使用IL-6、TNF-α作为M1型标志物, IL-10、TGF-β作为M2型的标志物, 进行血肿周围组织的ELISA测定, 结果(图 2C、E)显示, 与对照组相比, Tregs治疗组IL-10、TGF-β的表达量显著增加(P < 0.05), 而IL-6、TNF-α表达量减少(P < 0.05)。PCR结果(图 2D、F)显示, Tregs治疗组M2型小胶质细胞标志物Arg1、Ym1的表达增加, M1型标志物CCL3、iNOS的表达减少(P < 0.05)。这些结果说明Tregs可以诱导血肿周围脑组织中的小胶质/巨噬细胞向M2型极化。

|
| A:术后4 d血肿周围组织免疫荧光双染M1型标志物CD16/32(红光)和M2型标志物CD206(绿光)(×200);B:M1型和M2占总小胶质/巨噬细胞比例a:P < 0.05, 与对照组比较; C:ELISA检测血肿周围组织M1型相关标记物(IL-6、TNF-α)的表达a:P < 0.01, 与假手术组及Tregs治疗组比较; D:PCR检测血肿周围组织M1型相关mRNA(CCL3、iNOS)的表达a:P < 0.01, 与假手术组及Tregs治疗组比较; E:ELISA检测血肿周围组织M2型相关标记物(IL-10、TGF-β)的表达a:P < 0.01, 与假手术组及Tregs治疗组比较; F:PCR检测血肿周围组织M2型相关mRNA (Arg1、Ym1)的表达a:P < 0.01, 与假手术组及Tregs治疗组比较 图 2 Tregs诱导血肿周围脑组织中小胶质细胞/巨噬细胞M2型极化 |
2.3 Tregs诱导LPS/IL-4激活的BV2小胶质细胞M2型极化
将Tregs与激活的小胶质细胞共培养72 h后, M1型相关细胞因子IL-6、TNF-α以及相关mRNA CCL3、iNOS表达明显减少(P < 0.05, 图 3A、B), 同时M2型相关细胞因子IL-10、TGF-β以及相关mRNA Arg1、Ym1表达明显增加(P < 0.05, 图 3C、D)。细胞培养模型也验证了Tregs可以诱导小胶质细胞向M2型极化。
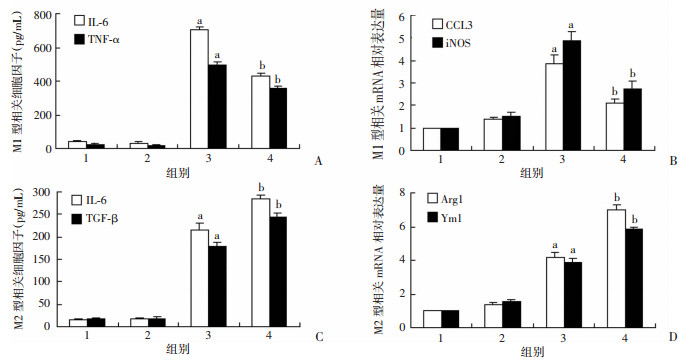
|
|
a:P < 0.05, 与BV2组比较; b:P < 0.05, 与LPS/IL-4刺激BV2组比较 1:BV2组; 2:BV2和Tregs共培养组; 3:LPS/IL-4刺激BV2组; 4:LPS/IL-4预刺激BV2后和Tregs共培养组 A:ELISA检测M1型相关细胞因子(IL-6、TNF-α)的表达; B:PCR检测M1型相关mRNA(CCL3、iNOS)的表达; C:ELISA检测M2型相关细胞因子(IL-10、TGF-β)的表达; D:PCR检测M2型相关mRNA(Arg1、Ym1)的表达 图 3 Tregs诱导LPS/IL-4激活的BV2小胶质细胞M2型极化 |
2.4 Tregs通过IL-10/STAT3信号通路调节小胶质细胞极化
在细胞实验中, LPS/IL-4激活小胶质细胞后, IL-10表达量明显增加(P < 0.05), 且与Tregs共培养促进IL-10表达量的增加(P < 0.05, 图 3C)。同样的, LPS/IL-4刺激BV2组和LPS/IL-4预刺激BV2后Tregs共培养组p-STAT3表达均增加(P < 0.05), 且LPS/IL-4预刺激BV2后Tregs共培养组p-STAT3表达明显高于LPS/IL-4刺激BV2组(P < 0.05), 用IL-10抗体中和IL-10后, p-STAT3水平明显降低(P < 0.05, 图 4A、B)。同时, LPS/IL-4刺激BV2组和LPS/IL-4预刺激BV2后Tregs共培养组M2型相关mRNA Arg1、Ym1和相关蛋白TGF-β表达均增加(P < 0.05),且LPS/IL-4预刺激BV2后Tregs共培养组表达明显高于LPS/IL-4刺激BV2组(P < 0.05), 用IL-10抗体中和IL-10后, Tregs的效应被逆转, LPS/IL-4刺激已加入IL-10抗体的BV2细胞培养组表达低于LPS/IL-4刺激BV2组(P < 0.05), LPS/IL-4刺激已加入IL-10抗体的BV2和Tregs共培养组表达低于LPS/IL-4预刺激BV2后和Tregs共培养组(P < 0.05), LPS/IL-4刺激已加入IL-10抗体的BV2和Tregs共培养组与LPS/IL-4刺激已加入IL-10抗体的BV2细胞培养组相比, 表达差异无统计学意义(P>0.05, 图 4C~E)。这些结果表明Tregs可以通过IL-10/STAT3信号通路调节小胶质细胞M2型极化。
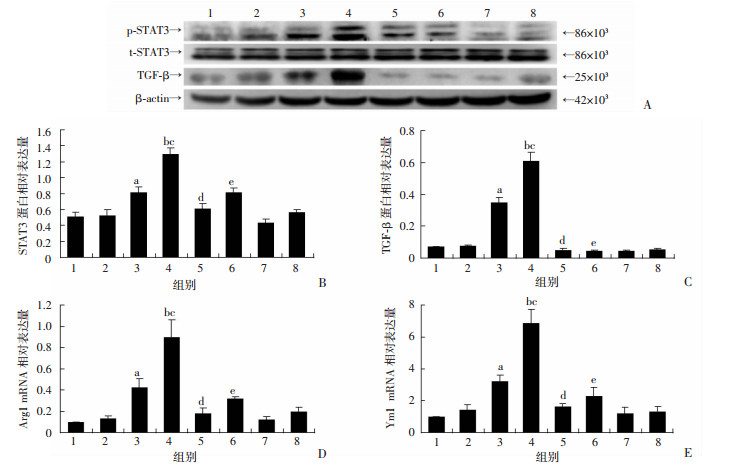
|
|
1:BV2组; 2:BV2和Tregs共培养组; 3:LPS/IL-4刺激BV2组; 4:LPS/IL-4预刺激BV2后和Tregs共培养组; 5:LPS/IL-4刺激已加入IL-10抗体的BV2细胞培养组; 6:LPS/IL-4刺激已加入IL-10抗体的BV2和Tregs共培养组; 7:加入IL-10抗体的BV2细胞培养组; 8:加入IL-10抗体的BV2细胞和Tregs共培养组 a:P < 0.05, 与BV2组比较; b:P < 0.05, 与BV2和Tregs共培养组比较; c:P < 0.05, 与LPS/IL-4刺激BV2组比较; d:P < 0.05, 与LPS/IL-4刺激BV2组比较; e:P < 0.05, 与LPS/IL-4预刺激BV2后和Tregs共培养组比较 A:Western blot检测t-STAT3、p-STAT3和TGF-β; B:p-STAT3/t-STAT3半定量分析; C:TGF-β蛋白半定量分析; D:Arg1 mRNA相对表达量; E:Ym1 mRNA相对表达量 图 4 Tregs通过IL-10/STAT3信号通路调节小胶质细胞极化 |
3 讨论
ICH后的继发性炎症损伤是造成预后不良的主要原因之一, 抑制炎症反应可以改善ICH预后[15], 使用芬戈莫德抑制外周淋巴细胞向中枢系统浸润, 可以减轻ICH所致炎症损伤[6]。同时, ICH炎症过程中存在保护性系统的激活, 增强保护性机制为ICH的治疗提供了新的研究方向。
Tregs广泛存在于包括脑组织的各种组织中, 已经被证实在多种炎症以及中枢退行性病变、脑缺血性疾病、ICH中起着重要的调节作用[15-16]。在本动物实验中, Tregs明显的降低小鼠ICH术后神经功能障碍评分, 减少脑组织含水量以及血肿体积, 同时血肿周围组织中促炎因子(IL-6、TNF-α)含量降低而抗炎因子(IL-10、TGF-β)含量增高, 表明Tregs减轻ICH所致的炎症损伤。
为了验证Tregs可能是通过诱导小胶质细胞M2型极化发挥抗炎作用的假设, 我们检测了血肿周围组织的炎症相关因子和mRNA水平, 结果发现M1型小胶质细胞相关的标记物(IL-6、TNF-α)及相关mRNA(CCL3、iNOS)表达减少, M2型小胶质细胞相关标记物(IL-10、TGF-β)及相关mRNA(Arg1、Ym1)表达增加。组织免疫荧光检测, 直观地从大体上观察到ICH后通过Tregs治疗, 脑组织中小胶质细胞的极化状态的改变, 使用Image-Pro Plus对荧光图中M1和M2计数, 计算M2型占总小胶质细胞百分比, 发现Tregs治疗组血肿周围组织M2型极化的小胶质细胞占总小胶质细胞百分比明显升高。这说明Tregs能够明显减少小胶质细胞炎症因子的表达, 并能诱导小胶质细胞向M2型极化。为进一步验证动物实验结果, 本研究构建了体外细胞模型。BV2细胞系为BLASI等在1990年应用携带癌基因v-raf/v-myc的反转录病毒J2感染原代培养的小鼠小胶质细胞而获得的永生细胞系[17], 具备原代培养的小胶质细胞的形态学、表型以及各项功能特点, 是目前应用最多的用于替代原代小胶质细胞的细胞系。因此, 我们利用BV2细胞和Tregs进行Transwell共培养建立体外细胞模型, 模拟ICH炎症环境下的小胶质细胞和Tregs之间的相互作用。在细胞实验中, 小胶质细胞可以被特定的激活剂激活成M1型或者M2型。在此前很多实验已经证实, 在ICH中小胶质细胞并不是被单一的激活成为某一特定的极化状态, 而是M1和M2混合的状态[18-20]。因此, 我们采用LPS/IL-4混合物刺激小胶质细胞, 模拟ICH小胶质细胞的激活状态[21]。结果发现, 与动物实验结果一致, M1型小胶质细胞相关的标记物(IL-6、TNF-α)及相关mRNA(CCL3、iNOS)表达减少, M2型小胶质细胞相关标记物(IL-10、TGF-β)及相关mRNA(Arg1、Ym1)表达增加。
进一步探究Tregs诱导小胶质细胞M2型极化的信号转导机制, 尤其是与ICH后神经保护和神经修复相关的抗炎反应的机制。本实验结果表明, 在Tregs和小胶质细胞共培养中, IL-10的表达量明显增加。IL-10是一个具有多效性的免疫调节因子, 在炎症反应和免疫反应中发挥重要作用[22], 能够调节TLR信号通路[23], 并且IL-10敲除鼠会表现出更重的炎症损伤[24]。同时, IL-10可以通过激活STAT3发挥其调节功能。因此, 我们假设Treg细胞是通过IL-10/STAT3信号通路诱导小胶质细胞M2型极化。本实验结果表明, Tregs诱导小胶质细胞M2型极化的同时磷酸化STAT3的表达水平显著升高。为了进一步确认Treg细胞通过IL-10激活STAT3在Tregs诱导小胶质细胞的M2型极化, 我们用IL-10抗体中和IL-10后用LPS/IL-4刺激Tregs, 发现缺少IL-10的小胶质细胞p-STAT3表达量明显降低。并且当IL-10被中和后, M2型小胶质细胞相关mRNA(Arg1 Ym1)表达水平显著下降。
综上所述, 本研究证明Tregs通过IL-10/STAT3信号通路诱导小胶质细胞M2型极化发挥抗炎作用改善ICH预后, 部分揭示Tregs通过发挥其抗炎作用治疗ICH的机制, 但渗入脑组织中的Tregs的功能变化和其他可能的抗炎机制还需要更深入的研究。
| [1] | VAN ASCH C J, LUITSE M J, RINKEL G J, et al. Incidence, case fatality, and functional outcome of intracerebral haemorrhage over time, according to age, sex, and ethnic origin: a systematic review and meta-analysis[J]. Lancet Neurol, 2010, 9(2): 167–176. DOI:10.1016/S1474-4422(09)70340-0 |
| [2] | ZHOU M, WANG H, ZHU J, et al. Cause-specific mortality for 240 causes in China during 1990-2013: a systematic subnational analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2016, 387(10015): 251–272. DOI:10.1016/S0140-6736(15)00551-6 |
| [3] | MENDELOW A D, GREGSON B A, FERNANDES H M, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage (STICH): a randomised trial[J]. Lancet, 2005, 365(9457): 387–397. DOI:10.1016/S0140-6736(05)17826-X |
| [4] | ARONOWSKI J, ZHAO X. Molecular pathophysiology of cerebral hemorrhage: secondary brain injury[J]. Stroke, 2011, 42(6): 1781–1786. DOI:10.1161/STROKEAHA.110.596718 |
| [5] | KEEP R F, HUA Y, XI G. Intracerebral haemorrhage: mechanisms of injury and therapeutic targets[J]. Lancet Neurol, 2012, 11(8): 720–731. DOI:10.1016/S1474-4422(12)70104-7 |
| [6] | ROLLAND W B, LEKIC T, KRAFFT P R, et al. Fingolimod reduces cerebral lymphocyte infiltration in experimental models of rodent intracerebral hemorrhage[J]. Exp Neurol, 2013, 241: 45–55. DOI:10.1016/j.expneurol.2012.12.009 |
| [7] | SICA A, MANTOVANI A. Macrophage plasticity and polarization: in vivo veritas[J]. J Clin Invest, 2012, 122(3): 787–795. DOI:10.1172/JCI59643 |
| [8] | SAKAGUCHI S, MIYARA M, COSTANTINO C M, et al. FOXP3+ regulatory T cells in the human immune system[J]. Nat Rev Immunol, 2010, 10(7): 490–500. DOI:10.1038/nri2785 |
| [9] | LOWTHER D E, HAFLER D A. Regulatory T cells in the central nervous system[J]. Immunol Rev, 2012, 248(1): 156–169. DOI:10.1111/j.1600-065X.2012.01130.x |
| [10] | TIEMESSEN M M, JAGGER A L, Evans H G, et al. CD4+CD25+Foxp3+ regulatory T cells induce alternative activation of human monocytes/macrophages[J]. Proc Nat Acad Sci, 2007, 104(49): 19446–19451. DOI:10.1073/pnas.0706832104 |
| [11] | ZHOU K, ZHONG Q, WANG Y C, et al. Regulatory T cells ameliorate intracerebral hemorrhage-induced inflammatory injury by modulating microglia/macrophage polarization through the IL-10/GSK3β/PTEN axis[J]. J Cereb Blood Flow Metab, 2017, 37(3): 967–979. DOI:10.1177/0271678X16648712 |
| [12] | FANG H, CHEN J, LIN S, et al. CD36-mediated hematoma absorption following intracerebral hemorrhage: negative regulation by TLR4 signaling[J]. J Immunol, 2014, 192(12): 5984–5992. DOI:10.4049/jimmunol.1400054 |
| [13] | CLARK W, GUNION-RINKER L, LESSOV N, et al. Citicoline treatment for experimental intracerebral hemorrhage in mice[J]. Stroke, 1998, 29(10): 2136–2140. DOI:10.1161/01.str.29.10.2136 |
| [14] | WEIRATHER J, HOFMANN U D W, BEYERSDORF N, et al. Foxp3+ CD4+ T cells improve healing after myocardial infarction by modulating monocyte/macrophage differentiation[J]. Circulation Research, 2014, 115(1): 55–67. DOI:10.1161/circresaha.115.303895 |
| [15] | WANG J, DOR S. Inflammation after intracerebral hemorrhage[J]. J Cereb Blood Flow Metab, 2007, 27(5): 894–908. DOI:10.1038/sj.jcbfm.9600403 |
| [16] | KIPNIS J, AVIDAN H, CASPI R R, et al. Dual effect of CD4+CD25+ regulatory T cells in neurodegeneration: a dialogue with microglia[J]. Proc Natl Acad Sci U S A, 2004, 101(Suppl 2): 14663–14669. DOI:10.1073/pnas.0404842101 |
| [17] | BLASI E, MATHIESON B J, VARESIO L, et al. Selective immortalization of murine macrophages from fresh bone marrow by a raf/myc recombinant murine retrovirus[J]. Nature, 1985, 318(6047): 667–670. DOI:10.1038/318667a0 |
| [18] | KUMAR A, ALVAREZ-CRODA D M, STOICA B A, et al. Microglial/macrophage polarization dynamics following traumatic brain injury[J]. J Neurotrauma, 2016, 33(19): 1732–1750. DOI:10.1089/neu.2015.4268 |
| [19] | MORGANTI J M, RIPARIP L K, ROSI S. Call off the dog(ma): M1/M2 polarization is concurrent following traumatic brain injury[J]. PLoS ONE, 2016, 11(1): e0148001. DOI:10.1371/journal.pone.0148001 |
| [20] | KIM C C, NAKAMURA M C, HSIEH C L. Brain trauma elicits non-canonical macrophage activation states[J]. J Neuroinflam, 2016, 13(1): 117. DOI:10.1186/s12974-016-0581-z |
| [21] | BARRETT J P, HENRY R J, VILLAPOL S, et al. NOX2 deficiency alters macrophage phenotype through an IL-10/STAT3 dependent mechanism: implications for traumatic brain injury[J]. J Neuroinflam, 2017, 14(1): 65. DOI:10.1186/s12974-017-0843-4 |
| [22] | COUPER K N, BLOUNT D G, RILEY E M. IL-10: the master regulator of immunity to infection[J]. J Immunol, 2008, 180(9): 5771–5777. DOI:10.4049/jimmunol.180.9.5771 |
| [23] | CURTALE G, MIROLO M, RENZI T A, et al. Negative regulation of Toll-like receptor 4 signaling by IL-10-dependent microRNA-146b[J]. Proc Natl Acad Sci USA, 2013, 110(28): 11499–11504. DOI:10.1073/pnas.1219852110 |
| [24] | BERG D J, KÜHN R, RAJEWSKY K, et al. Interleukin-10 is a central regulator of the response to LPS in murine models of endotoxic shock and the Shwartzman reaction but not endotoxin tolerance[J]. J Clin Invest, 1995, 96(5): 2339–2347. DOI:10.1172/JCI118290 |



