2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:乳腺外科
2. Department of Breast Surgery, First Affiliated Hospital, Army Military Medical University (Third Military Medical University), Chongqing, 400038, China
目前,卵巢癌的发病率和病死率均较高[1-2]。针对卵巢癌的标准治疗方案以外科手术治疗为主,辅以顺铂和紫杉烷联合化疗[3],中位生存期仅为18个月[4]。因此,需要寻找更有效的卵巢癌治疗手段。
嵌合抗原受体修饰T细胞(chimeric antigen receptor- modified T cells,CART)疗法是过继免疫治疗的典型代表。该方法利用基因转导技术在T细胞表面稳定表达可特异性识别肿瘤相关抗原(tumor-associate antigen,TAA)的单链可变区片段(single-chain variable fragment,ScFv),并与CD3ζ链和其他共刺激分子如CD28/CD137相连[5-7],从而特异性地激活T细胞,即利用抗原抗体特异性与高亲和性的特点,非MHC限制性识别肿瘤细胞并活化T细胞,进而产生免疫杀伤效应[8],具有靶向性强、杀瘤范围广和效果持久的特点。近年来,靶向CD19抗原的CART疗法,在治疗复发性、耐药性的B淋巴细胞肿瘤(急性淋巴细胞白血病、慢性淋巴细胞白血病、非霍奇金淋巴瘤)中展现出了超乎预期的效果,缓解率90%[9-11],完全缓解生存时间则长达2年[12]。然而,CART在卵巢癌等实体瘤治疗中效果尚不明确。
间皮素(mesothelin, MSLN)是一种40×103大小的糖基化膜蛋白,由间皮素编码基因合成的71×103前体蛋白加工处理而成[13],仅在有限的正常组织,如胸膜、心包膜、腹膜的单层间皮细胞和卵巢、输卵管、扁桃体上皮细胞少量表达[14],却均匀而弥散地高表达于卵巢癌(70%)等一些肿瘤细胞表面[15-17]。尽管MSLN在卵巢癌发生、发展中的作用尚待深入研究,但是其在正常组织中限制性低表达,而在卵巢癌组织中显著性高表达的特点,使其具备成为TAA的潜力。已有研究证实MSLN作为免疫治疗靶点的安全性和有效性,包括靶向MSLN抗毒素、抗MSLN抗体、MSLN疫苗和抗体偶联药物等[18-19],特别是采用鼠源性ScFv构建的CART细胞,在体外和免疫缺陷小鼠体内实验中,都展现出非MHC限制性抗肿瘤效应[20]。
本研究以MSLN作为TAA,采用人源化抗人MSLN ScFv,与T细胞活化分子CD3ζ链及共刺激分子CD28构建CAR融合基因,在保证CART细胞特异性识别肿瘤抗原、增强T细胞活化和续存能力、避免脱靶效应的同时,减少了宿主抗异基因体液免疫应答。通过体外和免疫缺陷小鼠原位移植瘤体内杀伤实验,探讨该CART细胞对卵巢癌细胞的杀伤能力,为进一步开展临床实验提供依据。
1 材料与方法 1.1 细胞系HEK293T细胞系购自ATCC,人卵巢癌细胞系A2780、H08910来自本实验室细胞冻存库,以含10% FBS的DMEM培养基培养。卵巢癌细胞系SNU-119购自中国科学院细胞库,白血病细胞系Jurkat由全军临床病理学研究所刘新东教授惠赠,人外周血单核细胞(peripheral blood mononuclear cells,PBMC)来自健康供者,以含10% FBS RPMI1640培养基(10 ℃热灭活FBS,50 U/mL青霉素、50 μg硫酸链霉素,10 mmol/L HEPES,2 mmol/L L-谷氨酰胺,1 mmol/L丙酮酸盐,55 μmol/L β-巯基乙醇)培养。以上细胞支原体检测阴性。
1.2 靶向MSLN-CAR的构建人源化抗人MSLN ScFv DNA片段由全军临床病理学研究所刘新东教授惠赠,采用分子克隆技术将该ScFv、CD3ζ链和CD28共刺激分子组成的融合链克隆到带绿色荧光蛋白(green fluorescent protein, GFP)标签的慢病毒载体PWPXLD(Addgene)中,命名为MSLN-CAR。
1.3 重组慢病毒生产转染前1 d,将5×106生长状态良好的第3~6代HEK293T细胞传入T-75培养瓶内。所有用于包装慢病毒的质粒都经过去内毒素大抽试剂盒(Invitrogen)标准流程提取。Lipofectamine3000(Invitrogen)将5 μg MSLN-CAR转染质粒、3.75 μg PSPAX2包装质粒、1.25 μg PMD2.G包膜质粒转入293T细胞,48 h后收取病毒原液,置于4 ℃保存。
1.4 CART的制备及扩增实验前1 d,用400 μL含抗CD3单克隆抗体(Biolegend,OKT3)和抗CD28单克隆抗体(Biolegend)的PBS液(各2 μg/mL)包被24孔板,贴封口膜4 ℃过夜。实验当天,用梯度离心法(GE Ficoll)提取健康供者PBMC,用RPMI1640完全培养基将PBMC细胞重悬(1×106/mL),移入预先包被抗体的24孔板中(2 mL/孔),置于孵箱培养24 h。小心吸去上清,将已收集并添加Polybrene(终浓度8 μg/mL,Yeasen)慢病毒液加入孔板内,孵箱内感染6 h后换成新鲜培养基(含人IL-2 200 IU/mL,Peprotech)。24 h后重复感染1次,48 h后通过流式细胞仪(Beckman,CytoFLEX)检测感染效率。将2×105个CART细胞与经辐照(40 Gy)的人PBMC细胞按1 :100混合,35 mL RPMI1640(含IL-2 200 IU/mL,OKT3 30 ng/mL)重悬于T-75培养瓶内,置于孵箱培养扩增,适时换液。
1.5 免疫组织化学染色观察按照标准流程,将保存于本实验室生物样本库的24例乳头状浆液性卵巢癌(FIGO分级ⅡB以上)和3例正常卵巢组织石蜡包埋样本制成切片后,进行:脱蜡→抗原修复→血清封闭→一抗(鼠抗人MSLN,Abcam,EPR4509)→二抗(Dako REALTM EnVisionTM)→显色剂→复染→脱水→封片。全玻片扫描(Axio Scan.Z1),Image Pro Plus 6.0软件分析定量。
1.6 Western blot检测哺乳动物蛋白抽提试剂盒M-PERTM(Thermo Fisher)收集全细胞样本,按标准流程提取蛋白并测浓度,经过电泳、转膜、封闭后孵鼠抗人CD3ζ链单克隆抗体(Santa Cruz,#Sc-1293)、鼠抗人MSLN单克隆抗体(Abcam,EPR4509)过夜、洗膜3次、兔抗鼠生物素化二抗(ZSGB)孵育,洗膜5次后滴加化学发光显色剂进行检测。
1.7 PCR检测PCR检测CAR结构和MSLN基因表达,引物序列见表 1。
| 引物名称 | 引物序列(5′→3′) | 片段大小(bp) |
| 引物1 | 正向: TCCGCGAGCTTTGTTTAA 反向: TCAGGAGGAATGCTGGGT |
87 |
| 引物2 | 正向: GATGAGGCTGACTATTACTGT 反向: AGGTGTTTCCCTTTCACA |
191 |
| 引物3 | 正向: GCAAGCATTACCAGCCCTAT 反向: CTCCTGCTGAACTTCACTCTG |
73 |
| 引物4 | 正向: CACCTACGACGCCCTTCA 反向: GCTGGACCTGGATTGCTT |
138 |
| MSLN | 正向: CTGGAAGCCTGCGTGGAT 反向: GGGTAACCTTGTGGGTAGAGC |
128 |
细胞经离心沉淀用1×PBS洗2次后加1 mL TRIzol(Invitrogen)充分吹打后室温静止5 min,随后按照RNA提取标准流程进行,即加氯仿、异丙醇、乙醇纯化和沉淀,加无RNA酶DEPC水溶解并测浓度。逆转录步骤按照TMRT reagent Kit(TaKaRa)反转录试剂盒标准程序进行,1 μL cDNA用于qRT-PCR,反应体系按照SYBR® Green(Thermo Fisher)标准体系和步骤配制,Applied Biosystems Real-time PCR仪(Thermo Fisher)扩增,Bio-Rad Image Lab Software 5.2.1进行数据采集和分析,表达水平变化倍数按2-△△Ct值计算。
1.8 细胞毒性实验卵巢癌细胞系SNU-119经慢病毒感染后稳定表达mCherry,调整细胞数为5 000个/μL。按照相应效靶比(E :T)调整CART细胞浓度。均匀地将1 μL靶细胞种植在96孔板孔底,保持液滴不干燥,30 min后小心地将相应比例的CART细胞加入并覆盖靶细胞,缓慢加入100 μL DMEM完全培养基,置于敷箱培养12 h。吸取E :T=1 :1组上清保存于-80 ℃冰箱。用PBS清洗孔板3次,置于荧光显微镜下拍照记录存活mCherry阳性细胞,Image Pro Plus 6.0软件进行存活细胞累积光密度(integrated optical density,IOD)定量分析。
1.9 细胞因子释放检测解冻“细胞毒性实验”中获得的共培养上清,按Human IL-2 QuantiGlo ELISA Kit(R&D,# Q2000B)和Human TNF-α QuantiGlo ELISA Kit(R&D,# QTA00B)试剂盒操作步骤,检测IL-2和TNF-α水平。
1.10 动物实验4~6周龄的雌性NOD/SCID小鼠购自中国协和医科大学实验动物学部,饲养于第三军医大学SPF级动物房。实验前25 d,将5×106表达mCherry荧光蛋白的SNU-119细胞接种于1只小鼠左侧腹股沟皮下。无菌条件下进行下列操作:瘤体体积为1 cm3左右时,脱颈处死小鼠并迅速分离肿瘤,用组织剪将肿瘤均匀分离为1 mm3的组织块,浸泡于灭菌的含1.0 % FBS的PBS液中。实验小鼠分为3组,每组6只,从左侧腹部做纵向切口暴露盆腔,探查左侧卵巢,用基质胶将1 mm3的肿瘤块粘附于卵巢,复原肠道组织后用基质胶粘合伤口。术后第7天进行小鼠活体成像检测成瘤,并分别于术后第7、15天经尾静脉回输各组T细胞(1×107/只)。分别于回输后第2天起,每隔7 d取小鼠尾静脉血20 μL,裂红细胞后进行染色(Biolegend),检查外周血CART细胞和相关细胞因子水平,并进行活体成像检测肿瘤体积,采用Living Image®4.4软件处理数据绘制肿瘤生长曲线。待肿瘤生长到1.5 cm3时处死小鼠,完整分离瘤体进行拍照。
1.11 统计学分析采用GraphPad Prism 5.0软件,数据以x ±s表示。qPCR检测CAR融合基因的表达采用单因素方差分析,免疫组化检测卵巢癌与正常组织MSLN表达定量数据采用Student’s t检验,细胞因子释放水平数据采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 MSLN在相关肿瘤组织/细胞系中高表达免疫组化检测卵巢癌(图 1A)MSLN表达水平:MSLN在正常卵巢组织中表达的表达量(6.4±1.2)显著低于卵巢癌组织[(449.1±1 089.0),P < 0.01]。通过qPCR(图 1B)和Western blot(图 1C)筛选出高表达MSLN的卵巢癌细胞系SNU-119和不表达MSLN的卵巢癌细胞系H08910,用于后续杀伤实验。

|
| A:免疫组化检测MSLN在卵巢癌组织(左)与正常组织(右)中的表达(二步法);B:PCR检测卵巢癌细胞系中MSLN的表达a:P < 0.01,与A2780、H08910比较;C:Western blot检测卵巢癌细胞系中MSLN的表达 图 1 MSLN在人源肿瘤样本和细胞系中的表达水平 |
2.2 制备抗MSLN-CART细胞
采用分子克隆技术将该人源抗人MSLN的ScFv及CD3ζ链和CD28共刺激分子组成的融合链克隆到带绿色荧光蛋白(GFP+)标签的慢病毒载体中,命名为MSLN-CAR(图 2A),基因测序证明与设计完全吻合。采用HEK293T作为工具细胞进行慢病毒包装(图 2B),显示慢病毒包装效率。通过慢病毒感染体外激活的PBMC细胞(可被激活的PBMC为T细胞),获取带GFP标签并表达抗MSLN-CAR的T细胞(图 2C),命名为抗MSLN-CART细胞。
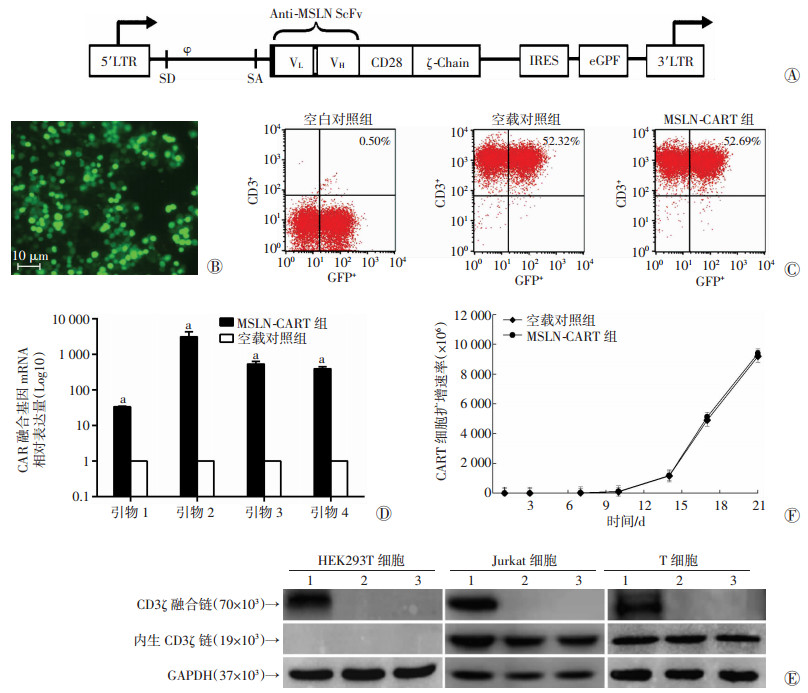
|
| LTR:长末端重复序列;ψ:包装信号;SD:剪接供体;SA:剪接受体;VL:免疫球蛋白轻链可变区;VH:免疫球蛋白重链可变区;scFv:单链可变区片段;ζ-Chain: T细胞抗原受体-ζ链;IRES:内部核糖体进入位点;eGFP:绿色荧光蛋白;A:CAR融合基因结构示意图;B:荧光显微镜观察慢病毒包装效率;C:流式细胞术检测CD3+和GFP+双阳性CART细胞变化;D:PCR检测CAR融合基因mRNA的表达a:P < 0.01,与空载对照组比较;E:Western blot检测结果;F:细胞计数获得CART细胞体外扩增速率分析 图 2 CART细胞的制备、验证和扩增 |
2.3 抗MSLN-CART细胞验证
采取qPCR和Western blot两种方法对CAR融合基因/蛋白进行检测。首先,按照CAR融合基因的构成要素,设计4组引物,各引物扩增产物为CAR融合基因各要素片段的链接部位,即能够扩增该链接部位则证明相关要素在T细胞中表达。与慢病毒空载对照组比较,仅MSLN-CART细胞内表达了相关CAR融合基因片段(图 2D)。采用MSLN-CAR慢病毒及其空载对照分别感染HEK293T、Jurkat细胞、T细胞后,Western blot检测CD3ζ链。MSLN-CAR慢病毒感染的各细胞系中,都可以检测到大小为70×103、含有CD3ζ分子的CAR融合蛋白,而在Jurkat和T细胞中则能检测到19×103大小的内生CD3ζ链(图 2E)。
采用CART细胞“快速扩增法”在3周内将2×105个CART细胞扩增到近1×1010(图 2F)。该扩增速率完全满足临床回输所需的细胞数量。
2.4 MSLN-CART细胞具有体外杀伤效能mCherry荧光蛋白慢病毒载体感染SNU-119细胞,使其稳定表达mCherry荧光蛋白并作为杀伤实验靶细胞。将等量的靶细胞SNU-119-mCherry接种于96孔板内,按照图 3A设置效应细胞与靶细胞比例(效靶比,E :T),分别将普通激活T细胞、感染慢病毒空载T细胞、抗MSLN-CART细胞与SNU-119-mCherry细胞共培养,12 h后收集上清并在荧光显微镜下观察细胞存活情况(图 3A),采用Image Pro Plus 6.0软件定量各组累积光密度,获得杀伤效率曲线结果(图 3C)。与野生型T细胞组和空载对照组相比,抗MSLN-CART细胞杀伤效率显著增强,E :T从4 :1到1 :4之间的杀伤率为100%,即使在最低E :T(1 :16)时也能达到80%左右的杀伤效率。结果显示,CART细胞在体外对卵巢癌细胞杀伤效能显著增强。
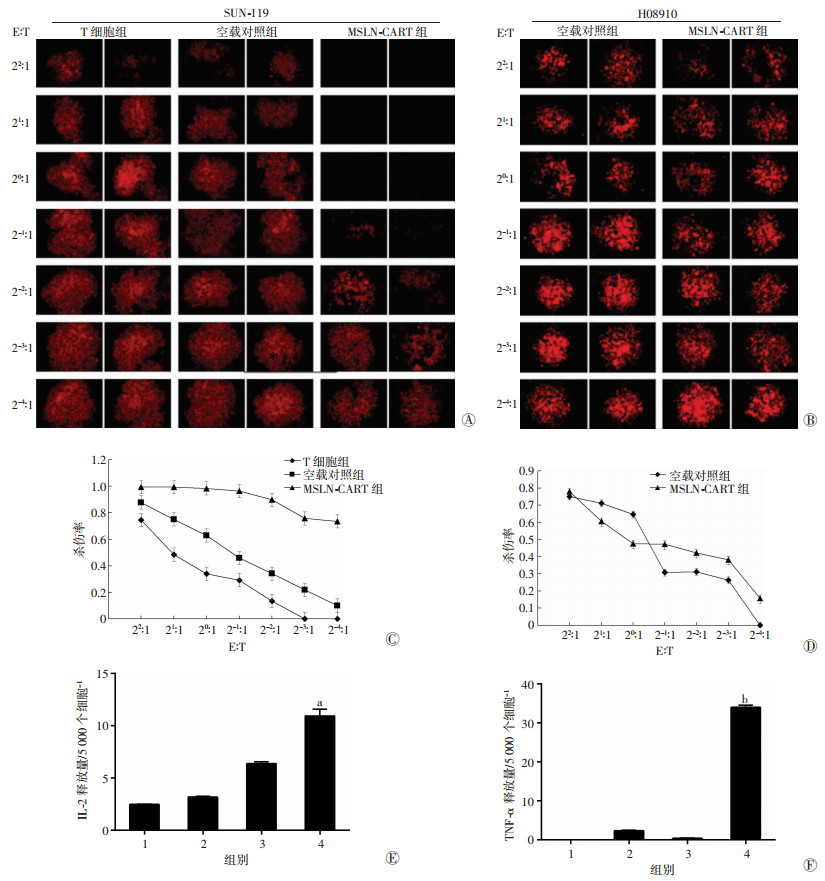
|
| A、B:荧光显微镜观察抗MSLN-CART对SNU-119和H08910细胞的毒性(×20);C:抗MSLN-CART对靶细胞SNU-119的杀伤率;D:抗MSLN-CART对靶细胞H08910的杀伤率;E、F:分别为ELISA法检测抗MSLN-CART与靶细胞SNU-119共培养上清IL-2、TNF-α的释放量1:空白对照组;2:T细胞组;3:空载对照组;4:抗MSLN-CART组;a:P < 0.01, 与空载对照组比较;b:P < 0.01,与T细胞组比较 图 3 抗MSLN-CART细胞体外杀伤效能 |
2.5 抗MSLN-CART细胞体外杀伤效能具有特异性
采用不表达MSLN并带mCherry荧光的卵巢癌细胞H08910作为靶细胞,按照图 3B设置的效靶比,分别将感染慢病毒空载T细胞和抗MSLN-CART细胞与H08910-mCherry细胞共培养,12 h后观察细胞存活情况(图 3B),采用Image Pro Plus 6.0软件定量各组累积光密度,获得杀伤效率曲线结果(图 3D),靶细胞为不表达MSLN的H08910时,空载细胞与抗MSLN-CART细胞杀伤效率无明显差别。结果显示,抗MSLN-CART细胞对MSLN阴性细胞杀伤效能未增强,即具有MSLN特异性。
2.6 体外抗MSLN-CART细胞促进细胞因子释放CART细胞通过产生脱粒酶和穿孔素,并分泌IL-2、IFN-γ、TNF-α杀灭靶细胞。取图 3A实验中E :T=1 :1组上清,检测相关细胞因子释放水平,可见抗MSLN-CART组IL-2、TNF-α水平更高(图 3E、F),具有更强的细胞毒效应。
2.7 抗MSLN-CART细胞在体内对卵巢癌具有杀伤效能将表达mCHerry卵巢癌细胞SNU-119皮下种植于NOD/SCID小鼠,待瘤体生长到1 cm3时将肿瘤均匀分离为1 mm3的组织块,种植到相应实验组小鼠卵巢,建立原位移植瘤模型。待活体成像确定原位移植成功后,给予各组T细胞回输。回输后严密观察小鼠,未见小鼠出现细胞因子释放综合征等副作用。回输后第15天,在T细胞缺陷的NOD/SCID小鼠外周血中成功检测到CART细胞(图 4A)。进一步通过活体成像,证实回输抗MSLN-CART细胞组肿瘤明细减小甚至消失(图 4B)。
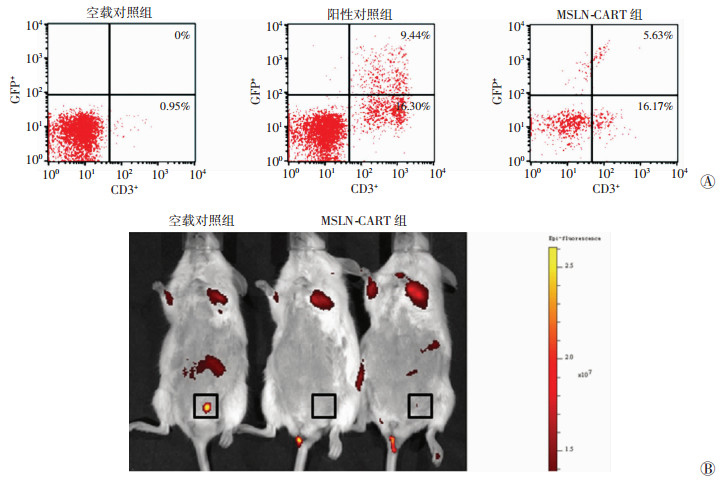
|
| A:流式细胞术检测抗MSLN-CART细胞在小鼠外周血中的变化;B:抗MSLN-CART细胞完全清除小鼠肿瘤细胞活体成像黑框内为卵巢原位移植瘤 图 4 抗MSLN-CART细胞体内杀伤效能 |
3 讨论
实体性肿瘤占人类肿瘤90%以上,而CART疗法治疗实体瘤的临床研究处于起步阶段。相关临床研究包括靶向癌胚抗原(CEA)治疗胃癌、胰腺癌和结直肠癌,靶向神经节苷脂-2(GD2)治疗神经母细胞瘤和骨肉瘤,靶向表皮生长因子受体(EGFR)治疗高级别胶质瘤等[21-22]。对于卵巢癌而言,可选择的TAA包括MSLN、人表皮生长因子受体-2(HER2)、叶酸受体(FR)和癌抗原125(CA125)[23]。其中,临床前研究证实,靶向MSLN的CART能够显著抑制荷卵巢癌小鼠肿瘤生长,促进多种细胞因子释放,甚至引发旁观者效应杀灭MSLN阴性肿瘤细胞[24]。宾夕法尼亚大学开展了T细胞瞬时表达MSLN mRNA治疗间皮瘤和胰腺癌的临床研究,结果显示,短暂表达CAR结构的CART细胞不仅体现出抗肿瘤效应,还能促进机体系统性细胞和体液免疫水平增强[25]。然而,由于研究者采用的CAR序列,来源于鼠源性单抗,患者出现了明显的过敏反应。因此,研究者建议在今后的临床试验中,应该采用人源性CART细胞做单次细胞注射。
既往已开展评估MSLN作为TAA的安全性研究[17, 25-26]。本研究对卵巢癌及对应癌旁组织进行了MSLN检测,得出了与既往研究[15]一致的结果,即:MSLN在卵巢癌等实体瘤中高表达,而在正常组织中则不表达或者低表达,体内实验结果更进一步证实靶向MSLN的CART治疗是安全的,可以进一步应用于临床试验。
异基因来源CAR结构所造成的转基因免疫原性炎症反应,是导致CART细胞在宿主体内续存时间短的重要原因。有研究表明,小鼠来源ScFv序列会引起严重的宿主抗移植物反应[27-28]。本研究采用人源抗MSLN的ScFv合成CAR结构,在免疫缺陷小鼠构建的肿瘤模型中,该CART细胞不仅展现出显著的肿瘤抑制能力,还可以在小鼠体内长期续存。
既往研究中,大多采用小鼠皮下移植瘤模型进行疗效评估,该模型适于观察瘤体变化和便于瘤内局部注射操作[29],然而其缺点也是非常明显的。为了更好地贴近临床实际,本研究选择建立小鼠原位卵巢移植瘤模型,更能反映和模拟人类肿瘤的实际生长情况。
成功实施CART过继免疫治疗,不仅要求获得特异性强、安全有效的CART细胞,对细胞的数量也有较高的要求:每位实体瘤患者需要回输1010数量级CART细胞才能发挥预期的抗肿瘤效应[30]。要实现这一目标,依赖于高效的体外制备和扩增技术。根据研究需求,本研究采用体外“快速扩增程序”,以异体来源PBMC细胞作为Feeder细胞,与CART细胞进行共培养,在3周内将2×105个CART细胞扩增到1×1010个。这些细胞形态和增殖能力良好,为下一步临床应用奠定基础。
CART治疗实体肿瘤还处于起步阶段,临床试验结果尚不尽如人意。截至目前,靶向MSLN的CART治疗卵巢癌的临床研究少见报道,相关研究有待推进。该领域的主要挑战包括:①寻找到合适的TAA,避免出现脱靶效应[31];②CAR融合基因设计不合理,造成CART细胞毒性较弱或者生存困难;③实体瘤肿瘤微环境对CART细胞产生抑制[22, 32];④肿瘤组织的异质性使瘤细胞TAA表达差异,尤其是原位癌与转移灶之间[22]。尽管还面临上述诸多挑战,CART疗法依然被研究者寄予厚望。本研究结果证实了抗MSLN-CART疗法在卵巢癌原位动物模型中的安全性和有效性,为进一步临床研究奠定了基础。
志谢: 感谢本院麻醉科甯交琳副教授的指导和帮助| [1] | SIEGEL R L, MILLER K D, FEDEWA S A, et al. Colorectal cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(3): 177–193. DOI:10.3322/caac.21395 |
| [2] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | BOOKMAN M A. Standard treatment in advanced ovarian cancer in 2005: the state of the art[J]. Int J Gynecol Cancer, 2005, 15(Suppl 3): 212–220. DOI:10.1111/j.1525-1438.2005.00444.x |
| [4] | ZHU X, CAI H, ZHAO L, et al. CAR-T cell therapy in ovarian cancer: from the bench to the bedside[J]. Oncotarget, 2017, 8(38): 64607–64621. DOI:10.18632/oncotarget.19929 |
| [5] | IRVING B A, WEISS A. The cytoplasmic domain of the T cell receptor zeta chain is sufficient to couple to receptor-associated signal transduction pathways[J]. Cell, 1991, 64(5): 891–901. DOI:10.1016/0092-8674(91)90314-o |
| [6] | LOSCH F O, MüLLER R, MUTSCHLER B, et al. Activation of T cells via tumor antigen specific chimeric receptors: the role of the intracellular signaling domain[J]. Int J Cancer, 2003, 103(3): 399–407. DOI:10.1002/ijc.10826 |
| [7] | BRIDGEMAN J S, HAWKINS R E, BAGLEY S, et al. The optimal antigen response of chimeric antigen receptors harboring the CD3zeta transmembrane domain is dependent upon incorporation of the receptor into the endogenous TCR/CD3 complex[J]. J Immunol, 2010, 184(12): 6938–6949. DOI:10.4049/jimmunol.0901766 |
| [8] | JENA B, DOTTI G, COOPER L J. Redirecting T-cell specificity by introducing a tumor-specific chimeric antigen receptor[J]. Blood, 2010, 116(7): 1035–1044. DOI:10.1182/blood-2010-01-043737 |
| [9] | MAUDE S L, TEACHEY D T, PORTER D L, et al. CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia[J]. Blood, 2015, 125(26): 4017–4023. DOI:10.1182/blood-2014-12-580068 |
| [10] | Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia; chimeric antigen receptor-modified T cells for acute lymphoid leukemia; chimeric antigen receptor T cells for sustained remissions in leukemia[J]. N Engl J Med, 2016, 374(10): 998. DOI: 10.1056/NEJMx160005. |
| [11] | KOCHENDERFER J N, WILSON W H, JANIK J E, et al. Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19[J]. Blood, 2010, 116(20): 4099–4102. DOI:10.1182/blood-2010-04-281931 |
| [12] | MAUDE S L, FREY N, SHAW P A, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia[J]. N Engl J Med, 2014, 371(16): 1507–1517. DOI:10.1056/NEJMoa1407222 |
| [13] | SHAW D R, MUMINOVA Z E, STRONG T V. Mesothelin: a new target for immunotherapy[J]. Clin Cancer Res, 2004, 10(24): 8751. DOI:10.1158/1078-0432.CCR-04-1359 |
| [14] | ORDÓÑEZ N G. Application of mesothelin immunostaining in tumor diagnosis[J]. Am J Surg Pathol, 2003, 27(11): 1418–1428. DOI:10.1097/00000478-200311000-00003 |
| [15] | KELLY R J, SHARON E, PASTAN I, et al. Mesothelin-targeted agents in clinical trials and in preclinical development[J]. Mol Cancer Ther, 2012, 11(3): 517–525. DOI:10.1158/1535-7163.MCT-11-0454 |
| [16] | HASSAN R, HO M. Mesothelin targeted cancer immunotherapy[J]. Eur J Cancer, 2008, 44(1): 46–53. DOI:10.1016/j.ejca.2007.08.028 |
| [17] | MORELLO A, SADELAIN M, ADUSUMILLI P S. Mesothelin-targeted CARs: driving T cells to solid tumors[J]. Cancer Discov, 2016, 6(2): 133–146. DOI:10.1158/2159-8290.CD-15-0583 |
| [18] | HASSAN R, MILLER A C, SHARON E, et al. Major cancer regressions in mesothelioma after treatment with an anti-mesothelin immunotoxin and immune suppression[J]. Sci Transl Med, 2013, 5(208): 208ra147. DOI:10.1126/scitranslmed.3006941 |
| [19] | O'HARA M, STASHWICK C, HAAS A R, et al. Mesothelin as a target for chimeric antigen receptor-modified T cells as anticancer therapy[J]. Immunotherapy, 2016, 8(4): 449–460. DOI:10.2217/imt.16.4 |
| [20] | CARPENITO C, MILONE M C, HASSAN R, et al. Control of large, established tumor xenografts with genetically retargeted human T cells containing CD28 and CD137 domains[J]. Proc Natl Acad Sci U S A, 2009, 106(9): 3360–3365. DOI:10.1073/pnas.0813101106 |
| [21] | YU S, LI A, LIU Q, et al. Chimeric antigen receptor T cells: a novel therapy for solid tumors[J]. J Hematol Oncol, 2017, 10(1): 78. DOI:10.1186/s13045-017-0444-9 |
| [22] | XIA A L, WANG X C, LU Y J, et al. Chimeric-antigen receptor T(CAR-T)cell therapy for solid tumors: challenges and opportunities[J]. Oncotarget, 2017, 8(52): 90521–90531. DOI:10.18632/oncotarget.19361 |
| [23] | DI S, LI Z. Treatment of solid tumors with chimeric antigen receptor-engineered T cells: current status and future prospects[J]. Sci China Life Sci, 2016, 59(4): 360–369. DOI:10.1007/s11427-016-5025-6 |
| [24] | LANITIS E, POUSSIN M, HAGEMANN I S, et al. Redirected antitumor activity of primary human lymphocytes transduced with a fully human anti-mesothelin chimeric receptor[J]. Mol Ther, 2012, 20(3): 633–643. DOI:10.1038/mt.2011.256 |
| [25] | BEATTY G L, HAAS A R, MAUS M V, et al. Mesothelin-specific chimeric antigen receptor mRNA-engineered T cells induce anti-tumor activity in solid malignancies[J]. Cancer Immunol Res, 2014, 2(2): 112–120. DOI:10.1158/2326-6066.CIR-13-0170 |
| [26] | HO M, HASSAN R, ZHANG J, et al. Humoral immune response to mesothelin in mesothelioma and ovarian cancer patients[J]. Clin Cancer Res, 2005, 11(10): 3814–3820. DOI:10.1158/1078-0432.CCR-04-2304 |
| [27] | PARKHURST M R, YANG J C, LANGAN R C, et al. T cells targeting carcinoembryonic antigen can mediate regression of metastatic colorectal cancer but induce severe transient colitis[J]. Mol Ther, 2011, 19(3): 620–626. DOI:10.1038/mt.2010.272 |
| [28] | LAMERS C H, WILLEMSEN R, VAN ELZAKKER P, et al. Immune responses to transgene and retroviral vector in patients treated with ex vivo-engineered T cells[J]. Blood, 2011, 117(1): 72–82. DOI:10.1182/blood-2010-07-294520 |
| [29] | ADUSUMILLI P S, CHERKASSKY L, VILLENA-VARGAS J, et al. Regional delivery of mesothelin-targeted CAR T cell therapy generates potent and long-lasting CD4-dependent tumor immunity[J]. Sci Transl Med, 2014, 6(261): 261ra151. DOI:10.1126/scitranslmed.3010162 |
| [30] | SOMERVILLE R P, DEVILLIER L, PARKHURST M R, et al. Clinical scale rapid expansion of lymphocytes for adoptive cell transfer therapy in the WAVE® bioreactor[J]. J Transl Med, 2012, 10: 69. DOI:10.1186/1479-5876-10-69 |
| [31] | LAMERS C H, SLEIJFER S, VAN STEENBERGEN S, et al. Treatment of metastatic renal cell carcinoma with CAIX CAR-engineered T cells: clinical evaluation and management of on-target toxicity[J]. Mol Ther, 2013, 21(4): 904–912. DOI:10.1038/mt.2013.17 |
| [32] | KOUIDHI S, NOMAN M Z, KIEDA C, et al. Intrinsic and tumor microenvironment-induced metabolism adaptations of T cells and impact on their differentiation and function[J]. Front Immunol, 2016, 7: 114. DOI:10.3389/fimmu.2016.00114 |



