骨肉瘤是目前骨科最常见的恶性肿瘤, 一方面其好发于肱骨近端、胫骨干骺端以及股骨, 影响患肢功能和预后。目前单纯手术切除病灶疗效不理想, 资料显示不进行辅助化疗的患者局部复发以及远处转移发生概率明显增高, 且5年生存率不到20%[1]。临床研究以及指南推荐顺铂、阿霉素、环磷酰胺作为骨肉瘤的一线化疗药物[2], 且20世纪70年代辅助化疗应用于治疗骨肉瘤后, 有效的化疗辅助下患者5年生存率可提高至60%~70%[2], 故有效的辅助化疗是预防保肢患者复发的主要手段。另一方面, 骨肉瘤高发于青少年和老年人, 需要减少用药剂量以避免大剂量的化疗药物引起的毒副反应, 但骨肉瘤耐药性导致部分患者肿瘤复发并影响生存率的现象近年来并没有得到进一步改善[3]。因此减少骨肉瘤耐药的发生、提高患者预后是目前临床工作的重点。骨肉瘤作为分化异常的成骨细胞[4], 分化抑制因子1(Id1)异常高表达在肿瘤中发挥重要功能。已有研究证实骨肉瘤高表达Id1[5], 且Enneking分级越高的骨肉瘤中这种异常越明显, 说明Id1与肿瘤恶性程度间的关联。此外, Id1是骨形成蛋白(bone morphogenetic protein, BMP)信号通路下游重要的信号靶点, 通过对目的靶基因转录以及相关蛋白的调控作用在骨肉瘤细胞中发挥重要功能[6-7]。研究证实Id1在多种疾病中存在核转移现象, 并通过介导与细胞存活、增殖、迁移以及耐药相关基因转录发挥功能[8]。因此, 有效抑制Id1这种负性调控基因参与转录能有效抑制Id1相关耐药性的产生, 从而提高患者的化疗效果[9]。目前研究显示, 包括顺铂在内的多种化疗药物均不能抑制多种肿瘤中高表达的Id1, 且Id1表达能够介导肿瘤细胞对顺铂等化疗药物耐药性的产生, 导致化疗失败[10]。本研究利用体外培养的骨肉瘤细胞系MG63、143B与HOS细胞株, 观察辣椒碱对这3株细胞系Id1表达的影响, 初步探讨辣椒碱抑制Id1对加强顺铂对骨肉瘤细胞杀伤作用的机制。
1 材料与方法 1.1 主要试剂与标本选取2015年9月至2016年10月重庆医科大学病理科收集的骨肉瘤患者肿瘤切除组织12例(实验组)以及进行全膝关节置换术的骨关节炎患者手术切除骨组织12例(对照组)。标本均进行福尔马林浸泡固定, 包埋制作石蜡切片, 室温保存。MG63、HOS以及143B细胞系均购于美国ATCC公司, 兔单克隆Id1、磷酸化p65(p-p65)以及磷酸化Smad1/5(p-Smad1/5)抗体购于美国CST公司, 鼠单克隆β-actin抗体、山羊抗兔二抗、山羊抗鼠二抗及山羊抗兔免疫荧光二抗、顺铂、核蛋白提取试剂盒均购于武汉碧云天公司, 辣椒碱购于美国Sigma公司, 胎牛血清、高糖DMEM培养基购于美国Gibco公司, 组化试剂盒购于北京中杉金桥公司。
1.2 实验方法 1.2.1 免疫组化检测病理组织切片Id1表达组织石蜡切片60 ℃加热30 min后, 二甲苯处理5 min, 2次。不同浓度乙醇(100%、95%、90%、80%、75%、50%)梯度脱水。于100 ℃枸橼酸溶液中煮沸10 min, 室温自然冷却进行抗原修复。中杉金桥免疫组化试剂盒进行封闭:3% H2O2处理20 min, PBS洗5 min, 3次。山羊血清封闭30 min, PBS清洗5 min, 3次, Id1抗体用PBS按照1 :100稀释后, 4 ℃孵育过夜, PBS清洗5 min, 3次。组化专用2抗孵育30 min, PBS清洗。镜下DAB(以1 :20稀释)染色, 出现明细染色后清洗。苏木精染色5 min后以饱和碳酸锂处理5 min, 梯度乙醇(50%、75%、80%、90%、95%、100%)脱水后, 二甲苯处理5 min, 中性树脂封片后观察。
1.2.2 MG63、HOS以及143B细胞培养和药物处理分组骨肉瘤细胞系接种于含10%胎牛血清的高糖培养基中, 于含5% CO2的培养箱中37 ℃培养, 每24小时换液。代细胞长至80%以上, PBS清洗1次后, 用0.25%的胰酶消化, 按1 :3进行传代。顺铂用PBS配置母液后培养基稀释, 分为空白对照组、顺铂5 μmol/L处理组、顺铂10 μmol/L处理组、顺铂15 μmol/L处理组、顺铂20 μmol/L处理组。上诉各组均处理细胞24 h。辣椒碱用DMSO配置母液后培养基稀释, 分为空白对照组、辣椒碱100 μmol/L处理组、辣椒碱150 μmol/L处理组、辣椒碱200 μmol/L处理组、辣椒碱250 μmol/L处理组。根据实验目的处理细胞12、24、48 h(图 4)。单独或联合处理细胞分为空白对照组、顺铂5 μmol/L单独处理组、辣椒碱150 μmol/L单独处理组、顺铂5μmol/L与辣椒碱150 μmol/L联合处理组。药物处理结束后, PBS清洗2次, 用0.25%的胰酶消化脱壁, 培养基终止消化, 反复吹打脱壁后, 移入离心管800 r/min离心5 min, 收集细胞进行相应操作。

|
| A、B:辣椒碱处理24 h后, 检测3种细胞系Id1表达量及其条带灰度值分析, 1:空白对照组, 2~5:分别为辣椒碱100、150、200、250 μmol/L处理组, a:P < 0.05, 与各细胞株的空白对照组相比较; C、D:辣椒碱处理MG63细胞不同时间后Id1表达量及其条带灰度值分析, 1、5:空白对照组, 2~4:分别为150 μmol/L辣椒碱作用12、24、48 h组, 6~8:分别为200 μmol/L辣椒碱作用12、24、48 h组, a:P < 0.05, 与空白对照组相比较 图 4 Western blot检测辣椒碱处理后3种细胞系Id1变化 |
1.2.3 蛋白印迹检测骨肉瘤细胞蛋白表达
收集细胞后, 800 r/min离心5 min去除上清液, RIPA裂解液于冰上充分裂解细胞30 min, 12 000 r/min离心15 min后获取上清液为蛋白, 碧云天5×Buffer按4 :1(4份蛋白上清液与1份5×Buffer)混匀, 100 ℃加热10 min。核蛋白用碧云天核蛋白提取试剂盒处理, 具体步骤按照相关操作说明书进行。用12%凝胶100 V恒压进行蛋白电泳。250 V恒压转膜1 h。胎牛蛋白封闭1 h, PBST(PBS与Twen-20配置)清洗5 min, 3次。4 ℃一抗孵育过夜, 二抗室温孵育1 h, 孵育显影液后美国BIO-RAD显像仪显影。
1.2.4 免疫荧光检测骨肉瘤细胞系Id1表达位置用25 mm细胞爬片放置于6孔板中接种细胞, 每孔种2×107个细胞, 孵育箱培养24 h后应用10 μmol/L顺铂、150 μmol/L辣椒碱或者共同作用处理细胞24 h。冷的4%多聚甲醛固定细胞爬片20 min, PBS清洗2次, 0.3% TritonX-100(PBS配置)破膜15 min, 5%胎牛血清封闭1 h, 兔单克隆Id1抗体用PBS稀释(1 :100)后4 ℃过夜。避光, 荧光二抗室温下孵育30 min, DAPI染核5 min, 封片。倒置荧光显微镜观察。
1.2.5 流式细胞学检测骨肉瘤细胞凋亡率106个细胞接种于直径10 cm的细胞培养皿中, 培养细胞至70%~80%, 加用150 μmol/L辣椒碱, 5 μmol/L顺铂或者联合用药24 h, 用冰的PBS清洗细胞3次后, 用0.25%胰酶处理脱壁, 800 r/min离心10 min。去除上清液后用PBS稀释细胞, annexin V-FITC以及PI根据操作手册处理细胞后利用美国Bioscience公司流式细胞仪检测对应荧光值, 根据FITC以及PI对应荧光强度分布进行分析。FITC-/PI-为正常细胞, FITC+/PI+为早期凋亡, FITC+/PI+为中晚期凋亡, FITC-/PI+为坏死细胞。分析早期以及中晚期凋亡细胞占所有细胞百分比。
1.3 统计学分析计量资料数据以x±s表示, 3组以上实验数据利用方差分析, 2组间对比采用t检验。数据进行3次独立实验证实。以P < 0.05为差异有统计学意义。
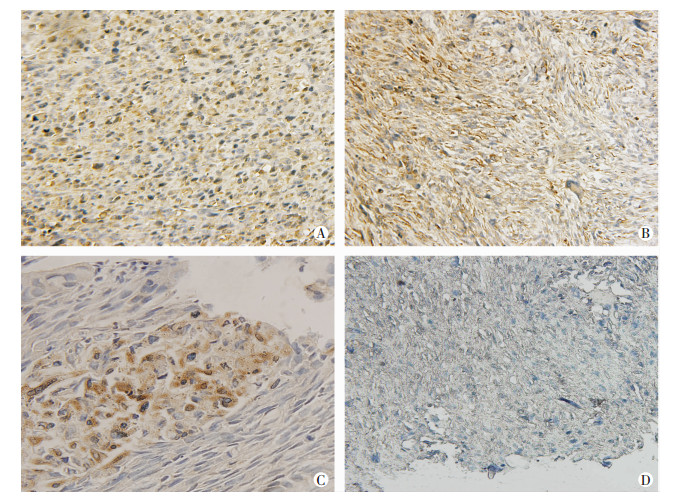
2 结果 2.1 骨肉瘤患者高表达Id1通过对比骨肉瘤患者与对照组Id1免疫组化, 证实骨肉瘤表达较高水平Id1;转移灶中可以发现Id1明显高于周围间质, 证实骨肉瘤较非骨肉瘤患者(骨关节炎患者组)细胞中高表达Id1(图 1)。
|
| A:14岁患者骨肉瘤组织(×100);B:74岁患者骨肉瘤组织(×100);C:转移灶显示肿瘤细胞与周围间质存在明显区别(×400);D:65岁骨关节炎患者全膝关节置换术后骨组织(×100) 图 1 免疫组化染色Id1蛋白检测骨肉瘤、骨肉瘤转移灶和非骨肉瘤患者骨组织 |
2.2 顺铂能够诱导骨肉瘤细胞表达Id1并促使Id1核转移
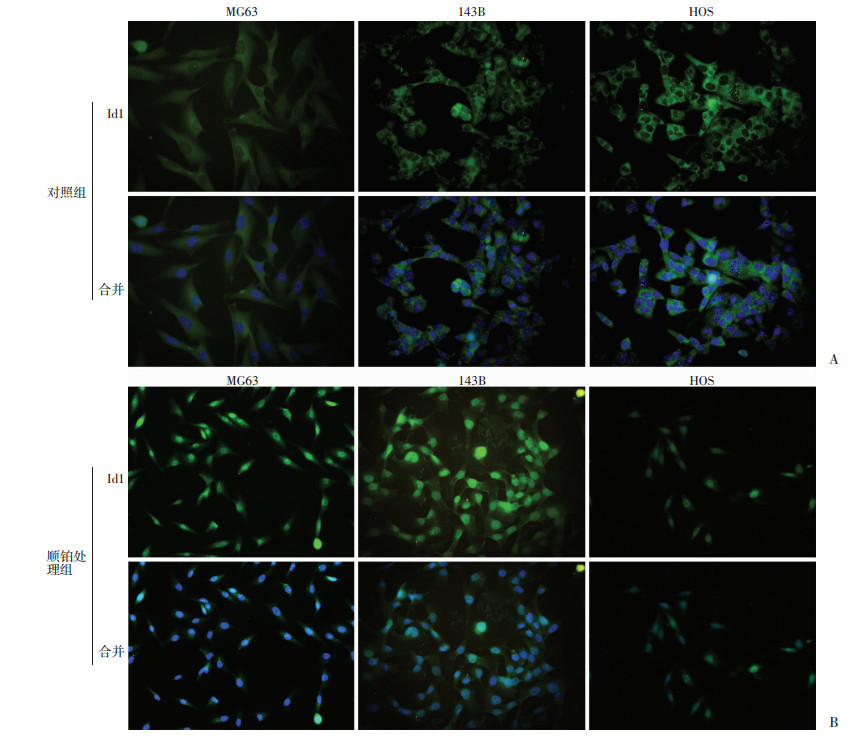
免疫蛋白印迹发现不同浓度的顺铂处理3种不同的骨肉瘤细胞系24 h后, Id1表达均有明显上升(图 2)。免疫荧光证实顺铂会引起3种肿瘤细胞株出现明显的Id1入核现象(图 3), 提示Id1参与顺铂引起的骨肉瘤转录调控。

|
|
1:空白对照组; 2:顺铂5 μmol/L处理24 h; 3:顺铂10 μmol/L处理24 h; 4:顺铂15 μmol/L处理24 h; 5:顺铂20 μmol/L处理24 h A:顺铂处理3种不同骨肉瘤细胞系后出现Id1表达上调; B:3种细胞株Id1条带灰度值分析 a:P < 0.05, 与空白对照组相比较 图 2 Western blot检测各组Id1的表达 |
|
| A:空白对照组3种细胞Id1表达部位; B:10 μmol/L顺铂处理3种不同细胞24 h后, 相对于空白组, 对照组核内Id1较明显上升 图 3 免疫荧光检测应用顺铂后Id1表达位置 (荧光显微镜×1 000) |
2.3 辣椒碱能有效抑制骨肉瘤表达Id1
3种不同的骨肉瘤应用不同浓度的辣椒碱处理24 h后, 一定浓度(150 μmol/L)的辣椒碱能够有效抑制Id1的表达(图 4)。利用MG63细胞进一步实验, 发现这种效果也呈时间梯度。
2.4 辣椒碱能够抑制MG63细胞系p-p65、p-Smad1/5的表达利用不同浓度辣椒碱处理MG63细胞系24 h后, p-p65以及p-Smad1/5均出现了下降(图 5)。证实辣椒碱可以通过影响p65以及Smad1/5的磷酸化影响骨肉瘤细胞系中Id1的表达。

|
| 1:空白对照组; 2~5:分别为辣椒碱100、150、200、250 μmol/L处理组 图 5 Western blot检测不同浓度辣椒碱处理24 h后Id1相关信号蛋白变化 |
2.5 辣椒碱能加强顺铂引起的骨肉瘤凋亡并抑制Id1核转移
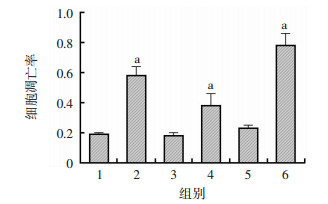
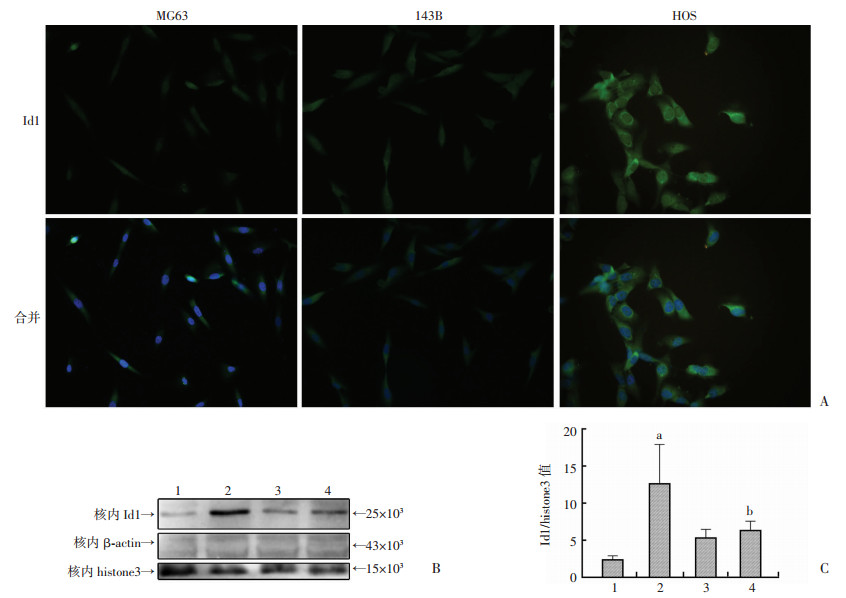
联用辣椒碱以及低浓度顺铂24 h后, 流式细胞学结果证实骨肉瘤细胞出现明显的凋亡(图 6)。并且辣椒碱能够有效抑制顺铂介导的骨肉瘤细胞中Id1的核转移(图 7)。证实辣椒碱能够通过抑制Id1的作用发挥药物增敏性。
|
|
1:5 μmol/L顺铂处理组MG63的凋亡; 2:5 μmol/L顺铂+ 150 μmol/L辣椒碱处理组MG63的凋亡; 3:5 μmol/L顺铂处理组143B的凋亡; 4:5 μmol/L顺铂+150 μmol/L辣椒碱处理组143B的凋亡; 5:5 μmol/L顺铂处理组HOS的凋亡; 6:5 μmol/L顺铂+150 μmol/L辣椒碱处理组HOS的凋亡 a:P < 0.05, 分别与未加150 μmol/L辣椒碱的对照组比较 图 6 流式细胞术检测辣椒碱与顺铂联合应用后3种骨肉瘤细胞凋亡程度 |
|
|
A:辣椒碱联合顺铂应用导致3种细胞系Id1环核现象(荧光显微镜×1 000);B:MG63细胞系核内蛋白分析; C:各组Id1与histone3灰度值比值进行分析 1:MG63空白对照组MG63的核内蛋白; 2:MG63+5 μmol/L顺铂MG63的核内蛋白; 3:MG63+150 μmol/L辣椒碱MG63的核内蛋白; 4:MG63+5 μmol/L顺铂+150 μmol/L辣椒碱MG63的核内蛋白 a:P < 0.05, 与空白对照组比较; b:P < 0.05, 与单独应用5 μmol/L顺铂组比较 图 7 免疫荧光及Western blot检测辣椒碱对顺铂介导的Id1入核作用 |
3 讨论
Id1是目前广泛存在的耐药相关性基因, 包括乳腺癌、前列腺癌以及恶性胶质瘤在内的多种恶性肿瘤中均显示高水平的Id1表达[9, 11-12]。研究证实利用病毒抑制Id1的表达后能提高化疗效果[13], 然而病毒潜在的致癌性以及副反应限制了临床应用。常规化疗药物对该肿瘤相关蛋白缺乏有效的抑制作用, 且恶性度更高的肿瘤往往表达更高水平的Id1, 进一步削弱化疗对恶性肿瘤患者的有效作用[10-12]。Id1作为一种负性转录蛋白调控多种与存活相关蛋白的转录表达, 影响p16、Bcl2等耐药相关蛋白的表达[12, 14]。研究证实Id1与上皮间质转化有关的TWIST、Snail等蛋白表达存在密切关系[13], 而肿瘤细胞的间质转化会进一步促进耐药性的发生。Id1在损伤以及炎症中会出现核转移过程进而促使这些细胞存活, 因此Id1的核转移与其功能密切相关[15-17]。本研究发现顺铂有效促进骨肉瘤细胞中Id1的核转移, 提示顺铂不仅提高骨肉瘤中Id1的表达, 并且促进Id1对转录的作用, 最终介导骨肉瘤对顺铂耐药性的发生。
前期实验中笔者发现辣椒碱能够在低浓度下有效地抑制骨肉瘤增殖, 这与其他肿瘤的研究[18-19]有相似之处, 然而辣椒碱的抗肿瘤原理仍存在争议。作为一种有效的抗炎镇痛药物[20], 小剂量辣椒碱的抗肿瘤作用原理报道不多。辣椒碱作为潜在的抗肿瘤辅助药物, 其作用机制仍存在争议。课题组首次发现辣椒碱能有效抑制Id1的表达。考虑到小剂量的辣椒碱或者短时间作用下均能有效抑制Id1的表达, 笔者认为低浓度辣椒碱可能通过抑制Id1的表达, 上调Id1抑制的p53、p21以及p16等周期蛋白表达, 从而发挥其抗肿瘤的功能, 而小剂量辣椒碱在体内外实验中的安全性已被证实, 为联合其他化疗药物抑制Id1从而提高治疗效果提供可能, 且这种作用较应用病毒抑制Id1更加安全可靠。进一步研究证实辣椒碱可能通过抑制NF-κB家族中的p65以及Smad蛋白家族中的Smad1/5抑制Id1。p65属于NF-κB家族, 是目前已知与炎症关系最密切的一类蛋白, 磷酸化的p65能够入核发挥转录因子的功能。研究提示活化的p65通过上调Bcl2以及Bcl-XL等存活相关蛋白介导耐药性的产生, 且Id1被证实与p65有密切的关系[21], 故Id1可能通过NF-κB家族发挥促肿瘤细胞存活的作用。Smad1/5蛋白是转录生长因子下游重要的功能蛋白, 而p-Smad1/5能够促进Id1的转录[22]。本研究结果显示, 辣椒碱能够有效抑制p-p65以及p-Smad1/5的表达, 故辣椒碱能通过改变以上蛋白信号通路抑制Id1的表达, 达到抑制肿瘤的作用。低浓度辣椒碱处理3种骨肉瘤细胞系能够有效加强顺铂介导凋亡现象, 我们发现这可能与其抑制顺铂引起的Id1入核有关。免疫荧光显示, 辣椒碱能够使3种骨肉瘤细胞系中的Id1出现特殊环核现象。对MG63进行核蛋白分析, 结果与免疫荧光观察的现象相符, 证实辣椒碱具有这种抑制功能。
辣椒碱的抗肿瘤作用是目前抗肿瘤新药研究的一个重点, 包括乳腺癌、前列腺癌以及恶性胶质瘤等均提示大剂量辣椒碱的抗肿瘤现象, 然而小剂量辣椒碱的作用原理仍不清楚。本研究结果证实辣椒碱对Id1这种广泛存在的癌基因在功能以及表达上均具有有效的抑制作用。且辣椒碱能够加强顺铂这类广谱抗肿瘤药物的杀伤作用。但这种现象能否复制在其他肿瘤上, 以及共同应用这两种药物在体内实验是否安全, 尚需进一步探索。本研究以体外实验为主, 但辣椒碱是否能在体内加强相关化疗药物作用, 以及是否会对集体造成未知的毒副作用仍缺少相应的证据, 课题组将在后续研究中探索体内作用效果。
| [1] | ISAKOFF M S, BIELACK S S, MELTZER P, et al. Osteosarcoma: current treatment and a collaborative pathway to success[J]. J Clin Oncol, 2015, 33(27): 3029–3035. DOI:10.1200/JCO.2014.59.4895 |
| [2] | GIANFERANTE D M, MIRABELLO L, SAVAGE S A. Germline and somatic genetics of osteosarcoma-connecting aetiology, biology and therapy[J]. Nat Rev Endocrinol, 2017, 13(8): 480–491. DOI:10.1038/nrendo.2017.16 |
| [3] | SZTURZ P, WOUTERS K, KIYOTA N, et al. Weekly low-dose versus three-weekly high-dose cisplatin for concurrent chemoradiation in locoregionally advanced non-nasopharyngeal head and neck cancer: A systematic review and meta-analysis of aggregate data[J]. Oncologist, 2017, 22(9): 1056–1066. DOI:10.1634/theoncologist.2017-0015 |
| [4] |
仇超, 康权, 迭小红, 等. Id1基因对人骨肉瘤细胞恶性逆转向成骨分化的影响[J].
第三军医大学学报, 2016, 38(4): 344–349.
QIU C, KANG Q, DIE X H, et al. Effect of Id1 gene on reversing malignant biological behaviors and inducing osteogenic differentiation of human osteosarcoma cells[J]. J Third Mil Med Univ, 2016, 38(4): 344–349. DOI:10.16016/j.1000-5404.201507046 |
| [5] | HAO L, LIAO Q, TANG Q, et al. Id-1 promotes osteosarcoma cell growth and inhibits cell apoptosis via PI3K/AKT signaling pathway[J]. Biochem Biophys Res Commun, 2016, 470(3): 643–649. DOI:10.1016/j.bbrc.2016.01.090 |
| [6] | ENDO-MUNOZ L, CUMMING A, SOMMERVILLE S, et al. Osteosarcoma is characterised by reduced expression of markers of osteoclastogenesis and antigen presentation compared with normal bone[J]. Br J Cancer, 2010, 103(1): 73–81. DOI:10.1038/sj.bjc.6605723 |
| [7] |
周栩, 权正学, 罗小辑, 等. Id1基因在BMP-2维持椎间盘细胞软骨特性中的作用[J].
第三军医大学学报, 2015, 37(20): 2011–2016.
ZHOU X, QUAN Z X, LUO X J, et al. Role of Id1 gene in maintenance of cartilage phenotype in BMP-2-induced intervertebral disc cells[J]. J Third Mil Med Univ, 2015, 37(20): 2011–2016. DOI:10.16016/j.1000-5404.201502101 |
| [8] | HU H, HAN H Y, WANG Y L, et al. The role of Id-1 in chemosensitivity and epirubicin-induced apoptosis in bladder cancer cells[J]. Oncol Rep, 2009, 21(4): 1053–1059. |
| [9] | MERN D S, HASSKARL J, BURWINKEL B. Inhibition of Id proteins by a peptide aptamer induces cell-cycle arrest and apoptosis in ovarian cancer cells[J]. Br J Cancer, 2010, 103(8): 1237–1244. DOI:10.1038/sj.bjc.6605897 |
| [10] | CHENG Y J, LEE Y C, CHIU W C, et al. High Id1 expression, a generally negative prognostic factor, paradoxically predicts a favorable prognosis for adjuvant paclitaxel plus cisplatin therapy in surgically treated lung cancer patients[J]. Oncotarget, 2014, 5(22): 11564–11575. DOI:10.18632/oncotarget.2595 |
| [11] | MURASE R, SUMIDA T, KAWAMURA R, et al. Suppression of invasion and metastasis in aggressive salivary cancer cells through targeted inhibition of ID1 gene expression[J]. Cancer Lett, 2016, 377(1): 11–16. DOI:10.1016/j.canlet.2016.04.021 |
| [12] | KIM H, CHUNG H, KIM H J, et al. Id-1 regulates Bcl-2 and Bax expression through p53 and NF-kappaB in MCF-7 breast cancer cells[J]. Breast Cancer Res Treat, 2008, 112(2): 287–296. DOI:10.1007/s10549-007-9871-6 |
| [13] | LING Y X, TAO J, FANG S F, et al. Downregulation of Id1 by small interfering RNA in prostate cancer PC3 cells in vivo and in vitro[J]. Eur J Cancer Prev, 2011, 20(1): 9–17. DOI:10.1097/CEJ.0b013e32833ebaa0 |
| [14] | LIN J, GUAN Z, WANG C, et al. Inhibitor of differentiation 1 contributes to head and neck squamous cell carcinoma survival via the NF-kappaB/survivin and phosphoinositide 3-kinase/Akt signaling pathways[J]. Clin Cancer Res, 2010, 16(1): 77–87. DOI:10.1158/1078-0432.CCR-08-2362 |
| [15] | GIL-BAZO I, CASTANON ALVAREZ E, LOPEZ I, et al. 1634pinhibitor of differentiation-1 (id1) and id3 expression correlates with epithelial-mesenchymal transition (emt)-related proteins (emtrp) in non-small cell lung carcinoma (nsclc)[J]. Ann Oncol, 2014, 25(4): iv565–iv566. DOI:10.1093/annonc/mdu359.6 |
| [16] | LI Y, WEN X, LIU Y. Tubular cell dedifferentiation and peritubular inflammation are coupled by the transcription regulator Id1 in renal fibrogenesis[J]. Kidney Int, 2012, 81(9): 880–891. DOI:10.1038/ki.2011.469 |
| [17] | QIU J, PENG Q, ZHENG Y, et al. OxLDL stimulates Id1 nucleocytoplasmic shuttling in endothelial cell angiogenesis via PI3K pathway[J]. Biochim Biophys Acta, 2012, 1821(10): 1361–1369. DOI:10.1016/j.bbalip.2012.07.016 |
| [18] | LEE M J, KEE K H, SUH C H, et al. Capsaicin-induced apoptosis is regulated by endoplasmic reticulum stress- and calpain-mediated mitochondrial cell death pathways[J]. Toxicology, 2009, 264(3): 205–214. DOI:10.1016/j.tox.2009.08.012 |
| [19] | HONG Z F, ZHAO W X, YIN Z Y, et al. Capsaicin enhances the drug sensitivity of cholangiocarcinoma through the inhibition of chemotherapeutic-induced autophagy[J]. PLoS ONE, 2015, 10(5): e0121538. DOI:10.1371/journal.pone.0121538 |
| [20] | DERRY S, RICE A S, COLE P, et al. Topical capsaicin (high concentration) for chronic neuropathic pain in adults[J]. Cochrane Database Syst Rev, 2017, 1: CD007393. DOI:10.1002/14651858.CD007393.pub4 |
| [21] | PENG X, WANG Y, KOLLI S, et al. Physical and functional interaction between the ID1 and p65 for activation of NF-κB[J]. Am J Physiol Cell Physiol, 2012, 303(3): C267–C277. DOI:10.1152/ajpcell.00365.2011 |
| [22] | KAMAID A, NEVES J, GIRALDEZ F. Id gene regulation and function in the prosensory domains of the chicken inner ear: a link between Bmp signaling and Atoh1[J]. J Neurosci, 2010, 30(34): 11426–11434. DOI:10.1523/JNEUROSCI.2570-10.2010 |



