2. 400016 重庆, 重庆医科大学:附属第一医院呼吸科
2. Department of Respiratory Diseases, First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
结核病(tuberculosis, TB)是由结核分枝杆菌(mycobacterium tuberculosis, MTB)所致的以呼吸系统感染为主的慢性传染病, 是当今世界上单一致病菌感染引起的病死率最高的疾病, 目前世界上还没有任何国家能够逃脱结核病的威胁[1]。世界范围内, 非洲结核病发病率最高, 中国位居第二。MTB是一种胞内寄生的革兰阳性棒状杆菌, 感染人体后, 一部分被巨噬细胞吞噬, 被免疫系统清除, 一部分则潜伏下来寄生于巨噬细胞内, 在巨噬细胞中存活并且进行大量繁殖[2]。YU等[3]的综述表明低频低强度超声(low-frequency and low-intensity ultrasound, LFLIU)已被医学研究者广泛采用, 用来提高抗生素对体内外的浮游菌、细菌生物膜、衣原体等的杀菌效果。本课题组前期研究表明LFLIU可以有效增强耻垢分枝杆菌(mycobacterium smegmatis, MS)细胞壁的通透性, 从而增强抗菌药物左氧氟沙星对MS的杀菌作用[4], 还证明LFLIU可直接导致卡介苗(bacillus Calmette-Guérin, BCG)的急性损伤, 其损伤程度和超声辐照剂量相关[5]。有学者报道, LFLIU可产生声空化效应[6], 而声空化是超声产生生物学效应的主要机制之一。
MTB的生长非常缓慢, 具有强传染性和致病性, 实验室需达到国家生物安全三级(BSL-3)要求, 才能进行大量MTB活菌操作, 而具有类似细胞壁结构的MS由于其生长快, 又无致病性常被用于实验研究[7]。因此, 本实验选用MS为实验菌株。LFLIU对细菌的杀菌效应有诸多报道, 但是对细胞内细菌的杀菌机制的相关研究较少。本实验探究LFLIU对巨噬细胞RAW264.7内的MS的损伤作用以及超声对巨噬细胞吞噬MS的影响, 以期为进一步研究LFLIU联合载药微泡杀灭巨噬细胞内MTB奠定实验基础。
1 材料与方法 1.1 材料 1.1.1 实验细胞小鼠腹腔巨噬细胞RAW264.7购自中国科学院上海细胞生物研究所, 耻垢分枝杆菌(MC 2155)购自中国生物制品检定所。
1.1.2 主要试剂和仪器DMEM高糖培养液、胎牛血清购自Gibco公司, 胰蛋白酶、PBS购自HyClone公司, MTT、二甲基亚砜(Dimethyl sulfoxide, DMSO)、双醋酸酯(Fluorescein diacetate, FDA)购自Sigma公司, 活性氧(reactive oxygen species, ROS)检测试剂盒、青霉素-链霉素溶液购自碧云天生物技术公司, Middlebrook OADC增菌液、Middlebrook 7H9肉汤购自美国BD公司。低频低强度超声仪器(频率42 kHz, 换能器直径45 mm)由苏州工业园区海纳科技有限公司定制, 酶标仪(ELX800)购自Bio-Tek公司, 流式细胞仪(FACSVantage SE)购自BD公司, 激光共聚焦显微镜(A1+R)购自Nikon公司。
1.2 方法 1.2.1 细胞培养RAW264.7细胞采用常规传代培养, 用含有DMEM高糖培养基(含体积分数为10%的胎牛血清、1%青霉素-链霉素溶液)于37 ℃、5% CO2培养箱中进行培养。每日用倒置显微镜观察细胞生长情况, 取对数生长期细胞进行实验。
1.2.2 细菌培养使用含10% OADC增菌液、0.05%吐温-80、0.2%甘油的7H9肉汤培养基培养MS菌, 在恒温水平摇床里培养24 h, 使MS菌的生长达到对数期, 调整MS菌浓度为1×106 CFU/mL。
1.2.3 超声辐照方式LFLIU仪器采用42 kHz的固定频率, 输出声强范围0.13~0.34 W/cm2, 连续可调, 换能器直径45 mm, 在换能器顶部均匀涂布一层医用超声耦合剂, 将35 mm细胞培养皿置于换能器正上方, 轻轻挤压排出空气, 然后进行超声辐照(图 1), 工作方式为连续波。超声辐照参数:对照组辐照声强为0 W/cm2, 实验组辐照声强分别为0.14、0.33 W/cm2(n=6)。超声辐照过程中, 使用温度计监测细胞培养液温度变化。
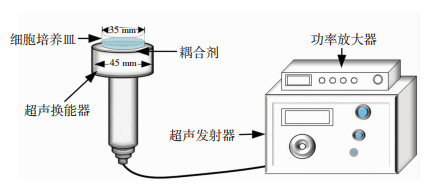
|
| 换能器(频率42 kHz, 直径45 mm)上涂布耦合剂, 细胞培养皿置于换能器正上方进行超声辐照 图 1 低频低强度超声辐照装置示意图 |
1.2.4 RAW264.7细胞活性检测
将对数生长期的RAW264.7细胞用胰酶消化后, 调整细胞数1×105/mL接种于细胞培养皿, 细胞贴壁8 h后, 用声强0.14、0.33 W/cm2的超声分别连续辐照0、5、10、15 min, 然后置于37 ℃、5% CO2培养箱中继续培养24 h, 用MTT法测RAW264.7细胞存活率:细胞存活率=D(490)实验组/D(490)对照组× 100%。实验重复3次。
1.2.5 超声作用下RAW264.7细胞对MS菌的吞噬实验取对数期生长的RAW264.7细胞, 调整细胞数1×105 /mL接种于培养皿, 细胞贴壁8 h后, 加入1.5 mL荧光素双醋酸酯(fluorescein diacetate, FDA)标记的MS菌悬液, 采用声强0.14 W/cm2的超声分别辐照0、5、10 min。然后培养皿置37 ℃、5% CO2培养箱中继续培养2 h, 接着用PBS洗去未吞噬的细菌, 胰酶消化细胞, 用流式细胞仪检测RAW264.7细胞对MS的吞噬率(将收集的细胞经FSC和SSC在二维Dot-plot图中划出巨噬细胞区, 然后对巨噬细胞作FDA荧光强度检测, 激发波长:485 nm, 发射波长:530 nm)。
1.2.6 RAW264.7细胞凋亡和坏死实验Annexin V-FITC/PI双染法检测RAW264.7细胞凋亡和坏死。取对数期生长的RAW264.7细胞, 调整细胞数1×105 /mL接种于培养皿, 细胞贴壁8 h后, 加入1.5 mL MS菌悬液, 将培养皿置37 ℃、5% CO2培养箱中继续培养2 h, 洗去未吞噬的细胞, 然后采用声强0.14 W/cm2的超声分别辐照0、5、10 min, 继续培养24 h, 接着用胰酶消化细胞并离心弃上清, 加入1 mL PBS轻轻吹打成细胞悬液, 同时加入5 μL Annexin V-FITC和10 μL PI染料, 混匀后室温避光孵育15 min, 用流式细胞仪检测RAW264.7细胞凋亡和坏死。另设3组, 不添加MS菌, 将MS菌替换为1.5 mL完全培养液, 其他做相同处理, 以便分析声强0.14 W/cm2的超声分别辐照0、5、10 min对RAW264.7细胞凋亡和坏死的影响。实验重复3次。
1.2.7 RAW264.7细胞内MS菌活性取对数期生长的RAW264.7细胞, 调整细胞数1×105 /mL接种于培养皿, 细胞贴壁8 h后, 加入1.5 mL MS菌悬液, 将培养皿置37 ℃、5% CO2培养箱中继续培养2 h, 洗去未被吞噬的细菌, 然后采用声强0.14 W/cm2的超声分别辐照培养皿0、5、10 min, 超声辐照完成后将培养皿置于37 ℃、5% CO2培养箱中继续培养24 h, 胰酶消化细胞, 5 900×g离心10 min, 1 mL PBS重悬沉淀, 用10倍梯度法稀释MS菌悬液, 取0.1 mL菌悬液涂布于LB琼脂培养皿进行菌落计数。实验重复3次。
1.2.8 RAW264.7细胞内ROS含量测定ROS检测试剂盒是一种利用荧光探针DCFH-DA进行ROS检测的试剂盒。DCFH-DA本身没有荧光, 可以自由穿过细胞膜, 进入细胞内, 被细胞内的酯酶水解生成DCFH, 而DCFH不能通过细胞膜, 从而使探针很容易被装载到细胞内, 细胞内的ROS可以氧化无荧光的DCFH生成有荧光的DCF, 检测DCF的荧光就可以知道细胞内ROS的水平。取对数期生长的RAW264.7细胞接种于培养皿, 细胞贴壁8 h后, 加入1.5 mL MS菌悬液, 孵育2 h后, 洗去未被吞噬的细菌, 按照ROS检测试剂盒说明书装载荧光探针DCFH-DA, 采用声强0.14 W/cm2的超声分别辐照培养皿0、5、10 min后, 将培养皿置于37 ℃、5% CO2培养箱中继续孵育30 min后, 立即采用流式细胞仪和激光共聚焦显微镜检测RAW264.7细胞内ROS。
1.3 统计学处理计量资料数据以x±s表示, 采用SPSS 17.0统计软件处理数据, 用GraphPad Prism 5.0作图。多组数据间差异采用单因素方差分析。
2 结果 2.1 LFLIU对RAW264.7细胞活性的影响超声强度为0.14、0.33 W/cm2, 辐照时间5、10、15 min时, 细胞存活率统计结果见表 1。超声强度为0.14 W/cm2, 作用时间5、10 min时, 对细胞生长活性影响较小, 故该超声参数用于后续实验。
| 超声强度 | 辐照时间 | ||
| 5 min | 10 min | 15 min | |
| 0.14 W/cm2 | 116.37±9.54 | 97.14±9.26 | 79.60±8.19a |
| 0.33 W/cm2 | 74.84±8.08b | 59.35±7.99b | 43.13±6.58b |
| a:P < 0.05, 与声强0.14 W/cm2作用5、10 min比较; b:P < 0.05, 与声强0.14 W/cm2比较 | |||
2.2 LFLIU促进RAW264.7细胞对MS菌的吞噬
流式细胞仪检测结果(图 2)显示:超声辐照RAW264.7细胞10 min与0 min相比, RAW264.7细胞对MS菌的吞噬率显著增加(P < 0.01), 辐照RAW264.7细胞10 min的吞噬率与5 min相比吞噬率明显增加(P < 0.05), 辐照5 min与0 min相比, RAW264.7细胞的吞噬率差异无统计学意义(P>0.05)。
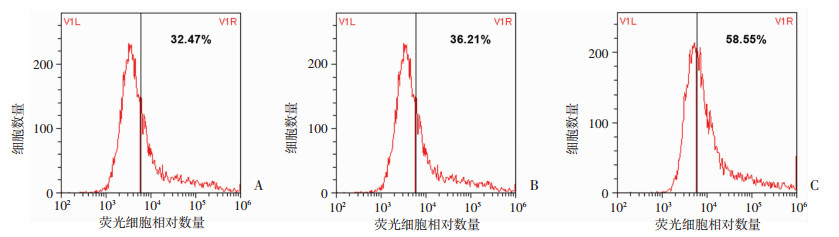
|
| A:0.14 W/cm2超声辐照0 min; B:0.14 W/cm2超声辐照5 min; C:0.14 W/cm2超声辐照10 min 图 2 流式细胞仪检测RAW264.7细胞对MS的吞噬率 |
2.3 LFLIU促进RAW264.7细胞凋亡
Annexin V-FITC/PI双染法检测结果(图 3和表 2)显示, MS菌感染RAW264.7细胞后, 声强0.14 W/cm2超声辐照5 min组细胞凋亡率和坏死率均高于超声辐照0 min组(P < 0.01), 而超声辐照10 min组细胞凋亡率和坏死率均未进一步增加。RAW264.7细胞没有感染MS菌的情况下, 单独使用0.14 W/cm2辐照5 min组细胞凋亡率和坏死率高于0 min组(P < 0.01), 10 min组RAW264.7细胞坏死率高于0 min组(P < 0.05), 差异均有统计学意义。
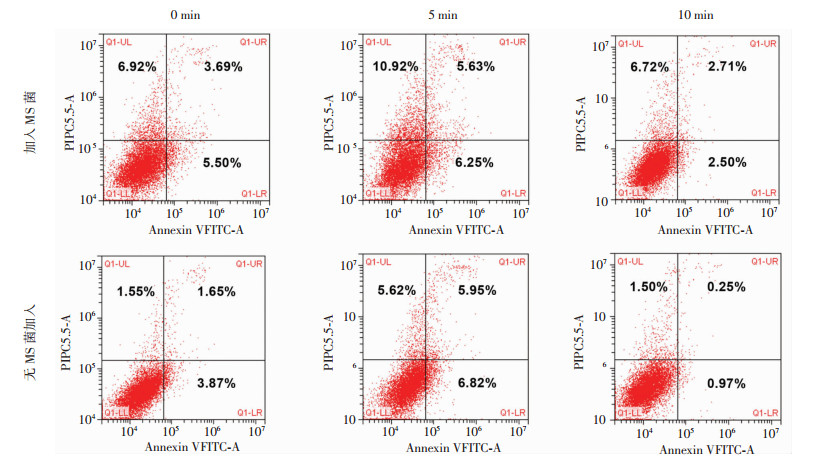
|
| 图 3 LFLIU对RAW264.7细胞凋亡和坏死的影响 |
| 组别 | 辐照时间 | |||
| 0 min | 5 min | 10 min | ||
| 加入MS菌 | 凋亡率 | 7.37±1.76 | 18.34±1.28b | 5.10±0.46 |
| 坏死率 | 6.51±1.08 | 17.90±1.48b | 5.47±1.37 | |
| 无MS菌加入 | 凋亡率 | 4.75±0.98 | 12.96±0.75b | 2.38±1.42 |
| 坏死率 | 1.26±0.27 | 5.70±0.41b | 3.26±1.57a | |
| a:P < 0.05, b:P < 0.01, 与作用0 min比较 | ||||
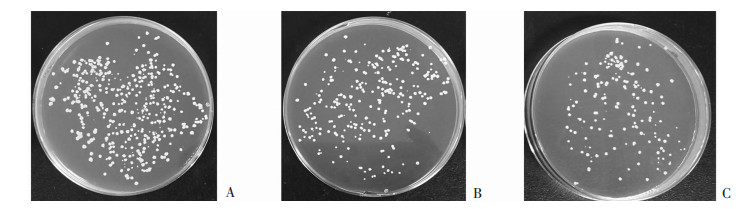
|
| A~C:分别是超声辐照0、5、10 min后, 破裂RAW264.7细胞后MS在LB平板上生长菌落 图 4 LFLIU对RAW264.7细胞内MS菌的活力影响 |
2.4 RAW264.7细胞内MS菌活力降低
平板菌落计数结果显示经LFLIU辐照后, RAW264.7细胞内MS菌活力随着辐照时间的增加而降低。超声辐照0 min组MS活菌数为(4.64±0.21)×105 CFU/mL, 超声辐照5、10 min组MS活菌数分别为(3.73±0.21)×105、(2.20±0.21)×105 CFU/mL, 超声辐照5、10 min组与超声辐照0 min组相比细菌活力下降(P < 0.05)。
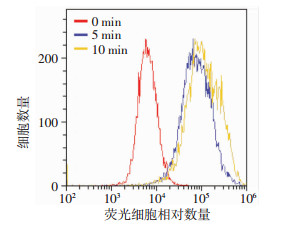
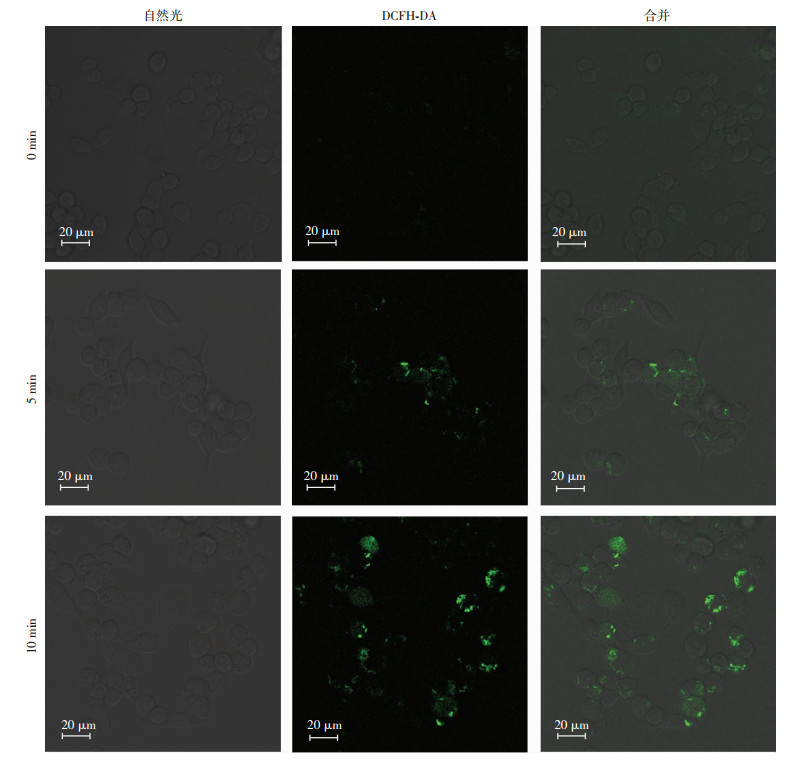
2.5 LFLIU刺激RAW264.7细胞产生ROS流式细胞术分析ROS水平的变化, 结果显示荧光曲线向右位移(图 5), 表明超声辐照10 min组RAW264.7细胞内ROS浓度高于超声辐照5 min组。用激光共聚焦显微镜观察RAW264.7细胞内ROS的水平, 结果显示随着超声辐照时间的增加, ROS浓度增加(图 6), 和流式结果一致。
|
| 图 5 流式细胞仪检测超声辐照后RAW264.7细胞内活性氧的产生 |
|
| 图 6 激光共聚焦显微镜观察超声辐照后RAW264.7细胞内活性氧的产生 |
3 讨论
目前, 全球约1/3的人口感染MTB, 其中10%的感染者可出现临床症状, 而大多数人以潜伏感染的形式感染MTB。TB给人类健康带来的危害日趋严峻[8]。传统治疗结核的方法主要是药物化疗, 治疗周期长, 患者依从性差, 易产生耐药菌株。非传统治疗方法如药物结合外科手术治疗, 患者的选择需满足多种条件且创伤大, 恢复慢。如经支气管动脉介入给药治疗, 难度较大, 费用昂贵, 对设备要求高[9]。因此, 我们希望寻求一种高效无创且能短期内杀灭MTB阻止耐药菌株产生的治疗方法。
超声波的生物学效应取决于超声波的参数(如频率、脉冲、声强等)及辐照时间。不同强度和时间的超声辐照所产生的生物学效应有很大差别[10], 高剂量可引起细胞的不可逆损伤。因此, 选择一个合适的超声辐照参数是我们进行本实验的前提。基于本实验室前期的实验结果, 本研究选择2个超声强度(0.14、0.33 W/cm2), 分别连续辐照RAW264.7细胞5、10、15 min, 24 h后利用MTT法测定各组细胞存活率以确定本实验合适的超声参数, 结果提示超声强度为0.14 W/cm2, 辐照5、10 min时对细胞的活性影响较小, 故确定该超声参数用于后续实验。
超声的生物学效应主要包括热效应、机械效应和空化效应等。低频低强度超声由于频率较低、强度不高, 因而在传播时声能衰减低、吸收少, 所产生的热效应和对细胞的温升作用均接近于可忽略的程度, 主要是空化效应起作用[11]。本实验用温度计监测超声辐照过程中细胞培养液温度变化(温升<0.5 ℃), 显然热效应不是LFLIU损伤MS菌的主要机制。
RAW264.7细胞受到外界刺激处于应激状态时, 会产生呼吸爆发, 通过还原型辅助酶Ⅱ(DADPH)氧化酶产生大量的超氧阴离子, 与此同时, 细胞内的可诱导型一氧化氮合酶基因被诱导表达, 产生大量的一氧化氮, 与超氧阴离子迅速反应, 生成具有强氧化性的过氧化亚硝基, 这些比分子氧更活泼的含氧物统称为ROS[12]。研究表明, 炎症部位活化的免疫细胞通过呼吸爆发产生ROS并杀伤细菌, 从而促进病原体的清除而减轻炎症[13]。LFLIU可以激发细胞产生ROS, ROS通过不同的途径诱导细胞凋亡[14]。本实验选用DCFH-DA荧光探针测量ROS, 其原理包括酯酶的水解和ROS的氧化两个过程[15]。RAW264.7细胞吞噬MS菌后, 在超声的激发下产生对MS菌有杀伤作用的ROS。使用激光共聚焦显微镜和流式细胞仪分析巨噬细胞ROS的产生, 发现随着超声辐照时间的增加, ROS含量增加, 说明LFLIU促进巨噬细胞产生ROS从而杀灭被吞噬的MS菌。
MTB是典型的胞内致病菌, 侵入机体感染宿主巨噬细胞, 诱导细胞凋亡, 激活巨噬细胞抗结核免疫机制, 抑制MTB在体内的扩散, 增强机体的免疫杀伤能力[16], 巨噬细胞诱导自身凋亡是杀伤MTB限制其在体内播散的重要机制之一。本实验中流式细胞仪结果提示, 使用0.14 W/cm2 LFLIU辐照吞噬MS菌的RAW264.7细胞5 min后, 超声促进了RAW264.7细胞的凋亡和坏死, 但是当超声辐照时间为10 min的时候, 巨噬细胞的凋亡率没有进一步增加, 对MS菌进行菌落计数, 发现MS菌的死亡率却随着超声辐照时间的增加而增加。通过流式细胞仪和激光共聚焦显微镜观察LFLIU刺激RAW264.7细胞产生ROS, 显示ROS的产生随着超声辐照时间的增加而增加。初步推测, 超声干预巨噬细胞后, 细胞内MS菌死亡率的增加不仅仅是由于RAW264.7细胞凋亡, 还和LFLIU刺激细胞产生的ROS有关。
本实验没有考察LFLIU联合抗菌药物对巨噬细胞内的MS的杀菌作用, 计划下一步携载药微泡进行深入研究。
| [1] | RUSSELL D G. Who puts the tubercle in tuberculosis?[J]. Nat Rev Microbiol, 2007, 5(1): 39–47. DOI:10.1038/nrmicro1538 |
| [2] | JOHNSON E E, SRIKANTH C V, SANDGREN A, et al. Siderocalin inhibits the intracellular replication of Mycobacterium tuberculosis in macrophages[J]. FEMS Immunol Med Microbiol, 2010, 58(1): 138–145. DOI:10.1111/j.1574-695X.2009.00622.x |
| [3] | YU H, CHEN S, CAO P. Synergistic bactericidal effects and mechanisms of low intensity ultrasound and antibiotics against bacteria: a review[J]. Ultrason Sonochem, 2012, 19(3): 377–382. DOI:10.1016/j.ultsonch.2011.11.010 |
| [4] | DONG Y, SU H, JIANG H, et al. Experimental study on the influence of low-frequency and low-intensity ultrasound on the permeability of the Mycobacterium smegmatis cytoderm and potentiation with levofloxacin[J]. Ultrason Sonochem, 2017, 37: 1–8. DOI:10.1016/j.ultsonch.2016.12.024 |
| [5] | SU H, LI Z, DONG Y, et al. Damage effects on bacille calmette-guérin by low-frequency, low-intensity ultrasound: a pilot study[J]. J Ultrasound Med, 2016, 35(3): 581–587. DOI:10.7863/ultra.14.11056 |
| [6] | TUDELA I, SáEZ V, ESCLAPEZ M D, et al. Simulation of the spatial distribution of the acoustic pressure in sonochemical reactors with numerical methods: a review[J]. Ultrason Sonochem, 2014, 21(3): 909–919. DOI:10.1016/j.ultsonch.2013.11.012 |
| [7] | REYRAT J M, KAHN D. Mycobacterium smegmatis: an absurd model for tuberculosis[J]. Trends Microbiol, 2001, 9(10): 472–474. DOI:10.1016/S0966-842X(01)02169-2 |
| [8] | SOTGIU G, SULIS G, MATTEELLI A. Tuberculosis-a world health organization perspective[J]. Microbiol Spectr, 2017, 5(1): 1–18. DOI:10.1128/microbiolspec |
| [9] | GENGENBACHER M, KAUFMANN S H. Mycobacterium tuberculosis: success through dormancy[J]. FEMS Microbiol Rev, 2012, 36(3): 514–532. DOI:10.1111/j.1574-6976.2012.00331.x |
| [10] | WU X, JOYCE E M, MASON T J. Evaluation of the mechanisms of the effect of ultrasound on Microcystis aeruginosa at different ultrasonic frequencies[J]. Water Res, 2012, 46(9): 2851–2858. DOI:10.1016/j.watres.2012.02.019 |
| [11] | ALEXANDROV B S, RASMUSSEN K Ø, BISHOP A R, et al. Non-thermal effects of terahertz radiation on gene expression in mouse stem cells[J]. Biomed Opt Express, 2011, 2(9): 2679–2689. DOI:10.1364/BOE.2.002679 |
| [12] | BEDARD K, KRAUSE K H. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology[J]. Physiol Rev, 2007, 87(1): 245–313. DOI:10.1152/physrev.00044.2005 |
| [13] | ISLAM M A, PRÖLL M, HÖLKER M, et al. Alveolar macrophage phagocytic activity is enhanced with LPS priming, and combined stimulation of LPS and lipoteichoic acid synergistically induce pro-inflammatory cytokines in pigs[J]. Innate Immun, 2013, 19(6): 631–643. DOI:10.1177/1753425913477166 |
| [14] | LEE H Z, LIN C J, YANG W H, et al. Aloe-emodin induced DNA damage through generation of reactive oxygen species in human lung carcinoma cells[J]. Cancer Lett, 2006, 239(1): 55–63. DOI:10.1016/j.canlet.2005.07.036 |
| [15] | HUANG S K, ZHANG Q, QIU Z, et al. Mechanistic impact of outdoor air pollution on asthma and allergic diseases[J]. J Thorac Dis, 2015, 7(1): 23–33. DOI:10.3978/j.issn.2072-1439.2014.12.13 |
| [16] | WEISS G, SCHAIBLE U E. Macrophage defense mechanisms against intracellular bacteria[J]. Immunol Rev, 2015, 264(1): 182–203. DOI:10.1111/imr.12266 |



