先天性肛门直肠畸形(congenital anorectal malformation, ARM)是小儿常见的消化道畸形之一,其发生率为1/5 000~1/2 000[1]。ARM具体的病因和发病机制尚不清楚,目前认为是遗传和环境因素共同作用的结果[2]。随着手术技术的发展,ARM疗效已经有明显的改善,但是由于其病理改变复杂,除了解剖学上的畸形外往往还伴有如肠道神经系统(enteric nervous system,ENS)等多个组织器官的异常,仍有许多患儿术后存在不同程度的排便功能障碍,严重影响其远期的生活质量[3-4]。维生素A(vitamin A,VA)作为一种脂溶性维生素,在调节视觉、免疫、生殖功能和胚胎生长发育方面发挥重要作用。既往报道孕鼠VA缺乏模型可以诱导子鼠发生ARM及ENS的异常[5],同时本课题组前期也发现在先天性巨结肠患儿体内也存在VA及其核受体维甲酸受体α(retinoic acid receptor α,RARα)水平的异常[6],但在ARM患者中是否也存在VA相关信号的改变目前还未见报道。故本研究拟进一步检测ARM患儿血清VA水平及肠组织RARα的表达特点,探究其与ARM患儿ENS发育异常的可能联系。
1 资料与方法 1.1 临床标本收集及分组收集2015年2月至2017年2月重庆医科大学附属儿童医院胃肠新生儿外科进行分期治疗(一期横结肠袢式造口、二期肛门成型术、三期造口还纳术)的30例ARM患儿的肠道标本,其中男性18例,女性12例;包括ARM伴直肠尿道球部瘘8例,伴前列腺部瘘3例,伴膀胱颈部瘘2例,伴舟状窝瘘6例,伴会阴瘘1例,不伴瘘管7例,一穴肛3例。
初诊时收集ARM及对照新生儿静脉血,立即送我院分子检验中心行VA浓度检测。二期行肛门成型术时留取ARM患儿部分直肠末端组织,手术时年龄151~485 d(中位年龄202.5 d);三期行关瘘术时留取患儿部分造瘘口横结肠组织,手术时年龄253~635 d (中位年龄352 d);对照组选取4例非消化道畸形婴儿直肠组织,手术时年龄165~351 d(中位年龄214 d)。所有手术切除肠组织立即处理或保存于-80 ℃备用,并送病理检查评估肠壁神经节细胞发育情况,再根据患儿直肠病理检查结果将直肠组织分为神经节细胞发育正常组和发育异常组(神经节细胞减少或缺失),每组各6例。本研究临床标本收集经重庆医科大学附属儿童医院伦理评审委员会审核通过(053/2014)。
1.2 实验主要试剂TRIzol试剂购自Life Technologies公司,逆转录试剂盒和SYBR GREEN荧光染料购自TaKaRa公司,全蛋白提取试剂盒购自凯基生物公司,RARα羊多克隆抗体购自Abcam公司,NeuN兔单克隆抗体购自Milipore公司,β-actin小鼠单克隆抗体购自Abcam公司,山羊两步法免疫组化检测试剂盒购自中杉金桥公司。
1.3 血清VA浓度检测初诊时收集新生儿静脉血2 mL,利用高效液相色谱法(high performance liquid chromatography, HPLC)测定血清VA浓度。
1.4 Real-time PCR检测RARα在肠组织的表达采用TRIzol法提取组织总RNA,经NanoDrop2000检测RNA浓度和纯度后,取1 μg RNA参照逆转录试剂盒将RNA逆转录为cDNA, 采用RT-PCR对cDNA扩增,以β-actin作为内参,按10 uL的反应体系,经变性、退火、延伸3步反应,35个扩增循环后,比较基因的相对表达量,重复3次进行统计分析。所用引物序列: RARα正义链,5'-CTGTTTGCTCCCAGAGAAGG-3',RARα反义链,5'-AGGGCTGGGCACTATCTCTT-3';β-actin正义链,5'-GTGAAGGTGACAGCAGTCGGTT-3',β-actin反义链,5'-GAGAAGTGGGGTGGCTTTTAGGA-3'。
1.5 免疫荧光检测RARα和神经元细胞核标志物NeuN在肠组织的表达定位取新鲜手术切除直肠标本,常规石蜡切片,脱蜡水化,抗原修复后牛血清白蛋白封闭,滴加山羊来源的RARα(1: 100)和兔来源NeuN(1: 100)一抗4 ℃孵育过夜,次日室温避光孵育荧光二抗,DAPI染核后封片,荧光显微镜下拍照观察。
1.6 免疫组化检测RARα在直肠神经丛的表达免疫组化肠组织切片处理步骤同免疫荧光,抗原修复后滴3%双氧水阻断内源性过氧化物酶,滴加山羊来源的RARα(1: 200)一抗4 ℃孵育过夜,经免疫组化试剂盒试剂1(聚合酶辅助剂)和试剂2(兔抗羊IgG聚合物),DAB控制显色,苏木精染核,脱水封片后在光学显微镜下拍照观察。
1.7 Western blot检测RARα在直肠组织的表达称取各组直肠组织100 mg,PBS清洗2次,加入裂解液RIPA(提前加入终浓度为1 mmol/L的蛋白酶抑制剂PMSF)1 mL, 冰上充分匀浆,4 ℃ 12 000 r/min离心10 min,收集上清。BCA法检测蛋白浓度。10%分离胶,5%浓缩胶电泳,湿转法转膜,5%脱脂牛奶封闭2 h,TBST洗膜3次× 5 min, 滴加RARα(1: 1 000)一抗4 ℃孵育过夜,次日室温孵育抗羊二抗2 h,滴加ECL发光液显影,Image J软件对灰度值进行统计分析。
1.8 统计学分析数据采用SPSS 18.0和Graphpad prism5.0软件进行统计学分析,数据以x±s表示,符合正态分布的资料两组间差异比较采用独立样本t检验,非正态分布资料两组间差异比较采用Mann-Whitney U检验,多组非正态分布资料的差异性检验采用Kruskal-Wallis检验,组间比较采用Dunns multiple comparison检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 初诊ARM血清VA水平结果32例初诊ARM新生儿血清VA浓度为(0.40±0.14)μmoL/L;30例非消化道畸形对照新生儿血清VA浓度为(0.54±0.10)μmoL/L。ARM组血清VA浓度显著低于对照组(P < 0.01,图 1)。
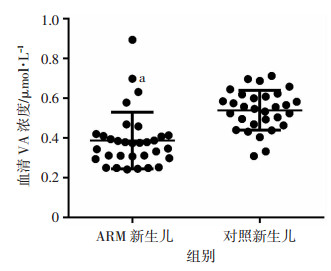
|
| a: P < 0.01, 与对照新生儿组比较 图 1 ARM新生儿与对照新生儿血清VA浓度 |
2.2 肠组织RARα mRNA水平比较结果
ARM患儿直肠末端组织RARα mRNA相对表达量(0.78±0.40)显著低于ARM患儿造瘘口横结肠(1.28±0.72,P < 0.01)和对照组直肠组织(1.12±0.14,P < 0.01),而造瘘口横结肠与对照组直肠之间差异无统计学意义(P > 0.05)。
2.3 免疫荧光检测RARα与神经元细胞核标志物NeuN在直肠肌间神经丛的定位采用免疫荧光双标检测RARα和NeuN在肌间神经丛内的表达情况,在正常的直肠肌间神经丛内,RARα表达在NeuN阳性的神经节细胞核及周围的神经纤维上,而在NeuN呈阴性表达的神经丛内,未见明显RARα阳性显色(图 2)。
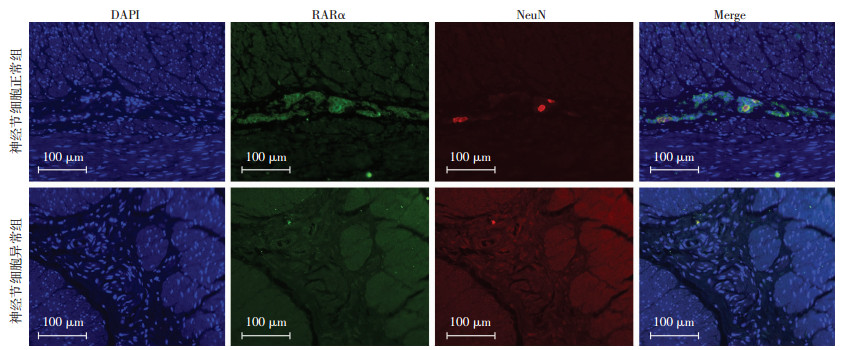
|
| 图 2 免疫荧光双标检测各组直肠肌间神经丛RARα和NeuN的表达 |
2.4 免疫组化检测RARα蛋白在ARM直肠神经丛的表达结果
RARα蛋白在神经节细胞发育正常组的直肠肌间神经丛内可见棕黄色阳性染色,而在发育异常组的直肠肌间神经丛未见明显阳性染色(图 3)。
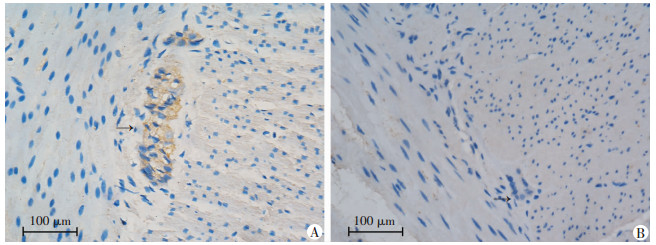
|
| A:神经节细胞正常组;B:神经节细胞异常组;↑:示肌间神经丛 图 3 免疫组化检测RARα在各组直肠神经丛的表达 |
2.5 Western blot检测RARα蛋白在ARM患儿直肠的相对表达量
结果见图 4,神经节细胞正常组直肠RARα蛋白相对表达量为(1.03±0.06),显著高于神经节细胞异常组直肠(0.77±0.08,P < 0.01)。
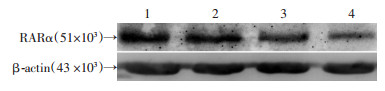
|
| 1、2:神经节细胞正常组;3、4:神经节细胞异常组 图 4 Western blot检测各组直肠RARα蛋白的表达 |
3 讨论
ARM居儿童消化道畸形的首位,现在手术能够矫正患儿解剖学上的异常,但是如何让患儿恢复正常的排便功能,获得更好的远期生活质量仍是困扰小儿外科医师的难题。既往研究认为ARM患儿自身ENS的发育情况是影响其术后排便功能的一个重要因素。MEIER-RUGE等[7]报道约60%ARM患儿直肠存在ENS的发育异常,还有部分患儿直肠末端伴有先天性巨结肠样的改变[8];我们前期对ARM患儿直肠行钙视网膜蛋白病理检查也发现许多患儿肠壁神经节细胞发育幼稚,数量减少或缺失;同时在ARM动物模型中也发现胎鼠的直肠末端神经节细胞数量减少[9],以上均说明ARM常常伴有ENS的异常,但目前对于其发生ENS异常的相关分子机制尚不明确。
VA是人体不可或缺的微量元素,通常以酯类形式存在,需代谢活化后发挥功能,维甲酸(retinoic acid,RA)是VA在体内重要的活性代谢产物,有着广泛的生理学和药理学的活性,RA在体内主要通过与RARs和RXRs这两类核受体作用来调控靶基因的表达[10]。近来文献报道RA可以调节ENS前体细胞从头向尾端迁移、增殖分化的过程,从而影响肠道神经细胞的定植[11-12];缺乏RA关键合成酶RADLH基因的敲除鼠表现出肠道神经元密度的减少[13],结合课题组前期发现先天性巨结肠患儿也存在VA缺乏的现象,所以我们猜想VA相关信号可能也参与了ARM患儿ENS发育异常过程。
本研究首先检测了ARM患儿血清VA的水平,选取的病例均为新生儿期初诊为ARM的患儿,由于目前暂无新生儿时期VA的标准参考区间,故我们以非消化道畸形的新生儿血清作为对照,结果发现ARM新生儿血清VA浓度显著低于对照新生儿;同时也低于我们前期检测的17例先天性巨结肠患儿[6],可能是由于巨结肠患儿就诊时年龄偏大,受饮食因素的影响较大。而胎儿时期体内VA主要通过胎盘来源于母亲,孕母和新生儿血清VA类化合物的浓度是高度相关的[14-15]。这提示ARM患儿母亲在孕期可能也处于VA缺乏的状态,但目前尚缺乏孕期VA水平与人类ARM发生、发展情况的流行病学相关调查[16]。
RARα是一类广泛分布表达于细胞核的特异性受体。研究报道,母鼠孕期VA缺乏会导致新生鼠血清VA和中枢神经系统内RARα水平降低,并导致神经元兴奋性下降[17];在中枢神经系统中,RARα在神经树突中也有表达,RA可通过作用于RARα影响下游靶基因GluR1等的表达水平来调节神经突触的可塑性[18-19],而在人ENS中,RARα的作用尚不明确。本研究发现ARM患儿直肠末端RARα mRNA水平显著低于非畸形对照直肠组织和患儿自身相对正常的横结肠组织;而RARα蛋白在直肠神经节细胞核及周围神经纤维上均有表达,且在经病理检查确证为神经节细胞发育异常的直肠组织内表达量显著低于发育正常的直肠组织,这说明肠道RARα表达水平与神经节细胞的发育程度是密切相关的。研究表明,VA缺乏可直接下调动物体内和体外培养细胞中RARα的转录水平[17]。因此,我们推测ARM患儿可能因为胚胎时期体内VA和RARα表达水平下调,进一步影响下游相关靶基因的表达而导致ENS发育异常。
近期研究表明在新生儿时期,肠道神经节细胞常常表现为胞体小,核小,未见核仁,发育还尚未成熟[20];并且人类ENS网络和肠运动功能逐渐成熟完善的过程贯穿于整个婴儿时期[21]。这说明在生后一段时间里,肠神经节细胞及ENS存在一个逐渐发育成熟的过程。WANG等[22]报道对于临床上有持续腹泻的患儿,通过补充VA可直接改善其血清VA水平和排便情况。而患者常在新生儿时期就已诊断,此时对于存在VA缺乏的ARM患儿适量补充VA是否可能有助于其肠道神经节细胞的发育,甚至排便功能的恢复是我们应该思考的问题。
综上,本研究发现VA和RARα水平在ARM患儿体内下调,并推测VA及其受体RARα可能参与了患儿ENS的发育过程,为认识ARM患儿ENS发育异常的机制提供了新的观点,但本研究仅是基于临床组织标本做了现象层面的检测,并未对相关的分子机制进行深入的探讨。至于VA及RARα是否能直接调控ENS的发育过程以及适量补充VA是否能进一步改善ARM患儿的排便功能还需进一步研究。
| [1] | GANGOPADHYAY A N, PANDEY V. Anorectal malformations[J]. J Indian Assoc Pediatr Surg, 2015, 20(1): 10–15. DOI:10.4103/0971-9261.145438 |
| [2] | WANG C, LI L, CHENG W. Anorectal malformation: the etiological factors[J]. Pediatr Surg Int, 2015, 31(9): 795–804. DOI:10.1007/s00383-015-3685-0 |
| [3] |
陈兰萍. 先天性肛门直肠畸形患儿术后排便功能障碍病因研究进展[J].
中华小儿外科杂志, 2012, 33(7): 541–543.
CEHN L P. Research advances in causes of postoperative defecation dysfunction in children withcongenital anorectal malformation[J]. Chin J Pediatr Surg, 2012, 33(7): 541–543. DOI:10.3760/cma.j.issn.0253-3006.2012.07.016 |
| [4] | RIGUEROS SPRINGFORD L, CONNOR M J, JONES K, et al. Prevalence of active long-term problems in patients with anorectal malformations: a systematic review[J]. Dis Colon Rectum, 2016, 59(6): 570–580. DOI:10.1097/DCR.0000000000000576 |
| [5] | HUANG Y, ZHENG S. The effect of vitamin A deficiency during pregnancy on anorectal malformations[J]. J Pediatr Surg, 2011, 46(7): 1400–1405. DOI:10.1016/j.jpedsurg.2011.02.042 |
| [6] |
罗媛圆, 滕银平, 刘行, 等. 先天性肠无神经节细胞症患儿中血清维生素A及肠组织维甲酸受体α和HA117的表达特点[J].
解剖学报, 2015, 46(4): 558–563.
LUO Y Y, TENG Y P, LIU H, et al. Expression of vitamin A in peripheral blood and differential expression of retinoic acid receptor α and HA117 in colon segments of children with Hirschsprung's disease[J]. Acta Anat Sin, 2015, 46(4): 558–563. |
| [7] | MEIER-RUGE W A, HOLSCHNEIDER A M. Histopathologic observations of anorectal abnormalities in anal atresia[J]. Pediatr Surg Int, 2000, 16(1/2): 2–7. DOI:10.1007/s003830050002 |
| [8] | ELTAYEB A A, REFAIY A. Association of Hirschsprung's disease with anorectal malformations: the early alarming signs for diagnosis and comorbidity related to this association[J]. J Pediatr Surg, 2014: [Epub ahead of print]. DOI:10.1016/j.jpedsurg.2014.04.007 |
| [9] | KONG M, WU Y, LIU Y. The impact of HuD protein on the intestinal nervous system in the terminal rectum of animal models of congenital anorectal malformation[J]. Mol Med Rep, 2017, 16(4): 4797–4802. DOI:10.3892/mmr.2017.7204 |
| [10] | DAS B C, THAPA P, KARKI R, et al. Retinoic acid signaling pathways in development and diseases[J]. Bioorg Med Chem, 2014, 22(2): 673–683. DOI:10.1016/j.bmc.2013.11.025 |
| [11] | URIBE R A, HONG S S, BRONNER M E. Retinoic acid temporally orchestrates colonization of the gut by vagal neural crest cells[J]. Dev Biol, 2018, 433(1): 17–32. DOI:10.1016/j.ydbio.2017.10.021 |
| [12] | SIMKIN J E, ZHANG D, ROLLO B N, et al. Retinoic acid upregulates ret and induces chain migration and population expansion in vagal neural crest cells to colonise the embryonic gut[J]. PLoS ONE, 2013, 8(5): e64077. DOI:10.1371/journal.pone.0064077 |
| [13] | WRIGHT-JIN E C, GRIDER J R, DUESTER G, et al. Retinaldehyde dehydrogenase enzymes regulate colon enteric nervous system structure and function[J]. Dev Biol, 2013, 381(1): 28–37. DOI:10.1016/j.ydbio.2013.06.021 |
| [14] | RHINN M, DOLLÉ P. Retinoic acid signalling during development[J]. Development, 2012, 139(5): 843–858. DOI:10.1242/dev.065938 |
| [15] | HANSON C, SCHUMACHER M, LYDEN E, et al. Status of vitamin A and related compounds and clinical outcomes in maternal-infant pairs in the Midwestern United States[J]. Ann Nutr Metab, 2017, 71(3/4): 175–182. DOI:10.1159/000481292 |
| [16] | ZWINK N, RISSMANN A, POTZSCH S, et al. Parental risk factors of anorectal malformations: Analysis with a regional population-based control group[J]. Birth Defects Res A Clin Mol Teratol, 2016, 106(2): 133–141. DOI:10.1002/bdra.v106.2 |
| [17] |
陈丽君, 任兰, 刘祖银, 等. 孕期边缘型维生素A缺乏对新生鼠RARα、Src和NMDAR1表达的影响[J].
上海交通大学学报(医学版), 2015, 35(4): 500–505.
CHEN L J, REN L, LIU Z Y, et al. Effects of marginal vitamin A deficiency in pregnancy on expressions of retinoic acid receptor alpha, Src, and NMDAR1 of newborn rats[J]. J Shanghai Jiaotong Univ(Med Sci), 2015, 35(4): 500–505. |
| [18] | CHEN L, LAU A G, SARTI F. Synaptic retinoic acid signaling and homeostatic synaptic plasticity[J]. Neuropharmacology, 2014, 78: 3–12. DOI:10.1016/j.neuropharm.2012.12.004 |
| [19] | DUONG V, ROCHETTE-EGLY C. The molecular physiology of nuclear retinoic acid receptors. From health to disease[J]. Biochim Biophys Acta, 2011, 1812(8): 1023–1031. DOI:10.1016/j.bbadis.2010.10.007 |
| [20] |
赵丽, 赵林胜, 赵绪稳, 等. 新生儿先天性巨结肠活检标本中Calretinin的诊断作用[J].
临床与实验病理学杂志, 2017, 33(1): 96–98.
ZHAO L, ZHAO L S, ZHAO X W, et al. Diagnosis of Calretinin in biopsy specimens in newborns with Hirschsprung's disease[J]. Chin J Clin Exp Pathol, 2017, 33(1): 96–98. |
| [21] | BERSETH C L. Motor function in the stomach and small intestine in the neonate[J]. Neo Rev, 2005, 7(1): e28–e33. DOI:10.1542/neo.7-1-e28 |
| [22] | WANG Y, GAO Y, LIU Q, et al. Effect of vitamin A and Zn supplementation on indices of vitamin A status, haemoglobin level and defecation of children with persistent diarrhea[J]. J Clin Biochem Nutr, 2016, 59(1): 58–64. DOI:10.3164/jcbn.15-68 |



