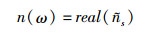2. 621900 四川 绵阳,中国工程物理研究院流体物理研究所;
3. 300072 天津,天津大学精仪学院
2. Institute of Fluid Physics, China Academy of Engineering Physics, Mianyang, Sichuan Province, 621900;
3. School of Precision Instrument and Optoelectronics Engineering, Tianjin University, Tianjin, 300072, China
胶质瘤是发病率、死亡率最高的颅内肿瘤, 且多发于脑功能区, 其首要治疗方法在于开颅手术中尽可能完整切除肿瘤。而实际上, 由于胶质瘤良/恶性组织直视下难以分辨, 加之缺乏快速客观的肿瘤范围识别技术, 往往因切除不全导致复发, 或因过分超出肿瘤范围切除, 造成脑功能区永久性损伤而致残[1-2]。因此, 胶质瘤良/恶性组织分界的术中快速客观识别方法是制约胶质瘤疗效的关键科学技术难题之一。由于太赫兹波能级与生物分子振、转能级吻合, 对生物组织间所含分子结构变化敏感, 对细胞恶性改变敏感, 对组织水含量变化敏感, 且对人体无电离辐射伤害, 成像速度相对较快, 应用环境要求相对宽松, 是借以实现手术中良/恶性组织边界快速分辨的良好技术手段[3]。本研究采用在体动物移植瘤模型进行太赫兹波检测的方式, 模拟神经外科手术中的原位检测, 初步探索并验证太赫兹波脑胶质瘤术中检测技术的可行性和发展潜力, 旨在提出脑肿瘤精准切除的新策略。
1 材料与方法 1.1 动物模型制备采用雄性6周龄C57小鼠(体质量25~30 g, 购于陆军军医大学实验动物中心), 取对数生长期的GL261胶质瘤细胞系(购于美国ATCC), 5%水合氯醛(35 mg/kg)腹腔注射麻醉后俯卧固定于小鼠脑立体定向仪, 根据小鼠头部解剖图谱确定钻孔位置(对应于右侧尾状核):前囟前0.14 mm, 中线右2.0 mm, 于相应位置使用开颅钻打磨颅骨, 微量注射器刺穿硬脑膜后进针2 mm进行注射, 约3周后生长形成瘤体可达脑半球表面的胶质瘤。采用MRI及HE染色确认肿瘤生长。
1.2 太赫兹检测装置构建采用实验室自主搭建的反射式全光纤太赫兹时域光谱系统, 获取在体条件下小鼠脑胶质瘤和正常脑组织的太赫兹时域脉冲信号。实验原理图如图 1所示。实验装置采用InGaAs光电导天线作为太赫兹脉冲的发射器和探测器; 光纤飞秒激光器(Menlosystem T-light FC)两个输出端口(分束比为50 :50), 一端作为泵浦飞秒脉冲激发发射天线产生太赫兹脉冲, 另一个端口作为探测飞秒脉冲激发的探测天线, 探测太赫兹脉冲瞬时电场强度[4]。本实验装置采用光纤耦合延时线改变太赫兹脉冲与探测飞秒脉冲之间的相对时延, 结合锁相放大探测技术, 实现太赫兹时域脉冲信号的探测记录。

|
| 图 1 反射式全光纤太赫兹时域光谱系统原理 |
1.3 动物胶质瘤及对照脑组织暴露手术
经MRI成像确定动物实验模型建立后, 选取肿瘤生长达到半球表面的荷瘤小鼠, 麻醉后将其固定于小动物立体定向仪, 根据MRI图像及小鼠头部解剖图谱确定患侧开窗位置(定位对应于肿瘤表面), 同时取对侧大脑半球相对于脑中线对称位置确定对照脑组织的检测点开窗位置, 避开小鼠颅骨中线位置静脉窦, 分别于两侧对称地磨除颅骨, 尖刀切除硬脑膜, 暴露肿瘤及大脑半球表面。
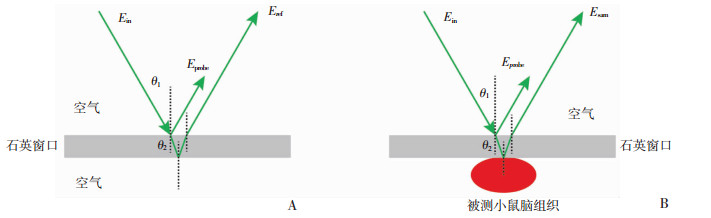
1.4 活体动物行太赫兹波检测的技术方案采用如图 2所示的原理进行反射式测量, 入射太赫兹波为偏振光, 入射角θ1为35°, 选用厚度为3 mm的透明石英玻璃作为测试窗口, 被测小鼠脑组织与石英玻璃紧贴, 保证脑组织反射表面的平整度。实验中, 以石英窗口上表面与空气形成的界面反射的太赫兹时域脉冲作为标定信号Eprobe, 矫正系统的振幅和相位抖动带来的测量误差, 保证实验的可重复性; 以未放置样本时石英窗口下表面与空气形成界面反射的太赫兹时域脉冲信号为参考信号Eref, 放置被测小鼠脑组织时, 石英窗口与小鼠脑组织形成的反射界面反射的太赫兹脉冲为样本信号Esam。为保证入射角的准确性和一致性, 入射探头和检测探头位置固定于光学平台, 检测窗孔位置响应保持在最佳反射点平面, 实验中采用手动升降平台调整实验动物所处位置和姿态, 保证待检测点抵近于检测窗孔的透明石英玻璃测试窗口。
|
|
A:测试参考信号时的原理图; B:测试样本信号时的原理图 θ1:入射角; θ2:石英窗口上表面与空气形成界面的折射角 图 2 活体脑组织太赫兹波反射检测原理示意图 |
为了保证被测小鼠存活, 整个实验在湿度10%空气中完成(恒温恒湿光学实验室内)。为了消除标定信号因空气中水蒸气吸收而引起振荡基底信号, 需选用厚度为5 mm的石英窗口获取样本信号处的振荡基底信号, 结合Eprobe对参考信号和样本信号进行预处理, 以提高被测样本太赫兹特征光谱数据的准确性。为了保证小鼠检测部位的稳定性, 制作了可进行太赫兹波反射检测的动物夹持固定装置。经过Eprobe标定矫正及消除振荡基底信号, 得到的参考时信号Eref, 经过快速傅立叶变换算法后, 获得频谱信号。
1.5 光谱参数提取模型根据文献[4-5]提出的模型, 基于反射式太赫兹时域光谱技术提取被测样本光谱参数, 对比预处理后样本信号与参考信号, 得到包含被测小鼠脑组织复折射率信息的太赫兹波的传递函数, 通过求解被测小鼠脑组织n=n-ik即可得到被测小鼠脑组织在太赫兹波段的折射率n(ω)和吸收系数α(ω)。在无限大平面波近似条件下, 复传递函数H(ω)为:
其中, rsa(ω)和rss(ω)均由菲涅尔公式可知, 设空气的复折射率为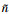
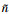
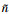
联立(1)和(2), 结合实验测定的复传递函数H(ω)以及基于透射式太赫兹时域光谱技术测定石英窗口复折射率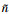
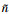
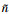
c为真空中的光速、ω为太赫兹波角频率。
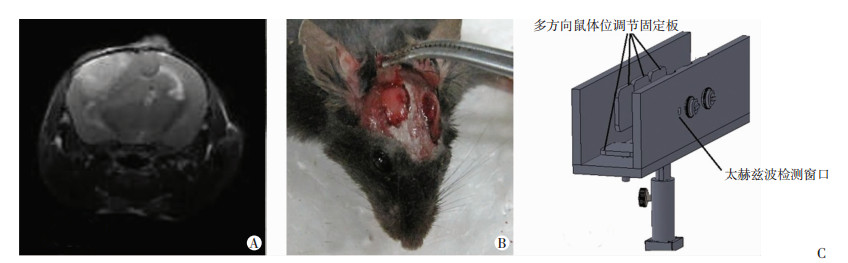
2 结果 2.1 实现荷瘤动物胶质瘤切除术术中太赫兹检测通过MRI检测, 在荷瘤动物中可筛选出肿瘤恰好突破半球表面的荷瘤动物(图 3A)。利用其一侧刚好突出大脑半球的肿瘤组织及其对侧正常脑组织(主要是皮层脑功能区, 图 3B), 利用自研的适配于光学平台的动物在体太赫兹检测装具(图 3C)进行动物固定, 配合前述光学设计方案, 可稳定实现荷瘤动物胶质瘤切除术术中太赫兹检测, 顺利提取到反射式太赫兹波光学信号。
|
| A:动物核磁检查筛选符合实验条件的C57荷瘤鼠; B:分别在C57荷瘤鼠肿瘤生长侧大脑半球及键侧大脑半球对称位置磨开骨窗便于检测; C:应用适配光学平台的动物活体太赫兹检测夹持固定装置 图 3 荷瘤动物造模及术中检测 |
2.2 实现基于胶质瘤与脑功能区太赫兹波差异的术中原位识别
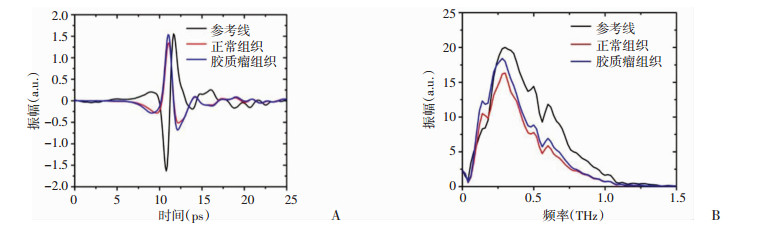
通过本部分所诉方法, 稳定获得参考时信号Eref、C57荷瘤小鼠活体正常脑组织太赫兹波反射信号Enormal和脑胶质瘤太赫兹波反射信号Eglioma(已经过Eprobe标定矫正及消除振荡基底信号, 图 4A), 图 4B为对应的频谱信号, 在0~1.5 THz范围内反射信号信噪比控制良好。
|
| A:经过预处理后, 获取的时域参考信号、正常脑组织的时域样本信号和脑胶质瘤的时域样本信号; B:经过FFT变换后获取的频域信号 图 4 时域光谱信号的获取和频域变换结果 |
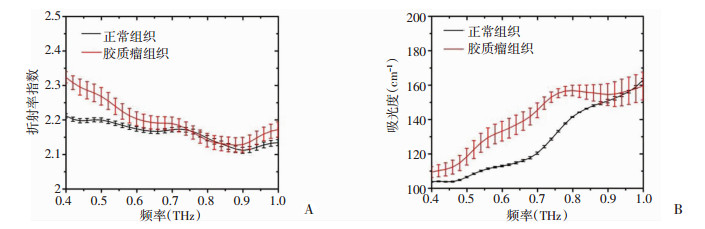
在体条件下, 对正常小鼠脑组织和肿瘤表面分别选取5个不同检测点进行测试, 根据光谱参数提取模型获取其在太赫兹波段的光谱参数。实验结果如图 5所示, 在0.4~1.0 THz波段, 在体正常脑组织和脑胶质瘤的折射率和吸收均表现出较为明显的差异。在体正常脑组织和脑胶质瘤的折射率在0.4~0.6 THz范围具有较大的差异性, 而二者的吸收系数在0.4~0.9 THz范围内具有较大的差异性。
|
| A:在体正常脑组织和脑胶质瘤在0.4~1.0 THz波段的折射率对比; B:在体正常脑组织和脑胶质瘤在0.4~1.0 THz波段的吸收系数对比 图 5 正常脑组织与脑胶质瘤太赫兹波谱信号差异对比 |
3 讨论
鉴于太赫兹波对含水组织穿透深度有限, 发展类似CT或MRI式非术中原位的透射式检测技术对于太赫兹波技术本身而言并不是当前技术条件下合理的研究策略, 而利用太赫兹波良好指纹特性发展术中原位反射检测的技术方法是可行的太赫兹波肿瘤临床应用研究方向之一。由于胶质瘤几乎不向远处转移, 大多数的胶质瘤切除后再次复发时仍生长在原发位置[6-7], 理论上只要将始发病灶的瘤体完全切除, 术后再辅以适当的放疗和化疗即可很大程度减少肿瘤复发可能。因此, 手术治疗仍是脑胶质瘤最主要的治疗手段, 脑胶质瘤患者的生存期及生存质量与手术切除准确程度密切相关。对应胶质瘤的高比例原位复发特点, 采用可能具有高原位识别效率的太赫兹波谱识别技术进行应用研究, 是理想的研究策略。
本课题组2014年曾进行GL261胶质瘤细胞系C57小鼠颅内种植成瘤模型石蜡切片标本的太赫兹波透射式研究, 初步展示太赫兹波应用于客观病理研究离体检测的潜力[8]。本研究为进一步推进太赫兹波原位识别研究, 选用反射式太赫兹波检测方式, 并配合使用肿瘤恰好突破半球表面的荷瘤动物进行活体反射检测, 保证活体条件下获得太赫兹反射波谱信息。目前国际上多个研究团队已经进行了系列太赫兹波胶质瘤检测研究, OH等[9]研究新鲜切除脑组织的太赫兹波谱成像特征, 展示太赫兹波对脑组织水含量和细胞密度变化的检测能力, 提示太赫兹波有望用于神经外科手术治疗。同期, 日本研究团队进行了新鲜脑胶质瘤组织成像研究[10]。韩国延世大学医学院医学融合研究所、延世大学医学院附属医院脑研究所脑肿瘤中心神经外科、韩国延世大学医学院放射科等8家单位联合进行了人胶质瘤标本离体成像研究, 对不同级别胶质瘤(WHOⅡ~Ⅳ级)进行了成像识别[11]。研究结果均显示太赫兹波对胶质瘤具有良好的识别能力, 提示胶质瘤术中应用太赫兹波进行术野肿瘤边界精细划分的应用模式, 是对核磁共振、神经导航等技术的有效补充, 有可能解决胶质瘤边界划分“最后1 mm”的问题。而本研究在此基础上, 进行了在体太赫兹检测波谱差异性分析, 为进一步发展太赫兹胶质瘤术中成像技术提供了谱学数据。
太赫兹波是对频率处在(0.1~10)×1012Hz范围内的电磁波的统称, 跨越了传统定义中的远红外波和高频微波两部分电磁波, 是最后一段尚未充分开发利用的电磁波, 被欧美日各国列为战略性发展方向。太赫兹光子能量在meV量级, 与生物分子的整体骨架振动和转动, 以及生物分子之间氢键的相互作用的特征能量相当。因此相对于其他光谱技术, 太赫兹光谱更能反映生物分子相互作用中能量较低的模式, 对生物分子的微小变化更为敏感, 用于医学诊断更容易区分不同的组织状态和病理差别[12]。针对肿瘤术中诊断, 具有以下优势:第一, 太赫兹光子能量低、辐射功率低(脉冲系统通常 < 1 mW), 不会对人体细胞造成电离损害, 进行术中应用的安全性和便利性强, 患者依从度高。第二, 太赫兹光谱技术定性分析准确性高, 主要基于3点原因:①肿瘤细胞生命活动更旺盛, 含水量更高, 水对太赫兹波的吸收更强[13]; ②肿瘤细胞染色体结构和数量高度异常, 所含的蛋白质等分子结构和浓度均与周围正常组织细胞差异较大, 是进行太赫兹波谱识别的良好靶标[14]; ③肿瘤细胞具有异型性并表现出特殊的排布规律, 较正常细胞明显增大变形、富含蛋白质的细胞核和异常的细胞核/细胞质, 亚细胞结构较正常细胞高度不均一, 导致肿瘤组织对太赫兹波的散射不同于其他组织。第三, 太赫兹波谱分析和成像速度快, 可以在数分钟内完成手术区域全面探查, 相对于目前最快的冰冻切片病理诊断方法亦可节约数十分钟手术等待时间, 且可动态随手术进度实时反馈。
综上所述, 因太赫兹波对肿瘤细胞水含量、蛋白质种类和分子结构、细胞形态改变、组织内细胞排布方式等肉眼难以察觉的信息具有高度的敏感性, 加之采取手术中应用的方式, 位于脑功能区(主要位于脑表层)的肿瘤已经经过手术解剖, 直接暴露于检测光下, 有望通过反射式太赫兹波谱检测、识别和成像的方式, 实现手术中既能定位又能定性的脑胶质瘤区域识别, 将“不可见”的良/恶性组织边界变为“可见”, 提高脑胶质瘤全切率的同时保护脑功能区, 提高患者生存质量, 延长生存时间[15]。
完全实现胶质瘤切除术中的太赫兹波识别尚需进一步研究。本实验已进行异种移植后自然生长于大脑半球的肿瘤表面和正常脑皮层表面太赫兹波反射特征的检测分析, 尚需考虑手术进行中, 切开瘤体或瘤周组织后, 组织液、血液乃至脑脊液干扰下肿瘤表面的太赫兹波谱特改变; 同时, 由于肿瘤的空间异质性, 同一患者肿瘤的不同部位可能具有不同的太赫兹波谱表现, 且肿瘤所处位置不一样, 其瘤周脑结构的太赫兹波谱表现也会有差异(目前至少已经证实脑灰质和白质太赫兹波谱特征具有显著差异)。这就对术中原位识别带来了更多挑战, 而目前国内外研究尚未考虑到这一问题。为解决这一问题, 后续研究需要在准确获取大量不同级别、不同部位胶质瘤瘤内及瘤周太赫兹波谱特征数据的基础上, 加强数据分析识别算法的研究。
| [1] | JIANG T, MAO Y, MA W, et al. CGCG clinical practice guidelines for the management of adult diffuse gliomas[J]. Cancer Lett, 2016, 375(2): 263–273. DOI:10.1016/j.canlet.2016.01.024 |
| [2] | BROWN TJ, BRENNAN MC, LI M, et al. Association of the extent of resection with survival in glioblastoma:A systematic review and meta-analysis[J]. JAMA Oncol, 2016, 2(11): 1460–1469. DOI:10.1001/jamaoncol.2016.1373 |
| [3] | YANG X, ZHAO X, YANG K, et al. Biomedical Applications of Terahertz Spectroscopy and Imaging[J]. Trends Biotechnol, 2016, 34(10): 810–824. DOI:10.1016/j.tibtech.2016.04.008 |
| [4] | CAI Y, BRENER I, LOPATA J, et al. Coherent terahertz radiation detection:Direct comparison between free-space electro-optic sampling and antenna detection[J]. Applied Physics Letters, 1998, 73(4): 444–446. DOI:10.1063/1.121894 |
| [5] | HUANG S, ASHWORTH P C, KAN K W, et al. Improved sample characterization in terahertz reflection imaging and spectroscopy[J]. Opt Express, 2009, 17(5): 3848–3854. DOI:10.1364/oe.17.003848 |
| [6] |
刘畅, 岳凌月, 王新柯, 等. 利用太赫兹反射式时域光谱系统测量有机溶剂的光学参数[J].
光谱学与光谱分析, 2012, 32(6): 1471–1475.
LIU C, QIU L Y, WANG X K, et al. Measurement of optical parameters of organic solvents by terahertz reflection time-domain spectroscopy system[J]. Spectrosc Spect Anal, 2012, 32(6): 1471–1475. DOI:10.3964/j.issn.1000-0593(2012)06-1471-05 |
| [7] | PETRECCA K, GUIOT M C, PANET-RAYMOND V, et al. Failure pattern following complete resection plus radiotherapy and temozolomide is at the resection margin in patients with glioblastoma[J]. J Neuro-oncol, 2013, 111(1): 19–23. DOI:10.1007/s11060-012-0983-4 |
| [8] | MENG K, CHEN T N, CHEN T, et al. Terahertz pulsed spectroscopy of paraffin-embedded brain glioma[J]. J Biomed Opt, 2014, 19(7): 077001. DOI:10.1117/1.JBO.19.7.077001 |
| [9] | OH S J, KIM S H, JI Y B, et al. Study of freshly excised brain tissues using terahertz imaging[J]. Biomed Opt Express, 2014, 5(8): 2837–2842. DOI:10.1364/BOE.5.002837 |
| [10] | YAMAGUCHI S, FUKUSHI Y, KUBOTA O, et al. Brain tumor imaging of rat fresh tissue using terahertz spectroscopy[J]. Sci Rep, 2016, 6: 30124. DOI:10.1038/srep30124 |
| [11] | JI Y B, OH S J, KANG S G, et al. Terahertz reflectometry imaging for low and high grade gliomas[J]. Sci Rep, 2016, 6: 36040. DOI:10.1038/srep36040 |
| [12] | YU C, FAN S, SUN Y, et al. The potential of terahertz imaging for cancer diagnosis:A review of investigations to date[J]. Quant Imaging Med Surg, 2012, 2(1): 33–45. DOI:10.3978/j.issn.2223-4292.2012.01.04 |
| [13] | GENTE R, KOCH M. Monitoring leaf water content with THz and sub-THz waves[J]. Plant Methods, 2015, 11: 15. DOI:10.1186/s13007-015-0057-7 |
| [14] | HATTORI T, AOKI K, SHIRAKI K. Terahertz spectroscopic study of ion effects on protein hydration[J]. 2015 40th International Conference on Infrared, Millimeter, and Terahertz waves (IRMMW-THz), 2015, 41(3): 247–256. DOI:10.1109/irmmw-thz.2015.7327636 |
| [15] | TARUTTIS A, NTZIACHRISTOS V. Advances in real-time multispectral optoacoustic imaging and its applications[J]. Nature Photon, 2015, 9(4): 219–227. DOI:10.1038/nphoton.2015.29 |