2. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院全军感染病研究所;
3. 400038 重庆,陆军军医大学(第三军医大学):基础医学院实验动物学教研室
2. Institute of Infectious Diseases, First Affiliated Hospital, Army Military Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Laboratory Animal Science, College of Basic Medical Sciences, Army Military Medical University (Third Military Medical University), Chongqing, 400038, China
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性滑膜炎、骨质破坏和关节功能丧失为特征的高致残率的自身免疫性疾病。RA好发于女性,女:男为3 :1[1]。目前其病因及发病机制尚不明确, 研究表明,遗传和环境因素在RA发病中均发挥重要作用[2],近年来,各腔道微生物与RA发病的关系成为研究热点。研究发现,阴道普氏菌属细胞壁脂多糖(lipopolysaccharide,LPS)可诱导多种促炎因子分泌及免疫细胞活化,导致全身性炎症反应[3]。但目前尚无阴道菌群与类风湿关节炎相关性的研究。阴道微生态平衡与宿主免疫功能关系密切,免疫应答及细胞因子分泌受阴道菌群的影响,阴道菌群失调可导致疾病的发生[4]。然而,传统的细菌培养技术难以全面鉴定阴道菌群组成,近年来分子生物学技术特别是高通量测序在微生物群落研究中应用广泛,可快速、简便地获得全面的、结构化的菌群结构信息。本研究采用Illumina MiSeq测序技术[5],对早期类风湿关节炎患者和健康育龄期妇女的阴道微生物群落进行检测、分析及比较,研究阴道菌群整体结构变化与类风湿关节炎发病之间的因果关系,为进一步从阴道黏膜免疫变化角度探讨RA病因及发病机制提供依据。
1 资料与方法 1.1 研究对象 1.1.1 类风湿关节炎患者组(RA组)选取2017年在陆军军医大学第一附属医院中西医结合与风湿免疫中心就诊的女性患者12例,年龄25~51岁。纳入标准:①符合1987年ACR或2009年ACR/EULAR的RA诊断分类标准;②病程≤6个月,既往未服用改变病情的抗风湿药(DMARDS),即新发未治患者;③Nugent评分0~3分。
1.1.2 对照组(HC组)选取同期本院健康体检中心就诊育龄期妇女12例,年龄34~51岁,详细询问病史,并进行阴道分泌物涂片等相关检查。纳入标准:①无任何临床症状;②阴道清洁度Ⅰ~Ⅱ度;③Nugent评分0~3分。
研究对象为已婚妇女,均签署知情同意书,年龄19~51岁。排除标准:①近3 d内有性生活史;②近1个月内有全身抗生素使用或阴道冲洗、用药史;③妊娠期、糖尿病、哺乳期、月经期;④明确有细菌性阴道病、滴虫、霉菌、HPV等感染。
1.2 材料及方法 1.2.1 主要试剂及仪器阴道拭子基因组DNA提取试剂盒(德国,Qiagen),TransGen AP221-02 PCR试剂盒(日本,TaKaRa),ABI GeneAmp® 9700型PCR仪(美国,ABI)。
1.2.2 标本采集用无菌棉拭子于阴道后穹窿中下1/3处旋转10~15 s,待拭子充分吸收分泌物后小心地取出(避免接触阴道口及外阴部)置于干燥试管中并放入冰盒中,迅速转运至-80 ℃冻存,用于细菌基因组DNA提取。
1.2.3 细菌基因组总DNA提取使用QIAamp® DNA Microbiome Kit提取阴道分泌物细菌基因组总DNA,具体步骤参考说明书,NanoDrop2000进行DNA浓度及纯度检测。DNA提取后置于-20 ℃冰箱保存。
1.2.4 16S rRNA V3-V4区PCR扩增及Illumina MiSeq测序以提取样本总DNA为模板,采用338F和806R引物对,扩增16S rRNA V3和V4区基因片段。所用引物序列为5′-ACTCCTACGGGAGGCAGCAG-3′(338F)和5′-GGACTACHVGGGTWTCTAAT-3′(806R)。PCR扩增体系(20 μL)为:5×FastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上下游引物(5 μmol/L)各0.8 μL,FastPfu聚合酶0.4 μL,模板DNA 0.5 μL,ddH2O 11.5 μL。PCR扩增条件为:预变性95 ℃,3 min,然后95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,连续27个循环后72 ℃延伸10 min,4 ℃保存。2%琼脂糖凝胶电泳检测PCR产物,以相等的终浓度将样品混合均匀,送至上海美吉生物进行双末端(2×300 bp)测序,测序平台为Illumina MiSeq。
1.2.5 生物信息学分析采用MiSeq Reporter软件对原始测序数据进行去除接头序列和低质量序列的预处理,再经过质量控制和序列拼接得到V3和V4区的组装序列,采用Uparse软件,对组装序列进行质控过滤,获得有效序列,并按97%的序列相似性将有效序列聚为操作分类单元(operational taxonomic units,OTU)。采用Mothur分析流程,将OTUs比对至Sliva数据库进行物种注释,其中属于乳酸菌属的OTU利用megablast进一步分类到菌种水平。然后进行Alpha多样性、Beta多样性、聚类分析。Alpha多样性分析包括细菌种类的多少(物种丰度)和细菌构成的复杂性(物种多样性)两方面的内容。细菌种类采用群落的物种丰度指数(Chao和Ace)来表示,而群落构成的复杂性采用物种多样性指数(Shannon和Simpson)来表示。Chao和Ace:是用两种不同的算法计算样本中所含OTU数目,用来估计群落中物种总数。Simpson:用于估计样本中微生物多样性,其数值越大,菌群多样性越低。Shannon:用于估计样本中微生物多样性,与Simpson指数相反,其值越大,群落多样性越高。β多样性分析是用于微生物群落结构相似性和差异比较。其中,PCoA(principal co-ordinates analysis,PCoA)分析也被称为主坐标分析,是基于除欧氏距离以外的其他距离,将复杂数据简化的技术,此种分析方法能够去除干扰,通过将原有数据降维,有效的计算出数据中主要元素和主成分,达到揭示复杂数据结构的目的。此种分析能够反映群落间的差异,直观地将差异标注在坐标图上,根据在群落间的个体表现出的分布情况,在PCoA图中的距离越远,群落组成越不同,差异性越大。多样本相似度树状图分析对比样本间相似和差异性的分析,包含采用Qiime计算Beta多样性距离矩阵,进行层次聚类(hierarchical cluatering),同时采用非加权组平均法(unweighted pair group method with arithmetic mean,UPGMA)构建树状结构,此结构用于可视化分析样本相似度。LEfSe分析是用于比较两组样本间阴道微生物群落结构及差异物种情况。首先在多组样本中采用非参数因子Kruskal-Wallis秩和检验检测不同分组间丰度差异显著的物种;然后基于获得的显著差异物种,利用成组的Wilcoxon秩和检验进行组间差异分析;最后采用线性判别分析(LDA)对数据进行降维并评估差异显著的物种的影响力大小(即LDA值)。
1.3 统计学分析采用SPSS 13.0统计软件。计量资料以x±s表示,两组间多样性指数比较采用Wilcoxon秩和检验。两组间差异物种比较LEfSe统计分析先采用Kruskal- Wallis秩和验检,再采用线性判别分析(LDA)。P<0.05为差异有统计学意义。
2 结果 2.1 受试者基本信息本研究选取新发未治女性类风湿关节炎患者(RA组)和健康育龄期妇女(HC组)各12例,两组基线资料见表 1。
| 组别 | n | 年龄 /岁 |
病程 /月 |
CCP/例 | 清洁度/例 | 口服避孕药 /例 |
|||
| 阳性 | 阴性 | Ⅰ~Ⅱ | Ⅲ~Ⅳ | ||||||
| RA组 | 12 | 44± 2 | 3.5± 2.7 | 7 | 5 | 6 | 6 | 2 | |
| HC组 | 12 | 45± 2 | - | 2 | 10 | 12 | 0 | 3 | |
| CCP:抗环瓜氨酸肽抗体 | |||||||||
2.2 测序信息
本研究测序样品24个, 共获得1264199条优化序列,平均序列长度为442,OTUs总数目为506。
2.3 Alpha多样性分析RA组和HC组的Shannon指数分别为1.03和0.52,Simpson指数分别为0.59和0.81,表明RA组阴道菌群多样性指数明显高于HC组(q值为0.12、0.12,P值为0.04、0.04),而ACE指数和Chao指数两组比较差异无统计学意义(q值为0.93、0.59, P值为0.93、0.47),见表 2。
| 组别 | Shannon指数 | Simpson指数 | ACE指数 | Chao指数 |
| RA组 | 1.03±0.72a | 0.59±0.28a | 80.28±35.27 | 74.05±31.55 |
| HC组 | 0.52±0.62 | 0.81±0.22 | 91.83±75.27 | 79.23±73.50 |
| a:P<0.05,与HC组比较 | ||||
2.4 菌群结构分析
对所有样品中微生物的16S rRNA基因V3-V4区序列进行Illumina测序,共检测到21个菌门。在门水平上,HC组中阴道菌群95.4%都是由厚壁菌门(Firmicutes)组成,其余20个菌门只占不到5%。RA组中主要由放线菌门(Actinobacteria)组成,占62.8%,厚壁菌门减少至35.6%,拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)增加,分别占阴道菌群的1.04%、0.42%(图 1A)。在菌属水平上,HC组以乳酸杆菌属(Lactobacillus)为优势菌属,占84.98%,同时还包括链球菌属(Streptococcus)、加德纳菌属(Gardnerella)、奇异菌属(Atopobium)等其他菌属,但含量较少。RA组中乳酸杆菌属含量减少至11.01%,同时加德纳菌属(Gardnerella)相对丰度显著增加,由1.08%升高至43.16%,是构成RA组阴道菌群的主要菌属;与HC组相比,双歧杆菌属(Bifidobacterium)、链球菌属(Streptococcus)、奇异菌属(Atopobium)、厌氧球菌属(Anaerococcus)相对丰度亦增加,分别占9.94%、8.05%、7.86%、3.34%,另外,还可见极少量消化链球菌属(Peptostreptococcus)、肠球菌属(Enterococcus)等(图 1B)。
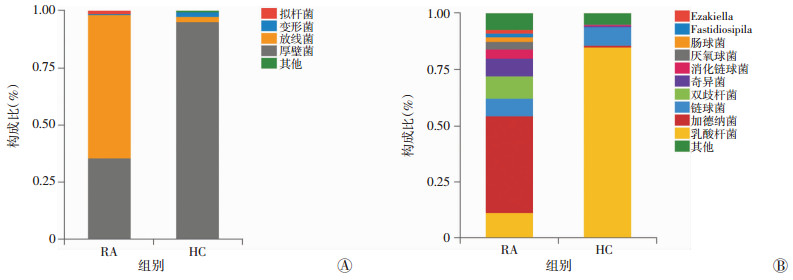
|
| A:门水平;B:属水平 图 1 两组阴道菌群相对丰度和微生物群落整体结构比较 |
2.5 Beta多样性分析
基于Weighted Unifrac距离进行PCoA主坐标分析,样本点间的距离代表菌群结构的相似度,结果显示:两组间菌群结构可明显区分,差异有统计学意义(图 2A)。同时对两组样本进行样本层级聚类分析(UPGMA)可视化分析样本菌群结构相似度,发现两组样本分别可较好聚类在一起(图 2B),说明RA组与健康组的菌群结构具有显著差异。
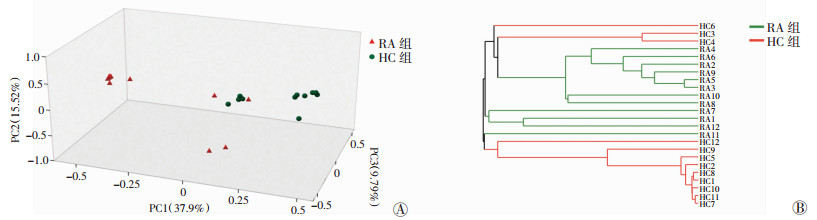
|
| A:PCoA分析;B:样本层级聚类树分析 图 2 两组阴道菌群PCoA主坐标分析和样本层级聚类分析 |
2.6 菌群LEfSe分析
对两组样本阴道菌群进行LEfSe分析,结果表明:在属水平上,RA组中加德纳菌属(Gardnerella)、双歧杆菌属(Bifidobacterium)、奇异菌属(Atopobium)、厌氧球菌属(Anaerococcus)、Peptoniphilus、巨型球菌属(Megasphaera)、Finegoldia、弯曲杆菌属(Campylobacter)、动弯杆菌属(Mobiluncus)相对丰度增加,且差异有统计学意义(LDA值为4.97、4.50、4.17、4.04、3.49、3.40、3.38、3.14、2.91,P值为0.017、0.046、0.018、0.007、0.015、0.044、0.032、0.023、0.046);HC组中乳酸杆菌属(Lactobacillus)富集,同时韦永氏球菌属(Veillonella)丰度增加(LDA值为5.24、3.30,P值为0.0005、0.026)。在菌种水平上, Lactobacillus_jensenii、Peptoniphilus_lacrimalis在两组间差异有统计学意义(LDA值为4.37、3.85,P值为0.008、0.041,图 3)。
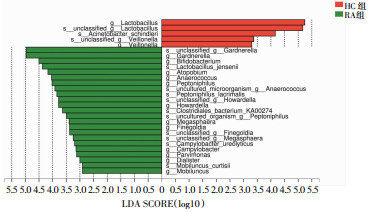
|
| 图 3 RA组和HC组间差异细菌的LEfSe分析 |
3 讨论
类风湿关节炎是一种以慢性滑膜炎和血管翳形成为主要病理改变的全身性自身免疫性疾病,其发病与遗传和环境因素等[6]相关。近年来,各腔道微生物成为RA病因学研究的热点。其中,肠道黏膜免疫和肠道菌群失调在RA发病中的作用及机制研究不断深入。SCHER等[7]运用16S rRNA高通量测序技术发现新发未治疗的RA患者肠道内P.copri丰度显著增加,并伴随拟杆菌等有益菌的减少,提示肠道菌群失调与RA发生密切相关。然而目前尚无阴道菌群与RA发病相关性研究。
研究发现,RA的发病可能起源于关节外的某一黏膜,黏膜表面受到微生物或环境因素的刺激产生自身免疫反应进而导致全身性免疫紊乱,黏膜免疫在RA发病中发挥重要作用[8]。研究表明,绝经前RA患者和RA易感群体(具备RA家族史或RA危险因素)的宫颈阴道分泌物中抗环瓜氨酸肽(anti-cyclic citrullinated peptide antibody,ACPA)抗体水平较健康对照组升高,且其与阴道局部炎症反应呈正相关,提示阴道黏膜可能是抗CCP抗体产生另一独特部位,阴道黏膜免疫或许参与RA发病[9]。RA好发女性,但具体原因未明。研究表明,低水平雌激素是RA发病的危险因素,高水平雌激素则是保护因素[10]。临床中妊娠期RA患者疾病活动度降低。口服避孕药与RA患者一级亲属(first degree relative, FDR)中RF阳性率降低有关[6]。但目前关于激素在RA发生、发展中的作用仍存在争议[11],而阴道菌群的研究可能会提供新的解释。研究发现,阴道上皮细胞表面的Toll样受体(Toll-like receptors,TLR)通过识别病原微生物细胞壁脂多糖(LPS),激活NF-кB信号通路,从而诱导促炎细胞因子分泌影响全身性炎症反应[12],提示阴道菌群调控阴道黏膜免疫反应可能参与全身性免疫反应。因此,本研究初步分析了阴道菌群与类风湿关节炎的相关性。
本研究用Illumina Miseq测序技术可获得全面、系统、结构化、准确的阴道微生物群落结构信息,通过对早期女性类风湿关节炎患者与健康人的阴道菌群数量和结构进行比较分析,结果表明:RA组与健康人的阴道微生物群落结构明显不同。Alpha多样性分析包括细菌种类的多少(物种丰度)和细菌构成的复杂性差异(物种多样性)两方面的内容。RA组阴道菌群Alpha多样性显著增加,表现为主要由加德纳菌属组成,乳杆菌属显著减少,同时双歧杆菌属、链球菌属、奇异菌属、厌氧球菌属等相对丰度明显升高。研究发现,阴道菌群多样性增加与生殖道炎症反应密切相关[13]。健康育龄期女性组阴道菌群主要由厚壁菌门组成,乳酸杆菌为优势菌属,同时含有少量链球菌属、加德纳菌属、奇异菌属等,与文献[14]报道一致。β多样性分析中采用PCoA主坐标分析和样本层级聚类树,发现RA组和健康人的阴道菌群结构不同,可明显区分。然后对两组样本阴道菌群进行LEfSe差异物种分析,统计各组间具有显著差异性的物种。正常情况下,乳杆菌属为阴道菌群中优势菌属。乳杆菌属(特别是卷曲乳杆菌)可产生乳酸,维持阴道酸性环境,并生成H2O2抑制杂菌,与较低的炎症水平有关[15]。研究表明,外源性阴道乳杆菌能使宿主体内IFN-γ增高、TNF-α降低、IL-2、SIgA增高[16]。加德纳菌属利用CD59调节分子激活P38丝裂原活化蛋白激酶信号转导通路,释放细胞溶解素,导致阴道上皮细胞死亡,从而使乳酸杆菌定植减少[17]。研究发现,阴道加德纳菌感染是反应性关节炎和Reiter’s syndrome的致病因素之一[18]。阴道奇异菌属可通过TLR2激活NF-κB信号通路,上调阴道上皮细胞IL-6、IL-8 mRNA水平的表达,促进炎症反应[19-20]。另外,研究发现,5%~10%的健康育龄期女性阴道菌群以阴道双歧杆菌为优势菌属,其可促进乳酸和过氧化氢的产生,并维持阴道酸性环境。因此,乳酸杆菌减少,加德纳菌属等厌氧菌属相对比例增加,即低丰度的条件致病菌在炎症条件下迅速增殖,阴道黏膜表面抗原提呈细胞(朗格汉斯细胞、CD14+/-树突状细胞及CD14+巨噬细胞)将其作为外来抗原,通过分子模拟或交叉免疫反应介导自身免疫损伤[22],同时阴道菌群失调可使阴道黏膜免疫反应和黏膜屏障功能减弱,可能导致宿主对RA易感性增加。
综上所述,早期类风湿关节炎患者阴道微生物群落中乳酸杆菌含量减少、加德纳菌及某些条件致病菌的相对丰度增加,阴道菌群失调与RA发病可能具有相关性,但二者间的因果关系仍未明。
| [1] | MYASOEDOVA E, CROWSON C S, KREMERS H M, et al. Is the incidence of rheumatoid arthritis rising: results from Olmsted County, Minnesota, 1955-2007[J]. Arthritis Rheum, 2010, 62(6): 1576–1582. DOI:10.1002/art.27425 |
| [2] | YANG B, LI J, YAN H, et al. The pathogenesis of rheumatoid arthritis is associated with milk or egg allergy[J]. N Am J Med Sci, 2016, 8(1): 40–46. DOI:10.4103/1947-2714.175206 |
| [3] | SI J, YOU H J, YU J, et al. Prevotella as a hub for vaginal microbiota under the influence of host genetics and their association with obesity[J]. Cell Host Microbe, 2017, 21(1): 97–105. DOI:10.1016/j.chom.2016.11.010 |
| [4] | JETHWA H, ABRAHAM S. The evidence for microbiome manipulation in inflammatory arthritis[J]. Rheumatology (Oxford), 2017, 56(9): 1452–1460. DOI:10.1093/rheumatology/kew374 |
| [5] | ZHOU H W, LI D F, TAM N F Y, et al. BIPES, a cost-effective high-throughput method for assessing microbial diversity[J]. ISME J, 2011, 5(4): 741–749. DOI:10.1038/ismej.2010.160 |
| [6] | DEANE K D, DEMORUELLE M K, KELMENSON LB, et al. Genetic and environmental risk factors for rheumatoid arthritis[J]. Best Pract Res Clin Rheumatol, 2017, 31(1): 3–18. DOI:10.1016/j.berh.2017.08.003 |
| [7] | SCHER J U, SCZESNAK A, LONGMAN RS, et al. Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis[J]. Elife, 2013, 2: e01202. DOI:10.7554/eLife.01202 |
| [8] | CATRINA A I, DEANE K D, SCHER J U. Gene, environment, microbiome and mucosal immune tolerance in rheumatoid arthritis[J]. Rheumatology(Oxford), 2016, 55(3): 391–402. DOI:10.1093/rheumatology/keu469 |
| [9] | DEMORUELLE M K, DEMORUELLE S K, HEATHER B N, et al. Anti-CCP antibody levels are elevated in cervicovaginal fluid in association with local inflammation in premenopausal women without RA[J]. Arthritis & Rheumatology, 2017, 69(S10): 2914. |
| [10] | ALPÍZAR-RODRÍGUEZ D, FINCKH A. Environmental factors and hormones in the development of rheumatoid arthritis[J]. Semin Immunopathol, 2017, 39(4): 461–468. DOI:10.1007/s00281-017-0624-2 |
| [11] | STRAUB R H. The complex role of estrogens in inflammation[J]. Endocr Rev, 2007, 28(5): 521–574. DOI:10.1210/er.2007-0001 |
| [12] | KELLY D, Conway S. Bacterial modulation of mucosal innate immunity[J]. Mol Immunol, 2005, 42(8): 895–901. DOI:10.1016/j.molimm.2004.12.003 |
| [13] | ANAHTAR M N, BYRNE E H, DOHERTY K E, et al. Cervicovaginal bacteria are a major modulator of host inflammatory responses in the female genital tract[J]. Immunity, 2015, 42(5): 965–976. DOI:10.1016/j.immuni.2015.04.019 |
| [14] | RAVEL J, GAJER P, ABDO Z, et al. Vaginal microbiome of reproductive-age women[J]. Proc Natl Acad Sci USA, 2011, 108(Suppl 1): 4680–4687. DOI:10.1073/pnas.1002611107 |
| [15] | ANAHTAR M N, GOOTENBERG D B, MITCHELL C M, et al. Cervicovaginal microbiota and reproductive health: the virtue of simplicity[J]. Cell Host & Microbe, 2018, 23(2): 159–168. DOI:10.1016/j.chom.2018.01.013 |
| [16] | MA B, FORNEY L J, RAVEL J. Vaginal microbiome: rethinking health and disease[J]. Annu Rev Microbiol, 2012, 66: 371–389. DOI:10.1146/annurev-micro-092611-150157 |
| [17] | PATTERSON J L, STULL-LANE A, GIRERD P H, et al. Analysis of adherence, biofilm formation and cytotoxicity suggests a greater virulence potential of Gardnerella vaginalis relative to other bacterial-vaginosis-associated anaerobes[J]. Microbiology, 2010, 156(Pt 2): 392–399. DOI:10.1099/mic.0.034280-0 |
| [18] | SCHAPIRA D, BRAUN-MOSCOVICI Y, NAHIR A M. Reactive arthritis induced by Gardnerella vaginalis[J]. Clin Exp Rheumatol, 2002, 20(5): 732–733. DOI:10.1016/j.ejr.2013.12.008 |
| [19] | LIBBY E K, PASCAL K E, MORDECHAI E, et al. Atopobium vaginae triggers an innate immune response in an in vitro model of bacterial vaginosis[J]. Microbes Infect, 2008, 10(4): 439–446. DOI:10.1016/j.micinf.2008.01.004 |
| [20] | DOERFLINGER S Y, THROOP A L, HERBST-KRALOVETZ M M. Bacteria in the vaginal microbiome alter the innate immune response and barrier properties of the human vaginal epithelia in a species-specific manner[J]. J Infect Dis, 2014, 209(12): 1989–1999. DOI:10.1093/infdis/jiu004 |
| [21] | FREITAS A C, HILL J E. Quantification, isolation and characterization of Bifidobacterium from the vaginal microbiomes of reproductive aged women[J]. Anaerobe, 2017, 47: 145–156. DOI:10.1016/j.anaerobe.2017.05.012 |
| [22] | ZHOU J Z, WAY S S, CHEN K. Immunology of the uterine and vaginal mucosae[J]. Trends Immunol, 2018, 39(4): 302–314. DOI:10.1016/j.it.2018.01.007 |



