2. 100088 北京,解放军火箭军总医院神经外科;
3. 401120 重庆,重庆医科大学第三附属医院神经疾病中心
2. Department of Neurosurgery, General Hospital of PLA Rocket Force, Beijing, 100088;
3. Department of Neurosurgery, the Third Affiliated Hospital of Chongqing Medical University, Chongqing, 401120, China
胶质母细胞瘤为常见的原发性颅脑肿瘤,以疗效差、预后不良为主要特点,其平均中位生存期仅为14个月[1-3]。目前已知遗传、细菌感染、环境影响以及其他多种因素均会参与胶质母细胞瘤的发生进程,然而其内在的分子机制仍然所知甚少[4]。因此,进一步探索胶质母细胞瘤的发病机制、进而发展新的治疗手段就显得尤为重要。
TRIM29基因又被称作ATDC基因,属于TRIM家族的一员(该家族成员超过70多种)[5]。研究表明,TRIM家族在参与调控诸多细胞进程(如细胞生长、分化、发生发育、凋亡及炎症等)中发挥重要作用[6-9]。近年来,TRIM家族对肿瘤的调控越发受到关注。作为TRIM家族的一员,TRIM29在诸多肿瘤中发挥着促癌作用。通过对TRIM29表达的检测,发现在膀胱癌、胃癌、肺癌以及胰腺癌中,TRIM29的高表达与肿瘤的恶性程度及肿瘤患者的不良预后呈正相关[10-11]。目前TRIM29在颅内肿瘤中的表达尚不明确,其对胶质母细胞瘤生物学行为的调控及相关作用机制更不清楚。因此,本实验将对TRIM29在胶质瘤中的表达进行检测,并分析其与临床特征的相关性,同时探究TRIM29对胶质母细胞瘤细胞增殖及迁移的影响, 并探索可能的分子作用机制。
1 材料与方法 1.1 主要试剂人胶质瘤细胞系(U-118 MG、U-87 MG、LN-229、A-172)购自美国ATCC细胞库(American Type Culture Collection),DAB检测试剂盒购自万类生物。胎牛血清、DMEM细胞培养基、胰蛋白酶、LipofectamineTM2000(Invitrogen), 总蛋白提取试剂盒(碧云天),MTT试剂盒(Sigma),Transwell小室(Millipore),鼠抗人TRIM29、α-tubulin、p-AKT及AKT一抗(Cell Signaling Technology),鼠抗人Ki67一抗(BD Biosciences),辣根过氧化物酶标记的山羊抗小鼠二抗(Life),对照组(shScramble)病毒及TRIM29干扰病毒(shTRIM29)由上海吉玛基因公司构建,见表 1。
| 名称 | 序列(5′→3′) |
| shScramble | 正义链: CCGGGAACTCGAGTTCACATGGTTCCTCGAGGAACCATGTGAACTCGAGTTCTTTTTG 反义链: AATTCAAAAAGAACTCGAGTTCACATGGTTCCTCGAGGAACCATGTGAACTCGAGTTC |
| shTRIM29 | 正义链: CCGGACCTGAGCCGTAACTTCATTGCTCGAGCAATGAAGTTACGGCTCAGGTTTTTTG 反义链: AATTCAAAAAACCTGAGCCGTAACTTCATTGCTCGAGCAATGAAGTTACGGCTCAGGT |
1.2 临床资料
选取2007年1月至2012年9月陆军军医大学第三附属医院神经外科手术切除的胶质瘤组织标本56例。所选病例术前均未行放化疗,术后病理组织学检查证实为胶质瘤。包括男性34例,女性20例;年龄31~67(45.3±9.3)岁,其中≤ 40岁20例,>40岁36例。据WHO分级,Ⅰ~Ⅱ期26例,Ⅲ期17例,Ⅳ期13例,见表 2。同时另取由高血压所导致的脑出血行正常脑组织切除减压患者标本16例为对照组。并于术中收集脑胶质母细胞瘤组织、癌旁组织及正常脑组织(对照)各4例用以TRIM29蛋白表达检测。
| 临床病理特征 | 例数 | TRIM29表达量 | P值 | |
| 低表达 | 高表达 | |||
| 年龄 | 0.063 | |||
| >40岁 | 36 | 14 | 22 | |
| ≤40岁 | 20 | 13 | 7 | |
| 性别 | 0.455 | |||
| 女性 | 22 | 12 | 10 | |
| 男性 | 34 | 15 | 19 | |
| WHO分级 | <0.001 | |||
| Ⅰ~Ⅱ | 26 | 20 | 6 | |
| Ⅲ | 17 | 5 | 12 | |
| Ⅳ | 13 | 2 | 11 | |
1.3 方法 1.3.1 免疫组化
采用DAB检测试剂盒检测TRIM29和Ki67的表达情况。结果判定标准:根据阳性细胞所占视野面积百分比评分为1(<10%),2(10%~50%),3(>50%~75%)和4(>75%)。染色强度分为无显色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。染色指数为两者计分相乘,0~1分:“-”;2~3分:“+”;4~6分:“+ +”;>6分:“+ + +”。>4判定为高表达,≤4判定为低表达。
1.3.2 细胞培养胶质瘤细胞株U-118 MG、U-87 MG、LN-229、A-172培养于恒定37 ℃,5%CO2浓度的细胞培养箱。细胞每2天更换1次培养基,对数生长期传代。
1.3.3 慢病毒感染U-87 MG细胞取对数期生长良好的U-87 MG细胞,以每孔5×104细胞数接种于12孔板。并将其分为空白对照组、shScramble组(阴性对照组)及shTRIM29组(实验组)。于37 ℃、5%CO2的培养箱中培养24 h,待细胞密度达到约40%时,将shScramble及shTRIM29慢病毒以感染复数值3分别感染对照组与实验组细胞。24 h后,更换培养液并加入3 μg/mL嘌呤霉素筛选获得感染成功的阳性细胞,待细胞生长状态稳定后,改用含低浓度嘌呤霉素的培养基维持培养,经扩大培养后即可获得稳定敲低的各组细胞株。
1.3.4 蛋白质提取以及Western blot检测应用总蛋白提取试剂盒提取各细胞及组织总蛋白,利用BCA法检测蛋白质浓度。通过10%的SDS-PAGE凝胶电泳各组蛋白质,并转膜至PVDF膜,以5%脱脂牛奶室温封闭2 h。再加入1 :1 000鼠抗人TRIM29抗体及鼠抗人1 :1 000 α-tubulin抗体,4 ℃中孵育过夜。次日TBST洗膜3次,每次5 min,室温下以1 :10 000辣根过氧化物酶标记的山羊抗小鼠二抗孵育2 h,TBST洗涤3次,每次5 min,利用ECL化学发光液显影。
1.3.5 MTT细胞增殖实验利用MTT实验检测TRIM29对U-87 MG细胞增殖的影响。细胞分为空白对照组、shScramble组(阴性对照组)及shTRIM29组(实验组),将各组U-87 MG细胞接种于96孔板内,分别于0、1、2、3、4、5 d每孔中加入5 mg/mL的MTT试剂10 μL, 避光于37 ℃孵育4 h,吸去上清,加入200 μL DMSO, 室温震荡10 min后,于波长560 nm处测定光密度值[D(560)]。
1.3.6 肿瘤细胞克隆形成实验1.2% Softagar配制:称取1.2 g软琼脂,定容至100 mL,经高压处理后置于60 ℃留存。底层胶:将500 μL 2×DMEM培养和等体积的1×DMEM培养基混匀后平铺于6孔板,等待冷却待用。上层胶:取5 mL离心管,加入2 mL 1×DMEM培养基,然后将各组细胞消化计数,按空白对照组、shScramble组(阴性对照组)及shTRIM29组(实验组)每组1 000个细胞加入离心管中进行悬浮;再准备另外一只离心管,向其中分别加入1.5 mL 2×DMEM和等体积的1.2% Softagar, 充分混匀后吸取2 mL于以上培养基充分混匀。最后向孔中加入1.5 mL混合液作为上层胶,每组重复3次,待胶充分凝固后放于37 ℃培养箱中进行培养。14~21 d后,用MTT染色30 min进行拍照检测。
1.3.7 Transwell实验检测细胞的迁移能力分别取对数生长期的空白对照组、shScramble组(阴性对照组)及shTRIM29组(实验组)U-87 MG细胞。经消化、离心后,用新鲜培养基重悬并进行细胞计数,以1×105/孔接种于小室的上室,改用1%的培养基进行饥饿培养,下室加入含10%胎牛血清的DMEM培养基,孵箱培养后,取出小室进行用多聚甲醛固定15 min,PBS洗涤3次×5 min,结晶紫染色20 min,PBS洗涤3次×5 min,干燥后置于显微镜下观察并计数。
1.3.8 裸鼠体内成瘤实验选取3~4周龄,由西南大学家蚕基因生物学国家重点实验室提供的雌性裸鼠进行实验。取对数生长期的空白对照组、shScramble组(阴性对照组)及shTRIM29组(实验组)U87-MG细胞,以PBS调整细胞数为4×105个/mL,取0.1 mL细胞悬液注射于小鼠前肢背部皮下,共18只,每组6只。之后每隔5 d观测裸鼠皮下肿瘤生长情况,并以游标卡尺测量肿瘤体积。在第30天时,通过颈椎脱臼法处死各组小鼠,并拍照测量肿瘤体积(长径×短径2×0.5)。
1.4 统计学分析采用SPSS 19.0统计软件进行数据分析,每项实验至少重复3次,计量资料以x ±s表示,两组间比较采用t检验;相关性分析采用Spearman相关分析。检验水准:α=0.05。
2 结果 2.1 胶质瘤组织中TRIM29蛋白表达与临床特征的关系TRIM29蛋白阳性表达主要定位于胶质瘤及正常脑组织的细胞质中。TRIM29在胶质瘤组织中多以强阳性表达,而在正常脑组织中阳性表达较少,多以阴性或弱阳性为主(图 1)。Spearman相关分析结果显示,胶质瘤组织中TRIM29的表达与胶质瘤WHO分级呈正相关(r=0.535, P < 0.05),与年龄、性别无明显相关性(表 2)。
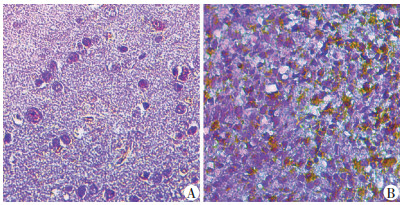
|
| A:TRIM29在正常脑组织中阴性表达;B:TRIM29在胶质瘤细胞中阳性表达 图 1 TRIM29在正常脑组织和胶质瘤组织中的表达(S-P ×200) |
2.2 TRIM29在胶质母细胞瘤组织及细胞中高表达
因TRIM29的表达与WHO分级呈显著正相关,故选取胶质母细胞瘤(Ⅳ级)组织及其细胞株作为研究对象。Western blot检测结果显示,相较于癌旁组织及正常组织,TRIM29在胶质母细胞瘤组织中的蛋白表达量显著增高(P < 0.05,图 2),同时,TRIM29在胶质母细胞瘤细胞株U-87 MG中的蛋白表达明显高于其他细胞株,故选择U-87 MG细胞用作后续研究。

|
|
A:TRIM29在胶质母细胞瘤组织(1)、癌旁组织(2)及正常组织(3)中的表达;B:TRIM29在胶质瘤细胞株中的表达 1:A172;2:LN-229;3:U-87 MG;4:U-118 MG 图 2 胶质瘤细胞、组织及正常组织中TRIM29的蛋白表达 |
2.3 在高表达TRIM29的胶质母细胞瘤细胞U-87 MG中敲低TRIM29
U-87 MG细胞具有恶性程度高,低分化,生长稳定高的特点。通过对各组U-87 MG细胞进行Western blot检测,发现shTRIM29组细胞中TRIM29的蛋白表达明显低于空白对照组以及shScramble组(P < 0.05,图 3)。这说明癌细胞TRIM29基因已被成功敲低。
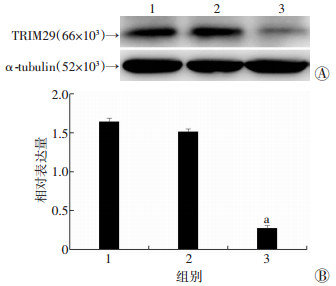
|
|
1:空白对照组;2:shScramble组;3:shTRIM29组 A:Western blot检测结果;B:TRIM29蛋白相对表达量a:P < 0.05,与空白对照组、shScramble组比较 图 3 Western blot检测各组胶质母细胞瘤细胞U-87 MG中TRIM29蛋白的表达 |
2.4 敲低TRIM29对U-87 MG细胞增殖的影响
通过绘制MTT生长曲线,发现敲低TRIM29后,明显抑制了U-87 MG细胞的增殖能力(P < 0.05,图 4A)。同时,肿瘤克隆形成实验也发现,shTRIM29组细胞形成的克隆数为(106±5),shScramble组及空白对照组细胞的克隆数分别为(259±6)、(266±5),实验组的克隆数明显低于shScramble组及空白对照组(P < 0.05,图 4B)。这表明TRIM29对U-87 MG细胞的增殖起促进作用。

|
| A:MTT检测各组细胞增殖能力;B:克隆形成实验结果 图 4 MTT及克隆形成实验检测TRIM29对U-87 MG细胞增殖的影响 |
2.5 TRIM29促进U-87 MG细胞的迁移能力
采用Transwell迁移实验检测敲低TRIM29对U-87 MG的迁移能力的影响(图 5),shTRIM29组细胞穿膜数为(91±8),明显低于shScramble组(295±12)及空白对照组细胞(298±14)(P < 0.05)。这提示TRIM29可促进U-87 MG的迁移,敲低TRIM29后,肿瘤细胞的迁移能力明显减弱。
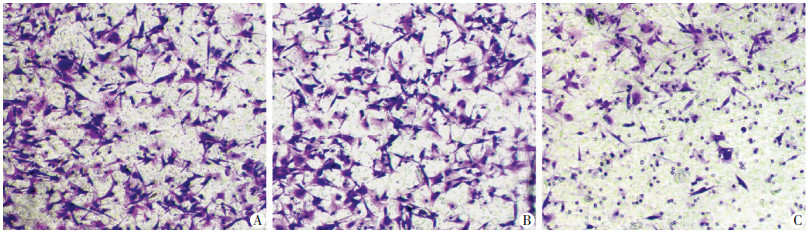
|
| A:空白对照组;B:shScramble组; C:shTRIM29组 图 5 Transwell实验检测TRIM29对U-87 MG细胞迁移的影响(结晶紫×100) |
2.6 TRIM29敲低可抑制裸鼠皮下移植瘤的生长
裸鼠皮下成瘤实验结果显示,接种空白对照组及shScramble组细胞的裸鼠,约10 d形成明显可见的肿瘤结节,而接种shTRIM29组细胞的裸鼠在15 d左右才形成较为明显的肿瘤结节。通过绘制皮下瘤体体积的生长曲线,发现shTRIM29组皮下瘤体的体积显著小于空白对照组及shScramble组(P < 0.05);且shScramble组及空白对照组之间差异无统计学意义(图 6A、B)。为进一步验证敲低TRIM29对胶质母细胞瘤增殖的影响,对取出的皮下瘤体组织进行免疫组化检测Ki67的表达水平,发现shTRIM29组皮下瘤体组织中Ki67表达明显降低(图 6C)。这提示shTRIM29组的增殖水平低于空白对照组与shScramble组。
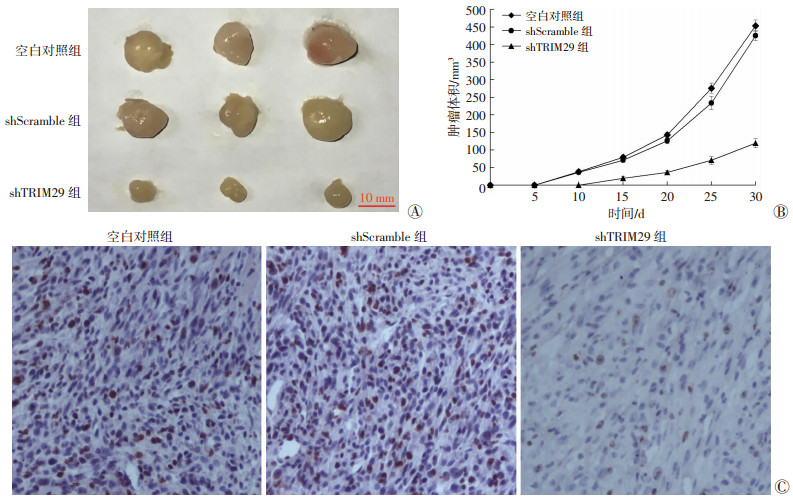
|
| A:各组裸鼠皮下瘤体大体观;B:各组皮下瘤体体积变化曲线;C:免疫组化检测各组移植瘤体中Ki67的表达(S-P ×200) 图 6 TRIM29对裸鼠皮下移植瘤生长的影响 |
2.7 敲低TRIM29对AKT通路蛋白表达的影响
Western blot检测结果显示,shTRIM29组细胞AKT通路中p-AKT蛋白表达相较空白对照组与shScramble组细胞蛋白表达明显下调(图 7)。这说明抑制TRIM29后胶质母细胞瘤细胞U-87 MG生物学行为的改变,可能通过AKT信号通路。
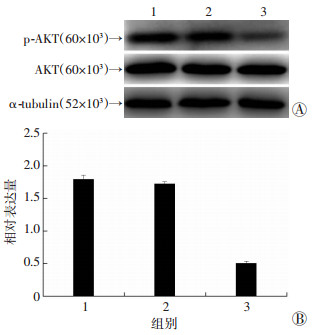
|
| 1:空白对照组;2:shScramble组; 3:shTRIM29组A:Western blot检测结果;B:各组p-AKT蛋白相对表达量 图 7 Western blot检测各组p-AKT、AKT蛋白的表达 |
3 讨论
肿瘤的发生、发展与肿瘤细胞的快速增殖以及迁移密不可分。通常来说,肿瘤细胞的增殖、迁移能力越强,其恶性程度越高、发展越快。然而,细胞增殖、迁移是一个十分复杂的过程,其中涉及多种基因、转录因子。因此,寻找调控细胞增殖及迁移的关键环节,对于肿瘤的研究便显得十分的重要。在近年的研究中,许多TRIM家族中的成员逐渐以抑癌或促癌因子而被大家熟知。作为该家族一员,TRIM29同样参与了多种肿瘤的生物过程。TRIM29目前已被发现在多种肿瘤中高表达,成为不少进展期恶性肿瘤的标志之一[10, 12-14]。值得注意的是,在乳腺癌中,TRIM29则表现出抑癌特性,其表达与乳腺癌的增殖、恶性程度呈明显负相关[15]。上述研究表明TRIM29在不同的肿瘤中,发挥着不同的调控作用。但目前在神经系统肿瘤中,TRIM29发挥着何种作用尚不清楚。
本研究首先通过免疫组化检测胶质瘤患者组织以及正常脑组织中TRIM29的表达量,发现TRIM29在胶质瘤组织中的表达明显高于正常脑组织。此外,通过对56例胶质瘤患者TRIM29的表达进行相关性分析,发现TRIM29的高表达与胶质瘤WHO分级呈正相关(P < 0.05),说明TRIM29与胶质瘤的发生、发展有密切的关系。随后,选择高表达TRIM29的胶质母细胞瘤(Ⅳ级)作为主要实验对象,通过Western blot检测发现TRIM29在胶质母细胞瘤组织中的表达量同样明显高于癌旁组织与正常组织,进一步在胶质瘤细胞株中检测发现在低分化细胞系胶质母细胞瘤细胞U-87 MG中TRIM29的蛋白表达最高,故选取U-87 MG进行后续实验。接下来利用慢病毒载体感染U-87 MG胶质母细胞瘤细胞,成功构建了TRIM29敲低的(shTRIM29) U-87 MG细胞株。通过MTT实验、软琼脂克隆形成实验以及裸鼠皮下成瘤实验,结果表明与shScramble组(阴性对照组)及空白对照组相比,shTRIM29组的细胞增殖能力明显受到抑制,表明下调TRIM29可抑制胶质母细胞瘤细胞的增殖能力。同时通过Transwell实验证明下调TRIM29可明显降低胶质母细胞瘤细胞的迁移能力。
Akt是一种丝氨酸/苏氨酸蛋白激酶,与细胞生长、增殖有关。研究表明Akt是P13K/AKT信号通路的关键调控因子,在特定情况下,可以被细胞因子、生长因子等多种因素激活,参与细胞的增殖、恶变、迁移等多种生物学反应,与肿瘤的发生密切相关[16]。目前已知胶质母细胞瘤常伴有AKT表达的升高,本实验通过Western blot检测结果显示,在胶质母细胞瘤细胞U-87 MG中敲低TRIM29可抑制AKT活化形式p-AKT的表达,为解释敲低TRIM29可抑制胶质母细胞瘤细胞的增殖和迁移提供了一定的理论依据,提示TRIM29可能通过调控AKT通路在胶质母细胞瘤中发挥促癌作用,但TRIM29在胶质母细胞瘤中具体如何调控AKT仍有待进一步探索。
本研究探讨了TRIM29表达水平的高低与胶质瘤恶性程度的关系,结果表明TRIM29的高表达与胶质瘤级别呈正相关。此外,TRIM29在胶质母细胞瘤中表达增高,敲低TRIM29可明显抑制U-87 MG细胞的增殖、迁移能力,且可抑制p-AKT蛋白的表达,提示TRIM29在胶质母细胞瘤中发挥促癌基因的作用,为临床治疗胶质母细胞瘤提供了新的靶标。
| [1] | RIDDICK G, FINE H A. Integration and analysis of genome-scale data from gliomas[J]. Nat Rev Neurol, 2011, 7(8): 439–450. DOI:10.1038/nrneurol.2011.100 |
| [2] | MEYER M A. Malignant gliomas in adults[J]. N Engl J Med, 2008, 359(17): 1850. DOI:10.1056/NEJMc086380 |
| [3] | KIM E, KIM M, WOO D H, et al. Phosphorylation of EZH2 activates STAT3 signaling via STAT3 methylation and promotes tumorigenicity of glioblastoma stem-like cells[J]. Cancer Cell, 2013, 23(6): 839–852. DOI:10.1016/j.ccr.2013.04.008 |
| [4] | DAGOGO-JACK I, SHAW A T. Tumour heterogeneity and resistance to cancer therapies[J]. Nat Rev Clin Oncol, 2018, 15(2): 81–94. DOI:10.1038/nrclinonc.2017.166 |
| [5] | KIMURA T, JIA J, KUMAR S, et al. Dedicated SNAREs and specialized TRIM cargo receptors mediate secretory autophagy[J]. EMBO J, 2017, 36(1): 42–60. DOI:10.15252/embj.201695081 |
| [6] | SATO T, TAKAHASHI H, HATAKEYAMA S, et al. The TRIM-FLMN protein TRIM45 directly interacts with RACK1 and negatively regulates PKC-mediated signaling pathway[J]. Oncogene, 2015, 34(10): 1280–1291. DOI:10.1038/onc.2014.68 |
| [7] | UCHIL P D, HINZ A, SIEGEL S, et al. TRIM protein-mediated regulation of inflammatory and innate immune signaling and its association with antiretroviral activity[J]. J Virol, 2013, 87(1): 257–272. DOI:10.1128/JVI.01804-12 |
| [8] | LOEDIGE I, GAIDATZIS D, SACK R, et al. The mammalian TRIM-NHL protein TRIM71/LIN-41 is a repressor of mRNA function[J]. Nucleic Acids Res, 2013, 41(1): 518–532. DOI:10.1093/nar/gks1032 |
| [9] | MANDELL M A, KIMURA T, JAIN A, et al. TRIM proteins regulate autophagy:TRIM5 is a selective autophagy receptor mediating HIV-1 restriction[J]. Autophagy, 2014, 10(12): 2387–2388. DOI:10.4161/15548627.2014.984278 |
| [10] | KOSAKA Y, INOUE H, OHMACHI T, et al. Tripartite motif-containing 29 (TRIM29) is a novel marker for lymph node metastasis in gastric cancer[J]. Ann Surg Oncol, 2007, 14(9): 2543–2549. DOI:10.1245/s10434-007-9461-1 |
| [11] | KANNO Y, WATANABE M, KIMURA T, et al. TRIM29 as a novel prostate basal cell marker for diagnosis of prostate cancer[J]. Acta Histochem, 2014, 116(5): 708–712. DOI:10.1016/j.acthis.2013.12.009 |
| [12] | JIANG T, TANG H M, LU S, et al. Up-regulation of tripartite motif-containing 29 promotes cancer cell proliferation and predicts poor survival in colorectal cancer[J]. Med Oncol, 2013, 30(4): 715. DOI:10.1007/s12032-013-0715-4 |
| [13] | TANG Z P, DONG Q Z, CUI Q Z, et al. Ataxia-telangiectasia group D complementing gene (ATDC) promotes lung cancer cell proliferation by activating NF-κB pathway[J]. PLoS ONE, 2013, 8(6): e63676. DOI:10.1371/journal.pone.0063676 |
| [14] | LAI W, ZHAO J, ZHANG C, et al. Upregulated ataxia-telangiectasia group D complementing gene correlates with poor prognosis in patients with esophageal squamous cell carcinoma[J]. Dis Esophagus, 2013, 26(8): 817–822. DOI:10.1111/j.1442-2050.2012.01400.x |
| [15] | AI L, KIM W J, ALPAY M, et al. TRIM29 suppresses TWIST1 and invasive breast cancer behavior[J]. Cancer Res, 2014, 74(17): 4875–4887. DOI:10.1158/0008-5472.CAN-13-3579 |
| [16] | STEGEMAN H, SPAN P N, KAANDERS J H, et al. Improving chemoradiation efficacy by PI3-K/AKT inhibition[J]. Cancer Treat Rev, 2014, 40(10): 1182–1191. DOI:10.1016/j.ctrv.2014.09.005 |



