2. 400016 重庆,重庆医科大学附属第一医院脂糖代谢实验室;
3. 400038 重庆,陆军军医大学(第三军医大学):生物医学分析测试中心;
4. 610083 成都,成都军区总医院重症医学科
2. Laboratory of Lipid & Glucose Metabolism, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016;
3. Biomedical Analysis Center, Army Medical University (Third Military Medical University), Chongqing, 400038;
4. Department of Intensive Care Medicine, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是指除外酒精和其他明确的肝损伤因素所致的以肝细胞内脂肪过度沉积为主要特征的代谢综合征。在我国,NAFLD总体发病率约为20%[1]。近年来由于经济水平以及生活方式的改变,其总体发病率逐年提高,在经济发达地区中可达30%以上[2];肥胖儿童中发病率甚至高达77%[3],已成为我国最常见的慢性肝病。NAFLD是由包括代谢、基因、环境等多种机制共同调控的复杂疾病,最基本的病理变化是肝细胞内甘油三酯等脂质的累积而引起的脂肪变性。随着病程进展,NAFLD可由单纯脂肪变性逐步发展为脂肪性肝炎、肝纤维化、肝硬化,甚至肝癌[3]。疾病进展至纤维化阶段则会导致肝细胞疤痕组织形成,使病情难以逆转。因此,在NAFLD早期清除肝细胞内脂质沉积是缓解和治疗非酒精性脂肪性肝病的关键。
Rab蛋白是小分子GTP结合蛋白Ras超家族中的一员。大多数Rab蛋白在调节膜转运和信号通路传导方面有重要作用[4]。近年来随着研究的深入,Rab蛋白在调节细胞内脂代谢方面的作用逐渐被发现并受到重视[5-7]。Rab32是一种在肝脏有较高表达水平的Rab蛋白[8]。有研究发现其定位于线粒体并与线粒体功能息息相关[9]。线粒体是脂质代谢的主要场所,提示Rab32可能参与了脂质代谢的调节。目前对Rab32对脂质蓄积的影响并无统一定论,本研究旨在观察Rab32对肝细胞内脂滴聚集水平的影响,为进一步研究Rab32蛋白对脂质代谢的调节机制奠定基础,为临床上非酒精性脂肪肝的防治提供新思路。
1 材料与方法 1.1 材料 1.1.1 质粒、菌株及细胞系Crispr质粒、pMD2.G和psPAX2质粒由瑞士Trono实验室惠赠,DH5α大肠杆菌感受态细胞购自美国Invitrogen公司,小鼠正常肝传代细胞AML12购自中国科学院典型培养物保藏委员会细胞库,293FT细胞购自ATCC公司。
1.1.2 主要试剂胎牛血清(FBS)、Insulin Transferrin Selenium Solution(ITS)、DMEM/F-12培养基、HBSS缓冲液、Opti-MEM培养基购自美国Gibco公司。RIPA裂解液、BCA蛋白浓度检测试剂盒、一抗稀释液及二抗稀释液购自江苏碧云天公司;封闭蛋白干粉购自武汉博士德公司;兔抗β-tubulin多克隆抗体、兔抗β-actin小鼠单克隆抗体购自美国CST公司;小鼠抗GFP多克隆抗体购自美国Abbkine公司;山羊抗Rab32多克隆抗体购自英国Abcam公司;辣根酶标记山羊抗兔IgG、辣根酶标记兔抗山羊IgG购自北京中杉公司;ECL化学发光试剂盒购自重庆葆光生物科技公司;尼罗红染料、胆固醇定量检测试剂盒购自美国Sigma公司;组织甘油三酯定量试剂盒购自北京普利莱公司。APC-Annexin V染料购自美国BD公司;7-ADD染料购自北京旷博生物技术公司。
1.2 方法 1.2.1 细胞培养及处理小鼠正常肝传代细胞AML12用含10%胎牛血清、1%ITS、100 U/mL青霉素、0.1 mg/mL链霉素、40 ng/mL地塞米松的DMEM/F-12培养基培养于5% CO2、37 ℃恒温恒湿培养箱中,细胞生长密度达90%左右时进行细胞传代。
细胞分3组:常规培养AML12细胞,通过转染FCD-EYFP-Rab32慢病毒表达载体构建Rab32过表达细胞系(过表达组),利用CRISPR/Cas9基因敲除技术构建Rab32敲除细胞系(敲除组),正常细胞设为对照组。
1.2.2 构建Rab32过表达及敲除细胞系使用BsrGⅠ和EcoRⅠ双酶切FCD-EYFP-Rab32载体,及Rab32 cDNA(合成自华大基因)片段。连接、转化、回收后送至华大基因测序验证,获得FCD-EYFP-Rab32慢病毒表达载体。通过Lipofectamine 2000(Thermo Fisher)转染293FT细胞的方法包装FCD-EYFP-Rab32慢病毒。病毒感染AML12细胞72 h后,经流式分选获得稳定表达细胞株。
小鼠RAB32基因位于6号染色体,在线(http://crispr.mit.edu/)设计2对针对小鼠RAB32基因向导RNA寡聚核苷酸(gRNA)序列。正义链1:5′-CACCGGCGAGGGACTAGGGCAACA-3′,反义链1:5′-AAACTGTTGCCCTAGTCCCTCGCC-3′;正义链2:5′-CACCGGATAATATAAACATCGACG-3′,反义链2:5′-AAACCGTCGATGTTTATATTATCC-3′。将2对sgRNA单链以逐步退火的方法形成双链后回收。然后将sgRNA双链片段连接至经BbsⅠ线性化后CRISPR Cas9(LentiCRISPRv2)载体中,送至华大基因测序验证后获得LentiCRISPR-Rab32-gRNA1,LentiCRISPR-Rab32-gRNA2。通过Lipofectamine 2000(Thermo Fisher)转染293FT细胞的方法分别包装LentiCRISPR-Rab32-gRNA1和LentiCRISPR-Rab32-gRNA2慢病毒。病毒感染AML12细胞72 h后,使用含2 μg/mL嘌呤霉素的培养基继续培养72 h,获得AML12敲除Rab32细胞群。使用流式细胞仪分选AML12单细胞至96孔板,待细胞长满后,使用Western blot鉴定敲除情况。
1.2.3 Western blot检测Rab32表达量细胞用无菌HBSS洗涤3次,根据细胞沉淀大小加入适量含蛋白酶抑制剂的RIPA裂解液冰上裂解45 min,离心取上清。BCA试剂盒测定蛋白浓度,将5×蛋白上样缓冲液加入到定量一致的蛋白中,100 ℃变性10 min。将等量总蛋白进行SDS-PAGE电泳,湿法转至PVDF膜,转膜后用5%脱脂奶粉室温封闭90 min。之后一抗(1 :1 000)4 ℃过夜孵育,TBST洗膜3次,每次10 min。二抗(4 :10 000)室温孵育90 min,TBST洗膜3次,每次10 min。完成后使用ECL试剂盒显影。
1.2.4 激光共聚焦显微镜观察脂滴变化将细胞以4%多聚甲醛固定20 min,PBS洗涤,以0.1 μg/mL尼罗红染料室温孵育10 min,PBS洗涤,DAPI染细胞核15 min,PBS洗涤后60%甘油封孔。图像由激光共聚焦显微镜(Laica-SP8)采集。
1.2.5 定量试剂盒检测细胞内甘油三酯及胆固醇水平待细胞生长密度约90%时以0.25%胰酶消化收集细胞,HBSS洗涤3次,按照定量试剂盒说明书检测细胞内甘油三酯及胆固醇水平。每组至少测定3次。
1.2.6 流式细胞术检测细胞凋亡水平待细胞生长密度约90%时用胰酶消化收集细胞,冷PBS洗2次,弃上清,用100 μL 1×Binding buffer重悬细胞后,加入2 μL APC-Annexin V,2 μL 7-ADD,混匀后室温避光孵育15 min,采用流式细胞仪(Accuri C6)检测细胞凋亡水平。
1.3 图像和统计学处理使用Image J 1.4对每组细胞各100个细胞进行图像分析,计算每个细胞中脂滴的数量和面积,每组3次平行试验;使用SPSS 19.0统计软件进行独立样本t检验及单因素方差分析。检验水准:α=0.05。
2 结果 2.1 Rab32敲除及过表达细胞系中Rab32蛋白的表达Western blot检测结果显示:Rab32过表达组中成功表达GFP-Rab32蛋白,而对照组和空载体组无GFP-Rab32蛋白表达;Rab32敲除组中Rab32蛋白表达水平(0.11±0.03)较对照组(0.63±0.05)明显降低(P < 0.01),见图 1。
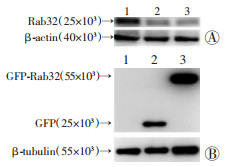
|
| A:抗Rab32抗体检测敲除组Rab32蛋白表达1:对照组;2:Rab32敲除组-1;3:Rab32敲除组-2;B:抗GFP抗体检测过表达组GFP-Rab32蛋白表达1:对照组;2:空载体组;3:Rab32过表达组 图 1 Western blot检测Rab32在AML12细胞中的表达 |
2.2 各组细胞内脂滴数量及面积
Rab32过表达组平均每个细胞内脂滴数为(21.91± 14.32),脂滴总面积为(16.82±14.37)μm2;对照组平均每个细胞内脂滴数为(33.89±17.31),脂滴总面积为(22.27±14.10)μm2;敲除组平均每个细胞内脂滴数为(58.23±42.28),脂滴总面积为(53.31±36.33)μm2。过表达组细胞内脂滴数及脂滴总面积均显著低于对照组(P < 0.01),敲除组细胞内脂滴数及脂滴面积均显著高于对照组(P < 0.01,图 2)。

|
| 图 2 共聚焦显微镜观察常规培养条件下3组细胞内脂滴情况(尼罗红) |
2.3 各组细胞内甘油三酯及胆固醇水平
Rab32过表达组细胞内甘油三酯水平为每毫克蛋白(104.03±12.28)nmol,胆固醇水平为每毫克蛋白(46.92±1.26)μg;对照组细胞内甘油三酯水平为每毫克蛋白(130.94±4.21)nmol,胆固醇水平为每毫克蛋白(81.11±0.65)μg;敲除组细胞内甘油三酯水平为每毫克蛋白(159.03±8.85)nmol,胆固醇水平为每毫克蛋白(93.38±3.33)μg。过表达组细胞内甘油三酯及胆固醇水平均显著低于对照组(P < 0.01);而敲除组细胞内甘油三酯及胆固醇水平均显著高于对照组(P < 0.01)。
2.4 各组细胞凋亡水平Rab32过表达组细胞凋亡率为(2.06±0.29)%,对照组细胞凋亡率为(1.98±0.32)%,敲除组细胞凋亡率为(1.97±0.12)%。3组细胞凋亡水平差异无统计学意义(P>0.05),见图 3。
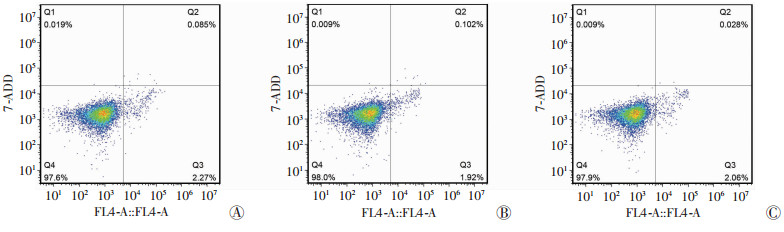
|
| A:对照组;B:Rab32过表达组;C:Rab32敲除组 图 3 流式细胞术检测3组细胞凋亡水平 |
3 讨论
随着人们生活水平的改善和生活方式的改变,NAFLD的发病人数越来越多,已超过慢性肝炎成为我国第一大肝病。目前临床上尚无针对NAFLD治疗的药物。Rab蛋白作为GTP结合蛋白Ras超家族中的一员,是膜转运过程中的重要分子。Rab32在小鼠肝组织中有较高的基因转录及蛋白表达水平,有研究报道Rab32对脂质代谢有一定调控作用,但目前对其认识尚不统一。因此,调控Rab32的表达可能是一个潜在的NAFLD治疗策略。本研究利用CAS9基因敲除技术敲除Rab32和构建EYFP-Rab32融合蛋白过表达Rab32,发现在过表达组中Rab32蛋白表达水平明显升高,敲除组中Rab32表达水平明显降低;同时3组细胞凋亡率无明显差异。这表明运用此两种方法可在细胞水平上有效调控Rab32的表达。
肝细胞内脂质的形成和沉积是产生NAFLD的直接原因。因此,调控肝细胞内脂质代谢是防治NAFLD的重要环节。近来越来越多的研究发现Rab蛋白参与了脂滴的代谢,利用质谱蛋白组学技术检测脂滴发现了包括Rab32在内的超过30种Rab蛋白[10-12],其中Rab7、Rab10、Rab18等Rab蛋白被明确证明通过调控自噬等方式参与了肝细胞脂质分解代谢,而Rab32在脂滴的形成及代谢中的作用仍有争议。前期研究表明Rab32在细胞内与脂滴并未共定位,而是定位于线粒体,敲低Rab32会导致线粒体裂解、功能障碍[13]。线粒体是脂质代谢的主要场所,线粒体功能障碍会导致脂质β氧化功能受损、代谢减慢,最终导致脂滴的累积[14]。这表明敲低Rab32会导致脂滴的形成增加。另一部分研究则显示敲低Rab32后,脂滴变小及数目变少。这些研究均未发现Rab32过表达对脂滴的形成有何影响[15-16]。因此,本研究通过调控Rab32的表达水平,在小鼠肝细胞中证实了敲除Rab32后细胞内脂滴显著增多,而过表达Rab32组较对照组脂滴显著减少。同时对肝细胞内的甘油三酯及胆固醇检测也显示敲除Rab32后细胞内甘油三酯及胆固醇水平显著升高;过表达Rab32组细胞内甘油三酯及胆固醇水平较对照组显著降低。甘油三酯和胆固醇等中性脂是构成细胞内脂滴的重要成分[17]。这些结果均表明Rab32影响了肝细胞内脂滴的形成和代谢。
总之,本研究提示Rab32参与了调节肝脏脂质代谢,Rab32有望成为治疗NAFLD的新的药物靶点,为NAFLD的防治提供了新思路。Rab32对于肝脏脂质的调节是否通过线粒体β氧化或自噬途径还有待进一步研究。
| [1] | FARRELL G C, WONG V W, CHITTURI S. NAFLD in Asia-as common and important as in the West[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(5): 307–318. DOI:10.1038/nrgastro.2013.34 |
| [2] | YAN J, XIE W, OU W N, et al. Epidemiological survey and risk factor analysis of fatty liver disease of adult residents, Beijing, China[J]. J Gastroenterol Hepatol, 2013, 28(10): 1654–1659. |
| [3] | BUZZETTI E, PINZANI M, TSOCHATZIS E A. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD)[J]. Metabolism, 2016, 65(8): 1038–1048. DOI:10.1016/j.metabol.2015.12.012 |
| [4] | PRASHAR A, SCHNETTGER L, BERNARD E M, et al. RabGTPases in immunity and inflammation[J]. Front Cell Infect Microbiol, 2017, 7: 435. DOI:10.3389/fcimb.2017.00435 |
| [5] | SCHROEDER B, SCHULZE R J, WELLER S G, et al. The small GTPase Rab7 as a central regulator of hepatocellular lipophagy[J]. Hepatology, 2015, 61(6): 1896–1907. DOI:10.1002/hep.27667 |
| [6] | LI Z, SCHULZE R J, WELLER S G, et al. A novel Rab10-EHBP1-EHD2 complex essential for the autophagicengulfment of lipid droplets[J]. Sci Adv, 2016, 2(12): e1601470. DOI:10.1126/sciadv.1601470 |
| [7] | LI C, LUO X, ZHAO S, et al. COPI-TRAPPII activates Rab18 and regulates its lipid droplet association[J]. EMBO J, 2017, 36(4): 441–457. DOI:10.15252/embj.201694866 |
| [8] | COHEN-SOLAL K A, SOOD R, MARIN Y, et al. Identification and characterization of mouse Rab32 by mRNA and protein expression analysis[J]. Biochim Biophys Acta, 2003, 1651(1/2): 68–75. |
| [9] | HAILE Y, DENG X, ORTIZ-SANDOVAL C, et al. Rab32 connects ER stress to mitochondrial defects in multiple sclerosis[J]. J Neuroinflammation, 2017, 14(1): 19. DOI:10.1186/s12974-016-0788-z |
| [10] | KRAHMER N, HILGER M, KORY N, et al. Protein correlation profiles identify lipid droplet proteins with high confidence[J]. Mol Cell Proteomics, 2013, 12(5): 1115–1126. DOI:10.1074/mcp.M112.020230 |
| [11] | LARSSON S, RESJO S, GOMEZ M F, et al. Characterization of the lipid droplet proteome of a clonal insulin-producing beta-cell line(INS-1 832/13)[J]. J Proteome Res, 2012, 11(2): 1264–1273. DOI:10.1021/pr200957p |
| [12] | RASINENI K, MCVICKER B L, TUMA D J, et al. RabGTPases associate with isolated lipid droplets(LDs) and show altered content after ethanol administration:potential role in alcohol-impaired LD metabolism[J]. Alcohol Clin Exp Res, 2014, 38(2): 327–335. DOI:10.1111/acer.12271 |
| [13] | BUI M, GILADY S Y, FITZSIMMONS R E, et al. Rab32 modulates apoptosis onset and mitochondria-associated membrane (MAM) properties[J]. J Biol Chem, 2010, 285(41): 31590–31602. DOI:10.1074/jbc.M110.101584 |
| [14] | BOREN J, BRINDLE K M. Apoptosis-induced mitochondrial dysfunction causes cytoplasmic lipid droplet formation[J]. Cell Death Differ, 2012, 19(9): 1561–1570. DOI:10.1038/cdd.2012.34 |
| [15] | WANG C, LIU Z, HUANG X. Rab32 is important for autophagy and lipid storage in drosophila[J]. PLoS ONE, 2012, 7(2): e32086. DOI:10.1371/journal.pone.0032086 |
| [16] | LI Q, WANG J, WAN Y, et al. Depletion of Rab32 decreases intracellular lipid accumulation and induces lipolysis through enhancing ATGL expression in hepatocytes[J]. Biochem Biophy Res Commun, 2016, 471(4): 492–496. DOI:10.1016/j.bbrc.2016.02.047 |
| [17] | ONAL G, KUTLU O, GOZUACIK D, et al. Lipiddroplets in health and disease[J]. Lipids Health Dis, 2017, 16(1): 128. DOI:10.1186/s12944-017-0521-7 |



