2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院生物治疗中心
2. Biological Therapy Center, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
淋巴细胞向肿瘤组织的浸润与机体的免疫反应、患者的预后存在重要关联。研究表明, 在结肠癌、黑色素瘤等恶性肿瘤中, CD8+ T细胞浸润到肿瘤组织的数量与患者的预后成正相关[1-4], 同时趋化因子在T细胞的迁移过程中发挥重要作用[5-6]。而趋化因子受体CXCR3在淋巴细胞通过血管内皮迁移到炎症部位的过程中起着关键性作用[7]。因此, 促进T细胞向肿瘤组织的迁移将有利于抗肿瘤免疫反应的发生。二肽基肽酶Ⅳ (dipeptidyl peptidase Ⅳ, DPP Ⅳ), 也称为CD26, 是一种具有多种生物学功能的细胞表面丝氨酸蛋白酶, 能够剪切多种蛋白质从而改变其生物学活性, 作用底物包括肠促胰岛素、CXCL10等多种趋化因子[8-10]。DPP Ⅳ抑制剂能有效抑制DPP Ⅳ对肠促胰岛素的剪切, 从而控制血糖, 现已成为广泛使用的新型抗糖尿病药物[11-13]。除了在Ⅱ型糖尿病治疗中的应用, DPP Ⅳ抑制剂在黑色素瘤、心脑血管疾病、结直肠癌等肿瘤治疗中的作用正逐渐被阐明。在结直肠癌中, DPP Ⅳ被认为是恶性肿瘤血清的识别指标, DPP Ⅳ高活性与不良预后呈正相关[14-15]。对于结肠癌中DPP Ⅳ高活性是否可通过阻断趋化因子对淋巴细胞的招募作用, 减少淋巴细胞向肿瘤的浸润, 进而DPP Ⅳ抑制剂是否可逆转该作用, 目前鲜有报道。
本研究以重要的趋化组合CXCL10/CXCR3为出发点, 检测T细胞表面CXCR3和结肠癌细胞系中DPP Ⅳ、CXCL10表达, 然后通过抑制DPP Ⅳ活性探究其对T细胞迁移的影响及机制, 以明确DPP Ⅳ抑制剂在T细胞迁移中的作用, 为进一步研究其在肿瘤免疫治疗中的作用提供实验基础。
1 材料与方法 1.1 实验材料HT29、LoVo、Caco2、SW620和293T细胞系、大肠杆菌Top10均由陆军军医大学(第三军医大学)第一附属医院生物治疗中心保存, T细胞来源于健康供者。
1.2 主要试剂与仪器限制性内切酶NheⅠ和SalⅠ购自Thermo公司, DNA连接酶购自TaKaRa公司。DMEM和1640培养基购自Gibco公司, FBS购自BI公司, 胰蛋白酶和DPP Ⅳ抑制剂Sitagliptin购自Sigma公司, 青霉素、链霉素购自华北制药。抗CD3抗体、抗CD28购自Miltenyi Biotec公司, 抗人CD3-FITC抗体、抗人CXCR3-PE抗体和CXCL10 ELISA检测试剂盒购自Biolegend公司。质粒抽提试剂盒购自Omega公司, DPP Ⅳ ELISA检测试剂盒购自R&D公司, 胶回收试剂盒、RNA提取试剂盒购自Promega公司。Transwell小室购自Corning公司, 重组人CXCL10趋化因子购自Peprotech公司, 重组人IL-2购自辽宁卫星生物公司, BSA购自上海生工生物工程股份有限公司。CO2恒温培养箱购自上海力申科学仪器有限公司, 流式细胞仪购自BD公司。
1.3 实验方法 1.3.1 T细胞的活化通过梯度离心法从健康供者外周血中分离出T细胞, 然后用抗CD3和抗CD28单克隆抗体活化T细胞, 活化后用含10%的1640培养液继续培养, 并添加100 IU/mL的IL-2刺激增殖。
1.3.2 流式细胞仪检测T细胞表面趋化因子受体的表达收集活化6 d和相应活化前的T细胞, PBS洗2遍, 添加1% FBS的PBS重悬后, 加入抗人CD3-FITC抗体、抗人CXCR3-PE抗体, 轻轻混匀后于4 ℃孵育30 min, 加入1 mL PBS 300×g离心5 min后用200 μL PBS重悬, 在流式细胞仪上检测T细胞表面CXCR3的表达。
1.3.3 ELISA检测DPP Ⅳ和CXCL10的表达用包被液稀释CXCL10、DPP Ⅳ捕获抗体, 以100 μL/孔加入不同96孔酶标板内, 4 ℃包被过夜。PBST洗板3次后, 加入100 μL封闭液室温封闭1 h。收集HT29、LoVo、Caco2、SW620细胞上清液, 设置3个重复孔, 同时将标准品等比稀释后分别加入酶标板中, 室温孵育2 h。加入生物素标记的检测抗体, 室温孵育1 h后清洗, 再加入HRP标记的亲和素室温孵育30 min, 最后加入TMB显色, 用酶标仪测定450 nm和570 nm处的光密度值[D(450)、D(570)]。
1.3.4 慢病毒载体pL-CXCL10(1-77)、pL-CXCL10(3-77)的构建pCDH载体用NheⅠ和SalⅠ双酶切后, 将酶切产物分别与基因合成的CXCL10(1-77)、CXCL10(3-77)片段进行连接后转化到Top10感受态细胞中, 次日挑取单菌落进行LB液体培养, 然后提取质粒, 用NheⅠ和SalⅠ双酶切后进行琼脂糖凝胶电泳检测, 阳性克隆质粒送南京金斯瑞生物科技公司测序, 重组载体命名为pL-CXCL10(1-77)和pL-CXCL10(3-77)。
1.3.5 慢病毒的制备及感染LoVo细胞将生长状态良好的293T细胞以1×106/孔铺到10 cm培养皿中, 过夜培养后换成无血清的DMEM培养液继续培养2 h。向1.5 mL Ep管中加入13 μg包装质粒(2G+REV+RRE)、15 μg目的质粒、60 μL CaCl2 (2.5 mol/L), 用水补足到600 μL, 轻柔混匀后, 逐滴加入600 μL HBS, 边滴加边涡旋振荡以充分混匀, 室温静置20 min后, 加到细胞培养皿中。4 h后弃去细胞上清, 换成5% FBS的DMEM培养液继续培养。转染48 h后收集细胞上清, 用PEG6000进行病毒纯化, 测定滴度后, 置于-80 ℃保存。将LoVo细胞以2×105/孔铺到24孔板中, 培养6 h后加入3 MOI的慢病毒, 培养48 h后收集细胞, 提取RNA后进行qRT-PCR检测。
1.3.6 qRT-PCR检测基因mRNA表达利用RNA提取试剂盒提取细胞中的总RNA, RNA反转录试剂盒将提取的RNA反转成cDNA后, 采用实时荧光定量PCR仪进行扩增, 通过SYBR-GREEN进行检测, 以GAPDH为内参, 检测感染前后细胞中CXCL10 mRNA表达(表 1)。扩增程序:95 ℃预变性30 s; 95 ℃变性5 s; 60 ℃退火30 s; 70 ℃延伸30 s, 共40个循环。
| 基因名称 | 序列(5′→3′) | 长度 (bp) |
| CXCL10(wt) | 上游:GGGAGTGCCACTGTCTAGGA 下游:ACCTCTTCTCGCCCTTCTTC |
39 |
| CXCL10(m) | 上游:ATCCAGGGCCTGTCTCGGA 下游:ACCTCTTCTCGCCCTTCTTC |
40 |
| CXCL10(wt):CXCL10全长形式; CXCL10(m):CXCL10截短形式 | ||
1.3.7 Transwell检测CXCL10对T细胞迁移的影响
在24孔板中加入600 μL DMEM培养液, 实验组加入5 μL重组人CXCL10因子, 对照组加入等量的PBS; 或者在24孔板中加入LoVo-CXCL10(1-77)和LoVo-CXCL10(3-77)细胞上清。放入Transwell小室。收集T细胞, 离心后用含1% BSA的1640培养液重悬, 按5×105/孔加入Transwell小室。37 ℃培养箱培养2 h后, 收集各组迁移到下室的细胞进行计数。
1.3.8 DPP Ⅳ对T细胞迁移的影响取600 μL LoVo细胞上清置于24孔板中, 对照组加入等量的DMEM培养液, 加入5 μL重组人CXCL10因子。小室中加入5×105 T细胞。培养2 h后, 收集各组迁移到下室的细胞进行计数。
1.3.9 DPP Ⅳ抑制剂对T细胞迁移的影响为了探究DPP Ⅳ抑制剂对T细胞向LoVo的迁移, 向下室中加入培养基(空白组)、LoVo细胞上清(对照组)、LoVo细胞上清+CXCL10因子(因子组)、LoVo细胞上清+CXCL10因子+0.5 mg/mL的DPP Ⅳ抑制剂Sitagliptin(联合组)。为了探究DPP Ⅳ抑制剂对T细胞向LoVo-CXCL10(1-77)的迁移, 向下室LoVo-CXCL10(1-77)细胞上清中加入Sitagliptin, 对照组加入等量PBS, 反应30 min。上室中均加入5×105 T细胞, 培养2 h后, 收集各组迁移到下室的细胞进行计数。
1.4 统计学分析采用GraphPad Prism 6软件进行统计学分析。计量资料用x±s表示, 多组间比较采用单因素方差分析, 两两比较采用t检验, 检验水准:α=0.05。
2 结果 2.1 CXCR3在活化T细胞表面高表达利用流式细胞术检测活化6 d和相应未活化的T细胞表面CXCR3的表达, 结果显示CXCR3在活化T细胞表面高表达(图 1)。

|
| A:活化前; B:活化后6 d 图 1 活化前后T细胞表面CXCR3的表达 |
2.2 结肠癌细胞系中DPP Ⅳ、CXCL10的表达
利用ELISA检测4株结肠癌细胞系中DPP Ⅳ、CXCL10的表达, 如图 2显示, LoVo细胞中DPP Ⅳ高表达但CXCL10低表达, 表达量分别为(1 956.5±95.6) pg/mL和(15.5±0.8) pg/mL; Caco2细胞中DPP Ⅳ低表达但CXCL10高表达, 表达量分别为(5.1±2.4) pg/mL和(3 115.3±95.7) pg/mL。
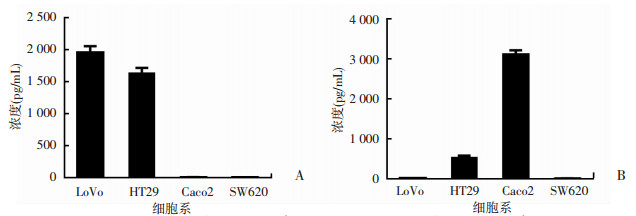
|
| A:结肠癌细胞系中DPP Ⅳ的表达; B:结肠癌细胞系中CXCL10的表达 图 2 ELISA检测4株结肠癌细胞系中DPP Ⅳ、CXCL10表达 |
2.3 DPP Ⅳ抑制T细胞向CXCL10的迁移
Transwell实验检测显示CXCL10能够显著增强T细胞的迁移能力。利用高表达DPP Ⅳ但低表达CXCL10的LoVo细胞, 探究DPP Ⅳ在T细胞迁移中的作用。结果显示T细胞向LoVo细胞上清的迁移低于对照组, 迁移数量分别为(11.2±0.2)×104和(16.5±1.3)×104, 这提示DPP Ⅳ会抑制T细胞向CXCL10的迁移。
2.4 DPP Ⅳ抑制剂促进T细胞的迁移向DPP Ⅳ表达量最高的LoVo细胞上清中加入DPP Ⅳ抑制剂Sitagliptin以抑制DPP Ⅳ酶活性, 然后外源加入100 μg/mL CXCL10因子, 通过Transwell实验检测DPP Ⅳ抑制剂处理与否对T细胞趋化的影响。结果显示, 相比于因子组, 联合组T细胞的迁移数量[(15.5±1.12)×104]明显增加(P < 0.05, 图 3), 恢复到了只使用CXCL10因子的相近水平, 表明DPP Ⅳ对T细胞迁移的抑制作用可以通过DPP Ⅳ抑制剂解除。
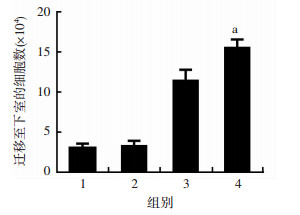
|
| 1:空白组; 2:对照组; 3:因子组; 4:联合组 a:P < 0.05, 与因子组比较 图 3 Transwell检测DPP Ⅳ抑制剂对T细胞迁移的影响 |
2.5 重组慢病毒载体pL-CXCL10(1-77)、pL-CXCL10(3-77)的构建与鉴定
通过基因合成表达全长和氨基端缺失2个氨基酸的CXCL10基因CXCL10(1-77)和CXCL10(3-77), 利用分子克隆技术, 连接到pCDH载体中, 形成pL-CXCL10(1-77)和pL-CXCL10(3-77)重组质粒。质粒用NheⅠ和SalⅠ双酶切鉴定, 结果显示酶切产物大小分别为306 bp和300 bp, 与目的基因的长度一致, 测序结果也完全吻合, 表明成功构建pL-CXCL10(1-77)、pL-CXCL10(3-77)重组质粒(图 4)。
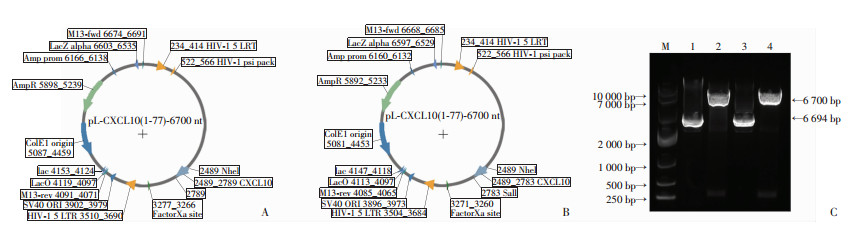
|
|
A:pL-CXCL10(1-77)结构示意图; B:pL-CXCL10(3-77)结构示意图; C:重组载体的酶切鉴定结果 M:DL10 000标准, 1:pL-CXCL10(1-77)质粒, 2:pL-CXCL10(1-77)用NheⅠ+SalⅠ双酶切产物, 3:pL-CXCL10(3-77)质粒, 4:pL-CXCL10(3-77)用NheⅠ+SalⅠ双酶切产物 图 4 pL-CXCL10(1-77)、pL-CXCL10(3-77)重组质粒的构建与鉴定 |
2.6 CXCL10(1-77)、CXCL10(3-77)对T细胞迁移的影响
向CXCL10本底表达量低的LoVo细胞分别感染pL-CXCL10(1-77)和pL-CXCL10(3-77)病毒, 得到LoVo-CXCL10(1-77)和LoVo-CXCL10(3-77)细胞。提取细胞RNA, 利用检测CXCL10全长形式的CXCL10(wt)引物和截短形式的CXCL10(m)引物, 进行qRT-PCR检测, 鉴定感染效率。结果显示, 相比于未感染的LoVo细胞, LoVo-CXCL10(1-77)细胞中CXCL10(wt)的mRNA表达(274 648±8 698)和LoVo-CXCL10 (3-77)细胞中CXCL10(m)的mRNA表达(129 510±3 073)显著增高(P < 0.01), 说明成功构建表达全长形式CXCL10的LoVo-CXCL10(1-77)和表达截短形式CXCL10的LoVo-CXCL10(3-77)细胞(图 5)。
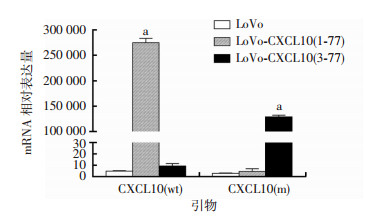
|
| a:P < 0.01, 与LoVo细胞比较 图 5 qRT-PCR鉴定CXCL10的mRNA表达 |
利用Transwell实验检测T细胞向LoVo-CXCL10 (1-77)和LoVo-CXCL10(3-77)细胞上清的迁移, 结果显示LoVo-CXCL10(1-77)组T细胞的迁移量为(9.5±0.9)×104, 对T细胞的趋化相比于对照组[(4.3±0.7)×104]提升了2.2倍(P < 0.01);而LoVo- CXCL10(3-77)组T细胞的迁移量为(4.4±0.7)×104, 对T细胞的招募与对照组基本一致。这说明只有全长形式的CXCL10能够促进T细胞的迁移, 截短形式的CXCL10对T细胞无招募作用。
2.7 DPP Ⅳ抑制剂促进T细胞向CXCL10(1-77)的迁移通过Transwell实验检测DPP Ⅳ抑制剂处理与否对T细胞迁移的作用, 发现DPP Ⅳ抑制剂处理前后T细胞向LoVo-CXCL10(1-77)的迁移量分别为(9.6±0.8)×104和(12.3±0.9)×104(图 6)。DPP Ⅳ抑制剂处理可显著增加T细胞向LoVo-CXCL10(1-77)的迁移(P < 0.05), 但是不影响LoVo-CXCL10(3-77)对T细胞的趋化作用。这表明DPP Ⅳ的作用底物是全长形式的CXCL10, 而对氨基端缺失的CXCL10无剪切作用, 且使用DPP Ⅳ抑制剂处理能增强T细胞的肿瘤迁移。

|
|
1:对照组; 2:LoVo-CXCL10(1-77)组; 3:LoVo-CXCL10(1-77)加DPP Ⅳ抑制剂组; 4:LoVo-CXCL10(3-77)组; 5:LoVo-CXCL10(3-77)加DPP Ⅳ抑制剂组 a:P < 0.05, 与LoVo-CXCL10(1-77)组比较 图 6 Transwell检测DPP Ⅳ抑制剂对T细胞向CXCL10(1-77)和CXCL10(3-77)迁移的影响 |
3 讨论
免疫治疗是指通过增强机体免疫系统识别和杀灭肿瘤的能力从而对抗癌症的治疗方式, 现已成为继手术、放疗和化疗之后的第4种肿瘤治疗模式[16]。淋巴细胞的浸润是免疫治疗有效的关键一环, 而趋化因子作为一类能够诱导炎症细胞向特定部位浸润的具有趋化作用的细胞因子, 在淋巴细胞的迁移过程中起着至关重要的作用[17-20]。已知趋化因子的生物学活性在蛋白翻译后水平受到外切酶DPP Ⅳ的调节, DPP Ⅳ能够剪切包括CXCL10在内的多种趋化因子, 使其形成无生物活性的拮抗形式[21-22]。这表明DPP Ⅳ可能通过趋化因子的介导在淋巴细胞的迁移中发挥一定的作用。
为了探究DPP Ⅳ及其抑制剂对T细胞迁移的影响, 我们首先检测T细胞表面与细胞迁移有关的趋化因子受体的表达, 发现CXCR3在活化T细胞表面普遍高表达。然后检测CXCR3的配体CXCL10和DPP Ⅳ对T细胞迁移的影响, 结果显示CXCL10能够趋化T细胞但是受到DPP Ⅳ的抑制, DPP Ⅳ抑制剂能够促进T细胞的迁移。为了进一步验证DPP Ⅳ抑制剂的作用机制, 我们利用慢病毒载体构建了稳定表达不同表达形式CXCL10的LoVo细胞系, 通过Transwell实验发现, 只有全长形式CXCL10能够趋化T细胞, 截短形式CXCL10对T细胞无招募作用, 同时DPP Ⅳ抑制剂能够促进T细胞向全长形式CXCL10的迁移。因此, DPP Ⅳ抑制剂能够抑制DPP Ⅳ对CXCL10的剪切, 保持CXCL10的生物活性, 从而促进对高表达CXCR3的T细胞的招募作用。
DPP Ⅳ抑制剂作为一种新型抗糖尿病药物, 因其安全有效性现已被广泛使用 。DPP Ⅳ的作用底物除了肠降血糖素, 还包括与淋巴细胞迁移相关的多种趋化因子。因此, 研究DPP Ⅳ抑制剂治疗糖尿病以外的作用, 能够实现其“老药新用”, 减少药物开发成本和时间, 具备良好的社会和经济效益。本研究通过体外实验发现DPP Ⅳ抑制剂能够通过趋化因子/趋化因子受体轴促进T细胞的迁移, 提示DPP Ⅳ抑制剂可能在肿瘤免疫治疗中发挥一定的作用。本研究在结肠癌细胞系中揭示了DPP Ⅳ抑制剂对T细胞迁移的作用, 该机制是否同样适用于其他肿瘤有待进一步验证, 此外也需要体内动物研究的进一步支撑。综上所述, DPP Ⅳ抑制剂在结肠癌实体肿瘤中表现出来的有益作用, 提示该抑制剂或可与肿瘤免疫治疗联合以提高肿瘤免疫疗法的效果。
| [1] | BREMNES R M, AL-SHIBLI K, DONNEM T, et al. The role of tumor-infiltrating immune cells and chronic inflammation at the tumor site on cancer development, progression, and prognosis:emphasis on non-small cell lung cancer[J]. J Thorac Oncol, 2011, 6(4): 824–833. DOI:10.1097/JTO.0b013e3182037b76 |
| [2] | NUNES C, WONG R, MASON M, et al. Expansion of a CD8(+)PD-1(+) replicative senescence phenotype in early stage CLL patients is associated with inverted CD4:CD8 ratios and disease progression[J]. Clin Cancer Res, 2012, 18(3): 678–687. DOI:10.1158/1078-0432.CCR-11-2630 |
| [3] | PAGÈS F, GALON J, DIEU-NOSJEAN M C, et al. Immune infiltration in human tumors:a prognostic factor that should not be ignored[J]. Oncogene, 2010, 29(8): 1093–1102. DOI:10.1038/onc.2009.416 |
| [4] | GALON J, COSTES A, SANCHEZ-CABO F, et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome[J]. Science, 2006, 313(5795): 1960–1964. DOI:10.1126/science.1129139 |
| [5] | HARLIN H, MENG Y, PETERSON A C, et al. Chemokine expression in melanoma metastases associated with CD8+ T-cell recruitment[J]. Cancer Res, 2009, 69(7): 3077–3085. DOI:10.1158/0008-5472.CAN-08-2281 |
| [6] | MLECNIK B, TOSOLINI M, CHAROENTONG P, et al. Biomolecular network reconstruction identifies T-cell homing factors associated with survival in colorectal cancer[J]. Gastroenterology, 2010, 138(4): 1429–1440. DOI:10.1053/j.gastro.2009.10.057 |
| [7] | MIKUCKI M E, FISHER D T, MATSUZAKI J, et al. Non-redundant requirement for CXCR3 signalling during tumoricidal T-cell trafficking across tumour vascular checkpoints[J]. Nat Commun, 2015, 6: 7458. DOI:10.1038/ncomms8458 |
| [8] | YU D M, YAO T W, CHOWDHURY S, et al. The dipeptidyl peptidase Ⅳ family in cancer and cell biology[J]. FEBS J, 2010, 277(5): 1126–1144. DOI:10.1111/j.1742-4658.2009.07526.x |
| [9] | BECKENKAMP A, DAVIES S, WILLIG J B, et al. DPPIV/CD26:a tumor suppressor or a marker of malignancy[J]. Tumour Biol, 2016, 37(6): 7059–7073. DOI:10.1007/s13277-016-5005-2 |
| [10] | OHNUMA K, TAKAHASHI N, YAMOCHI T, et al. Role of CD26/dipeptidyl peptidase Ⅳ in human T cell activation and function[J]. Front Biosci, 2008, 13: 2299–2310. DOI:10.2741/2844 |
| [11] | DEACON C F. Dipeptidyl peptidase-4 inhibitors in the treatment of type 2 diabetes:a comparative review[J]. Diabetes Obes Metab, 2011, 13(1): 7–18. DOI:10.1111/j.1463-1326.2010.01306.x |
| [12] | MILLER S, ST ONGE E L. Sitagliptin:a dipeptidyl peptidase Ⅳ inhibitor for the treatment of type 2 diabetes[J]. Ann Pharmacother, 2006, 40(7-8): 1336–1343. DOI:10.1345/aph.1G665 |
| [13] | MULVIHILL E E, DRUCKER D J. Pharmacology, physiology, and mechanisms of action of dipeptidyl peptidase-4 inhibitors[J]. Endocr Rev, 2014, 35(6): 992–1019. DOI:10.1210/er.2014-1035 |
| [14] | DE CHIARA L, RODRÍGUEZ-PIÑEIRO A M, RODRÍGUEZ-BERROCAL F J, et al. Serum CD26 is related to histopathological polyp traits and behaves as a marker for colorectal cancer and advanced adenomas[J]. BMC Cancer, 2010, 10: 333. DOI:10.1186/1471-2407-10-333 |
| [15] | LAM C S, CHEUNG A H, WONG S K, et al. Prognostic significance of CD26 in patients with colorectal cancer[J]. PLoS ONE, 2014, 9(5): e98582. DOI:10.1371/journal.pone.0098582 |
| [16] | YANG Y. Cancer immunotherapy:harnessing the immune system to battle cancer[J]. J Clin Invest, 2015, 125(9): 3335–3337. DOI:10.1172/JCI83871 |
| [17] | CHOW M T, LUSTER A D. Chemokines in cancer[J]. Cancer Immunol Res, 2014, 2(12): 1125–1131. DOI:10.1158/2326-6066.CIR-14-0160 |
| [18] | FRANCISZKIEWICZ K, BOISSONNAS A, BOUTET M, et al. Role of chemokines and chemokine receptors in shaping the effector phase of the antitumor immune response[J]. Cancer Res, 2012, 72(24): 6325–6332. DOI:10.1158/0008-5472.CAN-12-2027 |
| [19] | NASSER M W, ELBAZ M, AHIRWAR D K, et al. Conditioning solid tumor microenvironment through inflammatory chemokines and S100 family proteins[J]. Cancer Lett, 2015, 365(1): 11–22. DOI:10.1016/j.canlet.2015.05.002 |
| [20] | SARVAIYA P J, GUO D, ULASOV I, et al. Chemokines in tumor progression and metastasis[J]. Oncotarget, 2013, 4(12): 2171–2185. DOI:10.18632/oncotarget.1426 |
| [21] | CASROUGE A, BISIAUX A, STEPHEN L, et al. Discrimination of agonist and antagonist forms of CXCL10 in biological samples[J]. Clin Exp Immunol, 2012, 167(1): 137–148. DOI:10.1111/j.1365-2249.2011.04488.x |
| [22] | MORTIER A, GOUWY M, VAN DAMME J, et al. Effect of posttranslational processing on the in vitro and in vivo activity of chemokines[J]. Exp Cell Res, 2011, 317(5): 642–654. DOI:10.1016/j.yexcr.2010.11.016 |
| [23] | KARAGIANNIS T, BOURA P, TSAPAS A. Safety of dipeptidyl peptidase 4 inhibitors:a perspective review[J]. Ther Adv Drug Saf, 2014, 5(3): 138–146. DOI:10.1177/2042098614523031 |
| [24] | ANZ D, KRUGER S, HAUBNER S, et al. The dipeptidylpeptidase-Ⅳ inhibitors sitagliptin, vildagliptin and saxagliptin do not impair innate and adaptive immune responses[J]. Diabetes Obes Metab, 2014, 16(6): 569–572. DOI:10.1111/dom.12246 |



