在骨折愈合过程中, 延迟愈合或不愈合率较高, 一些生物物理疗法正在应用于治疗骨折愈合[1-2]。低强度聚焦超声(low-intensity pulsed ultrasound, LIPUS)能产生经皮传递的非侵入性的机械能, 可以加快并加强新鲜骨折的愈合, 对于延迟愈合与骨不连有较好疗效。骨髓间充质干细胞(bone marrow stromal cells, BMSCs)是一类多能干细胞, 具有强大的增殖能力和多向分化潜能, 在骨折愈合过程中发挥重要作用。研究提示LIPUS促进BMSCs的成骨分化[3], 然而具体作用机制尚不清楚。瞬时受体电位M7(transient receptor potential melastatin 7, Trpm7)是机械敏感的质膜钙通道, 参与调节细胞的增殖、分化、迁移、粘附、凋亡等生理功能[4]。本研究探讨Trpm7是否在LIPUS促进BMSCs的成骨分化过程中发挥作用, 以期进一步理解LIPUS在调节BMSCs成骨分化中的分子细胞作用机制。
1 材料与方法 1.1 实验材料 1.1.1 细胞、材料和试剂LIPUS仪器为重庆融海超声医学工程研究中心有限公司研制; BMSCs为实验室保存, α-MEM培养基和胎牛血清、0.25%胰蛋白购自Gibco公司, 磷酸缓冲盐溶液(PBS)、β-甘油磷酸钠、地塞米松、抗坏血酸、3-异丁基-1-甲基黄嘌呤(IBMX)、吲哚美辛、胰岛素、1%茜素红染液(pH 4.2)购自Solarbio公司, 油红O染液购自北京雷根生物公司, ALP染色试剂盒、ALP化学发光检测试剂盒购自BD公司, 高纯度总RNA快速提取试剂盒购自离心柱型BioTeke公司, Real Master Mix购自TIANGEN公司, 苯甲基磺酰氟购自PMSF, Beyotime公司。Trpm7抑制剂2-APB、二甲基亚砜(DMSO)、兔抗小鼠OPN、兔抗小鼠RUNX2、抗-GAPDH抗体购自Sigma Aldrich公司, APC标记大鼠抗小鼠CD29抗体、APC标记大鼠抗小鼠Sca-1抗体、APC标记大鼠抗小鼠CD11b抗体和APC标记大鼠抗小鼠CD45抗体购自Biolegend公司。
1.1.2 普通培养基、成骨及成脂培养基的制备普通培养基:α-MEM培养基+10%胎牛血清; 成骨培养基:α-MEM培养基+10%胎牛血清+10 mmol/L β-甘油磷酸钠+0.1 μmol/L地塞米松+50 μg/mL抗坏血酸C。成脂培养基:α-MEM培养基+10%胎牛血清+1 μmol/L地塞米松+10 μg/mL胰岛素+200 μmol/L吲哚美辛+0.5 mmol/L IBMX。
1.2 方法 1.2.1 小鼠BMSCs的培养及鉴定出生6~8周龄C57BL/6小鼠, 无菌条件取小鼠股骨及胫骨, 两端剪断, 用一次性注射器吸取普通培养基反复冲洗骨髓腔, 收集冲洗液, 离心弃上清, 加入普通培养基37 ℃, 5%二氧化碳孵育箱培养, 48 h后换液。胰蛋白酶消化传第4代的BMSCs, PBS重悬细胞后流式细胞仪检测CD29、Sca-1、CD11b、CD45的表达。细胞传代后接种于24孔板, 分别加入成脂培养基和成骨培养基, 培养21 d后进行茜素红和油红O染色。
1.2.2 实验分组及培养方法将小鼠BMSCs以50%的密度接种于24孔板。普通培养基每孔1 mL培养2 d, 吸去培养液, PBS洗2次, 更换为成骨培养基每孔1 mL(以后均使用成骨培养基培养), 每3天更换1次。LIPUS作用强度为500 mW/cm2, 频率1 MHz, 占空比为20%[5]。LIPUS分别作用1、2、3、5 min, 每天1次, 确定最佳作用时间。随后分为对照组、LIPUS组、LIPUS+DMSO组(LIPUS+0.02% DMSO)和LIPUS+2-APB组(LIPUS+50 μmmoL/L 2-APB)。DMSO与2-APB在每隔3 d更换成骨培养基时重新添加。
1.2.3 ALP活性检测照射完毕后, 吸去培养液, PBS轻洗3遍; 每孔加入100 μL ALP裂解液, 室温裂解5 min; 将裂解后液体转移至1.5 mL EP管中, 13 000 r/min离心3 min; 取上清液5 μL至一新EP管中, 加入1×LVPO缓冲液15 μL、ALP底物共25 μL体系, 孵育30 min; 单管式发光检测仪读数。
1.2.4 实时PCR检测基因表达取ddH2O 4.5 μL、2.5×Real Master Mix7.5 μL(避光)和cDNA 2 μL混合于8联管中, 混匀, 离心。放入Bio-Rad CFX Manager仪器中进行检测。
1.2.5 ALP染色ALP染色均处理7 d。24孔板如需染色4个孔, 则需配制1 mL的ALP染色液(每孔250 μL)。需占总体积1/25的AS-MIX 40 μL、ddH2O 1 mL、FAST-BLUE粉末滴至溶液淡黄色即制成染色工作液。细胞用PBS洗2次, 4%多聚甲醛固定1 min, PBS洗涤1次, 配好的染色液加入孔板中, 37 ℃孵箱孵育30 min, 显微镜下观察; 染色至蓝紫色时, 吸出染色液, 加入100 μL PBS, 镜下观察。
1.2.6 茜素红染色茜素红染色均处理21 d。细胞用PBS洗2次, 4%多聚甲醛固定1 min, PBS洗涤1次, 1%茜素红染液加入24孔板中, 37 ℃孵箱孵育5 min, 显微镜下观察; 染色至橙红色时, 吸出染色液, 加入100 μL PBS, 镜下观察。
1.2.7 油红O染色细胞用PBS洗2次, 4%多聚甲醛固定1 min, 加入油红O染液, 室温孵育30 min, 吸出染色液, 加入100 μL PBS, 镜下观察。
1.2.8 Western blot检测细胞内蛋白的表达对照组、LIPUS组、LIPUS+DMSO组和LIPUS+2-APB组用PBS洗2遍后加入1 mL PBS收集细胞, 13 000 r/min, 离心5 min(此步骤可重复3次, 尽量多地收取细胞), 每组加入细胞裂解液120 μL和PMSF 1.2 μL, 混匀震荡放于冰上裂解, 每隔10 min反复震荡混匀, 共3次。BCA法测定蛋白浓度。每组取10 μL蛋白, 电转法将蛋白质转移至PVDF膜上, TBST洗5次, 每次3 min; 5%脱脂奶粉室温封闭1 h, 加入GAPDH抗体、OPN、RUNX2抗体(1 :1 000稀释), 4 ℃孵育过夜, TBST洗5次, 每次3 min, 再加入兔二抗, 室温孵育1 h后TBST洗涤5次, 每次3 min, 化学发光法显色。
1.3 统计学分析各实验均重复3次。采用SPSS 17.0统计软件处理数据, 计量资料数据以x±s表示, 组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 BMSCs的培养与鉴定细胞贴壁生长, 胞体呈圆形或多边形, 流式细胞仪检测第4代BMSCs细胞均不表达CD11b(0.628%)和CD45(1.75%), 但表达CD29和Sca-1, 纯度分别为99.8%和93.8%。成骨诱导分化7 d和21 d后, 可见ALP和茜素红染色明显, 成脂诱导21 d后, 油红O染色可见明显脂滴(图 1)。

|
| A:ALP染色; B:茜素红染色; C:油红O染色 图 1 小鼠BMSCs分化能力检测 (×100) |
2.2 LIPUS促进BMSCs成骨分化的时间参数优化
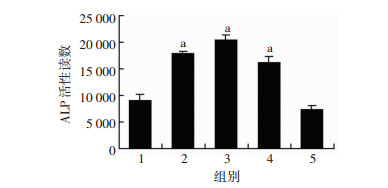
LIPUS处理每次1、2、3 min, 连续7 d后均见ALP活性读数明显升高(P < 0.05, 图 2), 每次处理5 min未见明显变化。其中处理2 min组ALP活性读数升高最为明显, 设定处理2 min为后续实验条件。
|
|
1:LIPUS未处理组(0 min时); 2~5:分别为LIPUS处理1、2、3、5 min组 a:P < 0.05, 与LIPUS未处理组(0 min时)比较 图 2 LIPUS处理不同时间时BMSCs ALP活性读数 |
2.3 LIPUS促进BMSCs成骨分化
对照组和LIPUS组照射3 d及7 d后进行ALP活性测定, LIPUS处理组较对照组ALP活性明显增高(P < 0.05)。7 d后进行ALP染色, LIPUS处理组中蓝紫色染色明显增加, 21 d后茜素红染色结果显示LIPUS处理组较对照组中红色钙结节明显增加(图 3)。这些结果提示LIPUS促进BMSCs早期和晚期成骨分化。

|
| A:LIPUS处理7 d和21 d后ALP染色和茜素红染色; B:LIPUS处理3 d和7 d后ALP活性读数 a:P < 0.05, 与3 d对照组比较; b:P < 0.05, 与7 d对照组比较 图 3 LIPUS对BMSCs成骨分化的影响 |
2.4 LIPUS促进BMSCs成骨相关基因的表达
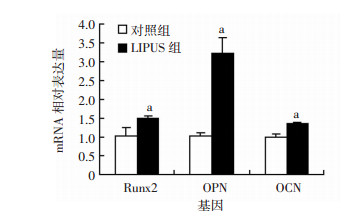
经LIPUS照射7 d后, 实时定量PCR检测, LIPUS处理组较对照组OPN、OCN、RUNX2 mRNA表达明显增加(P < 0.05, 图 4)。这说明LIPUS促进BMSCs成骨分化相关基因的表达。
|
| a:P < 0.05, 与对照组比较 图 4 实时定量PCR检测LIPUS处理对成骨分化基因Runx2、OPN和OCN表达的影响 |
2.5 LIPUS促进BMSCs成骨分化的过程中机械敏感离子通道Trpm7表达增加
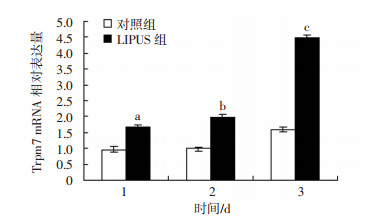
LIPUS处理1、2、3 d后Trpm7 mRNA表达水平较同时期对照组显著增加(P < 0.05, 图 5)。这提示BMSCs成骨分化的过程中LIPUS可以促进Trpm7表达增加。
|
| a:P < 0.05, 与1 d对照组比较; b:P < 0.05, 与2 d对照组比较; c:P < 0.05, 与3 d对照组比较 图 5 LIPUS照射下不同时间点Trpm7通道的mRNA表达 |
2.6 Trpm7通道抑制剂2-APB抑制LIPUS促成骨作用
LIPUS作用后能明显上调ALP的活性(P < 0.05), 25 μmol/L 2-APB作用下, ALP活性明显下降(P < 0.05, 图 6), 而400 μmol/L 2-APB作用时ALP活性下降最为明显。后续实验选取50 μmol/L 2-APB进行。

|
|
1:对照组; 2:LIPUS组; 3:LIPUS+DMSO组; 4~8:分别为25、50、100、200、400 μmol/L 2-APB组 a:P < 0.05, 与对照组比较; b:P < 0.05, 与LIPUS+DMSO组比较 图 6 不同浓度Trpm7通道抑制剂2-APB对LIPUS促成骨ALP活性的影响 |
2.7 Trpm7通道抑制剂2-APB抑制LIPUS促早期及晚期成骨分化
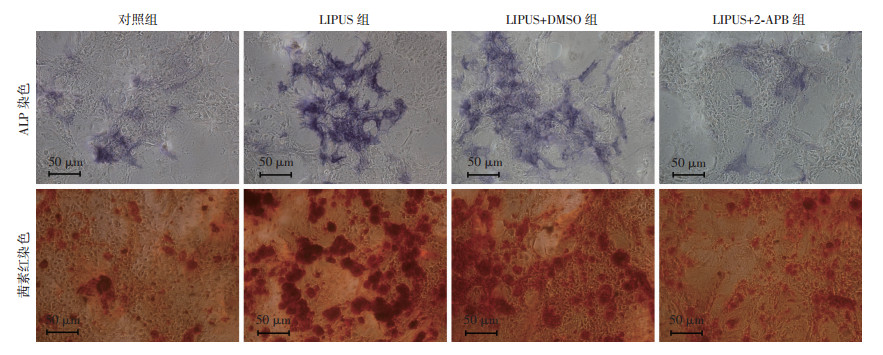
ALP染色与茜素红染色发现LIPUS组较对照组染色明显增多, 但LIPUS+2-APB组较LIPUS组、LIPUS+ DMSO组染色明显减少(图 7)。这说明Trpm7通道抑制剂2-APB抑制了LIPUS促早期及晚期成骨分化作用。
|
| 1:对照组; 2:LIPUS组; 3:LIPUS+DMSO组; 4:LIPUS+2-APB组 图 7 2-APB对LIPUS处理后BMSCs ALP染色和茜素红染色的影响 |
2.8 Trpm7通道抑制剂2-APB抑制LIPUS促成骨分化相关基因的蛋白表达
Western blot结果显示, 与对照组相比, LIPUS组、LIPUS+DMSO组中Trpm7和成骨分化相关基因OPN、Runx2的蛋白表达明显增加, 而50 μmoL/L 2-APB+LIPUS组与LIPUS组、LIPUS+DMSO组相比蛋白表达明显降低(图 8)。这说明抑制Trpm7通道可以减少LIPUS促成骨分化的作用。
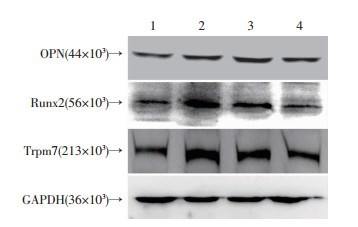
|
| 1:对照组;2:LIPUS组;3:LIPUS+DMSO组;4:LIPUS+2-APB组 图 8 Western blot检测LIPUS及2-APB对Trpm7和成骨分化相关蛋白表达的影响 |
3 讨论
骨折愈合是个复杂的生物学过程, 尽管现代骨科治疗技术不断发展, 仍有10%左右的骨折病例最终会发生延迟愈合或骨不连, 常需要植骨手术治疗[2]。骨愈合延迟的危险因素较多。因此, 需要寻求更加安全有效安全的加速骨折愈合的方法。研究发现一些生物物理疗法正在用于骨愈合过程中的辅助治疗[6]。LIPUS作为一种辅助治疗手段, 具有费用低、无电离辐射、简便、速度快和可携带等优点。临床研究已经证明低强度脉冲超声能加速骨折愈合并在治疗新鲜骨折中起着积极作用。因此, LIPUS被认为是促进骨折愈合的非侵入性声学手段[7]。超声作用的生物学效用与其参数包括强度、作用时间、占空比有关。研究发现超过1 W/cm2的强度会增加组织局部的温度, 尽管FDA批准30 mW/cm2的强度用于骨折愈合的治疗, 而更多研究致力于扩大治疗参数的范围, 增加超声强度并减少作用时间也能达到一定的效果[8-9]。本研究结果显示, 500 mW/cm2, 频率1 MHz, 作用2 min, 能有效促进小鼠BMSCs的成骨分化。
然而LIPUS是如何发挥作用的, 如何启动或激活骨折愈合的修复过程, 其潜在的调节机制并不清楚。BMSCs作为一种多能干细胞, 具有增殖、迁移、分化等功能。在骨折愈合的过程中, 骨折端募集足够数量的BMSCs并且进行有效的成骨分化是骨折愈合的前提条件和细胞学基础[10]。研究发现, 小鼠BMSCs在一定强度的LIPUS辐照下不仅可以提高早期反应基因瞬时表达, 同时能够加速骨分化标记基因骨黏连蛋白和骨桥蛋白表达, 提示LIPUS对成骨细胞谱系的分化有重要影响。在BMSCs的早期成骨分化阶段, 细胞高表达ALP。ALP活性作为成骨分化早期的一种标志。成熟的成骨细胞矿化活力显著增高, 钙结节沉积从而使细胞外基质矿化。故钙结节形成是检测晚期成骨的重要指标。本实验发现, 一定强度的超声处理能明显促进BMSCs的早期成骨分化, 持续作用21 d后导致晚期分化的形成。
细胞内外的力学微环境以及细胞机械力产生的机械信号对调控干细胞形态结构和功能发挥着重要作用。改变细胞外基质硬度、单纯压缩力、联合剪切力、牵张力和流体静压力等内源性和外源性应力均能不同程度地刺激间充质干细胞的成骨分化[11-13]。超声的生物学效应主要通过机械效应、热效应和空化效应发挥作用。在低强度超声中, 机械效应是作用于组织产生生物效应的主要因素。LIPUS以声波压的机械形式作用于BMSCs, 所产生的机械效应是促进成骨分化的主要因素。
细胞表面存在一些机械感应通道作用于细胞产生生物学效应[11]。Trpm7, 瞬时受体电位阳离子通道, 属于TRPM亚家族的一员。其羧基末端具有调节性激酶结构域[14-15], 是具有阳离子通道和蛋白激酶双重结构的膜蛋白, 因而也被称为“通道酶”, 广泛表达于心、肝、骨骼、脑等多种器官和组织中, 在骨髓来源的间充质干细胞和外周血干细胞中均有表达。研究表明Trpm7参与细胞分化, 在BMSCs成骨分化的过程中, Trpm7的表达增加, 而沉默Trpm7可以抑制成骨相关基因的表达。近年研究表明, 超声刺激细胞产生的生物学效应, 是通过细胞表面的一些离子通道介导的[16-17]。本实验发现, 在LIPUS处理促进BMSCs的成骨分化过程中, Trpm7的表达明显增加, 提示Trpm7参与LIPUS作用下BMSCs的成骨分化。
Trpm7作为一种机械敏感的质膜钙渗透性通道, 在机械刺激介导BMSCs成骨这一过程中发挥着积极作用, 可以介导胞质内钙增加, 上调BMSCs的Runx2的表达[18-19]。机械刺激可能激活与细胞骨架相连的Trpm7通道介导内质网的钙释放, 也可能Trpm7作为细胞膜上的信号效应器, 依赖于IP3信号通路介导ER上的钙通道开放。本实验发现, 在LIPUS应用下, 成骨分化相关蛋白表达增加伴随Trpm7表达明显增高; 而抑制Trpm7通道后则明显降低LIPUS促成骨分化相关蛋白的表达, 从而抑制LIPUS促进BMSCs成骨分化, 提示Trpm7在LIPUS促进BMSCs成骨分化中发挥重要作用。
LIPUS促进BMSCs成骨分化是一个复杂的生物学过程。本实验将机械敏感离子通道Trpm7与LIPUS促进BMSCs成骨分化过程联系起来, 不仅帮助理解LIPUS在刺激BMSCs成骨分化中的分子细胞作用机制, 也为临床上有效应用LIPUS治疗骨折愈合提供理论和应用基础。
| [1] | NOLTE P A, VAN DER KRANS A, PATKA P, et al. Low-intensity pulsed ultrasound in the treatment of nonunions[J]. J Trauma, 2001, 51(4): 693–703. DOI:10.1097/00005373-200110000-00012.x |
| [2] | UDDIN S M Z, QIN Y X. Enhancement of osteogenic differentiation and proliferation in human mesenchymal stem cells by a modified low intensity ultrasound stimulation under simulated microgravity[J]. PLoS ONE, 2013, 8(9): e73914. DOI:10.1371/journal.pone.0073914.x |
| [3] | ANGLE S R, SENA K, SUMNER D R, et al. Osteogenic differentiation of rat bone marrow stromal cells by various intensities of low-intensity pulsed ultrasound[J]. Ultrasonics, 2011, 51(3): 281. DOI:10.1016/j.ultras.2010.09.004.x |
| [4] | XIAO E, YANG H Q, GAN Y H, et al. TRPM7 senses mechanical stimulation inducing osteogenesis in human bone marrow mesenchymal stem cells[J]. Stem Cells, 2015, 33(2): 615–621. DOI:10.1002/stem.1858.x |
| [5] | MINHO Y, KITAEK L, PILLHOON C, et al. Application of ultrasound stimulation in bone tissue engineering[J]. Int J Stem Cells, 2010, 3(2): 74–79. DOI:10.15283/ijsc.2010.3.2.74 |
| [6] | PADILLA F, PUTS R, VICO L, et al. Stimulation of bone repair with ultrasound[J]. Adv Exp Med Biol, 2016, 880(1): 385–427. DOI:10.1007/978-3-319-22536-4_21 |
| [7] | POMINI K T, ANDREO J C, RODRIGUES ADE C, et al. Effect of low-intensity pulsed ultrasound on bone regeneration:biochemical and radiologic analyses[J]. J Ultrasound Med, 2014, 33(4): 713–717. DOI:10.7863/ultra.33.4.713 |
| [8] | ANGLE S R, SENA K, SUMNER D R, et al. Osteogenic differentiation of rat bone marrow stromal cells by various intensities of low-intensity pulsed ultrasound[J]. Ultrasonics, 2010, 51(3): 281–288. DOI:10.1016/j.ultras.2010.09.004 |
| [9] | SALGARELLA A R, CAFARELLI A, RICOTTI L. Optimal ultrasound exposure conditions for maximizing C2C12 muscle cell proliferation and differentiation[J]. Ultrasound Med Biol, 2017, 43(7): 1452–1465. DOI:10.1016/j.ultrasmedbio.2017.03.003 |
| [10] | MARSELL R, EINHORN T A. The biology of fracture healing[J]. Injury, 2011, 42(6): 551–555. DOI:10.1016/j.injury.2011.03.031 |
| [11] | KUO Y C, CHANG T H, HSU W T, et al. Oscillatory shear stress mediates directional reorganization of actin cytoskeleton and alters differentiation propensity of mesenchymal stem cells[J]. Stem Cells, 2015, 33(2): 429–442. DOI:10.1002/stem.1860.x |
| [12] | TAE-JIN K, CHIRLMIN J, JIHYE S, et al. Distinct mechanisms regulating mechanical force-induced Ca2+ signals at the plasma membrane and the ER in human MSCs[J]. Elife, 2015, 4(4): e04876. DOI:10.7554/eLife.04876.x |
| [13] | MONTELL C. The TRP superfamily of cation channels[J]. Sci STKE, 2005, 2005(272): re3. DOI:10.1126/stke.2722005re3.x |
| [14] | RYAZANOVA L V, HU Z, SUZUKI S, et al. Elucidating the role of the TRPM7 alpha-kinase:TRPM7 kinase inactivation leads to magnesium deprivation resistance phenotype in mice[J]. Sci Rep, 2014, 4: 7599. DOI:10.1038/srep07599.x |
| [15] | KAITSUKA T, KATAGIRI C, BEESETTY P, et al. Inactivation of TRPM7 kinase activity does not impair its channel function in mice[J]. Sci Rep, 2014, 4(4): 5718. DOI:10.1038/srep05718.x |
| [16] | IBSEN S, TONG A, SCHUTT C, et al. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans[J]. Nature Commun, 2015, 6: 8264. DOI:10.1038/ncomms9264.x |
| [17] | JAN K, SKI J, JON M, et al. Ultrasound modulates ion channel currents[J]. Sci Rep, 2016, 6: 24170. DOI:10.1038/srep24170.x |
| [18] | LIU Y S, LIU Y A, HUAMG C J, et al. Mechanosensitive TRPM7 mediates shear stress and modulates osteogenic differentiation of mesenchymal stromal cells through Osterix pathway[J]. Sci Rep, 2015, 5: 16522. DOI:10.1038/srep16522.x |
| [19] | YUE Y, YANG X, WEI X, et al. Osteogenic differentiation of adipose-derived stem cells prompted by low-intensity pulsed ultrasound[J]. Cell Prolif, 2013, 46(3): 320–327. DOI:10.1111/cpr.12035.x |



