2. 400016 重庆,重庆医科大学实验教学管理中心
2. Experimental Teaching Center, Chongqing Medical University, Chongqing, 400016, China
大气污染已成为人们广泛关注的热点问题。目前我国都市大气PM2.5污染已从传统的“煤烟燃烧型”向“尾气燃烧型”转化,汽车尾气、交通扬尘等交通相关性PM2.5已成为都市PM2.5污染的主要来源[1]。重庆市主城区是典型的山区河谷地形特征,大气环流稳定, 年均风速较低,大气扩散条件较差,污染现象更为突出。
传统PM2.5对肺部炎症因子的影响研究较多,但交通相关PM2.5的研究相对较少。以往的PM2.5染毒研究多采用气管切开滴注法,属侵入性操作,操作步骤复杂、步骤多,导致染毒效果受到实验动物麻醉状态、气道反应的个体差异、操作不确定性等因素的影响,使染毒剂量不同或药物在肺内分布不均。为了与PM2.5进入人体途径保持一致,本研究通过采集重庆市代表性交通要道及交通路口旁交通相关PM2.5,采用全身暴露染毒仪雾化吸入染毒法,模拟PM2.5进入人体的正常途径进行大鼠全身大剂量亚急性暴露染毒,评价交通相关PM2.5亚急性染毒暴露对大鼠肺部的急性损伤作用及肺部炎症因子表达的影响,初步探讨交通相关PM2.5的致病机制。
1 材料与方法 1.1 实验动物与分组清洁级雌性SD大鼠40只,体质量(180±10)g,由重庆医科大学实验动物中心提供[SCXK(渝)2012-001]。大鼠均未经生育交配,所有动物在室温(23±2)℃、相对湿度50%~70%、自然通风条件下饲养。日光灯模拟光照12 h,黑暗12 h,以清洁级饲料和净化水饲养,自由摄食和饮水,实验前在该实验室饲养1周适应环境。
1.2 仪器与试剂TH-1500型智能中流量空气采样器+PM2.5切割器(武汉天虹);玻璃纤维滤膜(φ=1 μm,德国Whatman);动物全身暴露装置(天津合普,8050 CFA);大鼠IL-2、IL-4、IL-6、TNF-α ELISA试剂盒(武汉博士德);TRIzol Reagent、TranStart Green qPCR Super Mix(北京全式金)。其余常规试剂均为国产分析纯。
1.3 PM2.5采集与混悬液制备参考严超等[2]的方法进行交通相关PM2.5的采样与混悬液制备。TH-1500型智能中流量空气采样器+PM2.5切割器,选择重庆市车流量较大、污染较重的交通主干道及交通路口(重庆市渝中区袁家岗路口、重庆市南岸区弹子石盘龙社区内环快速路旁)进行连续采样。采样时间2016年9月至2017年2月,采样条件:进气流量1 m3/min,24 h连续采样,每日更换滤膜,遇雨则暂停采样。根据中国空气质量在线监测分析平台数据,采样时间段内重庆市PM2.5浓度最高为88 μg/m3, 最低为22 μg/m3,平均值40.8 μg/m3。
将收集样本后的滤膜称重后,剪成1 cm×1 cm的方块,置于250 mL的广口玻璃瓶中,加入100 mL超纯水,将盛有剪好的滤膜和超纯水的广口瓶置于超声波清洗仪中,4 ℃恒温,超声清洗60 min后用8层纱布过滤,滤液于4 ℃、12 000 r/min,30 min离心。吸取上清液继续用于超声振荡,收集底层颗粒物,最后将浓缩的上清液及所有收集的沉淀合并,真空冷冻干燥48 h,冻干后得到灰黑色絮状物即为PM2.5。使用前将PM2.5粉末紫外照射30 min后用无菌磷酸盐缓冲液(phosphate buffer saline,PBS)配置成20 mg/mL的染毒母液备用。
1.4 染毒暴露组大鼠20只,经染毒柜适应环境3 d后,于每日下午14:00~16:00在全身暴露染毒装置染毒柜中进行连续染毒。染毒条件:PM2.5混悬液浓度0.2 mg/mL,染毒密闭舱容积500 L,混悬液雾化速度2.5 mL/min,进气流量1 m3/min。每天染毒2 h,连续染毒17 d。大鼠染毒剂量设定参照采样时间段内重庆市PM2.5浓度水平及GAVETT等[3]的方法,染毒舱内PM2.5浓度经换算峰值为120 μg/m3、平均值80~100 μg/m3,与采样时间段重庆市PM2.5污染水平高值相当或略高。经大鼠与人肺泡表面积、通风条件下的呼气量等校正参数校正后,该染毒剂量下每只大鼠每日经呼吸道摄入PM2.5约10.2 mg。染毒结束后暴露组大鼠与对照组大鼠饲养于同一环境中,对照组大鼠不做特殊处理。
1.5 样本采集与标本检测每日染毒结束后进行大鼠称质量,记录体质量变化。染毒期间密切观察大鼠一般情况,包括精神状况、有无毒性反应、饮食情况、外观变化及死亡等。
染毒结束后,大鼠常规乙醚麻醉、解剖板固定,用无菌生理盐水进行支气管肺泡灌洗,共5次,每次3 mL。合并回收的支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF),3 000 r/min离心20 min。离心后的细胞沉淀制作细胞涂片,瑞氏-吉姆萨复合染色,光镜下进行免疫细胞分类计数。上清液按照试剂盒说明书,ELISA法测定IL-2、IL-4、IL-6、TNF-α的含量。
处死大鼠,分离并剥取大鼠肺组织,一部分肺组织用10%福尔马林浸泡固定24h后,脱水、石蜡包埋,行病理切片、HE染色。另一部分肺组织快速液氮冷冻后置于-80 ℃冰箱保存备用。qPCR法检测肺组织中IL-1β、IL-4、IL-6、TNF-α mRNA的表达。TRIzol提取大鼠肺组织总RNA,mRNA反转录、荧光定量PCR仪进行qPCR分析。基因引物由上海生工合成,PCR反应条件: 94 ℃ 30 s,94 ℃ 5 s,60 ℃ 30 s,40个循环。引物序列如表 1。
| 炎症因子 | 引物 | 长度/bp |
| IL-1β | 正义链:5′-AACCTGCTGGTGTGTGACGTTC-3′ | 79 |
| 反义链: 5′-CAGCACGAGGCTTTTTTGTTGT-3′ | ||
| IL-4 | 正义链:5′-CGAGCTCACTCTCTGTGGTG-3′ | 79 |
| 反义链:5′-GAACGAGGTCACAGGAGAA-3′ | ||
| IL-6 | 正义链:5′-GCTGGAGTCACAGAAGGAG-3′ | 79 |
| 反义链:5′-GGCATAACGCACTAGGTTT-3′ | ||
| TNF-α | 正义链:5′-GCCAGCCGATGGGTTGTA-3′ | 148 |
| 反义链:5′-GGTTGACTTTCTCCTGGTATG-3′ | ||
| GAPDH | 正义链:5′-CTCATGACCACAGTCCATGC-3′ | 78 |
| 反义链:5′-GCTCTGGGATGACCTT-3′ |
1.6 统计学方法
计量资料以x±s表示,采用SPSS 18.0软件进行统计学分析。组间比较采用独立样本t检验。检验水准:α=0.05。
2 结果 2.1 各组大鼠一般情况及体质量变化情况染毒期间,对照组大鼠无明显异常,进食、饮水正常。暴露组大鼠染毒期间出现紧张、烦躁、易怒等表现,染毒后期出现相互追逐、撕咬。染毒结束后,大鼠精神萎靡、食欲不振,进食、进水明显少于对照组。经估算,对照组大鼠每日进食饲料20~25 g,实验组大鼠每日进食饲料10~12 g。表 1为染毒前、染毒3、10、17 d各组大鼠体质量情况,可见与对照组相比,PM2.5暴露对大鼠体质量影响明显,暴露组大鼠体质量明显低于对照组(P < 0.05,表 2)。
| 组别 | 染毒0 d | 染毒3 d | 染毒10 d | 染毒17 d |
| 对照组 | 184.75±6.71 | 192.75±5.61 | 211.08±5.40 | 268.65±9.37 |
| 暴露组 | 181.53±7.68 | 187.38±6.13 | 199.90±4.14 | 229.26±8.14 |
| t | 1.409 | 2.904 | 7.351 | 14.189 |
| P | 0.167 | 0.006 | 0.000 | 0.000 |
2.2 各组大鼠BALF免疫细胞分类计数比较
与对照组相比,暴露组大鼠BALF中炎症细胞总数、中性粒细胞数、单核/巨噬细胞数、淋巴细胞数均显著增多(P < 0.05,表 3)。
| 组别 | 总细胞数 | 粒细胞 | 淋巴细胞 | 单核/巨噬细胞 |
| 对照组 | 194.30±16.72 | 26.25±4.53 | 54.15±7.11 | 113.90±14.26 |
| 暴露组 | 931.10±52.94 | 148.65±23.13 | 232.35±21.81 | 547.20±31.18 |
| t | 59.350 | 23.223 | 34.746 | 56.518 |
| P | 0.000 | 0.000 | 0.000 | 0.000 |
2.3 交通相关PM2.5暴露对各组大鼠BALF炎症因子的影响
由表 3可见,与对照组相比,交通相关PM2.5暴露可导致暴露组大鼠BALF中IL-1β、IL-4、IL-6、TNF-α水平明显增高(P < 0.05,表 4)。
| 组别 | IL-1β | IL-4 | IL-6 | TNF-α |
| 对照组 | 56.18±3.36 | 16.43±0.42 | 28.37±2.27 | 58.45±3.48 |
| 暴露组 | 118.13±10.01 | 81.65±5.63 | 135.97±4.93 | 127.17±9.77 |
| t | 26.241 | 51.652 | 88.667 | 29.651 |
| P | 0.000 | 0.000 | 0.000 | 0.000 |
2.4 交通相关PM2.5暴露对各组大鼠肺组织炎症因子mRNA表达的影响
与对照组相比,交通相关PM2.5暴露可导致暴露组大鼠肺组织中IL-1β、IL-4、IL-6水平明显增高(P < 0.05);同时暴露组大鼠肺组织TNF-α mRNA水平明显降低(P>0.05,表 5)。
| 组别 | IL-1β | IL-4 | IL-6 | TNF-α |
| 对照组 | 1 | 1 | 1 | 1 |
| 暴露组 | 3.06±0.16 | 17.35±0.54 | 7.88±1.01 | 0.83±0.56 |
| t | 57.996 | 134.797 | 30.598 | 13.597 |
| P | 0.000 | 0.000 | 0.000 | 0.000 |
2.5 各组大鼠肺组织病理形态学改变
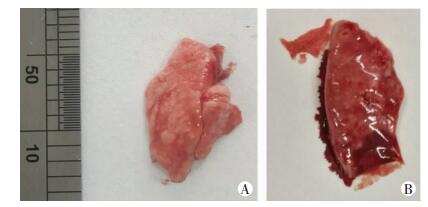
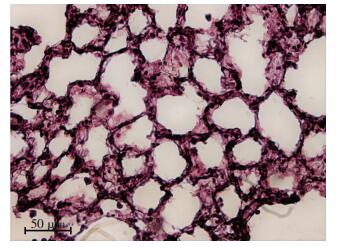
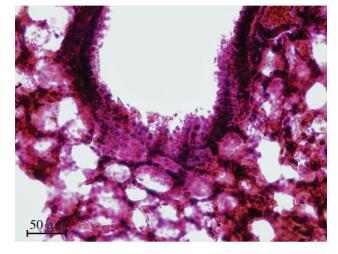
对照组大鼠肺组织呈粉红色、淡粉红色,质软,表面光滑,无明显异常,灌洗时回缩良好(图 1)。暴露组大鼠肺组织颜色较深,可见表面充血及散在出血点、白色斑点,部分大鼠肺底可见大片瘀血,灌洗时弹性减弱、回缩不良(图 1)。HE染色结果显示,对照组大鼠肺泡完整,肺泡壁无明显增厚,未见肺泡充血,无炎症细胞浸润(图 2)。暴露组大鼠肺泡间质增厚,肺内大量淋巴细胞、粒细胞浸润,肺泡间质增生(图 3)。
|
| 图 1 对照组(A)与PM2.5暴露组(B)大鼠肺组织大体观察 |
|
| 图 2 对照组大鼠肺部组织病理学变化(HE) |
|
| 图 3 暴露组大鼠肺部组织病理学变化(HE) |
3 讨论
雾霾与PM2.5污染目前已成为全球关注的热点健康问题,呼吸道是PM2.5等空气污染物进入人体的主要途径,呼吸系统也是主要受累器官。大量流行病学调查表明,PM2.5与肺炎、慢性阻塞性肺病、哮喘等呼吸系统疾病关系密切,可导致肺炎住院率增加和肺炎死亡率上升[4-5]。研究证实,PM2.5进入呼吸道后,可与支气管上皮细胞、肺泡巨噬细胞、肺上皮细胞等发生作用,刺激释放多种细胞因子,导致肺组织的炎症损伤[6-7]。细胞因子是由免疫细胞和非免疫细胞合成分泌的一类蛋白质,经自分泌或旁分泌发挥生物学活性,是反应机体免疫功能的一项敏感指标。
本实验结果显示,交通相关PM2.5暴露可导致大鼠肺部出现明显急性炎症反应,大鼠BALF中炎症细胞总数、淋巴细胞、单核/巨噬细胞、中性粒细胞数显著增加,IL-1β、IL-4、IL-6和TNF-α水平显著增高,肺组织IL-1β、IL-4、IL-6 mRNA表达水平增高,而TNF-α mRNA表达水平略有下降。IL-1β是IL-1家族中最重要的成员,也是重要的前炎症因子,可以直接介导炎症反应的产生,也可以通过诱导环氧化酶2、IL-6等其他炎性因子的表达,进一步激活更多炎症细胞因子,扩大机体炎症反应[8]。IL-4由Th2细胞分泌,是一种多效细胞因子,对B细胞、T细胞、肥大细胞等都有调节作用,可以通过诱导释放促炎症因子协调局部组织炎症[9]。IL-6是重要的炎症细胞因子,可诱导急性期炎症反应的产生、增强白细胞聚集、渗透,同时又可增强组织细胞对TNF-α的敏感性[10]。TNF-α主要由活化的单核巨噬细胞产生,是重要的炎症细胞因子,在启动和维持炎症中起到重要的作用[11]。研究发现,交通相关PM2.5可诱导大鼠释放大量炎症细胞因子、诱导炎症细胞增生聚集、刺激炎症反应产生。组织病理学检查亦证实,暴露组大鼠肺组织出现大量粒细胞、淋巴细胞及单核巨噬细胞等炎性细胞浸润、肺泡间质增生等炎症表现。传统煤炭燃烧型PM2.5主要成分以SO42-、NH4+、NO3-等可溶性离子以及Zn、Cu、Ni等过渡金属为主,而交通相关PM2.5则富含有机碳(OC)、元素碳(EC)、Pb、Cd等重金属以及苯并[b]荧蒽和苯并[k]荧蒽、苯并芘、1, 12-苯并芘等多环芳烃。目前认为交通相关PM2.5导致炎症细胞因子增高的机制可能包括颗粒物表面附着的重金属、多环芳烃等化学物质可诱导产生大量氧自由基,氧自由基可诱导产生大量炎症因子;而IL-6、TNF-α、IL-1β等炎症细胞因子除了可引起肺上皮细胞炎症反应外,还可进一步刺激其他炎症细胞因子的分泌,扩大机体炎症反应[12]。其中多环芳烃类物质可能起到了重要的作用。多环芳烃是一类重要的环境污染物,研究发现苯并芘(benzopyrene, BaP)可通过释放TNF-α、IL-1、IL-6等与EGFR受体结合,激活EGFR信号通路,诱导炎症损伤的发生。而环境浓度下的苯并[b]荧蒽对巨噬细胞RAW264.7具有一定的毒性作用,能够引起RAW264.7细胞产生氧化应激,激活炎症反应,降低巨噬细胞的吞噬能力[13]。
动物体质量是反应动物生长发育和一般情况的重要指标,可用于反映交通相关PM2.5暴露对大鼠健康的宏观影响。本研究发现,交通相关PM2.5暴露对大鼠体质量有明显影响,暴露组大鼠食欲下降、进食进水量减少,体质量增长明显低于对照组。这一结果国内其他类似研究结果相同。严超等[2]报道PM2.5与长期暴露可导致大鼠体质量下降,其原因可能为多脏器功能受损后导致的大鼠发育不良。本研究采用全身雾化染毒方法,部分PM2.5附着于大鼠毛皮,可能通过舔舐、梳毛等动作直接进入消化道,对大鼠消化系统产生直接损伤作用,导致营养吸收不良、体质量下降。PM2.5导致的大鼠体质量下降可能与染毒剂量有关,于莹莹等[14]、巨英超等[15]的研究由于染毒剂量较低,未发现PM2.5对大鼠体质量增长产生明显影响。此外,染毒期间暴露组大鼠还表现出烦躁、易怒等表现,说明除了呼吸系统外,交通相关PM2.5还可能对大鼠神经系统产生一定作用。
气管滴注法和雾化吸入法均是呼吸道给药、呼吸道疾病建模的常用研究方法。气管滴注法分为非暴露式和暴露式,以往的PM2.5染毒多采用暴露式气管滴注方法。苑少欣等[16]报道,暴露式气管滴注法为有创侵入性操作,产生的肺部炎症局限于滴注点附近,不能模拟感染的真实过程,即使通过气管滴注无菌生理盐水也可使小鼠肺湿重/干重比值、BALF总蛋白浓度、促炎细胞因子等参数显著升高,说明气管滴注法本身即可对机体造成刺激,产生较高严重背景。而雾化吸入法能够模拟患者与PM2.5接触的自然途径,且SMITH等[17]研究发现,雾化吸入较低剂量的脂多糖即可产生明显的肺部炎症和气道上皮化生现象。本研究采用全身口鼻吸入染毒系统代替传统气管滴注法进行PM2.5染毒。与气管滴注法相比,全身动态吸入染毒更接近人体吸入PM2.5的途径,且能够有效避免气管切开滴注导致的后续感染、死亡等缺点,染毒结果表明交通相关PM2.5短期大剂量暴露可导致大鼠肺部出现明显炎症反应。
| [1] | US Environmental Protection Agency (EPA). Health effects assessment document for diesel engine exhaust[R]. EPA/600/8 90/057FS. National Center for Environmental Assessment, Office of Research and Development Washington, DC: U. S. EPA, 2002. |
| [2] |
严超, 曹希宁, 沈炼桔, 等. 汽车尾气来源PM_(2.5)长期暴露导致大鼠多器官损害[J].
重庆医科大学学报, 2015, 40(6): 844–849.
YAN C, CAO X N, SHEN L J, et al. Long exposure to automobile exhaust source PM2.5 leads to inflammatory injury of multiple organs in SD rats[J]. J Chongqing Med Univ, 2015, 40(6): 844–849. DOI:10.13406/j.cnki.cyxb.000647 |
| [3] | GAVETT S H, HAYKAL-COATES N, HIGHFILL J W, et al. World trade center fine particulate matter causes respiratory tract hyperresponsiveness in mice[J]. Environ Health Perspect, 2003, 111(7): 981–991. DOI:10.1289/ehp.5931 |
| [4] | MA M, LI S, JIN H, et al. Characteristics and oxidative stress on rats and traffic policemen of ambient fine particulate matter from Shenyang[J]. Sci Total Environ, 2015, 526: 110–115. DOI:10.1016/j.scitotenv.2015.04.075 |
| [5] | DOMINICI F, PENG R D, BELL M L, et al. Fine particulate air pollution and hospital admission for cardiovascular and respiratory diseases[J]. JAMA, 2006, 295(10): 1127–1134. DOI:10.1001/jama.295.10.1127 |
| [6] | LUO B, LIU J, FEI G, et al. Impact of probable interaction of low temperature and ambient fine particulate matter on the function of rats alveolar macrophages[J]. Environ Toxicol Pharmacol, 2017, 49: 172–178. DOI:10.1016/j.etap.2016.12.011 |
| [7] | LI R, KOU X, XIE L, et al. Effects of ambient PM 2.5, on pathological injury, inflammation, oxidative stress, metabolic enzyme activity, and expression of c-fos and c-jun in lungs of rats[J]. Environ Sci Pollut Res, 2015, 22(24): 1–10. |
| [8] | CHEN M F, LU M S, CHEN P T, et al. Role of interleukin 1 beta in esophageal squamous cell carcinoma[J]. J Mol Med, 2012, 90(1): 89–100. DOI:10.1007/s00109-011-0809-4 |
| [9] | ANOVAZZI G, MEDEIROS M C, PIGOSSI S C, et al. Functionality and opposite roles of two interleukin 4 haplotypes in immune cells[J]. Genes Immun, 2017, 18(1): 33–41. DOI:10.1038/gene.2016.47 |
| [10] | MIKOWSKA P, POPKO K, DEMKOW U, et al. Pro-inflammatory cytokines in psychiatric disorders in children and adolescents: a review[J]. Oxygen Transport to Tissue XXXⅢ, 2017: 1–8. |
| [11] | LUAN Z G, ZHANG J, YIN X H, et al. Ethyl pyruvate significantly inhibits tumour necrosis factor-α, interleukin-1β and high mobility group box 1 releasing and attenuates sodium taurocholate-induced severe acute pancreatitis associated with acute lung injury[J]. Clin Exp Immunol, 2013, 172(3): 417–426. DOI:10.1111/cei.12062 |
| [12] | MA Q Y, HUANG D Y, ZHANG H J, et al. Exposure to particulate matter 2.5 (PM2.5) induced macrophage-dependent inflammation, characterized by increased Th1/Th17 cytokine secretion and cytotoxicity[J]. Int Immunopharmacol, 2017, 50: 139–145. DOI:10.1016/j.intimp.2017.06.019 |
| [13] |
杨金焕, 宗磊, 贡晨雪, 等. 环境浓度水平的苯并[b]荧蒽对巨噬细胞RAW264.7的作用[J].
环境科学学报, 2017, 37(3): 1133–1138.
YANG J H, ZONG L, GONG C X, et al. Effects of benzo[b]. fluoranthene on RAW264.7 cells at environmental concentration level[J]. Acta Sci Circum, 2017, 37(3): 1133–1138. DOI:10.13671/j.hjkxxb.2016.0237 |
| [14] |
于莹莹, 吴辉, 宋宏. 机动车尾气对大鼠支气管肺泡灌洗液影响的研究[J].
环境与健康杂志, 2009, 26(9): 780–782.
YU Y Y, WU H, SONG H. Effect of motor vehicle exhaust of main urban roadside on the inflammatory response in the airway of rats[J]. J Environment Health, 2009, 26(9): 780–782. DOI:10.16241/j.cnki.1001-5914.2009.09.035 |
| [15] |
巨英超, 刘亮, 贺宇彤, 等. 大气细颗粒物PM_(2.5)致Wistar大鼠肺部病变的研究[J].
肿瘤防治研究, 2017, 44(10): 652–658.
JU Y C, LIU L, HE Y T, et al. Pulmonary lesions of wistar rats induced by atmospheric particulate PM2.5[J]. Cancer Res Prev Treat, 2017, 44(10): 652–658. DOI:10.3971/j.issn.1000-8578.2017.17.0272 |
| [16] |
苑少欣, 孔雅娴, 李蕊, 等. 气管滴注法与雾化吸入法建立小鼠急性肺损伤模型及其效果比较[J].
中华实验和临床感染病杂志(电子版), 2014, 8(2): 8–12.
YUAN S X, KONG Y X, LI R, et al. Establishment and effectiveness comparison of mouse models of acute lung injury by intratracheal instillation and aerosol inhalation[J]. Chin J Exp Clin Infect Dis (Electron Vers), 2014, 8(2): 8–12. DOI:10.3877/cma.j.issn.1674-1358.2014.02.003 |
| [17] | SMITH K R, LEONARD D, MCDONALD J D, et al. Inflammation, mucous cell metaplasia, and Bcl-2 expression in response to inhaled lipopolysaccharide aerosol and effect of rolipram[J]. Toxicol Appl Pharmacol, 2011, 253(3): 253–260. DOI:10.1016/j.taap.2011.04.001 |



