2. 32224美国佛罗里达州,美国Mayo Clinic肿瘤生物系
2. Department of Cancer Biology, Mayo Clinic, Florida, USA, 32224
急性胰腺炎(acute pancreatitis, AP)是一种临床常见疾病,目前在西方国家的年发病率约为30/10万,其中重症急性胰腺炎占15%~20%[1-2]。由于对该疾病的发病机制认识不足,临床上仍然缺乏特异而有效的治疗方法及预防手段[3]。一般认为急性胰腺炎主要是由于胰腺分泌的消化酶自我消化胰腺及其周围组织而导致的严重急性炎症反应,从而继发一系列的器官功能障碍。到目前为止,胰腺消化酶一直是国内外胰腺炎领域研究中一个主要关注热点[4-7]。卡莫司他,化学名称为4-(4-胍基苯酰氧基)苯乙酸-N, N-二甲基氨基甲酰甲酯甲磺酸盐,是一种非肽类蛋白酶抑制剂。已有药理实验表明,卡莫他司对胰蛋白酶、激肽释放酶、纤维蛋白溶酶有很强的抑制作用[8]。推断摄入卡莫司他可能会通过抑制体内胰蛋白酶原活化,抑制急性胰腺炎的发生发展。本研究以雨蛙素腹腔注射法建立急性胰腺炎小鼠模型,用卡莫司他灌胃法进行治疗干预,观察卡莫司他对急性胰腺炎的治疗效果,以期为阐释急性胰腺炎的发生机制和临床治疗方向进一步提供依据。
1 材料与方法 1.1 实验动物及主要试剂C57BL/6J小鼠由海军军医大学(第二军医大学)动物实验中心提供,均为雄性,8~10周龄,体质量约20 g。实验用小鼠在12 h/12 h光照周期下饲养于海军军医大学(第二军医大学)动物实验中心SPF级动物实验室,自由进食及饮水。血清淀粉酶试剂购于Magle Life Science公司,卡莫司他购于Santa Cruz公司,雨蛙素试剂购于Sigma公司。
1.2 主要方法 1.2.1 急性胰腺炎小鼠模型雄性C57BL/6J小鼠18只,应用随机数字表法将小鼠随机分为3组(n=6),即对照组,非治疗组和治疗组。各组小鼠自由饮水条件下禁食12 h。非治疗组和治疗组每只小鼠腹腔注射雨蛙素水溶液的量为50 μg/kg,每小时注射1次,连续注射10次。对照组同法腹腔注射生理盐水。治疗组每只小鼠在注射雨蛙素3 h后进行第1次卡莫司他灌胃,12 h后进行第2次灌胃治疗,卡莫司他水溶液的灌胃剂量为350 mg·kg-1·d-1,共灌胃2次。非治疗组和对照组小鼠同法进行生理盐水灌胃。所有小鼠在注射雨蛙素24 h后处死。
1.2.2 行为学观察分别观察并记录对照组、非治疗组和治疗组小鼠在接受雨蛙素腹腔注射前后行动敏捷度、进食及饮水量、对外界刺激反应灵敏度等行为学的变化。
1.2.3 胰腺/体质量的计算于第1次雨蛙素注射24 h后处死小鼠,记录小鼠体质量(以g为单位);解剖腹部取小鼠胰腺组织,记录其胰腺肉眼观察形态、颜色、质地等性状,称量胰腺组织质量(以mg为单位);计算出胰腺/体质量(mg/g)。随后将胰腺组织置于10%福尔马林溶液中,用于组织病理学研究。
1.2.4 血清淀粉酶含量测定于第1次雨蛙素注射24 h后,即处死小鼠之前,对每只小鼠进行眶静脉取血约500 μL,肝素抗凝,离心分离血浆,取上层血清10 μL用于测定淀粉酶。测定血清淀粉酶水平的详细操作方法参考试剂盒说明书。分别记录各组所测得波长为620 nm时的光密度值[D(620)]。
1.2.5 HE染色及组织病理学评分新鲜胰腺组织10%福尔马林溶液固定24 h,系列乙醇脱水、二甲苯透明,石蜡包埋,4 ℃冷却,4 μm连续切片,组织切片在60 ℃烘箱内烤片过夜,二甲苯脱蜡15 min,2次,依次在100%、95%、90%、85%的乙醇中浸泡5 min,蒸馏水浸泡3 min,苏木精染色5 min,自来水漂洗5 min,盐酸酒精分化液30 s,自来水冲洗15 min,返蓝,伊红染色1 min,依次过80%、95%、100%的乙醇,各2 min,二甲苯2次,各2 min,通风橱风干,中性树脂封片。在光学显微镜下,每张切片随机选择5个高倍镜视野(×200),按照Schmidt标准[9]从水肿、出血、坏死及炎症细胞浸润4个方面进行双盲评分来确定组织病理学的变化。
1.2.6 免疫组织化学染色将新鲜胰腺组织标本固定、脱水、石蜡包埋、切片后,将组织切片在60 ℃烘箱内烤片过夜;二甲苯脱蜡2次,各15 min;100%、95%、85%、70%、50%浓度梯度乙醇依次浸泡,各5 min;PBS洗涤3次,各5 min;玻片架置于预热抗原修复液中,沸水孵育25 min;取出玻片架于室温冷却,注意防止干片;PBS洗涤3次,各5 min;3%过氧化氢溶液阻断内源性过氧化物酶活性,15 min;PBS洗涤3次,各5 min;1%胎牛血清封闭液室温封闭30 min;PBS洗涤3次,各5 min;浓度为1 :2 000的CD11b抗体4 ℃孵育过夜,室温复温,PBS洗涤3次,各5 min,二抗室温孵育40 min,PBS洗涤3次,各5 min;DAB显色,显微镜镜下观察控制显色时间,PBS冲洗终止反应,苏木精衬染5 min,流水冲洗2 min,依次过80%、95%、100%乙醇各2 min;二甲苯浸泡2次,各2 min;通风橱风干,中性树脂封片。
1.3 统计学处理采用SPSS 17.0统计软件处理数据,计量资料数据以x±s表示,两组数据之间的比较采用独立student t检验进行统计学分析,以P<0.05为差异有统计学意义。
2 结果 2.1 行为学改变对照组小鼠行动敏捷,进食及饮水基本正常,对外界刺激反应灵敏;未治疗组和治疗组小鼠在接受雨蛙素注射后,出现行动迟缓,进食及饮水减少,对外界刺激反应迟钝等行为学变化;而治疗组在接受卡莫司他灌注治疗后,行动灵敏程度增加,进食及饮水恢复正常,对外界刺激反应灵敏度增加。
2.2 胰腺质量/体质量肉眼下见对照组小鼠胰腺组织呈淡粉红色,薄片状,颜色均匀一致,光泽度好,无水肿及出血,胰腺质量/体质量值为(10.94±0.26)mg/g;未治疗组胰腺组织颜色晦暗,明显水肿,有的可见片状出血,与胰腺周围脏器有粘连,胰腺质量/体质量值为(15.64±0.74) mg/g;治疗组小鼠胰腺组织呈淡粉红色,轻度水肿,少有出血,与周围脏器粘连较少,胰腺质量/体质量值为(11.90±0.70)mg/g,其中未治疗组与治疗组比较差异有统计学意义(P=0.004),对照组与治疗组比较差异没有统计学意义(图 1)。
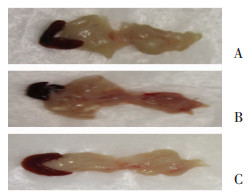
|
| 图 1 对照组(A)、非治疗组(B)和治疗组(C)C57BL/6J小鼠胰腺组织的大体标本观察 |
2.3 血清淀粉酶浓度
对照组小鼠血清淀粉酶D(620)值为(0.690±0.028),未治疗组为(0.910±0.057),治疗组为(0.840±0.063),其中未治疗组与卡莫司他治疗组比较差异有统计学意义(P=0.392),治疗组和对照组比较差异没有统计学意义(P>0.05)。
2.4 胰腺组织病理染色及评分光学显微镜下可见对照组小鼠胰腺形态学基本正常,结构相对完好,无炎症改变;未治疗组小鼠注射雨蛙素后胰腺出现水肿的病理改变,胰腺组织小叶间隙增宽、结构紊乱,腺泡细胞局限性或广泛性坏死,小叶间及坏死灶内有炎性细胞浸润。而治疗组胰腺形态学结构接近对照组小鼠,胰腺细胞水肿、坏死、炎症细胞浸润均比未治疗组减轻(图 2)。未治疗组与对照组的组织病理学评分比较差异有统计学意义(10.33±0.33 vs 0.33±0.21,P<0.05),而治疗组的病理学评分(3.83±0.31)也明显低于未治疗组(P<0.05)。
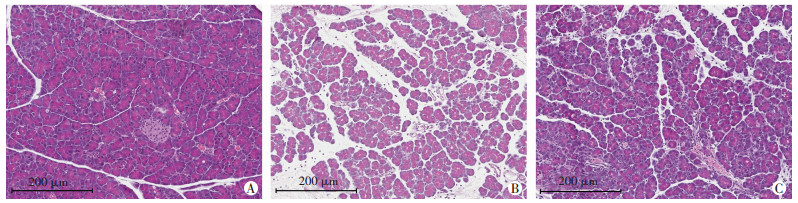
|
| A:对照组;B:非治疗组;C:治疗组 图 2 高倍镜下各组C57BL/6J小鼠胰腺组织的HE病理组织切片典型表现 |
2.5 CD11b在胰腺组织中的表达
由图 3可见,非治疗组的小鼠胰腺组织中CD11b的表达水平明显高于对照组和治疗组。
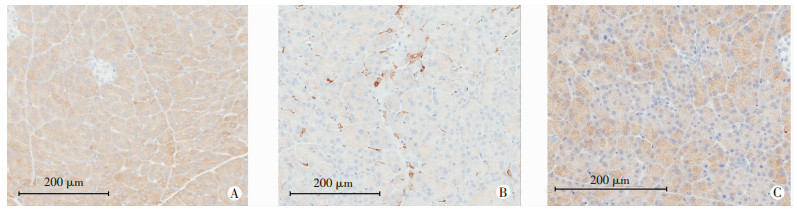
|
| A:对照组;B:非治疗组;C:治疗组 图 3 高倍镜下各组C57BL/6J小鼠胰腺组织中CD11b表达水平的比较 |
3 讨论
随着人们生活水平的提高和饮食、生活习惯的改变,急性胰腺炎的发病率逐年升高。其中15%~20%的患者可进展为重症急性胰腺炎,重症急性胰腺炎的病死率高达10%~20%,给患者带来了极大的精神和经济压力。急性胰腺炎的早期诊断和治疗是降低病死率的关键。胰蛋白酶原的活化引起急性胰腺炎的说法目前仍然存在很大的争议。GAISER等[10]认为胰蛋白酶原的活化可促进加重急性胰腺炎的发生发展。而DAWRA等[11]通过基因敲除鼠特异性胰蛋白酶原7后,发现胰蛋白酶总量减少了60%,虽然急性胰腺炎腺泡损伤明显减轻,但是全身及局部炎症反应缓解并不明显,其可能的机制可能并不依赖胰蛋白酶活化[12]。该研究通过对小鼠胰腺炎的干预治疗,初步得出的实验结论可以为证明胰蛋白酶活化在胰腺炎机制中的作用提供一定的理论依据。
目前国内临床在治疗胰腺炎方面主要以禁食、胃肠减压、抗炎止痛等对症支持治疗为主,并无特异有效的药物,部分生物制剂的疗效好坏不一,不够稳定[13]。日本学者EMORI等[14]用动物实验证明卡莫司他可减轻慢性胰腺炎的炎症,缓解慢性胰腺炎相关症状,但目前为止仍未有关于卡莫司他治疗急性胰腺炎的报道。本实验采用胰腺质量/体质量值反映胰腺水肿程度,血清淀粉酶水平可反映急性胰腺炎严重程度,结果显示卡莫司他治疗组小鼠的胰腺质量/体质量值明显低于非治疗组,而血清淀粉酶略低于非治疗组,可能与实验对象数量不够或者实验操作过程中产生的误差有关,也有可能与卡莫司他的药物生物利用度、是否存在体内其他作用机制相关,这仍需要大量基础动物、细胞和分子实验研究来进一步证实。
胰蛋白酶的功能主要是降解蛋白,激活其他各种消化酶的活性,从而引发一系列蛋白降解反应,腺泡细胞内的胰蛋白酶原的活化是诱发胰腺炎的关键因素。CD11b通常在单核细胞、巨噬细胞、淋巴细胞、粒细胞等炎症细胞表面表达,是常用于反映急性胰腺炎炎症程度的细胞因子。本实验也验证了雨蛙素诱导的急性胰腺炎导致大量的炎症细胞浸润,而胰蛋白酶抑制剂卡莫司他则明显减轻炎症细胞的浸润程度。大量实验[15-16]表明急性胰腺炎可能与NF-κB活化、细胞凋亡信号、内质网应激、非蛋白折叠反应相关,关于胰蛋白酶活化中心学说现在仍然存有争议,而本实验发现了卡莫司他对急性胰腺炎的治疗作用,可通过检测NF-κB、细胞凋亡信号、内质网应激、非蛋白折叠反应等信号通路关键分子的表达水平的变化进一步探究急性胰腺炎的发病机制。
| [1] | PANDOL S J, SALUJA A K, IMRIE C W, et al. Acute pancreatitis: bench to the bedside[J]. Gastroenterology, 2007, 132(3): 1127–1151. DOI:10.1053/j.gastro.2007.01.055 |
| [2] | SAH R P, DAWRA R K, SALUJA A K. New insights into the pathogenesis of pancreatitis[J]. Curr Opin Gastroenterol, 2013, 29(5): 523–530. DOI:10.1097/MOG.0b013e328363e399 |
| [3] | TONSI A F, BACCHION M, CRIPPA S, et al. Acute pancreatitis at the beginning of the 21st century: the state of the art[J]. World J Gastroenterol, 2009, 15(24): 2945–2959. DOI:10.3748/wjg.15.2945 |
| [4] | XUE J, SHARMA V, HABTEZION A. Immune cells and immune-based therapy in pancreatitis[J]. Immunol Res, 2014, 58(2-3): 378–386. DOI:10.1007/s12026-014-8504-5 |
| [5] | SKIPWORTH J R, NIJMEIJER R M, VAN SANTVOORT H C, et al. The effect of renin angiotensin system genetic variants in acute pancreatitis[J]. Ann Surg, 2015, 261(1): 180–188. DOI:10.1097/SLA.0000000000000655 |
| [6] | JI B, GAISER S, CHEN X, et al. Intracellular trypsin induces pancreatic acinar cell death but not NF-kappaB activation[J]. J Biol Chem, 2009, 284(26): 17488–17498. DOI:10.1074/jbc.M109.005520 |
| [7] | JAGANNATH S, GARG P K. Novel and Experimental Therapies in Chronic Pancreatitis[J]. Dig Dis Sci, 2017, 62(7): 1751–1761. DOI:10.1007/s10620-017-4604-0 |
| [8] | ISHIKURA H, NISHIMURA S, MATSUNAMI M, et al. The proteinase inhibitor camostat mesilate suppresses pancreatic pain in rodents[J]. Life Sci, 2007, 80(21): 1999–2004. DOI:10.1016/j.lfs.2007.02.044 |
| [9] | MASSON E, LE M C, CHANDAK G R, et al. Trypsinogen copy number mutations in patients with idiopathic chronic pancreatitis[J]. Clin Gastroenterol Hepatol, 2008, 6(1): 82–88. DOI:10.1016/j.cgh.2007.10.004 |
| [10] | GAISER S, DANILUK J, Liu Y, et al. Intracellular activation of trypsinogen in transgenic mice induces acute but not chronic pancreatitis[J]. Gut, 2011, 60(10): 1379–1388. DOI:10.1136/gut.2010.226175 |
| [11] | DAWRA R, SAH R P, DUDEJA V, et al. Intra-acinar trypsinogen activation mediates early stages of pancreatic injury but not inflammation in mice with acute pancreatitis[J]. Gastroenterology, 2011, 141(6): 2210–2217. DOI:10.1053/j.gastro.2011.08.033 |
| [12] | SAH R P, SALUJA A K. Trypsinogen activation in acute and chronic pancreatitis: is it a prerequisite[J]. Gut, 2011, 60(10): 1305–1307. DOI:10.1136/gut.2011.241703 |
| [13] | YADAV D, LOWENFELS A B. The epidemiology of pancreatitis and pancreatic cancer[J]. Gastroenterology, 2013, 144(6): 1252–1261. DOI:10.1053/j.gastro.2013.01.068 |
| [14] | EMORI Y, MIZUSHIMA T, MATSUMURA N, et al. Camostat, an oral trypsin inhibitor, reduces pancreatic fibrosis induced by repeated administration of a superoxide dismutase inhibitor in rats[J]. J Gastroenterol Hepatol, 2005, 20(6): 895–899. DOI:10.1111/j.1440-1746.2005.03826.x |
| [15] | SANCHEZ-ALVAREZ M, M A DEL POZO, C BAKAL. AKT-mTOR signaling modulates the dynamics of IRE1 RNAse activity by regulating ER-mitochondria contacts[J]. Sci Rep, 2017, 7(1): 1–15. DOI:10.1038/s41598-016-0028-x |
| [16] | LU M, LAWRENCE D A, MARSTERS S, et al. Opposing unfolded-protein-response signals converge on death receptor 5 to control apoptosis[J]. Science, 2014, 345(6192): 98–101. DOI:10.1126/science.1254312 |



