感音神经性耳聋(sensorineural hearing loss, SNHL)是人类最常见的致残性感觉障碍性疾病, 耳蜗内毛细胞带状突触结构、形态、数量和功能的异常均会导致感音神经性聋的发生。人类听觉信号精确高效的传递, 需要内耳毛细胞突触通过胞吐作用以囊泡形式释放神经递质, 然后通过内吞作用回收囊泡膜及相关蛋白, 从而实现囊泡的补充以及循环再利用。当内吞作用受阻时, 则不能维持细胞膜正常形态以及足够的囊泡分泌。研究表明, Dynamin在网格蛋白介导的囊泡内吞过程中发挥"剪刀"作用, 将网格蛋白包被的小泡与质膜分离[1], Dynamin缺失会引起囊泡内吞缺陷, 导致突触囊泡数量减少, 释放神经递质的能力减弱[2]。Dynamin有3个亚型:Dynamin-1、Dynamin-2、Dynamin-3, 分别由Dnm1、Dnm2、Dnm3基因编码。BOUMIL等[3]研究发现Dynamin-1突变鼠在3周龄即出现听力缺陷、癫痫发作等症状; 且Dynamin-1在神经系统中高度表达[4]。因此, Dynamin-1可能在听信号的传递过程中起着至关重要的作用。微小RNA(microRNA, miRNA)通过抑制靶基因翻译或者降解靶基因发挥调控基因表达的作用, 在耳蜗遭受各种压力时, miRNA的表达会发生变化。这些变化最终导致细胞死亡和感音神经性聋的发生[5]。生物信息学分析以及相关报道显示miR-140可能对Dynamin-1有靶向调控作用[6]。因此, 本研究采用免疫荧光染色和原位杂交法明确Dynamin-1与miR-140的表达定位情况, 用双荧光素酶法验证Dnm1是否是miR-140靶基因, 携带miR-140的腺相关病毒(adeno-associated virus, AAV)转染耳蜗后14 d检测小鼠耳蜗中Dnm1基因的mRNA水平及蛋白水平的表达变化, 为后续研究miR-140调控Dynamin-1影响内毛细胞突触囊泡内吞过程奠定实验基础。
1 材料与方法 1.1 实验材料 1.1.1 实验动物8周龄健康C57BL/J小鼠, 雌雄不限, 耳廓反射灵敏, 排除中耳及内耳疾病, 体质量22 g左右, 购于陆军军医大学实验动物中心, 动物实验通过伦理委员会审批, 动物使用许可证批号:SYXK(渝)20170002, 严格遵守批准机构的动物保健和使用协议。
1.1.2 实验试剂Anti-Dynamin 1抗体和山羊抗兔二抗(Abcam), 封闭山羊血清(索莱宝), 双标地高辛标记锁核苷酸探针mmu-miR-140(Exiqon), Anti-Dig AP(Sigma), NBT/BCIP片(Roche), 载体psiCHECK-2(Promega), Dnm1 3'UTR的目的序列、突变序列以及mmu-miR-140-3p质粒由上海生工合成, HEK293T细胞(中科院细胞库), 双荧光素酶检测试剂盒:Dual-Luciferase system(Promega), HBAAV2/8-CMV-mmu-miR140-GFP、HBAAV2/8-CMV-GFP过表达对照(汉恒生物), RIPA蛋白裂解液(碧云天), β-actin(睿瀛生物), TRIzol(Roche), 逆转录试剂盒(Thermo Fisher), Real-time PCR试剂(Roche)。
1.2 实验方法 1.2.1 生物信息学预测通过targetscan(http://www.targetscan.org/vert_71/)、mirwalk(http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk2/)、mirbase(http://www.mirbase.org/)等软件预测可能与Dynamin具有靶向调控作用的miRNAs, 包括miR-140、miR-30b、miR-194、miR-15a等。文献[7]表明, miR-140特异性表达在毛细胞和神经元上。HUANG等[6]在大鼠PC12细胞中通过荧光素酶报告基因实验证实miR-140通过直接碱基配对靶向调控Dnm1基因。因此, 我们推测mmu-miR-140-3p可能靶向内毛细胞中的突触囊泡内吞关键蛋白Dynamin-1。
1.2.2 基底膜制备颈椎脱臼法处死小鼠, 剪下头部, 取下耳蜗, 4%多聚甲醛经蜗顶小孔灌流4℃固定过夜(免疫荧光染色的基底膜需脱钙18 h以上)。次日立体显微镜下剥除蜗壳, 去除前庭膜、盖膜, 取下基底膜, 转移至盛有PBST的2 mL无酶EP管中, 以备后续实验操作。
1.2.3 免疫荧光染色将基底膜漂洗后PBST打孔30 min, 20%山羊血清37℃封闭30 min, 弃血清加入1:1 000的兔多克隆一抗孵育1 h, 洗净后按1:1 000的比例避光孵育二抗1 h, 洗净后用含DAPI的抗荧光淬灭剂封片。
1.2.4 基底膜原位杂交将基底膜梯度脱水水化后15 μg/mL的蛋白酶-k 37℃消化10 min; 再固定, 预杂交2 h后, 加入双标地高辛标记锁核苷酸探针54℃杂交过夜, 室温下封闭1 h, Anti-Dig AP(1:2 000)4℃孵育过夜; 漂洗后NBT/BCIP显色, 含DAPI的抗荧光淬灭剂封片。
1.2.5 m-Dnm1 3'UTR及mutation载体构建根据生物信息学预测的mmu-miR-140-3p与m-Dnm1 3'UTR区靶位点结合情况化学合成DNM1目的基因序列和突变序列, 以psiCHECK-2(Promega)为载体, XhoⅠ和NotⅠ为插入位点, 用XhoⅠ、NotⅠ双酶切, 37℃下20 μL酶切体系1 h, 对载体酶切产物进行琼脂糖凝胶电泳, 回收目的基因和载体片段。连接目的序列与载体, 将交换反应产物加入到感受态细胞验证后完成质粒抽提。
1.2.6 细胞转染将293T细胞和目的质粒分到96孔板中, 待细胞密度达到50%~70%准备转染。实验分3组:m-Dnm1 3'UTR(Dnm1野生型)组, m-Dnm1 3'UTR-muta(Dnm1突变型)组及对照组。将10 μL DMEM分别与0.16 μg的m-Dnm1、muta目的质粒以及5 pmol的对照组质粒充分混匀后室温放置(溶液A), 之后将10 μL DMEM与0.3 μL的转染试剂充分混匀(溶液B), 室温放置5 min; 将溶液A与溶液B充分混匀, 室温放置20 min; 转染前为细胞换取新鲜培养基, 之后将转染混合物加入混匀。37℃, 5%CO2培养; 转染6 h后换取新鲜培养基, 转染48 h后收集细胞检测。
1.2.7 荧光素酶活性检测按照Promega Dual-Luciferase system检测试剂盒的说明操作, 待细胞裂解后, 测定记录Firefly luciferase(Fluc)值, 作为内参值, 测定记录Renilla luciferase值(Rluc), 即为报告基因发光值。
1.2.8 圆窗膜注射腺相关病毒将8周龄C57BL/J小鼠用于AAV2/8-GFP注射。AAV的效价是1.2×1012 vg/mL。实验分为AAV-miR-140组、空载组及正常组。前2组通过4%的水合氯醛按照0.1 mL/10 g麻醉小鼠, 采用耳后入路圆窗膜注射方式[8-9]分别注射3 μL HBAAV2/8-CMV-mmu-miR140-GFP、HBAAV2/8-CMV-GFPA过表达对照; 正常组不注射。在AAV注射2周后检测miR-140、Dnm1 mRNA及Dynamin-1的表达情况。
1.2.9 实时定量PCR检测分别检测正常组、空载组、AAV-miR-140组转染前后miR-140的相对表达量及Dnm1的mRNA表达情况。各组分别取8只耳蜗按照TRIzol提取各组总RNA, 测定RNA的浓度及纯度。使用逆转录试剂盒(赛默飞世尔)进行逆转录。逆转录引物序列如下:mmu-miR-140-3p上游5'-ACACTCCAGCTGGGTACCACAGGGTAG-3', 下游5'-CTCAACTGGTGTCGTGGAGT-3';Dnm1上游5'-AATACCAACCACGAAGACTTCATAGGC-3', 下游5'-CTTGTACCAGGACAGATTCTCAGCAG-3';β-actin上游5'-GAGCACAGAGCCTCGCCTTT-3', 下游5'-AGAGGCGTACAGGGATAGCA-3'。根据罗氏Real-time PCR试剂说明书, 以β-actin为内参基因, 95℃预变性10 min, 开始循环:95℃ 30 s, 60℃ 30 s, 72℃ 30 s, 扩增40个循环周期。
1.2.10 Western blot检测分别检测正常组、空载组、AAV-miR-140组Dynamin-1蛋白的表达情况。各组分别取10只耳蜗组织加入RIPA蛋白裂解液, 于冰下超声粉碎, 4℃, 12 000 r/min, 离心20 min, 取上清用BCA法测定蛋白浓度; 上样; 电泳; 转膜; 5%脱脂牛奶室温封闭2 h, 一抗(1:500)4℃振摇过夜, PVDF膜取出后TBST缓冲液冲洗, 二抗(1:5 000)室温振摇、孵育1 h后洗膜3次, 膜上滴加化学发光显色液, 在化学发光仪上显色, 成像; 用AlPHalmager 2200图像分析软件测定各杂交带积分光密度值(integrated optical density, IOD), 以IOD表示蛋白的表达水平。
1.3 统计学方法采用SPSS 16.0统计软件, 计量资料以x ±s表示。多组间比较采用单因素方差分析, 两组之间比较采用t检验, 检验水准:α=0.05。
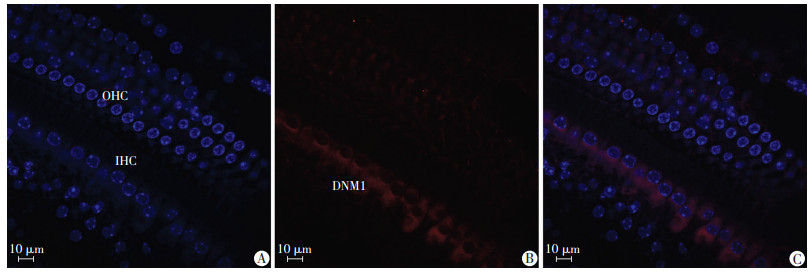
2 结果 2.1 Dynamin-1及miR-140在毛细胞中的表达 2.1.1 Dynamin-1主要表达于小鼠内毛细胞细胞质中激光共聚焦显微镜(LSM 880, ZEISS)下油镜观察及拍照, 激发光波长Alexa羊抗兔594 nm, 对所观察区域的毛细胞进行序列扫描并记录影像, 观察结果显示:在小鼠内毛细胞细胞核周围, Dynamin-1呈红色荧光均一地分布在内毛细胞细胞质内(图 1)。
|
| A:DAPI; B:Dynamin-1;C:Merge; IHC:内毛细胞; OHC:外毛细胞; 蓝色示细胞核; 红色为Dnm1阳性表达 图 1 激光共聚焦显微镜观察Dynamin-1在耳蜗毛细胞的表达 |
2.1.2 miR-140在内外毛细胞的细胞质中表达
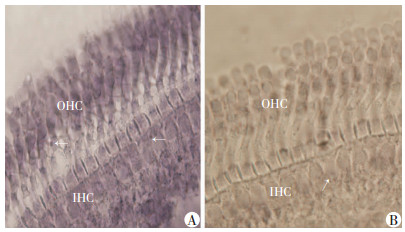
小鼠耳蜗基底膜miR-140原位杂交后显微镜观察提示:miR-140在耳蜗内外毛细胞均有表达, 且表达在细胞质内呈点状分布(图 2A), 阴性探针组未见染色(图 2B)。
|
| A:miR-140探针原位杂交染色; B:阴性对照探针原位杂交染色; IHC:内毛细胞; OHC:外毛细胞; 白色箭头:示miR-140表达强信号 图 2 光镜观察miR-140在耳蜗毛细胞的表达(×40) |
2.2 miR-140靶向调控Dnm1
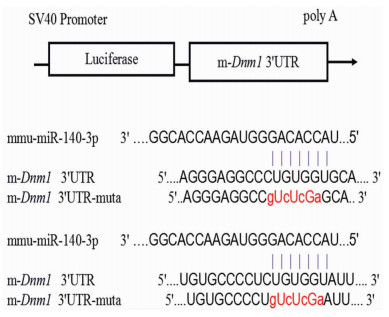
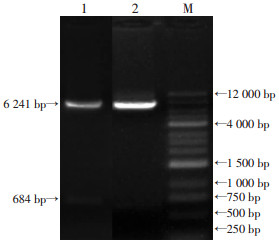
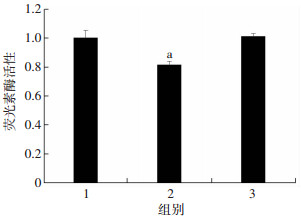
生物信息学预测结合已有研究报道分析Dnm1是miR-140-3p的靶基因。为了验证两者之间的关系, 化学合成mmu-miR-140-3p与m-Dnm1 3'UTR区结合位点序列(wt)及对应的突变位点序列(mut)见图 3, 构建野生型与突变型载体(psiCHECK-m-Dnm1-3UTR-wt/mut), 用XhoⅠ、NotⅠ双酶切后分别得到6 241 bp及684 bp两个条带(图 4), 琼脂糖凝胶电泳结果与预期一致, 成功构建过表达载体后分组共转染293T细胞行荧光素酶活性检测(图 5)。野生型组较对照组的Rluc/Fluc相对活性降低约19%, 突变型组较野生型组的Rluc/Fluc相对活性升高约20%, 较对照组相对活性下降约1%。荧光素酶活性检测结果显示, miR-140可抑制Dnm1的3'UTR荧光素酶报告基因活性, 提示miR-140可通过与Dnm1 3'UTR的结合, 负性调控Dnm1的表达, Dnm1是miR-140的靶基因。
|
| 3'UTR表示Dnm1与mmu-miR-140-3p的结合位点序列; muta为与其相对应的突变序列; 红色表示突变位点; 小写为突变碱基, 大写为原有序列碱基 图 3 mmu-miR-140-3p与m-Dnm1 3'UTR区两个结合位点序列及对应突变位点序列 |
|
| 1:Dnm1突变型; 2:Dnm1野生型; M:DNA标准 图 4 酶切电泳鉴定过表达质粒载体 |
|
| 1:对照组; 2:Dnm1野生型组; 3:Dnm1突变型组; a:P < 0.05, 与对照组比较 图 5 双荧光素酶报告基因检测mmu-miR140-3p与m-Dnm1 3'UTR的相互作用 |
2.3 miR-140抑制Dynamin-1的表达
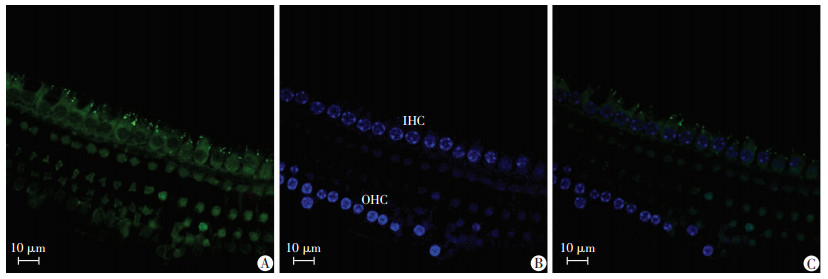
为了证实miR-140可以调控Dynamin-1的表达, 在C57小鼠耳蜗中通过圆窗膜注射分别转染携带miR-140前体及空载的腺相关病毒, AAV成功转染内毛细胞后通过荧光定量PCR检测耳蜗转染前后Dnm1 mRNA水平表达情况, Western blot检测耳蜗转染前后Dynamin-1的蛋白表达情况。圆窗膜注射携带miR-140前体及空载的腺相关病毒14 d后取小鼠耳蜗基底膜DPAI铺片, 激光共聚焦显微镜下油镜观察及拍照, 激发光波长为488、358 mm(DAPI), AAV导入14 d后在内毛细胞周围有高亮绿色荧光表达(图 6), 表明圆窗膜注射AAV转染内毛细胞成功。
|
| A:内毛细胞转染情况; B:DAPI; C:Merge; IHC:内毛细胞; OHC:外毛细胞; 蓝色示细胞核; 绿色亮点为AAV携带的GFP 图 6 激光共聚焦显微镜观察AAV转染耳蜗内毛细胞 |
分别检测正常组、空载组、AAV-miR-140组耳蜗的Dnm1 mRNA及Dynamin-1蛋白水平的表达差异以明确miR-140及Dynamin-1之间的关系。荧光定量PCR结果显示:AAV-miR-140组的miR-140较正常组及空载组的相对表达量明显升高(P < 0.05, 图 7A), Dnm1的mRNA表达下调(P < 0.05, 图 7B)。Western blot检测结果显示:AAV-miR-140组Dynamin-1蛋白的表达水平较正常组和空载组显著降低(P < 0.05, 图 8)。

|
| 1:正常组; 2:空载组; 3:AAV-miR-140组 图 7 实时定量PCR检测转染后耳蜗miR-140(A)及Dnm1 mRNA(B)的表达水平 |

|
| 1:正常组; 2:空载组; 3:AAV-miR-140组 图 8 Western blot检测耳蜗上调miR-140对Dynamin-1蛋白表达的影响 |
3 讨论
内耳毛细胞突触囊泡循环障碍是感音神经性耳聋发病机制中的重要一环, Dynamin在网格蛋白介导的突触囊泡内吞过程中发挥着至关重要的作用。对Dynamin的研究目前仅限于其参与突触囊泡内吞过程的分子机制, 在内耳毛细胞方面的研究几乎空白。本课题组前期已明确Dynamin各亚型在各年龄段小鼠耳蜗内毛细胞中有表达, 且Dynamin-1的表达量随年龄增长逐渐增多[4, 10]。miR-140因其对软骨发育及调控的重要作用[11]而受到关注; 越来越多的学者证实, miR-140在多种癌症组织中表达低下, 如结直肠癌[12]、非小细胞肺癌[13]、骨肉瘤[14]等, 具有抑制某些癌细胞生长、分化、迁移和侵袭等作用。目前miR-140在内耳的研究只在发育阶段和产后成熟阶段所显示出的差异表达上。WANG等[15]通过胚胎鼠及P1小鼠冰冻切片原位杂交证实miR-140在耳泡发育期就开始表达, 胚胎时期广泛表达于Kolliker器、Corti器、螺旋神经节、前庭等, 出生后开始特异性表达在毛细胞和神经元上, 表明miR-140在内耳发育以及毛细胞功能成熟过程中可能发挥着重要作用, 而miR-140在感音神经性耳聋中的作用目前尚不清楚。miR-140以往在内耳的研究仅是在P1小鼠毛细胞有表达, 其在成年鼠毛细胞是否表达以及具体定位表达情况不清楚。miR-140与内毛细胞突触囊泡内吞关键蛋白Dynamin-1之间的调控作用也缺少研究。
本研究通过基底膜原位杂交证实miR-140在成年鼠内外毛细胞的细胞质表达。这与WANG等[15]的实验结果一致。为了明确miR-140与Dynamin-1之间的关系, 我们采用了双荧光素酶报告基因验证Dnm1是miR-140的靶基因。目前比较成熟稳定的用于干扰内耳microRNA表达的主要方式有microRNA模拟物及抑制剂转染耳蜗毛细胞株(HEI-OC1)[16]或者转染体外培养的螺旋器[17]。本研究通过腺相关病毒携带miR-140转染耳蜗毛细胞直接在动物水平验证了miR-140过表达后对Dnm1的mRNA及其蛋白表达水平的影响, 上调miR-140后Dnm1的mRNA及其蛋白表达水平均显著下降。相较于脱离组织的体外验证, 腺相关病毒转染耳蜗毛细胞能够获得实际生理条件下的结果, 较体外验证的结果更加真实准确。圆窗膜注射携带microRNA前体的腺相关病毒的成功转染为我们后续实验提供了有利的技术手段。
越来越多的研究证明microRNAs在内耳发育、听功能的维持及感音神经性耳聋的发生、发展过程中具有重要作用。比如, 过表达miR-204下调跨膜蛋白酶丝氨酸3已经被报道对螺旋神经元的发育必不可少, 改变miR-204或许可以作为感音神经性耳聋潜在的治疗靶点[18]; PANG等[16]探讨了miR-34a参与自噬在年龄相关性听力损失发病机制中的作用, 激活miR-34a会削弱耳蜗细胞的自噬流, 并通过抑制自噬蛋白ATG9A促进耳蜗细胞死亡, 熊去氧胆酸通过恢复自噬活性显著挽救了miR-34a诱导的HEI-OC1细胞死亡。因此, miR-34a有希望作为治疗年龄相关性耳聋的靶点。本研究旨在明确miR-140能否抑制小鼠内毛细胞突触囊泡内吞关键蛋白Dynamin-1进而影响听信号的传输, 结果表明miR-140能抑制耳蜗内毛细胞Dynamin-1的表达。后续将验证干扰miR-140以后内毛细胞突触囊泡内吞过程是否会受到调控及其机制, 进一步阐释感音神经性耳聋可能的发病机制, 为听功能损伤的防护提供新的研究靶点。
| [1] | SCHMID S L, FROLOV V A. Dynamin:functional design of a membrane fission catalyst[J]. Annu Rev Cell Dev Biol, 2011, 27: 79–105. DOI:10.1146/annurev-cellbio-100109-104016 |
| [2] | RAIMONDI A, FERGUSON S M, LOU X, et al. Overlapping role of dynamin isoforms in synaptic vesicle endocytosis[J]. Neuron, 2011, 70(6): 1100–1114. DOI:10.1016/j.neuron.2011.04.031 |
| [3] | BOUMIL R M, LETTS V A, ROBERTS M C, et al. A missense mutation in a highly conserved alternate exon of dynamin-1 causes epilepsy in fitful mice[J]. PLoS Genet, 2010, 6(8): e1001046. DOI:10.1371/journal.pgen.1001046 |
| [4] |
蔡婷, 陈知己, 顾翔, 等. Dynamin在不同年龄段小鼠耳蜗中的表达[J].
中华耳鼻咽喉头颈外科杂志, 2015, 50(7): 583–586.
CAI T, CHEN Z J, GU X, et al. Expression of dynamin in mouse cochlea of different ages[J]. Chin J Otorhinolaryngol Head Neck Surg, 2015, 50(7): 583–586. DOI:10.3760/cma.j.issn.1673-0860.2015.07.012 |
| [5] | USHAKOV K, RUDNICKI A, AVRAHAM K B. MicroRNAs in sensorineural diseases of the ear[J]. Front Mol Neurosci, 2013, 6: 52. DOI:10.3389/fnmol.2013.00052 |
| [6] | HUANG W, LI M D. Nicotine modulates expression of miR-140*, which targets the 3'-untranslated region of dynamin 1 gene (Dnm1)[J]. Int J Neuropsychopharmacol, 2009, 12(4): 537–546. DOI:10.1017/S1461145708009528 |
| [7] | PATEL M, HU B H. MicroRNAs in inner ear biology and pathogenesis[J]. Hear Res, 2012, 287(1/2): 6–14. DOI:10.1016/j.heares.2012.03.008 |
| [8] | AKIL O, ROUSE S L, CHAN D K, et al. Surgical method for virally mediated gene delivery to the mouse inner ear through the round window membrane[J]. J Vis Exp, 2015(97): 52187. DOI:10.3791/52187 |
| [9] |
徐延军, 胡吟燕, 翟所强, 等. 耳后入路圆窗膜显微注射小鼠耳蜗基因转染新途径的研究[J].
听力学及言语疾病杂志, 2009, 17(3): 279–282.
XU Y J, HU Y Y, ZHAI S Q, et al. The study of a new approach to postauricular microinjection via the round window membrane for cochlear gene transfection in mouse[J]. J Audiol Speech Pathol, 2009, 17(3): 279–282. DOI:10.3969/j.issn.1006-7299.2009.03.023 |
| [10] |
蔡婷, 袁伟. 突触内吞关键蛋白Dynamin在小鼠耳蜗内毛细胞中的表达研究[J].
中华耳科学杂志, 2014, 12(4): 643–646.
CAI T, YUAN W. Study on the expression of synaptic endocytosis key protein dynamin in mice cochlear inner hair cells[J]. Chin J Otology, 2014, 12(4): 643–646. DOI:10.3969/j.issn.1672-2922.2014.04.033 |
| [11] | ZHANG R, MA J, YAO J. Molecular mechanisms of the cartilage-specific microRNA-140 in osteoarthritis[J]. Inflamm Res, 2013, 62(10): 871–877. DOI:10.1007/s00011-013-0654-8 |
| [12] | YU L, LU Y, HAN X, et al. microRNA-140-5p inhibits colorectal cancer invasion and metastasis by targeting ADAMTS5 and IGFBP5[J]. Stem Cell Res Ther, 2016, 7(1): 180. DOI:10.1186/s13287-016-0438-5 |
| [13] | YUAN Y, SHEN Y, XUE L, et al. miR-140 suppresses tumor growth and metastasis of non-small cell lung cancer by targeting insulin-like growth factor 1 receptor[J]. PLoS ONE, 2013, 8(9): e73604. DOI:10.1371/journal.pone.0073604 |
| [14] | GU R, SUN Y F, WU M F, et al. Biological roles of microRNA-140 in tumor growth, migration, and metastasis of osteosarcoma in vivo and in vitro[J]. Tumour Biol, 2016, 37(1): 353–360. DOI:10.1007/s13277-015-3801-8 |
| [15] | WANG X R, ZHANG X M, ZHEN J, et al. MicroRNA expression in the embryonic mouse inner ear[J]. Neuroreport, 2010, 21(9): 611–617. DOI:10.1097/WNR.0b013e328338864b |
| [16] | PANG J, XIONG H, LIN P, et al. Activation of miR-34a impairs autophagic flux and promotes cochlear cell death via repressing ATG9A:implications for age-related hearing loss[J]. Cell Death Dis, 2017, 8(10): e3079. DOI:10.1038/cddis.2017.462 |
| [17] | LI Y, LI A, WU J, et al. MiR-182-5p protects inner ear hair cells from cisplatin-induced apoptosis by inhibiting FOXO3a[J]. Cell Death Dis, 2016, 7(9): e2362. DOI:10.1038/cddis.2016.246 |
| [18] | LI Y, PENG A, GE S, et al. miR-204 suppresses cochlear spiral ganglion neuron survival in vitro by targeting TMPRSS3[J]. Hear Res, 2014, 314: 60–64. DOI:10.1016/j.heares.2014.05.002 |



