心脏纤维骨架处于心脏的中心位置,在不同平面将心脏分为几个腔室,支撑心肌的运动,既是心脏的形态中心,又是其力学中心,是心脏瓣膜的附着点。理解心脏纤维骨架的空间形态及毗邻结构,能促进对结构性心脏病的认识,深入理解房室间的血液流体动力学及心脏运动作用机制。心脏纤维骨架是心脏解剖的基础,要掌握心腔和间隔关系依赖于对纤维骨架解剖要点的理解。在尸体标本上呈现完整心脏纤维骨架的空间关系非常困难,解剖教材中通常借助美工绘制的模式图来展示该结构。
近年来,临床影像和3D打印技术均立足于真实解剖结构形态研究,且3D打印技术已逐渐应用于各类经导管介入瓣膜治疗手术[1]。有研究者用超声心动图像重建和打印正常和病理的三尖瓣[2]、二尖瓣[3],对其进行定量对比研究。还有研究利用心脏CT图像重建二尖瓣[4]、主动脉瓣[5],通过推测瓣膜和心脏纤维骨架的位置关系将3D打印的个性化瓣膜植入患者体内。然而,目前尚少见完整展现人体心脏纤维骨架原位解剖空间的研究,并且对超声、CT等临床影像方式而言,心脏纤维骨架的可视化仍然是具有挑战的工作。
中国可视化人体(Chinese visible human, CVH)数据集在完整性和准确性方面优于CT、MR、超声等活体成像技术所采集的图像,利用可视化人体数据集建立的高精度器官模型,解剖结构标志非常清楚[6]。本研究尝试用CVH图像观察心脏瓣膜及其毗邻结构,重建心脏纤维骨架及各瓣膜(cardiac fibrous skeleton and valves, CFSV),探讨3D打印CFSV模型在医学解剖教学及临床应用中的可行性和必要性。
1 材料与方法采用CVH数据集第5例(CVH5)作为图像来源。该数据集是通过将人体标本从头至足逐层铣切(层厚为0.2 mm),并用高清数码相机成像技术获得的分辨率为3 072×2 048的断层图像。
1.1 图像预处理选用CVH5的心脏部分(共780张彩色图像)作为具体的重建数据。由于CVH5原始图像太大,为了方便进行分割,需要进行图像裁剪,获得统一大小的心脏区域的图像。经裁剪后,这780张彩色图像的分辨率为940×870,体素大小为0.12×0.12×0.2,图像中心脏内部组织呈自然的纹理颜色,容易区分组织结构之间的边界。对裁剪后的图像进行配准(使用Photoshop软件,按顺序导入断层图像,依序号逐张进行手动配准并按原序号保存),使所有待分割图像处于同一坐标系下,为三维重建做好准备。
1.2 图像分割采用Amira软件进行图像分割。该软件能够识别生命科学和生物医学数据的来源以及类型、方式。它提供先进的可视化技术,可以对数据获得详细的了解,提供自动和交互式分割和建模工具。但是,Amira软件只能对灰度图像进行分割操作,在导入CVH5彩色图像时需选择单通道导入图像。
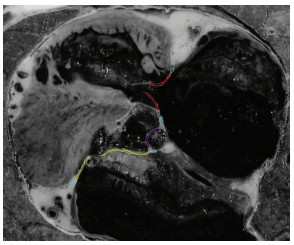
将预处理后的图像数据全部导入Amira软件。根据需要,分割出二尖瓣、三尖瓣、主动脉瓣、肺动脉瓣以及纤维瓣环,这些结构在CVH5中识别相对较难,所以大部分需要进行人工手动分割。为了更好地在心脏中观察心脏各瓣膜,对心脏的左右心室及心肌部分也进行了分割。分割时为每一个分割结构建立标签并设置为不同颜色,以便于下一步数据区分。分割图像示例如图 1所示。
|
| 黄色标识的是二尖瓣,红色是三尖瓣,紫色是主动脉瓣,浅蓝色是纤维瓣环 图 1 CVH5心脏瓣膜分割图像示例 |
1.3 三维重建及模型前处理
使用Amira软件对分割完成的组织结构通过面绘制进行三维重建(选中分割文件,选择“SurfaceGen”),观察重建的三维模型,找到模型中不规范的地方所对应的图像分割标签,返回原始图像分割文件进行分割调整,不断重复,直到三维重建的模型和真实的解剖结构相一致。最后,将重建的三维模型进行平滑处理,也可根据打印需要对模型的三角面片进行简化。
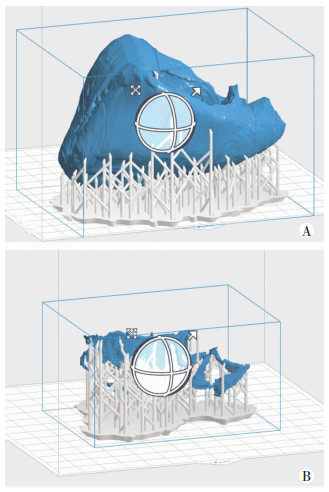
1.4 3D打印及其后处理将上述得到的三维模型(左右心室及心肌、心脏纤维骨架及各瓣膜)以STL格式的文件导出,将其导入立体光固化成型(stereo lithography appearance, SLA)打印机(Form2, Formlabs, Cambridge, MA)的配套软件PreForm中, 对模型参数进行设置。其中打印层厚根据模型需要调整为0.1 mm,以1 :1比例打印两个模型,选择光敏树脂材料(WhiteV2, Formlabs),设置支撑点大小为0.6 mm,生成带有支撑材料的模型(图 2),最后传输到打印机中进行3D打印。
|
| A:心脏左右心室及心肌模型(82.17 mm×103.09 mm×69.87 mm);B:心脏纤维骨架及各瓣膜模型(63.83 mm×82.88 mm×47.43 mm) 图 2 附有支撑材料的生成模型 |
打印完成后,用平铲从打印机中取下实体模型,并进行打印后处理。首先将模型放入装有约500 mL异丙醇的容器中进行清洗抛光(5 min左右),再将模型放在UV固化设备(UV-030A)中用紫外光对模型进行固化,然后将固化完成的模型拿出,用斜口钳去除模型支撑材料,并用平挫、细目磨砂纸等对模型表面进行打磨以消除3D打印模型表面支撑点的凸起部分,最后用刷子和丙烯颜料对实体模型表面进行着色,以更好地观察和区分不同的组织结构。
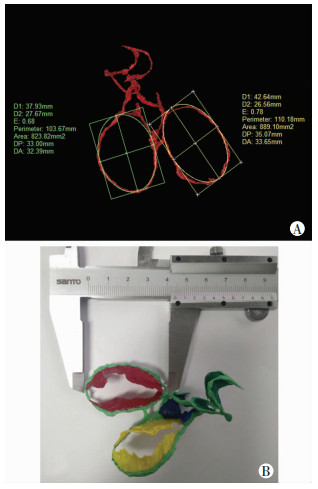
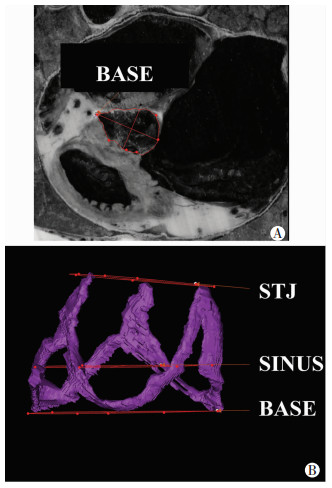
1.5 模型的测量为了进一步了解、分析心脏纤维骨架及各瓣膜(CFSV)的形态和功能,用Mimics软件的“Measure”功能对数字化三维模型的各瓣膜大小进行测量。由于心脏的三尖瓣和二尖瓣在形态上类似于椭圆,因此用Mimics软件的“Measure”标签下的“Ellipse”对三尖瓣环和二尖瓣环进行椭圆拟合(图 3A),同时用游标卡尺对3D打印的实体模型中三尖瓣环和二尖瓣环直径进行测量(图 3B)。对于心脏的肺动脉瓣和主动脉瓣,因其整体形态的不规则性,所以尝试用Mimics软件的“Measure”标签下的“Area”在原图中对肺动脉瓣环和主动脉瓣环从顶部到底部3个位置进行测量。其中主动脉根部三个水平面:基底环平面(base attachment of the root, BASE)、主动脉窦中部(center of the sinuses of valsalva, SINUS)平面和窦管交界平面(sino tubular junction, STJ)的测量示意如图 4所示。
|
| A:数字化三维模型的测量;B:3D打印实体模型的测量 图 3 二尖瓣、三尖瓣模型测量示意图 |
|
| A:在CVH5心脏部分图像中测量主动脉瓣环(基底环);B:三个水平面上主动脉瓣环模型的测量示意 图 4 主动脉瓣环的测量示意图 |
2 结果 2.1 数字化三维建模结果
完成了CVH5心脏纤维骨架以及主动脉瓣、肺动脉瓣、二尖瓣、三尖瓣等结构的分割及三维建模,其中纤维骨架及各瓣膜结构分别如图 5所示。纤维骨架由肺动脉瓣环、主动脉瓣环、三尖瓣环、纤维三角和二尖瓣环组成,其主体结构由纤维三角、二尖瓣环和主动脉瓣环构成,附件结构为三尖瓣环和肺动脉瓣环。得到CFSV的整体三维可视化模型,如图 6所示。通过构建的数字化三维模型观察瓣膜的形态、空间位置、朝向以及瓣膜附着点,可以看出尖瓣弯曲的幅度较半月瓣大,几个瓣叶的大小相对比较一致,而半月瓣的形态平坦,类似于椭圆且瓣叶大小不一致。
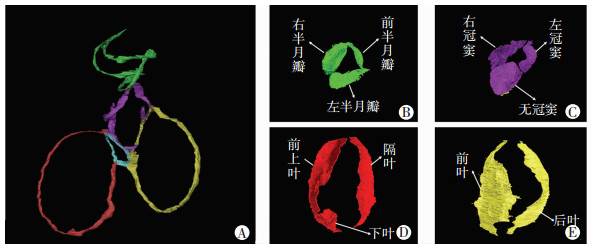
|
| A:心脏纤维骨架(其中浅蓝色部分为纤维三角,其他颜色与瓣膜颜色相对应);B:肺动脉瓣;C:主动脉瓣;D:三尖瓣;E:二尖瓣 图 5 人体心脏纤维骨架以及各瓣膜 |
|
| A:模型前面观;B:模型后面观;C:模型上面观;D:模型侧面观 图 6 心脏纤维骨架及瓣膜结构整体三维模型(多面观) |
2.2 3D打印结果
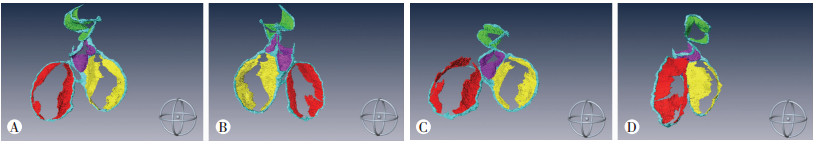
根据数字化三维模型成功完成了心脏左右心室及心肌模型、心脏纤维骨架及各瓣膜模型的3D打印,最后得到的实体模型如图 7所示。在心脏左右心室及心肌的模型上对比观察心脏纤维骨架及瓣膜,可以更清楚地理解瓣膜解剖结构及其与周围心腔室的空间毗邻关系。
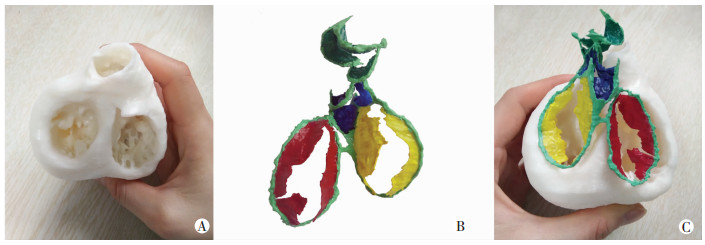
|
| A:心脏左右心室及心肌模型;B:心脏纤维骨架及各瓣膜模型;C:两个模型的匹配 图 7 3D打印实体模型 |
2.3 数字化三维模型和3D打印实体模型的测量结果
通过观察3D打印的实体模型可以看出三尖瓣和二尖瓣并不在心脏内部的同一个平面上,测量显示它们之间存在20.4°的角度差(图 8)。三尖瓣环与二尖瓣环数字化模型的测量结果(表 1)表明:(1)TVR与MVR长短轴直径之比分别为1.61和1.37,即三尖瓣比二尖瓣的圆环更扁;(2)三尖瓣环与二尖瓣环数字化三维模型与3D打印模型测量值的差异δ为(0.62± 1.19)mm。肺动脉瓣环和主动脉瓣环的测量数据(表 2)显示,主动脉根部SINUS平面比BASE和STJ平面都要大,STJ平面的直径最小。另外,肺动脉瓣的面积和周长比主动脉瓣略大。
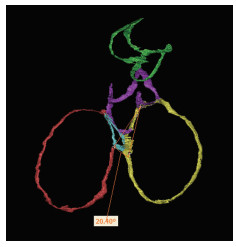
|
| 图 8 二尖瓣、三尖瓣平面角度差测量示意图 |
| 类型 | 名称 | 短轴 /mm |
长轴 /mm |
周长 /mm |
面积 /mm2 |
| 数字化 | 三尖瓣环 | 26.56 | 42.64 | 110.18 | 889.10 |
| 三维模型 | 二尖瓣环 | 27.67 | 37.93 | 103.67 | 823.82 |
| 3D打印 | 三尖瓣环 | 26.48 | 41.02 | 106.20 | 852.67 |
| 模型 | 二尖瓣环 | 26.08 | 38.74 | 100.10 | 793.12 |
| 类型 | 位置 | 短轴 /mm |
长轴 /mm |
周长 /mm |
面积 /mm2 |
| 肺动脉瓣环 | 顶部 | 18.46 | 21.57 | 63.93 | 295.21 |
| 中间 | 18.60 | 21.69 | 64.53 | 308.85 | |
| 底部 | 14.72 | 19.80 | 57.04 | 226.76 | |
| 主动脉瓣环 | STJ | 15.22 | 16.36 | 51.39 | 181.82 |
| SINUS | 17.79 | 19.20 | 60.32 | 248.68 | |
| BASE | 16.78 | 18.71 | 58.77 | 221.13 |
3 讨论 3.1 心脏纤维骨架及其瓣膜解剖教学
由于心脏纤维骨架所处的位置解剖结构复杂,心脏4个瓣膜开口有自己的方向,且不完全位于一个平面上,瓣膜结构又比较薄,在现有的影像(MR、CT、超声)资料中定位和识别非常困难。传统解决方法是通过尸体解剖观察心脏内部结构及周围组织,但这会破坏心脏原有的空间关系。特别是心脏纤维骨架比较抽象,难以在尸体解剖中展现和表达,初学者难以准确理解其空间形态,瓣间三角结构是大动脉瓣环扩大术的解剖基础,而主动脉瓣环、二尖瓣环、三尖瓣环的形态是相应瓣膜置换术中人工瓣膜选择和设计的依据。
数字化三维建模可为研究复杂形态空间走形和对应二维影像之间的关系提供方式。原位重建是保障心脏纤维骨架及各瓣膜(CFSV)结构保持准确性的关键,因没有相对位移和形变,能最大限度地保持毗邻结构空间的相对位置关系[7]。因此,通过将CFSV结构进行原位重建并探讨其3D打印实体模型在医学解剖教学中的应用非常有必要。将3D打印瓣膜模型用于解剖教学,是一种全新的尝试,对启发学生空间想象能力及临床适应能力均有重要意义。
3.2 CVH数据集建模及3D打印解剖是外科的基础,现代影像和3D打印都注重于真实人体的解剖。用CVH数据集建立CFSV模型的优势有:①纹理可辨识性。CVH数据集是从尸体获得的包含丰富解剖学信息的高分辨率、连续断层切片图像,各组织器官呈自然的纹理颜色,纤维骨架为致密结缔组织,纤维结构呈白色,容易区分它与周围毗邻组织的边界,且连续断层图像形式与临床的CT和MRI具有一致性,但其水平分辨率和层间距均高于临床影像,能够呈现丰富的解剖细节,特别是二尖瓣、三尖瓣等需要在心脏轴面来观察的结构。②原位的空间关系。CVH数据集保持了解剖结构的原位空间关系。图像的层间距小于临床连续断层影像,层间距越小越能展现不规则细节,可作为临床影像的有效补充。
3D打印通过CVH数据集构建的CFSV模型可以弥补传统尸体解剖教学的缺陷,用与时俱进的方法帮助学生更深入地认识人体原位心脏的结构,理解心脏运动规律,进一步提高医学生解剖教学的质量,为医学生进入临床奠定基础。对于复杂先天性心脏病的手术而言,利用3D打印模型进行术前规划和演练能进一步评估手术的可操作性:一方面是手术的必要性,相关解剖结构的空间角度关系是否能满足手术操作的条件,避免不必要的开胸手术风险;另一方面是可行性,对于一些复杂手术,可以通过3D打印技术为病人提供个性化的3D模型,在充分论证术式和路径之后,去挑战一些高难度术式,提高临床手术技能。
研究中测量结果显示,心脏各瓣膜的数字化三维模型和3D打印实体模型之间存在一定差异,可能有以下原因:①由于测量方式的局限性,传统的游标卡尺等测量工具对于CFSV这种不规则形态的3D打印实体模型测量难以完全吻合其特征边缘,手动操作容易带来误差,而数字化三维模型可以不受空间形态的限制,在复杂、不规则形态的测量方面更具优势;② 3D打印机的精度及打印材料的选择会导致一定程度的精度损失,在打印较高精度要求的3D模型时需要对打印机及打印材料严格筛选和评估。因此,除了人为测量带来的不可避免的误差以外,随着3D打印机精度的提高以及纳米材料成型技术的发展,未来可为临床诊疗提供更精确、更有参考价值的数据。
3.3 3D打印瓣膜解剖模型在临床应用中的意义为了更好地分析心脏瓣膜及其毗邻解剖结构,一些研究[8-9]对二尖瓣的形态进行了定量研究。MAFFESSANTI等[10]通过磁共振采集的心脏水平长轴面图像推断二尖瓣环和三尖瓣环的位置,研究二尖瓣环和三尖瓣环的形态特征。也有学者定量地研究了三尖瓣的形态和功能[11-13]。并且,有研究[14]认为心脏4个瓣膜的位置在同一平面上,但本研究通过观察CFSV的3D打印模型(图 7B),其空间形态非常的不规则。进一步通过测量(图 8)表明MVR与TVR之间存在20.4°的角度差,说明心脏各瓣膜并不完全处于同一平面上。因此,难以用某个平面去捕捉其不规则的形态特征,在临床影像上常常由于不同平面的选择而引起量化评估结果的不一致。
随着3D打印技术的兴起,临床上逐步使用3D打印的模型来进行手术规划和术前预演,相应解剖结构的形态、尺寸及其空间关系对选择手术方式和手术辅助材料都有很重要的作用,能够为更精确的手术提供保障,提高手术的成功率,减少患者术后并发症。
利用3D打印技术生成瓣膜已经成为医学领域研究的热点,有很多研究都在探索3D打印心脏瓣膜在指导瓣膜置换介入手术中的应用。RIPLEY等[15]利用心脏CT数据重建并打印主动脉根部,探索其在经导管主动脉瓣置换手术前的辅助解剖可视化应用,以预测和避免手术并发症。VUKICEVIC等[16]利用心脏CT和三维经食管超声心动图(3D TEE)重建同时多材料打印患者个性化二尖瓣装置模型,实现新型经导管二尖瓣修复策略的功能评估。还有研究[17]通过3D CT数据建立主动脉根部模型用以探讨主动脉根部及其几个窦的大小和几何形状变化。
本研究通过CVH高分辨率断层重建三维模型,展现真实的人体原位心脏空间结构,证明了用数字化人体打印复杂的解剖教学模型——心脏纤维骨架及瓣膜(CFSV)模型的可行性。有必要将3D打印出来的CFSV实体模型用于医学解剖教学,帮助学生直观地观察心脏纤维骨架在心脏三维空间中的位置,认识心脏瓣膜的解剖结构从而理解心脏瓣膜的功能,进而更深入理解心脏的解剖形态结构与功能。3D打印技术为复杂解剖结构的案例教学提供了一个思路,可作为现有解剖教学资源的有益补充,缓解当今解剖教学中尸体严重缺乏的困境。结合3D打印前沿技术,学生对复杂解剖结构及其毗邻关系的学习将越来越容易,但也对教师进行解剖结构形态和功能的教学提出了更高的要求。CVH数字模型来源于真实人体标本无器质性病变,其形态、大小及与各腔室的空间毗邻关系与正常人体具有一致性。利用CVH数据对心脏瓣膜进行数字化三维重建及打印可作为手术预演、验证手术入路、重塑瓣膜原位形态的重要方式。
利用3D打印的解剖模型虽然能够将心脏纤维骨架这类抽象的空间结构原位展示出来,但是也存在不足:在材料属性上缺乏传统尸体解剖标本物理特性的触感,特别是对于心肌弹性、致密结缔组织韧性的感受不如尸体标本那么真实。另外,3D打印瓣膜直接用于临床治疗存在相容性、耐久性及生长潜力等问题,需要对3D打印可能产生的模型误差有充分的估计和认识。但随着生物材料的发展、3D打印技术及其精度的提高,人工心脏瓣膜将越来越安全、有效[18],可为未来临床应用打下坚实的基础。当然,传统解剖是不可替代的外科基础,对于临床手术术式及其解剖技能的培训仍然需要结合传统解剖教学,使两者相互补充,相得益彰。
| [1] |
王媛, 王墨扬, 任心爽, 等. 3D打印技术在心脏瓣膜病领域的应用进展[J].
中华心血管病杂志, 2017, 45(2): 167–169.
WANG Y, WANG M Y, REN X S, et al. The application of 3D printing in the field of heart valvular disease[J]. Chin J Cardiol, 2017, 45(2): 167–169. |
| [2] | MURARU D, VERONESI F, MADDALOZZO A, et al. 3D printing of normal and pathologic tricuspid valves from transthoracic 3D echocardiography data sets[J]. Eur Heart J Cardiovasc Imaging, 2017, 18(7): 802–808. DOI:10.1093/ehjci/jew215 |
| [3] | MAHMOOD F, OWAIS K, TAYLOR C, et al. Three-dimensional printing of mitral valve using echocardiographic data[J]. JACC Cardiovasc Imaging, 2015, 8(2): 227–229. DOI:10.1016/j.jcmg.2014.06.020 |
| [4] | LITTLE S H, VUKICEVIC M, AVENATTI E, et al. 3D Printed Modeling for Patient-Specific Mitral Valve Intervention: Repair With a Clip and a Plug[J]. JACC Cardiovasc Interv, 2016, 9(9): 973–975. DOI:10.1016/j.jcin.2016.02.027 |
| [5] | GALLO M, D'ONOFRIO A, TARANTINI G, et al. 3D-printing model for complex aortic transcatheter valve treatment[J]. Int J Cardiol, 2016, 210: 139–140. DOI:10.1016/j.ijcard.2016.02.109 |
| [6] |
肖嵛, 谭立文, 向明滟, 等. 基于数字化人体的高精度器官模型3D打印初探[J].
第三军医大学学报, 2015, 37(21): 2147–2150.
XIAO Y, TAN L W, XIANG M Y, et al. Application of 3D printing techniques in human organ models from Chinese Visible Human[J]. J Third Mil Med Univ, 2015, 37(21): 2147–2150. |
| [7] |
李颖. 心脏可视化研究及其在量化分析中的应用[D]. 重庆: 第三军医大学, 2016.
LI Y. Visualization study of the heart and its application in quantitative analysis[D]. Chongqing: Third Military Medical University, 2016. |
| [8] | GORDIC S, NGUYEN-KIM T D, MANKA R, et al. Sizing the mitral annulus in healthy subjects and patients with mitral regurgitation: 2D versus 3D measurements from cardiac CT[J]. Int J Cardiovasc Imaging, 2014, 30(2): 389–398. DOI:10.1007/s10554-013-0341-4 |
| [9] | MIHAILA S, MURARU D, PIASENTINI E, et al. Quantitative analysis of mitral annular geometry and function in healthy volunteers using transthoracic three-dimensional echocardiography[J]. J Am Soc Echocardiogr, 2014, 27(8): 846–857. DOI:10.1016/j.echo.2014.04.017 |
| [10] | MAFFESSANTI F, GRIPARI P, PONTONE G, et al. Three-dimensional dynamic assessment of tricuspid and mitral annuli using cardiovascular magnetic resonance[J]. Eur Heart J Cardiovasc Imaging, 2013, 14(10): 986–995. DOI:10.1093/ehjci/jet004 |
| [11] | MIGLIORANZA M H, MIHAILA S, MURARU D, et al. Dynamic changes in tricuspid annular diameter measurement in relation to the echocardiographic view and timing during the cardiac cycle[J]. J Am Soc Echocardiogr, 2015, 28(2): 226–235. DOI:10.1016/j.echo.2014.09.017 |
| [12] | OWAIS K, TAYLORC E, JIANGL, et al. Tricuspid annulus: a three-dimensional deconstruction and reconstruction[J]. Ann Thorac Surg, 2014, 98(5): 1536–1542. DOI:10.1016/j.athoracsur.2014.07.005 |
| [13] | VERONESI F, ADDETIAK, LAMBERTIC, et al. 3D evaluation of tricuspid annulus morphology in patients with pulmonary hypertension[C]//Computing in Cardiology Conference. IEEE, 2013: 241-244. |
| [14] | MISFELD M, SIEVERSH H. Heart valve macro- and microstructure[J]. Philos Trans R Soc Lond B Biol Sci, 2007, 362(1484): 1421–1436. DOI:10.1098/rstb.2007.2125 |
| [15] | RIPLEY B, KELILT, CHEEZUMM K, et al. 3D printing based on cardiac CT assists anatomic visualization prior to transcatheter aortic valve replacement[J]. J Cardiovasc Comput Tomogr, 2016, 10(1): 28–36. DOI:10.1016/j.jcct.2015.12.004 |
| [16] | VUKICEVIC M, PUPERID S, JANE GRANDE-ALLENK, et al. 3D printed modeling of the mitral valve for catheter-based structural interventions[J]. Ann Biomed Eng, 2017, 45(2): 508–519. DOI:10.1007/s10439-016-1676-5 |
| [17] | YANG D H, KIMD H, HANDSCHUMACHERM D, et al. In vivo assessment of aortic root geometry in normal controls using 3D analysis of computed tomography[J]. Eur Heart J Cardiovasc Imaging, 2017, 18(7): 780–786. DOI:10.1093/ehjci/jew146 |
| [18] |
郝凤阳, 苏健, 孙璐, 等. 人工心脏瓣膜的发展[J].
医疗装备, 2017, 30(13): 186–190.
HAO F Y, SU J, SUN L, et al. Development of artificial heart valve[J]. Med Equipment, 2017, 30(13): 186–190. DOI:10.3969/j.issn.1002-2376.2017.13.125 |



