2. 400016 重庆,重庆医科大学:附属第一医院实验研究中心
2. Experimental Research Center, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
最近的流行病学数据表明, 在过去的50年中, 男性不育发病率在不断增加。目前, 大约有15%的夫妻不孕, 其中50%归因于男性因素[1]。男性不育症最常见于精子发生障碍, 临床上称为少精症或无精子症。哺乳动物精子发生是一种高度复杂的生物学过程, 发生于睾丸曲细精管内, 受内在遗传机制和外在环境因素的调节。虽然对雄性生殖的研究取得了很大进展, 但我们对精子发生分子机制的认识仍然有限。
富亮氨酸α-2-糖蛋白1(leucine-rich-alpha-2-glycoprotein 1, Lrg1)是富亮氨酸蛋白家族成员之一, 目前研究显示其参与包括信号转导、细胞粘附、发育和DNA修复等在内的多种生理过程。在胃癌、卵巢癌、肺癌、膀胱癌和胰腺癌等恶性肿瘤中, LRG1的表达明显升高[2-3]。此外, 在类风湿性关节炎、溃疡性结肠炎和2型糖尿病[4]中也观察到其表达增加。WANG等[5]报道, LRG1可与转化生长因子-β(transforming growth factor-beta, TGF-β)辅助受体结合, 导致促血管生成Smad1/5/8信号通路的激活。
本课题组前期发现, 在cryptochrome 1基因缺失小鼠中, 睾丸LRG1的表达明显增加。此外, MATZUK等[6]研究显示, 睾丸Brdt基因小分子抑制剂JQ1具有抗生育效应。我们通过分析睾丸芯片数据(GDS5172), 发现JQ1显著上调睾丸Lrg1表达。这些结果表明在睾丸损伤情况下, Lrg1表达水平上调, 提示其可能在睾丸生殖功能中发挥生物学效应。因此, 本研究检测了LRG1在小鼠睾丸中的定位, 并通过基因敲除小鼠模型来探索Lrg1在雄性生殖中的潜在生物学活性。
1 材料与方法 1.1 材料12只3月龄C57BL/6野生型(wild-type, WT)小鼠(雌雄各半)购于重庆医科大学实验动物中心(SYXK2012-0001), 用于Lrg1基因敲除小鼠繁殖及作为对照小鼠。给予小鼠自由饮食, 所有操作均符合伦理学要求。抗LRG1单克隆来源于Santa Cruz公司(sc-390920)。蛋白提取Kit、BeyoECL Plus Western blot检测kit购自碧云天公司。LH和睾酮ELISA检测试剂盒购于USCN公司。SYBR PrimeScript RT-PCR kit (Perfect Real Time)与基因组DNA Extraction kit购于TaKaRa公司。
1.2 Lrg1基因敲除小鼠制备与鉴定Lrg1基因敲除小鼠制备利用Crispr/cas9技术, 由深圳华大方舟完成。Crispr gRNA序列为GGAATGCCTGATACTGCAGTCGG。PCR方法鉴定Lrg1敲除小鼠:取出生1周龄小鼠鼠尾提取基因组DNA, PCR扩增, 扩增产物连接到T载体, 测序鉴定。PCR扩增引物:上游:5′-AGGAAGGACTCAGTGGGTACAGTTT-3′, 下游:5′-GGTTGTGGGAGATGTCGAAGC-3′。
1.3 免疫荧光取饲养至4月龄Lrg1敲除小鼠与野生型对照小鼠睾丸组织切片(5 μmol/L), 经脱蜡、梯度酒精脱水后, 进行抗原修复, 用0.01 mol/L PBST漂洗3次, 山羊血清室温封闭30 min。与抗LRG1抗体(1 :100)孵育后用PBS洗涤, 随后与FITC标记二抗孵育1 h, 荧光显微镜下观察。
1.4 qRT-PCR检测基因表达水平用Trizol试剂提取小鼠睾丸总RNA。按照说明, 总RNA逆转录为cDNA, 随后以cDNA为模板进行PCR扩增。引物Tgf-β1 上游:5′-TGACGTCACTGGAGTTGTACGG-3′, 下游:5′-GGTTCATGTCATGGATGGTGC-3′; Tgf-β2 上游:5′-TCGACATGGATCAGTTTATGCG-3′, 下游:5′-CCCTGGTACTGTTGTAGATGGA-3′; Mt3 上游:5′-ACCTGCCCCTGTCCTACTG-3′, 下游:5′-CCTTGGC-ACACTTCTCACATC-3′; Zfy2 上游:5′-ATCCTTTGACAGCCGACATTT-3′, 下游:5′-CCTCACAGTTGATTCTGGCATC-3′; Kcnip4 上游:5′-GTGGCTGTAGGAAACGGTGTA-3′, 下游:5′-CTCATCTTCCACGCTGTCTGTAT-3′; β-actin 上游:5′-TCGTGCGTGACATCAAAGAG-3′, 下游:5′-CAAGAAGGAAGGCTGGAAAA-3′。PCR反应条件:95 ℃ 30 s; 95 ℃ 10 s, 60 ℃ 15 s, 40个循环; 最后进行熔解曲线分析。基因表达水平用2-ΔΔCt方法分析。
1.5 Western blot检测4月龄Lrg1敲除小鼠与野生型对照小鼠睾丸标本用蛋白质提取试剂盒提取总蛋白, BCA法测定蛋白含量。50 μg总蛋白进行PAGE电泳后, 电转至PVDF膜, 10%脱脂奶粉封闭, 依次与一抗(抗LRG1抗体1 :500)、辣根过氧化物酶(HRP)标记的二抗于37 ℃孵育1 h, BeyoECL Plus化学发光试剂显色, 检测。
1.6 LH与睾酮测定按照产品说明书, 测定4月龄Lrg1敲除小鼠与野生型对照小鼠(n=6)血清LH和睾酮水平; 并测定睾丸匀浆液睾酮水平。
1.7 睾丸形态学分析睾丸固定于Bouin’s液后, 石蜡包埋, 5 μm厚睾丸组织切片进行HE染色, 显微镜下进行形态学观察, 测量生精小管直径与周长, 计数每100个生精小管退化的精细胞数量及平均每生精小管中圆形精子的数量。
1.8 附睾精子计数精子活力分析附睾尾于预温DMEM培养基中剪碎后, 孵育待精子游离, 用血细胞计数板计数精子数量(×106/mL)。于显微镜下评估精子活动力, 每只小鼠计数200精子中前向运动、非前向运动及不活动精子数量, 精子活力表示为前向运动与非前向运动占总精子数量的百分比。
1.9 睾丸组织RNA表达谱分析睾丸组织RNA表达分析利用数字基因表达谱方法。文库构建和高通量测序在华大基因进行。全部实验包含2个生物学重复, 每个生物学样本由3个睾丸标本混合而成。测序完成后, 基因表达水平采用每百万读序中来自某基因每千碱基长度的读序数法(reads per kb per million reads, RPKM)表示[7]。用NOISeq方法[8]筛选两组间差异基因:log2-ratio绝对值≥0.585及probability≥0.8。
1.10 生物信息学分析利用PANTHER分类系统对差异表达基因进行基因本体(gene ontology, GO)分析。用String系统构建蛋白与蛋白相互作用(protein-protein interaction, PPI)网络, 并利用MCODE算法识别PPI网络中核心模块。在TargetScan与DIANA-TarBase v.7.0平台预测miRNAs靶基因, 利用Cytoscape v.3.5.1平台构建miRNA-mRNA调节网络。
1.11 统计学分析数据采用x±s表示, 统计分析采用Excel 2007软件, 两组间比较采用t检验。检验水准α=0.05。
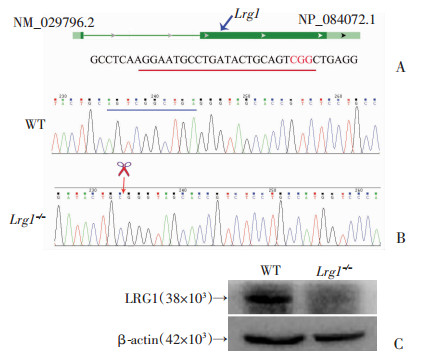
2 结果 2.1 Lrg1基因敲除小鼠鉴定小鼠出生7 d后剪尾端提取DNA, PCR扩增产物连接到T载体测序, 结果表明敲除小鼠Lrg1基因10 bp片段缺失(图 1A, B)。进一步Western blot分析睾丸LRG1表达, 证实敲除小鼠LRG1蛋白表达缺失(图 1C)。
|
|
A:gRNA靶向Lrg1基因位点; B:测序分析; C:Western blot检测睾丸LRG1表达 WT:野生型对照; Lrg1 -/-:Lrg1敲除 图 1 利用Crispr/Cas9技术敲除Lrg1基因小鼠的鉴定 |
2.2 免疫荧光法检测LRG1在睾丸表达情况
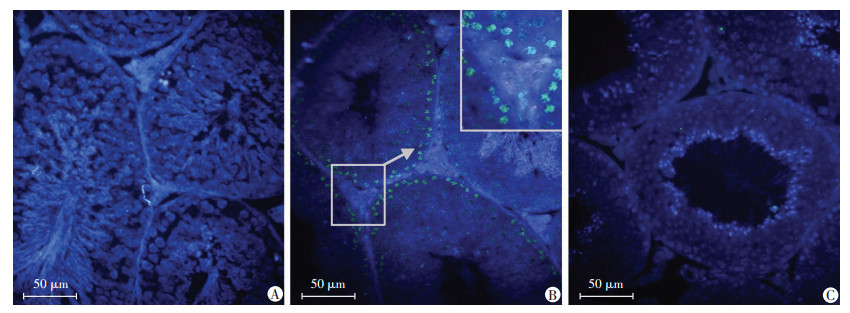
免疫荧光检测提示LRG1表达于野生型小鼠睾丸精原细胞与精母细胞, 而Lrg1基因敲除小鼠无表达(图 2), 表明Lrg1基因敲除导致其蛋白表达缺失。
|
|
A:阴性对照; B:野生型小鼠; C:Lrg1敲除小鼠 绿色示LRG1, 蓝色示DAPI 图 2 免疫荧光检测LRG1在小鼠睾丸中的表达 |
2.3 Lrg1敲除导致附睾精子数量减少与活力下降
Lrg1敲除小鼠未见明显结构与发育异常, 体质量、睾丸与附睾质量与野生对照组相比, 亦无明显差异。但精子数量与精子活力明显下降(P < 0.05), 提示Lrg1敲除影响小鼠的生精功能(表 1)。
| 组别 | 体质量(g) | 睾丸质量(g) | 附睾质量(g) | 精子计数(×106/mL) | 精子活力(%) |
| WT小鼠 | 30.32±2.07 | 0.090±0.010 | 0.028±0.015 | 6.77±1.86 | 61.2±6.8 |
| Lrg1-/-小鼠 | 31.93±2.36 | 0.075±0.018 | 0.017±0.010 | 4.76±0.54a | 51.6±7.2a |
| a:P < 0.05, 与WT小鼠比较 | |||||
2.4 HE染色结果
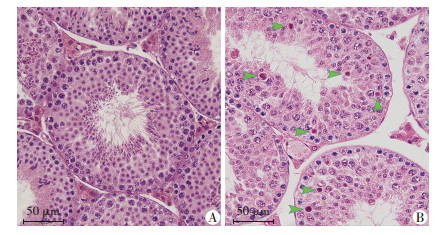
睾丸切片HE染色显示(图 3), 4月龄Lrg1敲除小鼠与野生小鼠的生精小管均边界完整, 测定睾丸生精小管直径与周长显示, Lrg1敲除小鼠明显低于野生小鼠; 此外, Lrg1敲除小鼠睾丸生精小管中退化细胞数量明显增加, 平均每生精小管中圆形精子细胞数量下降(表 2), 进一步表明生精功能受损。
|
| A:野生型小鼠; B:Lrg1敲除小鼠, ▼:示退化生精细胞 图 3 HE染色观察野生型小鼠与Lrg1敲除小鼠睾丸组织病理学改变 |
| 组别 | 生精小管直径(μm) | 生精小管周长(μm) | 退化生精细胞/100生精小管(个) | 圆形精子/生精小管(个) |
| WT小鼠 | 196.22±27.88 | 643.59±89.51 | 26.17±5.03 | 76.00±12.45 |
| Lrg1-/-小鼠 | 183.67±26.32a | 565.69±88.45a | 196.00±40.34b | 60.00±11.40b |
| a:P < 0.05, b:P < 0.01, 与WT小鼠比较 | ||||
2.5 激素分析
通过测定野生小鼠与Lrg1敲除小鼠LH水平, 发现Lrg1敲除导致血清LH明显增加(P < 0.05);而血清睾酮与睾丸睾酮水平均明显下降(P < 0.05), 提示Lrg1敲除损伤睾丸睾酮产生功能(表 3)。
| 组别 | 血清LH(ng/mL) | 血清睾酮(ng/mL) | 睾丸睾酮(ng/g) | |
| WT小鼠 | 0.32±0.08 | 2.90±0.92 | 39.95±8.10 | |
| Lrg1-/-小鼠 | 0.47±0.09a | 1.91±0.29a | 29.73±3.38b | |
| a:P < 0.05, b:P < 0.01, 与WT小鼠比较 | ||||
2.6 Lrg1敲除导致小鼠睾丸基因表达谱变化
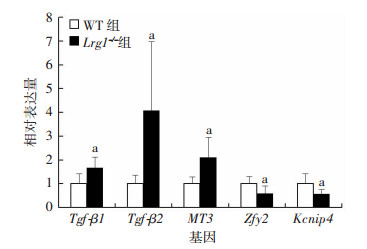
为了分析Lrg1敲除导致的小鼠生殖表型变化潜在机制, 我们通过高通量测序对睾丸基因表达谱进行了检测。总体发现有1 208个差异基因(包含17个miRNA), 其中877个下调, 331个上调。qRT-PCR分析结果显示与测序结果的趋势一致(图 4)。
|
| a:P < 0.05, 与WT组比较 图 4 qRT-PCR验证在野生型小鼠与Lrg1敲除小鼠睾丸中差异表达基因(n=6, x±s) |
2.7 差异表达基因GO分析
利用PANTHER分类系统将差异基因按细胞组分(cellular component)、分子功能(molecular function)与生物学程序(biological process)进行分类(表 4)。
| 基因本体 | 分类 | 百分比(%) |
| 分子功能 | 连接活性(GO:0005488) | 43.0 |
| 催化活性(GO:0003824) | 36.4 | |
| 转运蛋白活性(GO:0005215) | 6.4 | |
| 受体活性(GO:0004872) | 6.2 | |
| 结构分子活性(GO:0005198) | 3.9 | |
| 信号传感器活性(GO:0004871) | 1.9 | |
| 生物学程序 | 细胞程序(GO:0009987) | 27.8 |
| 代谢程序(GO:0008152) | 25.3 | |
| 发育程序(GO:0032502) | 8.2 | |
| 对刺激的反应(GO:0050896) | 8.0 | |
| 生物调节(GO:0065007) | 6.3 | |
| 多细胞生物程序(GO:0032501) | 6.0 | |
| 定位(GO:0051179) | 5.7 | |
| 细胞成分组织或生物发生(GO:0071840) | 5.7 | |
| 复制(GO:0000003) | 2.8 | |
| 免疫系统程序(GO:0002376) | 2.5 | |
| 细胞组分 | 细胞部分(GO:0044464) | 45.7 |
| 细胞器(GO:0043226) | 27.7 | |
| 大分子复合物(GO:0032991) | 12.7 | |
| 膜(GO:0016020) | 7.5 | |
| 胞外区(GO:0005576) | 4.9 |
分子功能分类中, 差异表达基因集中于连接(binding)(43.0%)、催化活性(catalytic activity)(36.4%)和转运蛋白活性(transporter activity)(6.4%)。在生物学程序分类中, 主要集中于细胞程序(cellular process) (27.8%)、代谢程序(metabolic process)(25.3%)与发育程序(developmental process)(8.2%)。在细胞程序的12个亚分类程序中, 有丝分裂(meiosis)、减数分裂(mitosis)及染色体分离(chromosome segregation)的关联基因在Lrg1敲除小鼠中均下调。此外, 31个基因归类于生殖(reproduction), 其中9个归类于受精(fertilization)亚类, 且在Lrg1敲除小鼠中均下调; 15个属于精子发生(spermatogenesis)亚类, 除Hoxd9与Xlr5c上调外, 其他13个基因在Lrg1敲除小鼠中均下调。
在代谢程序分类中, 大多数归类于碳化合物代谢(carbohydrate metabolic process)、核碱基化合物代谢(nucleobase-containing compound metabolic process)和蛋白代谢(protein metabolic process)的基因在Lrg1敲除小鼠中表达下调, 而归类于细胞氨基酸生物合成(cellular amino acid biosynthetic process)和含硫化物代谢(sulfur compound metabolic process)的基因多数上调。
2.8 PPI网络分析为了识别差异表达基因中功能关联蛋白, 本研究构建了PPI网络。ACTRT1是精子细胞骨架的主要组分, 在精子形成中发挥重要作用。结果显示104个基因与ACTRT1直接关联(图 5), 且除了13个基因(CAD、GTF3A、HIST2H3C2、KLF2、RASL11B、RHOB、SMTN、TNNC2、ZBTB7B、ZFP213、ZFP553、ZFP668和ZFP771)在Lrg1敲除小鼠睾丸中表达上调外, 其他91个均下调。另外我们发现这104个基因中, 48个基因(46个下调, 2个上调)属于C2H2锌指蛋白(zinc finger proteins, ZFPs)。

|
| 图 5 Lrg1敲除小鼠与野生小鼠睾丸中差异表达的ACTRT1与其功能关联蛋白String分析 |
研究进一步用MCODE插件分析PPI网络中的核心模块(图 6)。模块A中所有基因表达均下调, 主要位于染色体区域, 参与有丝分裂核分裂、有丝分裂细胞周期、姐妹染色单体分离、减数分裂细胞周期等。模块B中, 大多数基因位于中心体, 参与中心体形成。模块C中, 与模块A相似, 大多数基因位于染色体区域, 参与DNA包装、减数分裂细胞周期、精细胞核分化、组氨酸交换等。模块D中, 多数基因上调, 其中4个基因包含Globin功能域(PF00042), 参与氧运输。模块E中, 8个基因具有RNA连接活性, 其中Smc5与Smc6 参与端粒维持。

|
| A:参与18个基因有丝分裂核分裂, 有丝分裂细胞周期, 姐妹染色单体分离, 减数分裂细胞周期, 减数分裂Ⅱ, 涉及141个相互作用, 得分16.59;B:参与10个基因纤毛组装体, 中心体组织, 涉及45个相互作用, 得分10;C:参与10个基因DNA包装, 染色体组织, 减数分裂细胞周期, 精子细胞核分化, 组蛋白交换, 涉及31个相互作用, 得分6.89;D:参与14个基因氧运输, β-丙氨酸代谢, 涉及41个相互作用, 得分6.31;E:参与16个基因通过重组进行端粒维护, 涉及34个相互作用, 得分4.53 图 6 Lrg1敲除小鼠与野生小鼠睾丸中差异表达基因PPI网络核心模块分析 |
2.9 miRNA-mRNA作用网络
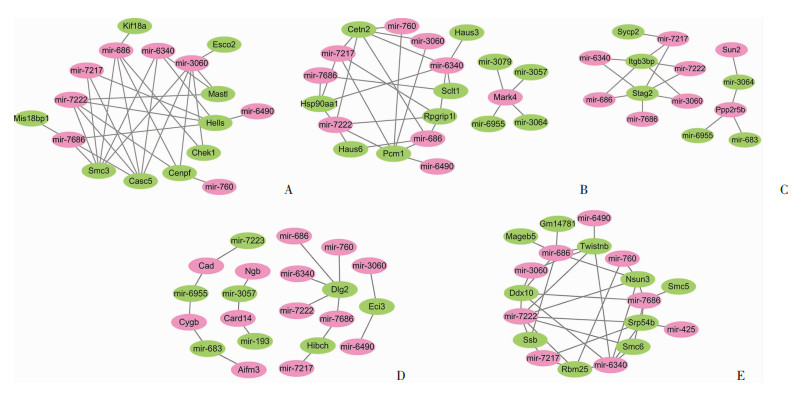
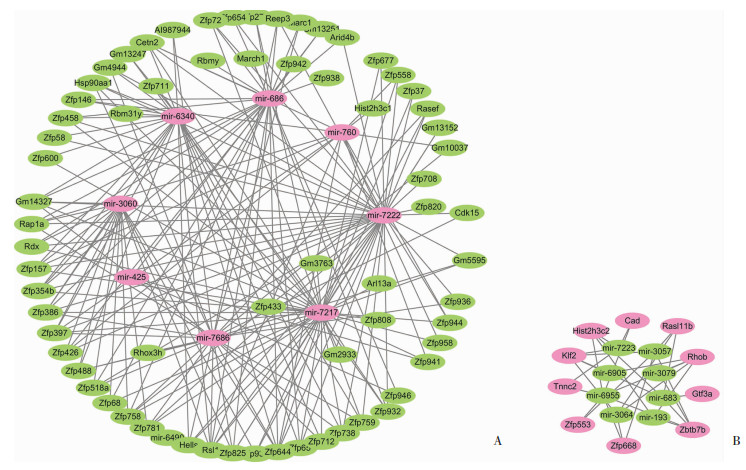
在1 208个差异基因中, 包含17个差异表达miRNAs, 其中mir-193、mir-683、mir-3057、mir-3064、mir-3079、mir-6905、mir-6955和mir-7223在Lrg1敲除小鼠睾丸中表达上调; mir-425、mir-686、mir-760、mir-3060、mir-6340、mir-6490、mir-7217、mir-7222与mir-7686下调。为了揭示失调的miRNAs的生物学意义, 我们用TargetScan 7.1与miRBase 7.0预测其对应的包含于差异基因中的靶基因。如图 7所示, 在与Actrt1关联的104个基因中, 68个下调mRNAs与8个上调miRNAs呈负相关(图 7A), 10个上调mRNAs与8个下调miRNAs呈负相关(图 7B)。此外, 这些miRNAs与PPI网络中核心模块包含的基因亦呈关联(图 8)。这些结果表明Lrg1敲除导致睾丸miRNA-mRNA调节网络失衡, 并进而可能引起睾丸功能异常。
|
| A:上调miRNAs与下调mRNAs; B:下调miRNAs与上调mRNAs; 粉色节点示上调, 浅绿色节点示下调 图 7 Lrg1敲除小鼠与野生小鼠睾丸差异表达miRNAs-mRNA(与Actrt1关联基因)功能调节网络分析 |
3 讨论
此前对Lrg1研究主要集中于肿瘤, 在血管生成中发挥重要作用[5], 炎症可以促进其表达。此外, LRG1促进TGF-β1介导的Lewis肺癌细胞株生长抑制[9]。本研究中, 我们发现Lrg1参与睾丸生殖功能。
免疫荧光实验结果显示, LRG1在睾丸中表达于分化发育早期阶段的生精细胞, 圆形精子与长形精子均无表达。Lrg1敲除雄鼠具有生育能力, 但睾丸形态学分析显示, 退化生精细胞数量增加, 平均每生精小管中圆形精子细胞数量减少, 生精小管直径和周长降低。此外, Lrg1敲除小鼠附睾精子数量和精子活力明显较野生对照小鼠减少。这些结果表明:Lrg1敲除损伤睾丸生精功能。
睾酮对雄性生殖系统的发育至关重要。90%~95%的睾酮由睾丸中的Leydig细胞产生[10]。Lrg1敲除小鼠血清和睾丸内睾酮水平显著低于野生对照小鼠, 表明Lrg1表达缺失扰乱小鼠类固醇激素生成。睾酮产生受到Leydig细胞自分泌、旁分泌因素的精细调控。鉴于LRG1并不表达于Leydig细胞, Lrg1敲除导致的生精细胞发育损伤可能通过旁分泌方式对睾酮产生发挥抑制作用。此外, 由脑垂体分泌的LH负责启动睾酮生成, 其水平由睾酮的负反馈调节控制[11]。血清ELISA检测结果表明Lrg1敲除小鼠血清LH浓度显著降低, 可能是由于低睾酮水平引起反馈调节所致。
为了分析Lrg1敲除对睾丸损伤的分子机制, 我们通过RNA测序分析, 对比分析了野生型对照小鼠与Lrg1敲除小鼠睾丸基因表达谱。结果显示LRG1缺失引起睾丸基因表达谱明显变化, 差异基因主要集中于代谢程序和细胞程序。
在差异表达基因中, 我们观察到Tgf-β1 与Tgf-β2表达均明显增加。Tgf-β信号调节诸多生物学功能, 包括细胞迁移、存活、增殖和分化。此前研究已经证明, LRG1可以直接与高内皮小静脉中的TGF-β1结合, 进而局部调节细胞粘附。此外, LRG1通过诱导细胞凋亡增强TGF-β1在人肝细胞癌Hep3B细胞中的作用[12]。这些报道显示Lrg1可能通过调节Tgf-β信号发挥其生理功能。
在睾丸中, Tgf-β信号亦调节多种细胞过程, 包括睾丸发育、支持细胞紧密连接的动力学和Leydig细胞类固醇生成。在Lrg1敲除小鼠中, Tgf-β1和Tgf-β2均增加, 而Tgf-β信号的缺失或过表达会损害雄性睾丸发育和功能。因此, 本研究结果提示在睾丸中, Lrg1与Tgf-β信号通路也相关, 并可能是造成睾丸损伤的原因之一。此外, Tgf-β1抑制睾丸Leydig细胞中LH介导的类固醇生成[13], 因此, 我们推测Tgf-β1表达上调(至少部分)导致Lrg1敲除小鼠中睾酮水平的降低。
精子发生包括精原细胞的有丝分裂更新和分化、精母细胞的减数分裂和精子形成。差异表达基因GO分析显示, 分类为减数分裂(下调9个, 上调1个)、有丝分裂(下调19个, 上调1个)与染色体分离(下调14个, 上调1个)的基因在Lrg1敲除小鼠的表达多数下调。其中Hormad1、Mastl、Smc1b、Smc2、Smc3、Smc4、Sycp1与Sycp2均归类于减数分裂。Hormad1是含HORMA结构域的编码基因, 在减数分裂生殖细胞中特异性表达。在第1次减数分裂前期, HORMAD1在精母细胞的核中表达, 在粗线期早期达到最高水平[14], 因此, Lrg1敲除导致的Hormad1表达下调可能会损伤减数分裂进程。染色体结构维持(structural maintenance of chromosomes, SMC)家族蛋白成员在染色体结构变化中, 包括染色体凝聚(SMC2/4)和姐妹染色单体黏连(SMC1/3)中发挥关键作用[15]。MASTL是一种蛋白激酶, 缺乏Mastl导致有丝分裂延迟伴随着染色体凝结和异常纺锤体的缺陷[16]。SYCP1是联会复合体横丝的主要结构元件, 是公认的减数分裂的标记物[17]。因此, 这些数据表明, 在LRG1表达缺失的睾丸中, 有丝分裂和减数分裂异常, 这可能导致了生精小管中圆形精子数量的减少。
与GO分析结果对应的是, PPI网络核心模块分析显示, 在5个核心模块中, 其中4个与有丝分裂细胞周期、减数分裂细胞周期和染色体分离有关, 进一步表明Lrg1敲除可能主要通过这些程序损伤生精功能。此外, 15个精子发生关联基因中, 13个下调, 也从基因层面表明Lrg1敲除小鼠睾丸生精功能下降。
睾丸能量代谢的各种改变是精子发生受损和男性生育力降低的风险因素[18-19]。在Lrg1敲除小鼠中, 归类于碳水化合物代谢、含核碱基化合物代谢和蛋白质代谢过程中的多数基因在Lrg1敲除小鼠中表达下调。这些代谢关联基因的变化可能会导致生殖功能异常。
蛋白编码基因的转录受到严格调控, 以维持细胞正常生长和功能。基因转录可受控于转录水平与转录后水平, 前者主要由序列特异性转录因子(transcription factors, TFs), 后者主要受到非编码RNA, 如miRNAs的调控。miRNAs也可调控TF mRNA的转录, 因此miRNAs和TFs可形成复杂的调控网络[20-21]。在差异表达谱中, 我们发现48个C2H2锌指蛋白家族成员表达失调, 其中46个下调, 仅2个上调。锌指蛋白家族成员具有转录抑制活性, 一些锌指蛋白家族基因已被证明在睾丸功能中发挥重要作用[22-23]。因此, 基于锌指蛋白对其下游基因起到抑制转录的作用, 其表达异常可能对睾丸功能产生广泛影响。但由于本研究筛选出的差异表达锌指蛋白尚无功能报道, 与Lrg1关联尚需进一步研究。
此外, 在识别的差异表达基因中, 包含17个miRNA。通过分析其靶基因, 我们建立了miRNA与异常表达mRNA之间的调节网络, 提示Lrg1表达缺失会影响miRNA而调控睾丸基因转录。综合分析, 提示睾丸Lrg1敲除导致睾丸转录调控网络(包括TFs与miRNAs)失调。
综上, 本研究表明LRG1表达于睾丸精原细胞和精母细胞。我们推测Lrg1表达异常可能通过破坏睾丸转录调节网络, 从而影响睾丸精细胞有丝分裂、减数分裂、染色体分离及代谢程序相关基因的表达, 进而损伤睾丸精细胞的发育, 导致精子数量减少与活力下降及类固醇生成功能异常。本研究为男性生殖相关的分子机制研究提供了新的信息。
| [1] | INHORN M C, PATRIZIO P. Infertility around the globe: new thinking on gender, reproductive technologies and global movements in the 21st century[J]. Hum Reprod Update, 2015, 21(4): 411–426. DOI:10.1093/humupd/dmv016 |
| [2] | FURUKAWA K, KAWAMOTO K, EGUCHI H, et al. Clinicopathological significance of leucine-rich alpha2-glycoprotein-1 in sera of patients with pancreatic cancer[J]. Pancreas, 2015, 44(1): 93–98. DOI:10.1097/MPA.0000000000000205 |
| [3] | ZHANG H, CAO J, LI L, et al. Identification of urine protein biomarkers with the potential for early detection of lung cancer[J]. Sci Rep, 2015, 5: 11805. DOI:10.1038/srep11805 |
| [4] | PEKS L, TAVINTHARAN S, WANG X, et al. Elevation of a novel angiogenic factor, leucine-rich-alpha2-glycoprotein (LRG1), is associated with arterial stiffness, endothelial dysfunction, and peripheral arterial disease in patients with type 2 diabetes[J]. J Clin Endocrinol Metab, 2015, 100(4): 1586–1593. DOI:10.1210/jc.2014-3855 |
| [5] | WANG X, ABRAHAM S, MCKENZIE J A G, et al. LRG1 promotes angiogenesis by modulating endothelial TGF-beta signalling[J]. Nature, 2013, 499(7458): 306–311. DOI:10.1038/nature12345 |
| [6] | MATZUK M M, MCKEOWN M R, FILIPPAKOPOULOS P, et al. Small-molecule inhibition of BRDT for male contraception[J]. Cell, 2012, 150(4): 673–684. DOI:10.1016/j.cell.2012.06.045 |
| [7] | LI B, DEWEY C N. RSEM:accurate transcript quantification from RNA-Seq data with or without a reference genome[J]. BMC Bioinformatics, 2011, 12: 323. DOI:10.1186/1471-2105-12-323 |
| [8] | TARAZONA S, GARCIA-ALCALDE F, DOPAZO J, et al. Differential expression in RNA-seq:a matter of depth[J]. Genome Res, 2011, 21(12): 2213–2223. DOI:10.1101/gr.124321.111 |
| [9] | TAKEMOTO N, SERADA S, FUJIMOTO M, et al. Leucine-rich alpha-2-glycoprotein promotes TGFbeta1-mediated growth suppression in the Lewis lung carcinoma cell lines[J]. Oncotarget, 2015, 6(13): 11009–11022. DOI:10.18632/oncotarget.3557 |
| [10] | WANG Y, CHEN F, YE L, et al. Steroidogenesis in Leydig cells: effects of aging and environmental factors[J]. Reproduction, 2017, 154(4): R111–R122. DOI:10.1530/REP-17-0064 |
| [11] | RAMASWAMY S, WEINBAUER G F. Endocrine control of spermatogenesis:Role of FSH and LH/testosterone[J]. Spermatogenesis, 2014, 4(2): e996025. DOI:10.1080/21565562.2014.996025 |
| [12] | LADD J J, BUSALD T, JOHNSON M M, et al. Increased plasma levels of the APC-interacting protein MAPRE1, LRG1, and IGFBP2 preceding a diagnosis of colorectal cancer in women[J]. Cancer Prev Res (Phila), 2012, 5(4): 655–664. DOI:10.1158/1940-6207.CAPR-11-0412 |
| [13] | PARK E, SONG C H, PARK J I, et al. Transforming growth factor-beta1 signaling represses testicular steroidogenesis through cross-talk with orphan nuclear receptor Nur77[J]. PLoS One, 2014, 9(8): e104812. DOI:10.1371/journal.pone.0104812 |
| [14] | WOJTASZ L, DANIEL K, ROIG I, et al. Mouse HORMAD1 and HORMAD2, two conserved meiotic chromosomal proteins, are depleted from synapsed chromosome axes with the help of TRIP13 AAA-ATPase[J]. PLoS Genet, 2009, 5(10): e1000702. DOI:10.1371/journal.pgen.1000702 |
| [15] | UHLMANN F. SMC complexes:from DNA to chromosomes[J]. Nat Rev Mol Cell Biol, 2016, 17(7): 399–412. DOI:10.1038/nrm.2016.30 |
| [16] | ALVAREZ-FERNANDEZ M, SANCHEZ-MARTINEZ R, SANZ-CASTILLO B, et al. Greatwall is essential to prevent mitotic collapse after nuclear envelope breakdown in mammals[J]. Proc Natl Acad Sci U S A, 2013, 110(43): 17374–17379. DOI:10.1073/pnas.1310745110 |
| [17] | SEO E K, CHOI J Y, JEONG J H, et al. Crystal structure of C-terminal coiled-coil domain of SYCP1 reveals non-canonical anti-parallel dimeric structure of transverse filament at the synaptonemal complex[J]. PLoS One, 2016, 11(8): e0161379. DOI:10.1371/journal.pone.0161379 |
| [18] | RATO L, MENESES M J, SILVA B M, et al. New insights on hormones and factors that modulate Sertoli cell metabolism[J]. Histol Histopathol, 2016, 31(5): 499–513. DOI:10.14670/HH-11-717 |
| [19] | RATO L, ALVES M G, SOCORRO S, et al. Metabolic regulation is important for spermatogenesis[J]. Nat Rev Urol, 2012, 9(6): 330–338. DOI:10.1038/nrurol.2012.77 |
| [20] | AGUDA B D. Modeling microRNA-transcription factor networks in cancer[J]. Adv Exp Med Biol, 2013, 774: 149–167. DOI:10.1007/978-94-007-5590-1_9 |
| [21] | ARDA H E, WALHOUT A J. Gene-centered regulatory networks[J]. Brief Funct Genomics, 2010, 9(1): 4–12. DOI:10.1093/bfgp/elp049 |
| [22] | JIN S, CHOI H, KWON J T, et al. Identification of target genes for spermatogenic cell-specific KRAB transcription factor ZFP819 in a male germ cell line[J]. Cell Biosci, 2017, 7: 4. DOI:10.1186/s13578-016-0132-4 |
| [23] | JIN S, CHOI H, KWON J T, et al. Identification and characterization of reproductive KRAB-ZF genes in mice[J]. Gene, 2015, 565(1): 45–55. DOI:10.1016/j.gene.2015.03.059 |