三阴性乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体(human epidermal growth factor receptor-2,HER-2)均表达阴性的一种特殊的乳腺癌亚型,具有侵袭性高和预后差的特点[1-3],其可能原因有广泛的基因组不稳定性、ER缺失、磷酸肌醇3-激酸(PI3K)途径活化、独特的肿瘤微环境、遗传突变等。其中TNBC独特的肿瘤微环境起了较大的作用,其特征是有大量血管内皮生长因子(vascular endothelial growth factor,VEGF)以及更多的肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)和肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)[4]。肿瘤微环境由肿瘤细胞、间质细胞以及免疫细胞构成,肿瘤相关巨噬细胞是肿瘤微环境中的重要成分,所占比例可达间质细胞的50%~80%。研究表明,TAMs的浸润数量与乳腺癌的分期、分级、转移潜力及预后正相关[5]。巨噬细胞在不同的肿瘤微环境刺激下发生不同性质的活化。大致分为两类: M1型经典活化巨噬细胞和M2型替代活化巨噬细胞。M1型巨噬细胞促进抗肿瘤免疫应答,抑制肿瘤生长;而M2型巨噬细胞增强肿瘤细胞迁移和侵袭,促进肿瘤生长[6]。微小RNA(microRNA,miRNA)是长度约为22个核苷酸的小型非编码RNA。每一种癌症都有某些特定的miRNA改变,可以作为一种癌症特异性的“特征”,以提高诊断、预后和治疗靶点的准确性[7]。研究表明,miRNA参与调节许多细胞过程,包括代谢稳态、细胞增殖和细胞凋亡[8],并且通过控制巨噬细胞表型的平衡来达到控制炎症和免疫的特殊作用[9-10]。也有研究发现miR-382的表达水平与乳腺癌的预后密切相关[11],但其对TAMs的极化是否有影响,目前还少见相关报道。本研究探讨过表达miR-382对TAMs极化和TNBC生物学特征的影响,为进一步了解miR-382以及研究TAMs极化在TNBC发生发展中的作用及机制提供新的思路和实验数据。
1 材料与方法 1.1 主要材料及试剂4T1小鼠TNBC细胞株购自中国科学院上海生命科学研究院细胞库;RPMI1640培养基和胎牛血清购自GIBCO公司;逆转录试剂盒和qRT-PCR试剂盒购自TaKaRa公司;Matrigel基质胶购自BD公司;IL-10大鼠单克隆抗体、TNF-α小鼠单克隆抗体、PGC-1α兔多克隆抗体购自Abcam公司,p-NF-κB p65、NF-κB p65抗体购自Cell Signaling公司,GAPDH购自碧云天公司;Fitc标记的CD86、APC标记的CD206单克隆抗体购自Thermo Fisher Scientific公司;过表达miR-382的慢病毒包装(MIMAT0000747)购自上海吉凯基因化学技术有限公司;PCR引物购自重庆金麦生物技术有限公司;Transwell小室(孔径0.4 μm)购自Corning公司。
1.2 方法 1.2.1 细胞培养4T1细胞培养于含有10%胎牛血清(FBS)、1%的青霉素-链霉素双抗的RPMI1640培养基中,在37 ℃、5%CO2及饱和湿度的培养箱中常规培养,用0.25%的胰酶消化传代,实验所用细胞处于对数生长期。
1.2.2 PMs的提取、培养以及TCM的提取PMs的提取方法详见参考文献[12]。将小鼠脱颈椎处死,并浸入75%乙醇中10 s,取出小鼠沥干后用注射器吸取6 mL RPMI1640培养基注入小鼠腹腔中,轻揉小鼠腹部2 min后用注射器将腹腔液吸入离心管中,在1 000 r/min,4 ℃条件下离心10 min,提取的PMs接种在含10%胎牛血清、1%的青霉素-链霉素双抗的RPMI1640培养基中,37 ℃、5%CO2及饱和湿度的培养箱中常培养,实验所用细胞处于对数生长期。4T1细胞在无血清的RPMI1640中培养24 h,收集上清即TCM[13-14],再用完全培养基补充为10%的浓度用于后续实验。
1.2.3 PMs细胞转染将原代培养的PMs以5×105/孔均匀接种至6孔板,每孔培养基为2 mL, 轻轻混匀后常规培养,12 h后在各孔中分别加入15 μL慢病毒颗粒液(干扰、阴性对照),轻柔混匀后置于培养箱培养。72 h后,在荧光显微镜观察细胞转染效率。然后加浓度为2 μg/mL的puromycin筛选细胞,维持加药直到正常细胞全部死完。qRT-PCR进行验证。
1.2.4 Transwell共培养利用Transwell(孔径0.4 μm)共培养[15],将4T1细胞接种于6孔培养板底部,将PMs细胞或过表达miR-382的PMs接种在与6孔培养板匹配的Transwell悬挂小室(孔径0.4 μm),二者分开培养至细胞贴壁后,将贴有PMs细胞的小室移至4T1细胞的6孔板中,建立上下双层细胞共培养体系,无血清培养基培养24 h后用于后续实验。
1.2.5 实验分组PMs(极化指标和PGC-1α、NF-κB表达)相关实验分组:(1)PMs对照组:将5×105/孔的PMs常规培养贴壁后加入完全培养基培养24 h。(2)TAMs实验组:将5×105/孔的PMs常规培养贴壁后加入10%TCM培养24 h。(3)L-TAMs实验组:将5×105/孔的过表达miR-382的PMs常规培养贴壁后加入10%TCM培养24 h。每组实验重复3次。检测4T1细胞(生物学特征)相关实验分组:(1)4T1对照组:无血清培养4T1细胞24 h。(2)4T1+PMs实验组:4T1细胞与PMs进行Transwell共培养24 h。(3)4T1+L-PMs实验组:4T1细胞与过表达miR-382的PMs进行Transwell共培养24 h。每组实验重复3次。
1.2.6 qRT-PCR实验收集各组细胞后采用Trizol提取总RNA,利用TaKaRa试剂盒逆转录RNA成cDNA(反应条件:42 ℃ 10 min→30 ℃ 20 min→99 ℃ 5 min→ 4 ℃ 5 min)再进行qRT-PCR检测,TNF-α、IL-10、PGC-1α以β-actin为内参,具体引物序列见表 1。miR-382以U6为内参,具体引物序列属于金麦生物技术有限公司机密。反应条件:96 ℃ 5 min→(96 ℃ 30 s→57 ℃/59 ℃ 30 s→72 ℃ 30 s)×40次循环→72 ℃ 10 min。
| 引物名称 | 引物序列 | 片段大小/bp |
| TNF-α | 上游5′-CGCTGAGGTCAATCTGCCCAAGTAC-3′下游5′-GGGGGCTGGGTAGAGAATGGATG-3′ | 113 |
| IL-10 | 上游5′-AAGGCAGTGGAGCAGGTGAAGAG-3′下游5′-GCAGGTGTTTTAGCTTTTCATTTTG-3′ | 138 |
| PGC-1α | 上游5′-GCGGGATGATGGAGACAGCTATG-3′下游5′-CGTCCACAAAAGTACAGCTCGAAG-3′ | 129 |
| β-actin | 上游5′-ACCCCGTGCTGCTGACCGAG-3′下游5′-TCCCGGCCAGCCAGGTCCA-3′ | 249 |
1.2.7 流式细胞术分析PMs极化指标
收集各组的PMs,PBS洗2次,离心后加入1 mL 4%多聚甲醛固定10 min,PBS洗2次,离心后加入1 mL 0.1% Triton通透5 min,PBS洗2次,离心后加入CD206和CD86抗体重悬,冰上孵育30 min,PBS洗2次,离心后加入400 μL PBS重悬,流式细胞仪检测细胞极化表型。
1.2.8 流式细胞术分析4T1细胞凋亡率与细胞周期分布收集各组的4T1细胞,用预冷的PBS洗2次,离心后加入400 μL PBS重悬,Annexin-V-FITC/PI双染法检测细胞凋亡率;收集各组的4T1细胞后用预冷的PBS洗2次,然后加入400 μL预冷的75%乙醇重悬,放入4 ℃冰箱过夜后流式细胞仪检测细胞周期分布。
1.2.9 Transwell侵袭实验在上室的聚碳酸酯膜上加入60 μL稀释好的Matrigel基质胶,置于细胞培养箱中37 ℃约1 h使其凝固。然后在上室加入100 μL无血清的1×105/mL的4T1细胞悬液,下室按实验分组分别加入500 μL 1×105/mL的PMs、过表达miR-382的PMs细胞悬液或无细胞的10%FBS的RPMI1640培养基。常规培养24 h后取出上室,多聚甲醛室温固定,PBS洗2次,0.1%结晶紫染色10 min,PBS洗2次,去掉上室液体,将棉签轻轻擦去上室细胞,自然风干后显微镜下观察并计数穿膜细胞数,随机取3个视野取均值。
1.2.10 Western blot实验收集各组细胞后加入全细胞裂解液裂解后提取总蛋白,BCA测定蛋白浓度,上样量为30 μg。10%聚丙烯酰胺凝胶电泳后,PVDF转膜,室温摇床封闭2 h,洗膜后加一抗(1: 1 000)和GAPDH(1: 1 000),4 ℃过夜孵育,洗膜后加对应的二抗(1: 8 000)室温孵育1 h,洗膜后化学发光显色。
1.2.11 激光共聚焦显微镜成像将PMs接种在含有玻片的6孔板中,按照实验分组培养24 h,用4%多聚甲醛在37 ℃固定,PBS洗3次,取出细胞爬片贴于载玻片上,用0.1%的Triton在37 ℃孵育10 min进行透膜,PBS洗3次,加入2%BSA封闭30 min,再加入适量的PGC-1α(1: 300)、NF-κB p65 (1: 400)和p-NF-κB p65(1: 100)抗体4 ℃过夜孵育,次日PBS洗3次,加入荧光二抗(1: 40),37 ℃避光孵育1 h,PBS洗3次,加入适量DAPI在37 ℃孵育5 min,加抗荧光淬灭封片液,激光共聚焦显微镜拍照。
1.3 统计学分析采用SPSS 19.0统计软件,计量资料以x±s表示,两组均数间采用独立样本t检验,多组均数间比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 TCM刺激不同处理的PMs后miR-382的核酸表达变化与PMs组(1.00±0.06)比较,TAMs组miR-382的核酸表达水平(0.50±0.14)明显降低(P < 0.05),而L-TAMs组miR-382的核酸表达水平(2.70±0.56)明显高于PMs组和TAMs组(P < 0.05)。提示4T1细胞与PMs共培养后,TAMs中miR-382核酸表达水平降低,而运用慢病毒介导PMs过表达miR-382后,TAMs中miR-382核酸表达显著升高。
2.2 过表达miR-382对TAMs极化的影响 2.2.1 流式细胞术检测TAMs的极化变化与PMs组比较,TAMs组M1型细胞比例降低1.23%,M2型细胞(CD206)比例增高55.71%(P < 0.05),而L-TAMs组M1型细胞比例增高43.08%(P < 0.05),M2型细胞比例增高约1.62%(P < 0.05);与TAMs组比较,L-TAMs组M1型细胞比例增高44.31%(P < 0.05),而M2型细胞比例降低54.09%(P < 0.05)。这提示TAMs中miR-382的水平影响TAMs的极化表型(表 2)。
| 组别 | M1型细胞(CD86) | M2型细胞(CD206) |
| PMs组 | 4.05±1.55 | 0.36±0.18 |
| TAMs组 | 2.82±1.08 | 56.07±13.71 |
| L-TAMs组 | 47.13±3.40 | 1.98±0.21 |
2.2.2 Western blot检测TAMs的极化变化
与PMs组比较,TAMs组IL-10(M2型分泌因子)蛋白表达水平明显增高(P < 0.05),TNF-α(M1型分泌因子)蛋白表达水平明显降低(P < 0.05),而L-TAMs组IL-10蛋白表达水平明显降低(P < 0.05),TNF-α蛋白表达水平却明显增高(P < 0.05);L-TAMs组与TAMs组比较,IL-10蛋白表达水平明显降低(P < 0.05),TNF-α蛋白表达水平却明显增加(P < 0.05)。见图 1。提示TAMs中miR-382的水平影响TAMs分泌因子表型。

|
| A:Western blot检测IL-10和TNF-α蛋白表达;B:半定量分析;a:P < 0.05,与PMs组比较;b:P < 0.05,与TAMs组比较 图 1 Western blot检测miR-382对TAMs极化的影响 |
2.2.3 qRT-PCR检测TAMs的极化变化
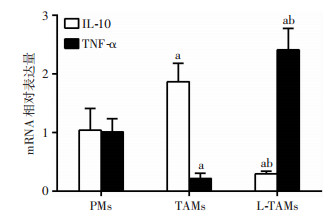
与PMs组比较,TAMs组IL-10核酸表达水平明显增高(P < 0.05),TNF-α核酸表达水平明显降低(P < 0.05),L-TAMs组IL-10核酸表达水平明显降低(P < 0.05),TNF-α核酸表达水平却明显增高(P < 0.05);而L-TAMs组与TAMs组比较,IL-10核酸表达水平明显降低(P < 0.05),TNF-α核酸表达水平却明显增加(P < 0.05)。见图 2。提示TAMs中miR-382的水平影响TAMs分泌因子表型。
|
| a:P < 0.05,与PMs组比较;b:P < 0.05,与TAMs组比较 图 2 qRT-PCR检测miR-382对TAMs极化的影响 |
2.3 过表达miR-382的TAMs对4T1细胞生物特性的影响 2.3.1 对4T1细胞侵袭能力的影响
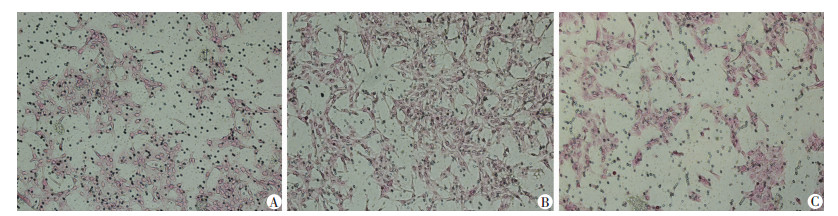
4T1组3个视野的4T1细胞穿膜细胞数为(214.00±28.23)个,4T1+PMs组3个视野的4T1细胞穿膜细胞数为(386.67±12.53)个,4T1+L-PMs组3个视野的4T1细胞穿膜细胞数为(77.00±10.54)个。与4T1组比较,4T1+PMs组的穿膜细胞数增加(P < 0.05),而4T1+L-PMs组的穿膜细胞数减少(P < 0.05);4T1+L-PMs组与4T1+PMs组比较,4T1+L-PMs组的穿膜细胞数明显减少(P < 0.05)。见图 3。提示过表达miR-382的TAMs可以增强4T1细胞的侵袭能力。
|
| A:4T1组;B:4T1+PMs组;C:4T1+L-PMs组 图 3 miR-382对4T1细胞侵袭能力的影响(结晶紫×100) |
2.3.2 对4T1细胞凋亡率的影响
4T1+PMs组4T1细胞的凋亡率(6.30±1.73)%,与4T1组(17.76±2.65)%比降低了约11.46%(P < 0.05),而4T1+L-PMs组(27.80±3.20)%,比4T1组增高了约1.565倍(P < 0.05),而比4T1+PMs组增高了约4.413倍(P < 0.05)。提示过表达miR-382的TAMs可以诱导4T1细胞凋亡。
2.3.3 对4T1细胞周期的影响4T1+L-PMs组4T1细胞的S期百分比(43.03±2.16)%与4T1组(22.83±2.95)%相比升高约24.2%(P < 0.05);而与4T1+PMs组(18.55±1.23)%比较,4T1+L-PMs组升高24.48%(P < 0.05)。提示过表达miR-382的TAMs将4T1细胞阻滞在S期。
2.4 过表达miR-382的TAMs对PGC-1α表达的影响与PMs组(1.00±0.00)比较,TAMs组PGC-1α蛋白表达水平(1.45±0.18)明显增高(P < 0.05),并且是在细胞核大量表达,而L-TAMs组PGC-1α蛋白表达水平(0.45±0.14)降低(P < 0.05);L-TAMs组与TAMs组比较,L-TAMs组PGC-1α蛋白表达水平明显降低(P < 0.05),并且在细胞浆中表达(图 4)。同时,与PMs组(1.00±0.12)比较,TAMs组PGC-1α核酸表达水平(2.15±0.30)明显增高(P < 0.05),而L-TAMs组PGC-1α核酸表达水平(0.52±0.03)降低(P < 0.05);L-TAMs组与TAMs组比较,L-TAMs组PGC-1α核酸表达水平明显降低(P < 0.05)。提示TAMs中miR-382的水平影响PGC-1α的表达,过表达的miR-382抑制PGC-1α的表达。

|
| A:Western blot检测PGC-1α蛋白表达;B:激光共聚焦显微镜观察PGC-1α蛋白的表达与分布情况 图 4 miR-382对PGC-1α表达的影响 |
2.5 过表达miR-382的TAMs对NF-κB转录活性的影响
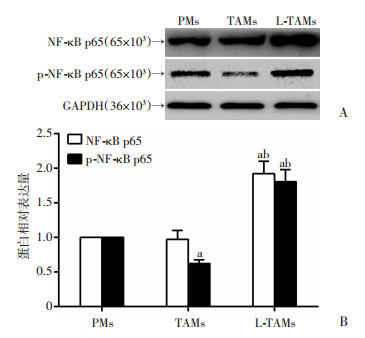
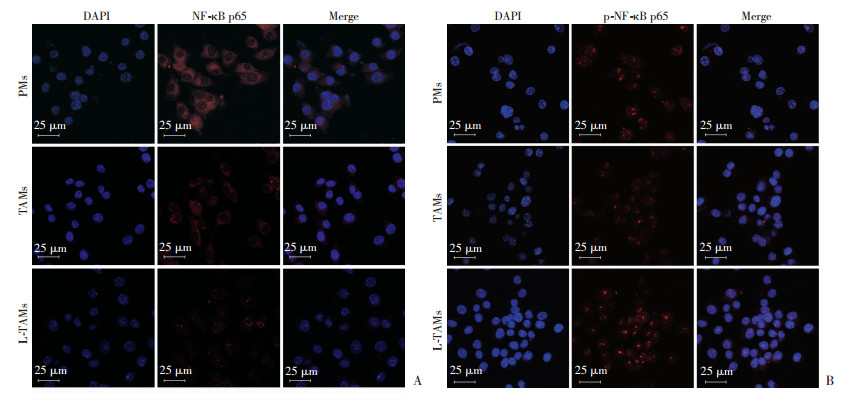
如图 5所示,与PMs组比较,TAMs组NF-κB p65蛋白表达水平无统计学差异;L-TAMs组与TAMs组比较,NF-κB p65蛋白表达水平明显增高(P < 0.05);与PMs组比较,TAMs组p-NF-κB p65蛋白表达水平明显下降(P < 0.05),而L-TAMs组表达水平明显增高(P < 0.05)。与TAMs组比较,L-TAMs组p-NF-κB p65蛋白表达水平明显增高(P < 0.05)。图 6所示:PMs组与TAMs组NF-κB p65蛋白表达位于细胞质中,而L-TAMs组NF-κB p65蛋白在细胞核内有表达;L-TAMs组与PMs组和TAMs组比较,p-NF-κB p65蛋白表达水平明显增高(P < 0.05),并且在细胞核内大量表达。提示TAMs中miR-382的水平影响NF-κB的转录活性,过表达的miR-382增强了NF-κB的转录活性。
|
| A: Western blot检测NF-κB p65和p-NF-κB p65蛋白表达;B:半定量分析;a:P < 0.05,与PMs组比较;b:P < 0.05,与TAMs组比较 图 5 Western blot检测NF-κB p65和p-NF-κB p65蛋白表达 |
|
| A:NF-κB p65蛋白的表达与分布情况;B:p-NF-κB p65蛋白的表达与分布情况 图 6 激光共聚焦显微镜观察NF-κB的转录活性 |
3 讨论
TNBC占所有乳腺癌的15%~20%,具有独特的临床病理特征,如高病理组织学分级、易局部复发、转移早、侵袭性强、预后差等特点[1-2]。探索TNBC生长和转移的分子机制, 准确识别TNBC有效靶点是亟待解决的问题。TAMs在肿瘤微环境中起着重要作用,根据功能表型不同,巨噬细胞大致分为M1型和M2型,在乳腺癌肿瘤微环境刺激下,TAMs接近于M2型,M2型TAMs为肿瘤的生长提供了有利的微环境[16]。多个miRNA被证明是巨噬细胞生理和病理事件的重要介质[17-18],异常的miRNA通过作用于细胞信号、基因表达和巨噬细胞的形态特征来调节巨噬细胞的炎症性表型[19-20]。我们的前期研究发现,用TCM刺激PMs形成TAMs后,TAMs中miR-382的表达水平下调,同时伴有TAMs呈M2型极化,分泌大量IL-10(M2型分泌因子),使共培养中TNBC细胞的侵袭能力增强并且凋亡率降低。为了更好地了解TNBC肿瘤微环境对TAMs中miR-382的表达影响,以及TAMs中miR-382的表达变化对TNBC细胞的作用,我们运用慢病毒介导PMs过表达miR-382,使TAMs过表达miR-382后发现,miR-382低表达的TAMs呈M2型极化,分泌大量IL-10。而过表达miR-382的TAMs抑制其M2型极化趋势,促进TAMs向M1型极化,分泌大量TNF-α(M1型分泌因子)。发生上述变化的TAMs可以进一步改变共培养体系中TNBC细胞的生物学特性,主要表现为TAMs使共培养中的TNBC细胞侵袭能力增强,凋亡率下降。而TAMs过表达miR-382后,TNBC细胞的侵袭能力减弱,凋亡率增高,并且使TNBC细胞阻滞在S期,抑制TNBC细胞的增殖。
在上述实验的基础上,我们进一步对其机制进行了研究。PGC-1α是PGC-1家族的亚型之一,是过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的辅激活因子[21]。乳腺癌等转移性癌细胞的特异性有利于线粒体呼吸和增加的ATP产生,并且利用转录共激活物PGC-1α,以增强氧化磷酸化,线粒体生物合成和耗氧率,所以PGC-1α的表达水平与TNBC细胞的侵袭能力和转移能力呈负相关[22-23]。多个miRNA参与PGC-1α表达调控,miR-217对PGC-1α起抑制作用,PGC-1α的下调促进乳腺癌的增殖[24]。NF-κB(nuclear factor-kapa B)家族中异源二聚体p65/p50是最常见的形式,NF-κB(p50/p65聚体)同其抑制蛋白IκB组合构成复合物以保持无活性状态存在于细胞质中,当IκB被磷酸化之后,NF-κB被释放出,并转位到细胞核[25]。PGC-1α对NF-κB有调节作用,PGC-1α的过表达可抑制NF-κB的活性,因此抑制TAMs中TNF-α、IL-12和IL-1β等M1型炎症因子的分泌,促进TGF-β与IL-10等M2型炎症因子的分泌[26]。此外,PGC-1在癌细胞的增殖和侵袭过程中增强了线粒体呼吸并且抑制了NF-κB的活性,抑制PGC-1α表达能够显著降低癌细胞的增殖和侵袭能力[21]。在本实验中发现,与正常PMs比较,TAMs中PGC-1α的蛋白表达水平以及核酸表达水平均增高,p-NF-κB p65的表达减低,NF-κB的转录活性降低。而在过表达miR-382的TAMs中,PGC-1α的蛋白表达水平与核酸表达水平下降,p-NF-κB p65的蛋白表达水平增高并且在细胞核内大量表达,NF-κB的转录活性增强。因此我们推测,miR-382对TAMs极化调控的具体机制可能与TAMs过表达miR-382后抑制PGC-1α的表达,解除了其对NF-κB转录活性的抑制作用有关。
综上所述,我们推测在TNBC中,TAMs的miR-382通过抑制PGC-1α的表达、增强NF-κB的转录活性,抑制TAMs的M2型分化,进而抑制TNBC细胞的增殖和侵袭。
| [1] | COSTA R, SHAH A N, SANTA-MARIA C A, et al. Targeting epidermal growth factor receptor in triple negative breast cancer:new discoveries and practical insights for drug development[J]. Cancer Treat Rev, 2017, 53: 111–119. DOI:10.1016/j.ctrv.2016.12.010 |
| [2] | DENKERT C, LIEDTKE C, TUTT A, et al. Molecular alterations in triple-negative breast cancer-the road to new treatment strategies[J]. Lancet, 2017, 389(10087): 2430–2442. DOI:10.1016/S0140-6736(16)32454-0 |
| [3] |
余腾骅, 王智亮, 赵晨晖, 等. 雌激素激活GPR30/ERK通路促进三阴性乳腺癌MDA-MB-468细胞迁移及侵袭[J].
第三军医大学学报, 2014, 36(20): 2077–2082.
YU T H, WANG Z L, ZHAO C H, et al. Estrogen enhances migration and invasion in triple-negative breast cancer MDA-MB-468 cells via activating GPR30/ERK signaling pathway[J]. J Third Mil Med Univ, 2014, 36(20): 2077–2082. |
| [4] | YU T, DI G. Role of tumor microenvironment in triple-negative breast cancer and its prognostic significance[J]. Chin J Cancer Res, 2017, 29(3): 237–252. DOI:10.21147/j.issn.1000-9604.2017.03.10 |
| [5] | HAO N B, LU M H, FAN Y H, et al. Macrophages in tumor microenvironments and the progression of tumors[J]. Clin Dev Immunol, 2012, 2012: 948098. DOI:10.1155/2012/948098 |
| [6] | FUJIMOTO H, SANGAI T, ISHⅡ G, et al. Stromal MCP-1 in mammary tumors induces tumor-associated macrophage infiltration and contributes to tumor progression[J]. Int J Cancer, 2009, 125(6): 1276–1284. DOI:10.1002/ijc.24378 |
| [7] | MAR-AGUILAR F, MENDOZA-RAMIREZ J A, MALAGON-SANTIAGO I, et al. Serum circulating microRNA profiling for identification of potential breast cancer biomarkers[J]. Dis Markers, 2013, 34(3): 163–169. DOI:10.3233/DMA-120957 |
| [8] | CALIN G A, CROCE C M. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006, 6(11): 857–866. DOI:10.1038/nrc1997 |
| [9] | DENARDO D G, BRENNAN D J, REXHEPAJ E, et al. Leukocyte complexity predicts breast cancer survival and functionally regulates response to chemotherapy[J]. Cancer Discov, 2011, 1(1): 54–67. DOI:10.1158/2159-8274.CD-10-0028 |
| [10] | YUAN Z Y, LUO R Z, PENG R J, et al. High infiltration of tumor-associated macrophages in triple-negative breast cancer is associated with a higher risk of distant metastasis[J]. Onco Targets Ther, 2014, 7: 1475–1480. DOI:10.2147/OTT.S61838 |
| [11] | MING J, ZHOU Y, DU J, et al. miR-381 suppresses C/EBP-dependent Cx43 expression in breast cancer cells[J]. Biosci Rep, 2015, 35(6): e00266–e00266. DOI:10.1042/bsr20150167 |
| [12] | PINEDA-TORRA I, GAGE M, DE JUAN A, et al. Isolation, culture, and polarization of murine bone marrow-derived and peritoneal macrophages[J]. Methods Mol Biol, 2015, 1339: 101–109. DOI:10.1007/978-1-4939-2929-0_6 |
| [13] | COLEGIO O R, CHU N Q, SZABO A L, et al. Functional polarization of tumour-associated macrophages by tumour-derived lactic acid[J]. Nature, 2014, 513(7519): 559–563. DOI:10.1038/nature13490 |
| [14] | YAN W, LIU X, MA H, et al. Tim-3 fosters HCC development by enhancing TGF-β-mediated alternative activation of macrophages[J]. Gut, 2015, 64(10): 1593–1604. DOI:10.1136/gutjnl-2014-307671 |
| [15] | ZHANG B, WANG J, GAO J, et al. Alternatively activated RAW264.7 macrophages enhance tumor lymphangiogenesis in mouse lung adenocarcinoma[J]. J Cell Biochem, 2009, 107(1): 134–143. DOI:10.1002/jcb.22110 |
| [16] | COFFELT S B, TAL A O, SCHOLZ A, et al. Angiopoietin-2 regulates gene expression in TIE2-expressing monocytes and augments their inherent proangiogenic functions[J]. Cancer Res, 2010, 70(13): 5270–5280. DOI:10.1158/0008-5472.CAN-10-0012 |
| [17] | PONOMAREV E D, VEREMEYKO T, BARTENEVA N, et al. MicroRNA-124 promotes microglia quiescence and suppresses EAE by deactivating macrophages via the C/EBP-α-PU.1 pathway[J]. Nat Med, 2011, 17(1): 64–70. DOI:10.1038/nm.2266 |
| [18] | MENG Q L, LIU F, YANG X Y, et al. Identification of latent tuberculosis infection-related microRNAs in human U937 macrophages expressing Mycobacterium tuberculosis Hsp16.3[J]. BMC Microbiol, 2014, 14: 37. DOI:10.1186/1471-2180-14-37 |
| [19] | GRAFF J W, DICKSON A M, CLAY G, et al. Identifying functional microRNAs in macrophages with polarized phenotypes[J]. J Biol Chem, 2012, 287(26): 21816–21825. DOI:10.1074/jbc.M111.327031 |
| [20] | ZHANG Y, ZHANG M, ZHONG M, et al. Expression profiles of miRNAs in polarized macrophages[J]. Int J Mol Med, 2013, 31(4): 797–802. DOI:10.3892/ijmm.2013.1260 |
| [21] | PUIGSERVER P, WU Z, PARK C W, et al. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis[J]. Cell, 1998, 92(6): 829–839. DOI:10.1016/s0092-8674(00)81410-5 |
| [22] | LEBLEU V S, O'CONNELL J T, GONZALEZ HERRERA K N, et al. PGC-1α mediates mitochondrial biogenesis and oxidative phosphorylation in cancer cells to promote metastasis[J]. Nat Cell Biol, 2014, 16(10): 992–1003. DOI:10.1038/ncb3039 |
| [23] | MCGUIRK S, GRAVEL S P, DEBLOIS G, et al. PGC-1α supports glutamine metabolism in breast cancer[J]. Cancer Metab, 2013, 1(1): 22. DOI:10.1186/2049-3002-1-22 |
| [24] | ZHANG S, LIU X, LIU J, et al. PGC-1 alpha interacts with microRNA-217 to functionally regulate breast cancer cell proliferation[J]. Biomed Pharmacother, 2017, 85: 541–548. DOI:10.1016/j.biopha.2016.11.062 |
| [25] | CHEW C L, CONOS S A, UNAL B, et al. Noncoding RNAs:Master Regulators of Inflammatory Signaling[J]. Trends Mol Med, 2018, 24(1): 66–84. DOI:10.1016/j.molmed.2017.11.003 |
| [26] | FURRER R, EISELE P S, SCHMIDT A, et al. Paracrine cross-talk between skeletal muscle and macrophages in exercise by PGC-1α-controlled BNP[J]. Sci Rep, 2017, 7: 40789. DOI:10.1038/srep40789 |



