2. 510080 广州, 中山大学附属第一医院:特需医疗与健康管理中心门诊;
3. 516081 广东 惠州, 中大惠亚医院外科
2. Clinic of Private and Health Care Unit, the First Affiliated Hospital of Sun Yat-sen University, Guangzhou, Guangdong Province, 510080;
3. Department of Surgery, Zhongda Huiya Hospital, Huizhou, Guangdong Province, 516081, China
动脉粥样硬化是许多外周动脉疾病重要的发病基础,包括下肢动脉、冠状动脉及脑动脉狭窄或闭塞等[1]。随着我国人民生活水平的提高及人口老龄化的日趋加重,各种动脉粥样硬化性疾病的发病率逐年提高。动脉粥样硬化被认为是一类炎症性疾病,而近期研究人员认为NLRP3(NLR family pyrin domain containing 3)炎性体介导的天然免疫反应就是重要的一类炎症参与者[2]。NLRP3炎性体是一种多蛋白复合物,主要由NLRP3蛋白、ASC蛋白及pro-Caspase-1蛋白构成。其激活的主要作用是使pro-Caspase-1蛋白(蛋白分子量为45×103)被剪切转变为具有生物学活性的Caspase-1蛋白(蛋白分子量为20×103),继而促进炎症因子IL-1β的产生与释放[3]。近年有文献报道,NLRP3炎性体激活不仅可以促进IL-1β释放,还会增加高迁移率族蛋白B1(high mobility group box 1,HMGB1)释放[4-5]。HMGB1最初被认为是一种高度保守的DNA结合蛋白,与DNA的转录、复制与修复密切相关。然而,当HMGB1被释放到细胞以外后,可与免疫受体结合,包括Toll样受体(Toll-like receptors,TLRs)和晚期糖基化终产物受体(receptor of advanced glycation endproducts, RAGE),成为一类炎症因子并促进炎症反应的发生[6-9]。有研究发现动脉平滑肌细胞与HMGB1关系密切,不但是动脉粥样硬化发病过程中HMGB1的主要来源之一,也是HMGB1重要的作用靶细胞[10]。HMGB1可以显著促进血管平滑肌细胞增殖、迁移、凋亡及钙化,而这些生物学功能与动脉粥样硬化的发生、下肢动脉硬化闭塞症患者支架内再狭窄等一系列病理过程密切相关[11-12]。因此,寻找一种可以抑制平滑肌细胞HMGB1释放的调控因子至关重要。
MicroRNAs(miRNAs)是一类由内源基因编码的长度为18~24个核苷酸的非编码单链RNA分子[13-14]。miRNAs主要通过与靶向结合靶基因的3′UTR端,直接降解靶基因mRNA片段或抑制蛋白翻译,在转录后水平调控靶基因的mRNA[15]。我们前期研究表明,血细胞分泌的miR-223不但可进入到动脉平滑肌细胞中,还对细胞的生物功能发挥调控作用,具有显著的抗动脉粥样硬化作用[16]。通过生物信息学预测NLRP3可能是miR-223的靶基因之一,而NLRP3炎性体及其下游的HMGB1蛋白均为动脉粥样硬化不可或缺的参与者。本研究分析miR-223调节NLRP3炎性体表达及调控血管平滑肌细胞释放HMGB1的具体机制,阐明miR-223在动脉粥样硬化中的调控作用,以期为动脉粥样硬化的防治提供新的思路。
1 材料与方法 1.1 实验材料 1.1.1 动脉组织标本、质粒及细胞系下肢动脉组织来源于我院严重外伤截肢患者或健康器官捐献者,标本均取自2015年9月至2016年9月中山大学附属第一医院收治的患者,标本取材经患者及家属知情并签署同意书,本研究通过中山大学附属第一医院伦理委员会批准(伦审[2015]07号)。荧光素报告基因表达质粒和荧光素报告基因检测试剂盒购于美国Promega公司,293T细胞系由本科室保存。
1.1.2 主要试剂DMEM培养基、Opti-MEM优化培养基购于美国Gibco公司,胎牛血清、Lipofectamine RNAiMAX转染试剂、Lipo2000转染试剂、Trizol、青霉素-链霉素混合溶液购于美国Invitrogen公司,RIPA蛋白裂解液购于美国CST公司,mRNA逆转录试剂盒、mRNA qRT-PCR试剂盒购于大连TaKaRa公司,NLRP3抗体购于美国Sigma-Aldrich公司,Caspase-1抗体、GAPDH抗体、山羊抗兔二抗购于美国CST公司,酶联免疫吸附测定试剂盒购于日本Shino-Test公司,脂多糖(LPS)、腺嘌呤核苷三磷酸(ATP)购于美国Sigma- Aldrich公司。
1.2 实验方法 1.2.1 原代人动脉平滑肌(human arterial smooth muscle cells,HASMCs)的培育及鉴定收集严重外伤截肢患者或健康器官捐献者的下肢股动脉组织,离体的动脉组织标本迅速置入4 ℃含20%胎牛血清(FBS)DMEM培养基内,超净台无菌环境内清除结缔组织,剥除动脉外膜。纵向剖开动脉,用显微镊刮除内膜以去除内皮细胞。将中膜组织置于另一培养皿中,倒入含20%胎牛血清(FBS)DMEM培养基,用显微剪反复剪切成3 mm×3 mm大小的组织块。将剪切好的组织小块均匀摆置于培养瓶底,瓶底朝上并向瓶内注入适量培养液(20% FBS+DMEM+100 U/mL青霉素及链霉素双抗),于37 ℃孵箱内放置使组织块与瓶壁贴附紧密。2 h后将培养瓶慢慢翻转平放,使组织块完全浸入完全培养基中,继续放入细胞培养箱内静置培养,待细胞长出后进行形态学观察,并通过免疫荧光检测SM-α-actin蛋白的表达情况进行细胞纯度鉴定。本研究中实验均采用第3~8代细胞进行。
1.2.2 细胞转染将对数生长期(第3~8代)HASMCs接种到培养板,24 h后待细胞生长至密度为60%~80%时,利用Lipofectamine RNAiMAX进行转染。根据说明书,将miR-223 mimic及对应的miR-223阴性对照加入Opti-MEM优化培养基,随后加入Lipofectamine RNAiMAX混合成转染复合物,使miR-223 mimic及miR-223阴性对照最终浓度为50 nmol/L或100 nmol/L。转染复合物在常温下孵育20 min后分别加入6孔板中,并加入不含双抗的完全培养基。培养箱内转染8 h后更换为不含双抗的10% FBS+DMEM高糖培养基。
1.2.3 NLRP3炎性体激活HASMCs培养于含有10% FBS的DMEM培养基中,待细胞融合度至60%~80%时,加入脂多糖(LPS)预处理16 h后换为无血清培养基培养,随后加入5 mmol/L ATP刺激1 h。按照试剂盒说明书采用ELISA方法检测细胞上清中HMGB1含量,或提取细胞RNA及蛋白,检测细胞内相应RNA及蛋白变化。细胞分组:空白对照组、LPS刺激组、ATP刺激组、LPS 100 ng/mL+ATP刺激组,LPS 500 ng/mL+ATP刺激组,LPS 1 000 ng/mL+ATP刺激组。所有实验重复3次。
1.2.4 实时荧光定量PCR(qRT-PCR)利用Trizol试剂提取HASMCs总RNA,检测总RNA含量及纯度后通过试剂盒反转录成cDNA。最后通过实时荧光定量PCR对目的RNA进行定量测定。所有实验步骤按照厂家提供说明书进行。使用引物序列:GAPDH上游引物5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物5′-TGGTGAAGACGCCAGTGGA-3′,片段大小138 bp;NLRP3上游引物5′-AGCCTGGGCAACAATGACCT-3′,下游引物5′-CACTCCTACCAAGAAGGCTCAAAGA-3′,片段大小194 bp;has-miR-223引物5′-CTGGTCCTAGTCAAATACCCCA-3′,片段大小64 bp;U6引物5′-ACGCAAATTCGTGAACGTT-3′,片段大小90 bp。所有实验重复3次。
1.2.5 免疫印迹(Western blot)使用RIPA裂解试剂(加入蛋白酶抑制剂)提取各处理组HASMCs的总蛋白,提取后采用BCA方法测量蛋白浓度。等量的各组总蛋白通过SDS-PAGE分离后电转至PVDF膜,随后用5%脱脂牛奶室温封闭非特异性位点,2 h后置于4 ℃孵育一抗(1: 500)过夜。TBST洗涤3遍后使用辣根过氧化物酶标记二抗(1: 2 000)室温孵育1 h,蛋白采用ECL发光法检测蛋白表达量,并通过GE Image Quant Las 4000 mini成像系统(GE, 美国)拍摄并保存图像。所有实验重复3次。
1.2.6 酶联免疫吸附测定(ELISA)各组HASMCs经过相应处理后,收集细胞上清液后立刻放置于-80 ℃超低温冰箱保存备用。各组HASMCs细胞上清液中HMGB1的含量通过ELISA试剂盒检测,具体步骤遵循试剂盒说明书。所有实验重复3次。
1.2.7 双荧光素酶报告基因系统分别构建野生型及突变型的NLRP3-3′-UTR荧光素酶psi-Check2载体,利用Lipo 2000将载体与miR-223 mimic(或miR-223阴性对照或miR-223抑制剂)共转染进入293T细胞,并按照试剂盒操作说明测定荧光素酶活性。各处理组活性差异,即△活性倍数=实验组(海肾荧光素酶/萤火虫荧光素酶)/对照组(海肾荧光素酶/萤火虫荧光素酶)。所有实验重复3次。
1.3 统计学分析采用GraphPad Prism 5.0和SPSS 19.0统计软件,计量资料以x±s表示,采用t检验,变异性使用方差检验。检验水准α=0.05。
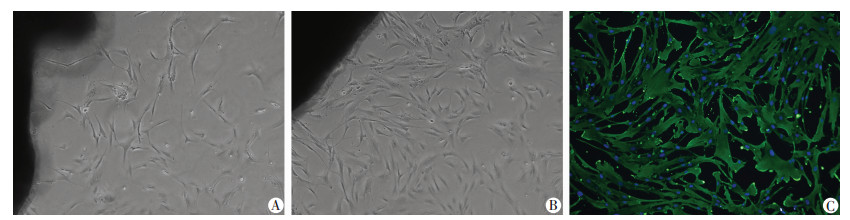
2 结果 2.1 原代HASMCs的培育与鉴定利用组织块贴壁法分离培养原代HASMCs,倒置显微镜下可见大量原代细胞从动脉组织块边缘爬出,呈长梭形或星形,具有“峰-谷”样的生长特点,即细胞生长密度疏密相互交错(图 1A、B)。通过细胞免疫荧光技术对第3~4代细胞进行鉴定,荧光倒置显微镜下观察发现:几乎所有长梭形细胞表达SM-α-actin(图 1C),证实分离出的原代细胞为HASMCs。
|
| A、B:倒置显微镜观察原代HASMCs从组织块边缘爬出, 呈典型的“峰-谷”样的生长特点(×50);C:细胞免疫荧光技术检测HASMCs内SM-α-actin表达(×100) 图 1 原代HASMCs分离及鉴定结果 |
2.2 LPS联合ATP诱导HASMCs内NLRP3炎性体的激活
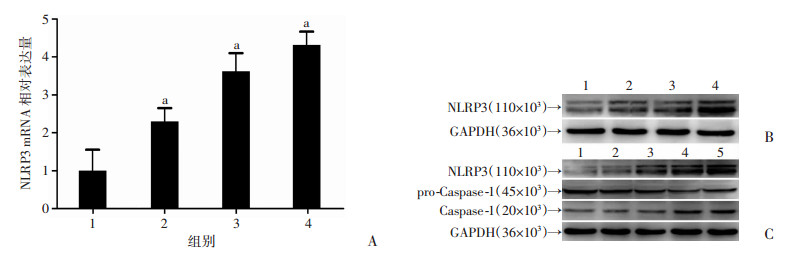
HASMCs分别加入了不同浓度的LPS(100、500、1 000 ng/mL)后,分别通过RT-qPCR及Western blot检测细胞内NLRP3 mRNA及蛋白表达情况。RT-qPCR及Western blot结果显示:相对于空白对照组,加入LPS可以提高HASMCs内NLRP3的mRNA(图 2A,P < 0.01)及蛋白水平(图 2B,P < 0.05),并与LPS浓度呈正相关。HASMCs分别加入LPS及ATP后,Western blot检测细胞内NLRP3炎性体含量及其活性,结果显示:LPS联合ATP可以上调HASMCs内NLRP3的蛋白表达(P < 0.05),而且还可以提高细胞内活性状态Caspase-1的表达量(图 2C,P < 0.05),提示LPS联合ATP可以诱导细胞内NLRP3炎性体的装配及激活。
|
| A:RT-qPCR检测HASMCs内NLRP3 mRNA表达量;1:空白对照组, 2:LPS(100 ng/mL)组, 3:LPS(500 ng/mL), 4:LPS(1 000 ng/mL)组;a:P < 0.01,与空白对照组比较;B:Western blot检测HASMCs内NLRP3蛋白表达量;1:空白对照组,2: LPS(100 ng/mL)组,3:LPS(500 ng/mL),4:LPS(1 000 ng/ml)组;C:Western blot检测HASMCs细胞NLRP3及Caspase-1蛋白表达量;1:空白对照组,2:ATP(5 mmol/L)组,3:LPS(100 ng/mL)组,4:ATP(5 mmol/L)+LPS(100 ng/mL)组,5:ATP(5 mmol/L)+LPS(500 ng/mL)组 图 2 RT-qPCR和Western blot检测LPS和ATP对HASMCs内NLRP3炎性体的影响 |
2.3 NLRP3炎性体激活促进HASMCs释放HMGB1
HASMCs分别加入LPS及ATP后,通过ELISA检测细胞上清HMGB1的含量。结果显示:LPS联合ATP作用于HASMCs后,可以显著提高细胞上清中HMGB1的含量(图 3A,P < 0.01),提示LPS联合ATP促进HASMCs向胞外分泌HMGB1。进一步实验中,在LPS和ATP激活HASMCs内NLRP3炎性体的基础上加入Caspase-1抑制剂ZYVAD-FMK,通过ELISA检测细胞上清HMGB1的含量,结果显示:加入ZYVAD-FMK后可以显著减少细胞上清HMGB1的含量(图 3B,P < 0.01),提示LPS联合ATP激活HASMCs内NLRP3炎性体的同时,可以通过Caspase-1促进HASMCs释放HMGB1。

|
| A:ELISA检测HASMCs上清中HMGB1含量;1:空白对照组,2:ATP(5 mmol/L)组,3:LPS(100 ng/mL)组,4:ATP(5 mmol/L)+LPS(100 ng/mL)组,5:ATP(5 mmol/L)+LPS(500 ng/mL)组;a:P < 0.05,b:P < 0.01,与ATP(5 mmol/L)组及LPS(100 ng/mL)组比较;B:ELISA检测HASMCs上清中HMGB1含量;1:空白对照组,2:ATP(5 mmol/L)+LPS(500 ng/mL)组,3:ATP(5 mmol/L)+LPS(500 ng/mL)+DMSO组,4:ATP(5 mmol/L)+LPS (500 ng/mL)+ZYVAD-FMK;a: P < 0.05,与ATP(5 mmol/L)+ LPS(500 ng/mL)+DMSO组比较 图 3 ELISA检测NLRP3炎性体激活对HASMCs上清HMGB1含量的影响 |
2.4 miR-223靶向抑制HASMCs中NLRP3表达
通过TargetScan等生物信息学预测网站得出NLRP3可能是miR-223的直接靶基因。为明确miR-223是否靶向调节NLRP3,我们转染miR-223进入HASMCs,通过RT-qPCR及Western blot检测细胞内NLRP3 mRNA及蛋白表达情况。结果显示:转染miR-223不仅可以显著下调HASMCs内NLRP3 mRNA水平,还能明显减少NLRP3蛋白表达(图 4A、B,P < 0.05)。进一步构建NLRP3的3′UTR报告质粒,利用双荧光素酶报告系统,对miR-223的靶点进行验证,发现过表达miR-223的NLRP3野生型载体报告基因荧光素酶活性显著较对照组下调(P < 0.01),而抑制miR-223表达荧光素酶活性则升高,相反在突变型载体报告基因荧光素酶活性则无明显改变(图 4C,P < 0.05),提示NLRP3为miR-223直接靶基因。

|
| A:miR-223对NLRP3 mRNA表达水平的影响;1:对照组,2:miR-223阴性对照组,3:miR-223 mimic组(50 nmol/L);a:P < 0.05,与miR-223阴性对照组比较;B:miR-223对NLRP3蛋白表达水平的影响;1:对照组,2:miR-223阴性对照组,3:miR-223 mimic组(50 nmol/L);C:293T细胞中miR-223对荧光素酶表达的影响;1:对照组,2:miR-223阴性对照组,3:miR-223组(50 nmol/L),4:miR-223抑制剂阴性对照组,5:miR-223抑制剂组;a:P < 0.01,与miR-223阴性对照组比较;b:P < 0.05,与miR-223抑制剂阴性对照组比较 图 4 miR-223对NLRP3的靶向调控作用 |
2.5 miR-223通过抑制NLRP3蛋白抑制HMGB1释放
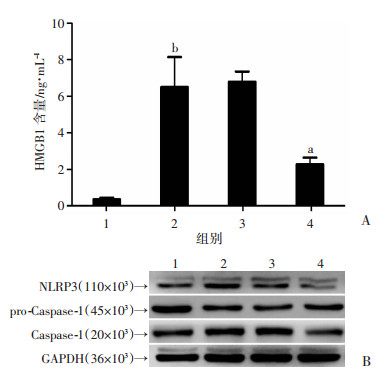
在LPS和ATP激活HASMCs内NLRP3炎性体的基础上转染miR-223mimic,通过ELISA检测HASMCs上清中HMGB1的含量,发现转染miR-223mimic后可以显著抑制NLRP3表达及炎性体的激活(P < 0.05),同时减少Caspase-1的形成(P < 0.05),继而显著减少细胞上清HMGB1的含量(图 5,P < 0.01),提示miR-223可以通过抑制NLRP3蛋白抑制HMGB1释放。
|
|
1:空白对照组;2:ATP(5 mmol/L)+LPS(500 ng/mL)组;3:ATP(5 mmol/L)+LPS(500 ng/mL)+miR-223阴性对照组;4:ATP(5 mmol/L)+LPS(500 ng/mL)+miR-223(50 nmol/L)组 A:ELISA检测HASMCs上清中HMGB1含量a:P < 0.05,与ATP(5 mmol/L)+LPS(500 ng/mL)+miR-223阴性对照组比较;b:P < 0.01,与空白对照组比较;B:HASMCs细胞Western blot检测结果 图 5 miR-223对HASMCs上清中HMGB1含量的影响 |
3 讨论
天然免疫反应是人体抵御病原微生物第一道防线,也是动脉粥样硬化的重要过程之一。越来越多的证据表明,慢性血管炎症伴随动脉粥样硬化每一个发病阶段,是动脉粥样硬化发病的使动因素之一[17-20]。天然免疫反应的激活依赖模式识别受体(pattern recognition receptors,PRRs)识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)或内源性危险相关分子模式(danger-associated molecular patterns,DAMPs),继而通过下游一系列分子信号产生炎症因子,介导炎症反应。目前研究发现模式识别受体共有四类,分别为Toll样受体(TLRs)、NOD样受体(NLRs)、RIG样解螺旋酶(RLHs)和C-型凝集素(CTLs)。在这些PRRs中,NLR受体家族是十分重要的一类。而在NLRs家族的众多成员中,NLRP3又是最为重要,也是研究最为深入的一种。NLRP3蛋白在正常细胞中表达含量较低,然而一旦细胞受到炎症刺激后则表达上调。当NLRP3蛋白表达水平达到阈值后则可装配形成NLRP3炎性体。NLRP3炎性体激活需要两步。首先,病原体或内源性病原相关分子模式结合模式识别受体(一般是Toll样受体)后激活NF-κB通路诱发pro-IL-1β、NLRP3蛋白转录与翻译,致使炎性体活化相关蛋白达到阈值。随后,ATP、细菌毒素、脂多糖等特殊物质,直接刺激NLRP3炎性体装配,诱导Caspase-1活化,产生IL-1β和IL-18[3, 21]。以往研究这类免疫反应时一直侧重于天然免疫细胞,但近年来血管平滑肌细胞介导的炎症反应越来越得到重视。在动脉粥样硬化的发病过程中,许多代谢产物都可以成为DAMPs,如ox-LDL、胆固醇结晶等。这些代谢产物作用于血管平滑肌细胞,激活了血管中膜层或内膜下平滑肌细胞的NLRP3炎性体通路[22-25]。
HASMCs是构成血管中膜层的主要细胞,其增殖、迁移和炎症基因表达是导致动脉粥样硬化内膜增生和下肢动脉硬化闭塞症(arteriosclerosis obliterans,ASO)介入治疗后支架内再狭窄的主要原因之一[26-27]。在生理状态下,血管平滑肌的增殖迁移被许多因子所调控,处于一种相对较低的水平。但是在动脉粥样硬化病理过程中,许多炎症因子通过自分泌或旁分泌的机制作用于血管平滑肌细胞,使其发生表型转变,由收缩表型转变为分泌表型或促炎表型,继而促进平滑肌细胞增殖并向内膜下迁移。迁移至内膜下的平滑肌细胞吞噬脂质物质后形成泡沫细胞,促进动脉粥样硬化的恶化[28-30]。除增殖迁移外,HASMCs炎症在动脉粥样硬化中的作用同样不可小觑。既往文献报道过许多炎症通路可在血管平滑肌细胞中激活,也有许多文献报道了炎症因子作用于血管平滑肌细胞造成动脉粥样硬化病理过程进一步恶化。本研究结果表明,在受到LPS的促炎刺激后,HASMCs可以像其他免疫细胞一样,NLRP3炎性体通路相关蛋白表达上调,在加入ATP后,HASMCs中NLRP3炎性体甚至被直接激活,使HASMCs本身成为炎症因子的来源之一。不仅如此,LPS+ATP的经典刺激组合还诱导了HASMCs中HMGB1的释放,激活了HMGB1及其下游的分子信号,活化了另一条分子信号通路参与动脉粥样硬化。
HMGB1是细胞核内含量最大的染色质蛋白之一,在正常生理状态下结合DNA发挥生物学功能。然而一旦细胞坏死或受到炎症刺激时,HMGB1则被释放到细胞以外与邻近的细胞表面受体结合,进一步促进炎症反应与细胞坏死,形成一条正反馈通路[31]。除了促炎反应外,在动脉粥样硬化中HMGB1还有其他重要作用。有文献证明动脉粥样硬化的斑块本身不但高表达HMGB1蛋白,还向周围的基质内释放HMGB1。PORTO等[32]报道,斑块释放HMGB1的主要细胞类型就是血管平滑肌细胞。在受到促动脉粥样硬化因子(如胆固醇)刺激后,HASMCs大量分泌HMGB1,胞外的HMGB1再次结合HASMCs表面受体促进细胞增殖、迁移和泡沫细胞形成。基于此种现象,PORTO等提出血管平滑肌细胞是HMGB1-动脉粥样硬化环路反应的中心。本研究结果和既往文献报道类似,在受到炎症刺激后,HASMCs向细胞上清中分泌HMGB1,并且这种HMGB1释放与NLRP3炎性体依赖的炎症反应密切相关。NLRP3炎性体通路也有许多天然抑制物,包括Z-YVAD-FMK、Ⅰ型干扰素及细胞自噬等。事实上,只要可以使构成NLRP3炎性体的任何一种蛋白表达降低就可以抑制NLRP3炎性体通路,其中miR-223就是近些年新发现的一种NLRP3蛋白负调控非编码RNA。本研究显示,当使用miR-223负性调控NLRP3蛋白水平后,HMGB1的释放被显著抑制,提示miR-223是一类潜在预防平滑肌细胞过度增殖、迁移及炎症反应的工具。
miR-223是一类髓系细胞特异性表达的microRNA,本身并不在HASMCs中表达。但是最新研究表明,血细胞(如白细胞、血小板等)分泌的miR-223不仅可以进入HASMCs,还对HASMCs的生物学功能产生了巨大的影响[16]。既往文献已经报道在白细胞中,miR-223对NLRP3蛋白具有负性调控机制,可以抑制巨噬细胞内NLRP3炎性体通路激活,但是并没有文献报道miR-223与HMGB1有相关性[33-34]。本研究结果表明,在HASMCs中,miR-223对NLRP3蛋白的调控功效依旧强大,可以显著降低NLRP3蛋白的表达。此外,miR-223还可通过对NLRP3炎性体的调节,间接抑制HMGB1的释放。在后续的研究中,我们还将探索NLRP3炎性体的激活及HMGB1的释放是否影响HASMCs对miR-223的摄取,明确miR-223、NLRP3及HMGB1相互间的调控网络,阐明miR-223在内皮细胞及巨噬细胞中的生物功能。
综上所述,本研究证实了血管平滑肌细胞也参与动脉粥样硬化发病过程中的炎症调控网络。miR-223可以通过转录后调控NLRP3蛋白表达抑制NLRP3炎性体通路活化,继而抑制血管平滑肌细胞的HMGB1释放,提示miR-223对动脉粥样硬化具有保护作用,可以成为将来早期干预动脉粥样硬化的新靶点。
| [1] | LIAPIS C D, AVGERINOS E D, KADOGLOU N P, et al. What a vascular surgeon should know and do about atherosclerotic risk factors[J]. J Vasc Surg, 2009, 49(5): 1348–1354. DOI:10.1016/j.jvs.2008.12.046 |
| [2] | HOSEINI Z, SEPAHVAND F, RASHIDI B, et al. NLRP3 inflammasome:Its regulation and involvement in atherosclerosis[J]. J Cell Physi, 2018, 233(3): 2116–2132. DOI:10.1002/jcp.25930 |
| [3] | WEN H, MIAO E A, TING J P. Mechanisms of NOD-like receptor-associated inflammasome activation[J]. Immunity, 2013, 39(3): 432–441. DOI:10.1016/j.immuni.2013.08.037 |
| [4] | WILLINGHAM S B, ALLEN I C, BERGSTRALH D T, et al. NLRP3(NALP3, Cryopyrin) facilitates in vivo caspase-1 activation, necrosis, and HMGB1 release via inflammasome-dependent and-independent pathways[J]. J Immunol, 2009, 183(3): 2008–2015. DOI:10.4049/jimmunol.0900138 |
| [5] | BUI F Q, JOHNSON L, ROBERTS J, et al. Fusobacterium nucleatum infection of gingival epithelial cells leads to NLRP3 inflammasome-dependent secretion of IL-1beta and the danger signals ASC and HMGB1[J]. Cell Microbiol, 2016, 18(7): 970–981. DOI:10.1111/cmi.12560 |
| [6] | KANG R, CHEN R, ZHANG Q, et al. HMGB1 in health and disease[J]. Mol Aspects Med, 2014, 40: 1–116. DOI:10.1016/j.mam.2014.05.001 |
| [7] | VANDE W L, KANNEGANTI T D, LAMKANFI M. HMGB1 release by inflammasomes[J]. Virulence, 2011, 2(2): 162–165. DOI:10.4161/viru.2.2.15480 |
| [8] | BIANCHI M E, CRIPPA M P, MANFREDI A A, et al. High-mobility group box 1 protein orchestrates responses to tissue damage via inflammation, innate and adaptive immunity, and tissue repair[J]. Immunol Rev, 2017, 280(1): 74–82. DOI:10.1111/imr.12601 |
| [9] | UGRINOVA I, PASHEVA E. HMGB1 protein:a therapeutic target inside and outside the cell[J]. Adv Protein Chem Struct Biol, 2017, 107: 37–76. DOI:10.1016/bs.apcsb.2016.10.001 |
| [10] | CAI J, WEN J, BAUER E, et al. The role of HMGB1 in cardiovascular biology:danger signals[J]. Antioxid Redox Signal, 2015, 23(17): 1351–1369. DOI:10.1089/ars.2015.6408 |
| [11] | WANG K, LI W, YU Q, et al. High mobility group Box 1 mediates interferon-gamma-induced phenotypic modulation of vascular smooth muscle cells[J]. J Cell Biochem, 2017, 118(3): 518–529. DOI:10.1002/jcb.25682 |
| [12] | HUANG S C, WANG M, WU W B, et al. Mir-22-3p inhibits arterial smooth muscle cell proliferation and migration and neointimal hyperplasia by targeting HMGB1 in arteriosclerosis obliterans[J]. Cell Physiol Biochem, 2017, 42(6): 2492–2506. DOI:10.1159/000480212 |
| [13] | SCHWARTZ S M. Perspectives series:cell adhesion in vascular biology. Smooth muscle migration in atherosclerosis and restenosi[J]. J Clin Invest, 1997, 99(12): 2814–2816. DOI:10.1172/JCI119472 |
| [14] | OWENS G K, KUMAR M S, WAMHOFF B R. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J]. Physiol Rev, 2004, 84(3): 767–801. DOI:10.1152/physrev.00041.2003 |
| [15] | FARH K K, GRIMSON A, JAN C, et al. The widespread impact of mammalian MicroRNAs on mRNA repression and evolution[J]. Science, 2005, 310(5755): 1817–1821. DOI:10.1126/science.1121158 |
| [16] | SHAN Z, QIN S, LI W, et al. An endocrine genetic signal between blood cells and vascular smooth muscle cells:role of microRNA-223 in smooth muscle function and atherogenesis[J]. J Am Coll Cardiol, 2015, 65(23): 2526–2537. DOI:10.1016/j.jacc.2015.03.570 |
| [17] | LU X, KAKKAR V. Inflammasome and atherogenesis[J]. Curr Pharm Des, 2014, 20(1): 108–124. DOI:10.2174/13816128113199990586 |
| [18] |
周超, 季新忠, 刘巧, 等. 炎症诱导SCAP功能失调促进ApoE-/-小鼠动脉粥样硬化的分子机制[J].
第三军医大学学报, 2016, 38(9): 938–943.
ZHOU C, JI X Z, LIU Q, et al. Molecular mechanism of cholesterol sensor SCAP dysfunction in atheroma formation in ApoE-/-mice induced by inflammation[J]. J Third Mil Med Univ, 2016, 38(9): 938–943. DOI:10.16016/j.1000-5404.201510111 |
| [19] | GROH L, KEATING S T, JOOSTEN L, et al. Monocyte and macrophage immunometabolism in atherosclerosis[J]. Semin Immunopathol, 2018, 40(2): 203–214. DOI:10.1007/s00281-017-0656-7 |
| [20] | TALL A R, YVAN-CHARVET L. Cholesterol, inflammation and innate immunity[J]. Nat Rev Immunol, 2015, 15(2): 104–116. DOI:10.1038/nri3793 |
| [21] | HANEKLAUS M, O'NDILL L A, COLL R C. Modulatory mechanisms controlling the NLRP3 inflammasome in inflammation:recent developments[J]. Curr Opin Immunol, 2013, 25(1): 40–45. DOI:10.1016/j.coi.2012.12.004 |
| [22] | GREBE A, LATZ E. Cholesterol crystals and inflammation[J]. Curr Rheumatol Rep, 2013, 15(3): 313. DOI:10.1007/s11926-012-0313-z |
| [23] | SAMSTAD E O, NIYONZIMA N, NYMO S, et al. Cholesterol crystals induce complement-dependent inflammasome activation and cytokine release[J]. J Immunol, 2014, 192(6): 2837–2845. DOI:10.4049/jimmunol.1302484 |
| [24] | JIANG Y, WANG M, HUANG K, et al. Oxidized low-density lipoprotein induces secretion of interleukin-1beta by macrophages via reactive oxygen species-dependent NLRP3 inflammasome activation[J]. Biochem Biophys Res Commun, 2012, 425(2): 121–126. DOI:10.1016/j.bbrc.2012.07.011 |
| [25] | HOSEINI Z, SEPAHVAND F, RASHIDI B, et al. NLRP3 inflammasome:Its regulation and involvement in atherosclerosis[J]. J Cell Physiol, 2018, 233(3): 2116–2132. DOI:10.1002/jcp.25930 |
| [26] | BENNETT M R, SINHA S, OWENS G K. Vascular smooth muscle cells in atherosclerosis[J]. Circ Res, 2016, 118(4): 692–702. DOI:10.1161/CIRCRESAHA.115.306361 |
| [27] | LACOLLEY P, REGNAULT V, SEGERS P, et al. Vascular smooth muscle cells and arterial stiffening:relevance in development, aging, and disease[J]. Physiol Rev, 2017, 97(4): 1555–1617. DOI:10.1152/physrev.00003.2017 |
| [28] | YIN Y W, LIAO S Q, ZHANG M J, et al. TLR4-mediated inflammation promotes foam cell formation of vascular smooth muscle cell by upregulating ACAT1 expression[J]. Cell Death Dis, 2014, 5: e1574. DOI:10.1038/cddis.2014.535 |
| [29] | FISHER E A, MIANO J M. Don't judge books by their covers:vascular smooth muscle cells in arterial pathologies[J]. Circulation, 2014, 129(15): 1545–1547. DOI:10.1161/CIRCULATIONAHA.114.009075 |
| [30] | VENGRENYUK Y, NISHI H, LONG X, et al. Cholesterol loading reprograms the microRNA-143/145-myocardin axis to convert aortic smooth muscle cells to a dysfunctional macrophage-like phenotype[J]. Arterioscler Thromb Vasc Biol, 2015, 35(3): 535–546. DOI:10.1161/ATVBAHA.114.304029 |
| [31] | SCAFFIDI P, MISTELI T, BIANCHI M E. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J]. Nature, 2002, 418(6894): 191–195. DOI:10.1038/nature00858 |
| [32] | PORTO A, PALUMBO R, PIERONI M, et al. Smooth muscle cells in human atherosclerotic plaques secrete and proliferate in response to high mobility group box 1 protein[J]. FASEB J, 2006, 20(14): 2565–2566. DOI:10.1096/fj.06-5867fje |
| [33] | BAUERNFEIND F, RIEGER A, SCHILDBERG F A, et al. NLRP3 inflammasome activity is negatively controlled by miR-223[J]. J Immunol, 2012, 189(8): 4175–4181. DOI:10.4049/jimmunol.1201516 |
| [34] | NEUDECKER V, HANEKLAUS M, JENSEN O, et al. Myeloid-derived miR-223 regulates intestinal inflammation via repression of the NLRP3 inflammasome[J]. J Exp Med, 2017, 214(6): 1737–1752. DOI:10.1084/jem.20160462 |



