放射技术在生活中应用日益广泛,急性放射病防治研究越发受到重视,人体受到中剂量的放射会发生严重骨髓抑制,重者危及生命[1]。骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSCs)是成人骨髓内具有多向分化潜能的干细胞,可分化为骨、软骨、脂肪,是骨髓微环境的重要组成部分[2]。相比造血干细胞,BM-MSCs具有较强的辐射抵抗性,在急性放射后仍然可存活[3],是放射后机体造血恢复的重要造血支持细胞,但是其功能受到不可逆的损伤,放射后出现细胞衰老,促成了造血微环境的异常,影响造血恢复[4]。因此,研究急性放射损伤导致BM-MSCs衰老的机制对于骨髓型急性放射病的防治有着重要意义。目前放射损伤导致BM-MSCs衰老的机制尚未完全阐明,放射后BM-MSCs短期内会出现DNA损伤修复,并耐受高剂量的辐射而存活,但是随后会不可逆地进入衰老,并出现功能减低,主要表现为分化功能异常[5]、增殖能力减弱、造血支持功能减低[4],相关机制有待进一步研究。本研究通过构建放射损伤导致BM-MSCs衰老的体外模型,以及体外操控BM-MSCs中lncRNA-TUG1的表达水平,观察lncRNA-TUG1在放射损伤导致的BM-MSCs衰老进程中所起的作用,为干预放射导致的BM-MSCs的衰老提供可能靶点。
1 材料与方法 1.1 BM-MSCs细胞系来源与培养人骨髓间充质干细胞(HMSC-bm)购自ScienCell公司,已验证CD73+、CD90+、CD105+,并可在体外诱导分化,符合国际细胞治疗协会(International Society for Cellular Therapy,ISCT) [6]制定的间充质干细胞标准。在人骨髓间充质干细胞培养液(HUXMA-90011,Cyagen)中,37 ℃、5% CO2条件下培养,细胞贴壁生长达>80%融合后,以0.25%胰酶消化细胞,按1:2~1:4传代。
1.2 放射处理采用9 Gy剂量(Co60)γ射线对BM-MSCs放射,放射剂量率为700 cGy/min。
1.3 细胞蛋白提取与免疫印迹在冰上用细胞刮刮下细胞,离心收集后加入现配的RIPA和PMSF裂解液,涡旋2 min,4 ℃ 10 000×g离心15 min,收集上清,将提取的细胞总蛋白分别进行SDS-PAGE电泳,转膜与免疫印迹,所用抗体包括p53(ab1101)、γ-H2AX (ab26350)(Abcam)。
1.4 RNA提取,反转录及实时荧光定量PCR总RNA通过TRIzol试剂(10296010,Invitrogen)按照说明书进行提取,通过反转录试剂盒(First Strand cDNA Synthesis Kit, FSK-100,TOYOBO)得到cDNA,qPCR通过FastStart Universal SYBR Green Master Mix (04913850001,Roche)试剂盒在20 μL体系一式三份下进行,程序为94 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s。lncRNA-TUG1 PCR引物序列:lncRNA-TUG1上游5′-TAGCAGTTCCCCAATCCTTG -3′,下游5′-CACAAATTCCCATCATTCCC-3′,片段大小76 bp;β-actin上游5′-ACCCCGTGCTGCTGACCGAG-3′,下游5′-TCCCGGCCAGCCAGGTCCA-3′,片段大小190 bp。
1.5 Lnc-RNA TUG1 shRNA慢病毒载体转染BM-MSCs在NCBI查询下载lncRNA-TUG1的序列,干扰RNA的序列,lncRNA-TUG1-1:5′-GGATATAGCCAGAGAACAA-3′;lncRNA-TUG1-2:5′-GCUUGGCUUCUAUUCUGAAUCCUUU-3′。提取慢病毒包装系统中质粒DNA,溶于除菌的TE中,以紫外光吸收法测定其浓度及纯度,保证所提质粒DNA的D(260)/D(280)为1.8~2.0。将过表达片段、干扰片段、质粒经酶切、连接并转化到感受态细胞中,培养细菌并提取质粒。将构建好的质粒转染293T细胞,收集病毒,进行滴度测定。将构建的shRNA病毒液感染BM-MSCs,48 h后在荧光显微镜下观察转染效率,puromycin进一步筛选阳性细胞后qRT-PCR检测lncRNA-TUG1抑制效率。
1.6 SA-β-gal染色检测BM-MSCs放射前后细胞衰老用细胞衰老β-半乳糖苷酶染色试剂盒(C0602,碧云天)对处理的BM-MSCs进行染色处理。
1.7 CCK-8检测BM-MSCs细胞增殖96孔板中每孔接入3 000个细胞,37 ℃、5% CO2孵育24 h后进行处理,按说明书加入CCK-8试剂[CK04,东仁化学科技(上海)]处理,酶标仪检测450 nm处吸光度值[D(450)]反映细胞增殖活性。
1.8 统计学分析采用GraphPad Prism 6统计软件,计量资料数据以x±s表示,组间比较采用t检验分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 放射诱导BM-MSCs高表达lncRNA-TUG1,短期出现DNA损伤修复及细胞衰老放射后BM-MSCs中lncRNA-TUG1表达显著增高,4、24 h分别上升至原来的1.56倍(P < 0.05)和2.00倍(P < 0.01)。放射后4 h内磷酸化γ-H2AX显著增高,提示DNA损伤发生,24 h后磷酸化γ-H2AX减低,表明DNA损伤逐渐修复,但仍然存在DNA损伤,与此同时,衰老相关蛋白p53随着时间延长显著增高(图 1)。放射损伤后2 d,与未放射组[衰老细胞百分率为(7.3±0.9)]比较,放射[衰老细胞百分率为(69.0± 2.0)]显著增加BM-MSCs细胞衰老(P < 0.01,图 2)。放射损伤后72 h CCK-8检测显示BM-MSCs细胞增殖减低40%(P < 0.01),表明放射显著抑制BM-MSCs细胞增殖。
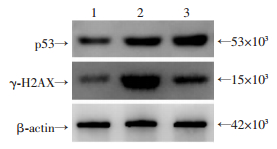
|
| 1:放射后0 h;2:放射后4 h;3:放射后24 h 图 1 放射后0、4、24 h BM-MSCs中γ-H2AX、p53变化 |
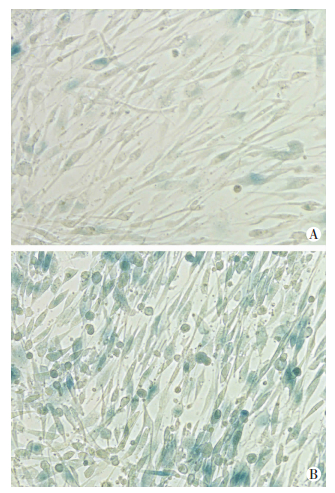
|
| A:对照组;B:放射组 图 2 放射2 d后BM-MSCs衰老显著增加(β-半乳糖苷酶染色,×200) |
2.2 抑制lncRNA-TUG1促进BM-MSCs放射后的DNA损伤修复,减少细胞衰老
为研究lncRNA-TUG1在放射损伤导致的衰老中的作用,我们同时将转染空载体慢病毒的对照组BM-MSCs与干扰lncRNA-TUG1的干扰组BM-MSCs进行放射处理后提取RNA、总蛋白,并进行β-半乳糖苷酶染色。放射诱导干扰组BM-MSCs表达lncRNA-TUG1升高,但显著低于对照组(图 3)。
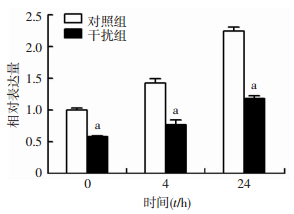
|
| a:P < 0.01,与同时间对照组比较 图 3 放射后0、4、24 h内BM-MSCs和干扰组中lncRNA-TUG1变化 |
2.3 放射后BM-MSCs和干扰组中p-53和γ-H2AX的变化
放射后4 h,干扰组与对照组r-H2AX水平均升高,两组无明显差异。放射后24 h,干扰组r-H2AX水平与放射前比无明显差异,对照组r-H2AX水平明显高于放射前,提示干扰lncRNA-TUG1可能促进BM-MSCs在放射损伤后的DNA修复。放射后24 h,干扰组细胞衰老相关蛋白p53显著低于对照组,提示干扰组细胞衰老程度较低(图 4)。放射后2 d,干扰lncRNA-TUG1组衰老细胞百分率显著低于对照组(P < 0.01,图 5、6),表明干扰lncRNA-TUG1显著减少放射导致的BM-MSCs衰老。
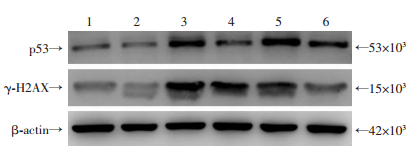
|
| 1:未放射对照组;2:未放射干扰组;3:放射后4 h对照组;4:放射后4 h干扰组;5:放射后24 h对照组;6:放射后24 h干扰组 图 4 放射后0、4、24 h内对照组BM-MSCs和干扰组中p-53和γ-H2AX变化 |

|
| A:未放射对照组;B:放射后对照组;C:未放射干扰组;D:放射后干扰组 图 5 放射2 d后对照组和干扰lncRNA-TUG1组BM-MSCs的衰老检测(β-半乳糖苷酶染色×200) |

|
| a:P < 0.01,与未放射组及放射干扰组比较 图 6 放射后2 d β-半乳糖苷酶染色检测各组细胞衰老百分率 |
3 讨论
BM-MSCs是成人骨髓内具有多向分化潜能的干细胞,是骨髓造血的重要支持细胞,相比造血干细胞,具有较强的放射抵抗性,但是其功能受到不可逆的损伤,出现细胞衰老,促成了造血微环境的异常,影响放射后的造血恢复,研究放射引起BM-MSCs衰老的机制对急性放射病的防治有重要意义。
长链非编码RNA(long noncoding RNA,lncRNA)是一类转录本长度超过200 nt、不编码蛋白的RNA,过去被认为是无功能的转录“噪音”,然而越来越多的研究表明其在细胞的生命活动中发挥着重要的作用。大量lncRNA的功能与作用仍不清楚,在近年来越来越受到重视[7]。早期研究报道lncRNA-TUG1可能参与小鼠的视网膜发育[8];在肿瘤细胞研究中报道,lncRNA-TUG1的上游受直接p53调控[9],调控p53介导的多种细胞效应;近年发现lncRNA-TUG1在多种肿瘤中异常表达,影响肿瘤细胞的增殖、凋亡,并与部分肿瘤患者的预后相关[9-14],表明lncRNA-TUG1可能在细胞的功能中发挥重要作用。本研究中lncRNA-TUG1在放射后显著增高,BM-MSCs出现DNA损伤修复,细胞衰老显著增加;而干扰lncRNA-TUG1后,BM-MSCs在放射后DNA损伤修复明显加快,细胞衰老显著减低,表明lncRNA-TUG1是BM-MSCs放射损伤修复过程中的一个抑制因素,而干预lncRNA-TUG1表达可以促进BM-MSCs的损伤修复并减少衰老。
本研究发现lncRNA-TUG1在放射致BM-MSCs损伤过程中发挥重要的调控作用并促进放射诱导BM-MSCs衰老进程,为深入研究放射致BM-MSCs损伤发生的机制研究提供了新的思路。然而lnc-RNA TUG1如何参与放射对BM-MSCs的衰老具体机制尚不清楚,仍然有待进一步的研究探索。
| [1] | FLIEDNER T M, CHAO N J, BADER J L, et al. Stem cells, multiorgan failure in radiation emergency medical preparedness: a U.S./European Consultation Workshop[J]. Stem Cells, 2009, 27(5): 1205–1211. DOI:10.1002/stem.16 |
| [2] | BIANCO P. "Mesenchymal" stem cells[J]. Annu Rev Cell Dev Biol, 2014, 30: 677–704. DOI:10.1146/annurev-cellbio-100913-013132 |
| [3] | NICOLAY N H, LOPEZ PEREZ R, SAFFRICH R, et al. Radio-resistant mesenchymal stem cells: mechanisms of resistance and potential implications for the clinic[J]. Oncotarget, 2015, 6(23): 19366–19380. DOI:10.18632/oncotarget.4358 |
| [4] | CHEN L, RAN Q, XIANG Y, et al. Co-activation of PKC-δ by CRIF1 modulates oxidative stress in bone marrow multipotent mesenchymal stromal cells after irradiation by phosphorylating NRF2 Ser40[J]. Theranostics, 2017, 7(10): 2634–2648. DOI:10.7150/thno.17853 |
| [5] | ZHANG X, XIANG L, RAN Q, et al. Crif1 promotes adipogenic differentiation of bone marrow mesenchymal stem cells after irradiation by modulating the PKA/CREB signaling pathway[J]. Stem Cells, 2015, 33(6): 1915–1926. DOI:10.1002/stem.2019 |
| [6] | DOMINICI M, LE BLANC K, MUELLER I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006, 8(4): 315–317. DOI:10.1080/14653240600855905 |
| [7] | LI X, WU Z, FU X, et al. Long noncoding RNAs: insights from biological features and functions to diseases[J]. Med Res Rev, 2013, 33(3): 517–553. DOI:10.1002/med.21254 |
| [8] | YOUNG T L, MATSUDA T, CEPKO C L. The noncoding RNA taurine upregulated gene 1 is required for differentiation of the murine retina[J]. Curr Biol, 2005, 15(6): 501–512. DOI:10.1016/j.cub.2005.02.027 |
| [9] | ZHANG E B, YIN D D, SUN M, et al. P53-regulated long non-coding RNA TUG1 affects cell proliferation in human non-small cell lung cancer, partly through epigenetically regulating HOXB7 expression[J]. Cell Death Dis, 2014, 5: e1243. DOI:10.1038/cddis.2014.201 |
| [10] | ISIN M, OZGUR E, CETIN G, et al. Investigation of circulating lncRNAs in B-cell neoplasms[J]. Clin Chim Acta, 2014, 431: 255–259. DOI:10.1016/j.cca.2014.02.010 |
| [11] | HUANG M D, CHEN W M, QI F Z, et al. Long non-coding RNA TUG1 is up-regulated in hepatocellular carcinoma and promotes cell growth and apoptosis by epigenetically silencing of KLF2[J]. Mol Cancer, 2015, 14: 165. DOI:10.1186/s12943-015-0431-0 |
| [12] | LIU Q, SUN S, YU W, et al. Altered expression of long non-coding RNAs during genotoxic stress-induced cell death in human glioma cells[J]. J Neurooncol, 2015, 122(2): 283–292. DOI:10.1007/s11060-015-1718-0 |
| [13] | XU Y, WANG J, QIU M, et al. Upregulation of the long noncoding RNA TUG1 promotes proliferation and migration of esophageal squamous cell carcinoma[J]. Tumour Biol, 2015, 36(3): 1643–1651. DOI:10.1007/s13277-014-2763-6 |
| [14] | MA B, LI M, ZHANG L, et al. Upregulation of long non-coding RNA TUG1 correlates with poor prognosis and disease status in osteosarcoma[J]. Tumour Biol, 2016, 37(4): 4445–4455. DOI:10.1007/s13277-015-4301-6 |



