2. 400038 重庆,陆军军医大学(第三军医大学):第三附属医院(野战外科研究所)创伤实验室,创伤、烧伤与复合伤国家重点实验室
2. State Key Laboratory of Trauma, Burns and Combined Injury, Center of Bone Metabolism and Repair, Institute of Surgery Research, Third Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400042, China
小肠上皮在人体营养物质交换中起着十分重要的作用,同时也是防止细菌侵袭和毒素摄入的重要物理屏障。小肠的这些重要作用都是建立在上皮细胞快速自我更新能力的基础上。肠干细胞位于隐窝底部,在日常情况下即可不断分裂,生成的子代细胞可以在有限扩增后分化为吸收系细胞和分泌系细胞。分泌系小肠上皮细胞主要包括杯状细胞、潘氏细胞和小肠内分泌细胞[1]。这些细胞可分泌生长因子、抗菌肽、黏液和一些激素,在维持小肠上皮自稳态、调节吸收功能等多方面都起到重要作用。成纤维细胞生长因子受体(fibroblast growth factor receptor, Fgfr)属于跨膜酪氨酸激酶受体家族,分为Fgfr1、Fgfr2、Fgfr3和Fgfr4等4种类型[2]。研究表明,Fgfr1和Fgfr2在整个成年小鼠的小肠中均有表达[3-4],Fgfr3主要在小肠隐窝的下半部分表达,而Fgfr4则主要在胚胎小肠上皮表达[5]。成纤维细胞生长因子(Fgf)配体与受体的结合激活胞质内RAS-MAPK、PI3K-AKT、PLCγ和STAT等细胞内信号通路[6],从而在调控成体组织中的代谢功能、组织修复和再生等方面起作用[2]。Fgfr3在小鼠小肠发育过程中可调节潘氏细胞分化[7],某些Fgfr配体例如成纤维细胞生长因子10(Fgf10)在小肠上皮细胞分化中可调节潘氏细胞和杯状细胞分化平衡。Fgf及其受体对小肠微环境的改变影响了小肠的增殖和分化能力[2-7]。然而,至今人们对Fgfr2在成年小鼠小肠上皮增殖和分化中的作用知之甚少。本研究拟对Fgfr2在成年小鼠小肠上皮增殖和分化中的作用进行初步探索,了解Fgfr2对小肠微环境的影响,以期进一步阐释Fgfr2在小肠增殖和分化的作用机制。
1 材料与方法 1.1 材料与试剂 1.1.1 实验动物Fgfr2flox/flox小鼠来源于陆军军医大学(第三军医大学)第三附属医院(野战外科研究所)陈林教授实验室,Villin-CreERT+/-小鼠为本实验室引进;实验动物均饲养于陆军军医大学(第三军医大学)实验动物中心,环境为SPF级。
1.1.2 试剂和仪器鼠尾直接PCR试剂盒购自美国Bimake公司,HE染色试剂盒购自美国Sigma公司,Alcian染色试剂购自美国Ukas公司,Brdu试剂购自美国Thermo公司,抗-Fgfr2抗体购自美国Thermo公司,抗-Tubulin抗体购自中国碧云天公司,抗-Lysozyme抗体购自美国Santa Cruz公司,抗-Brdu抗体购自美国BD生物公司,抗-Chromogranin A抗体购自美国Protein Tech公司,免疫组化DAB显色试剂盒购自中国迈新试剂公司。图像采集使用日本奥林巴斯BX63显微镜。
1.2 方法 1.2.1 小鼠的繁殖和基因型鉴定小肠上皮诱导敲除Fgfr2小鼠的繁殖过程见图 1。基因型为Fgfr2flox/flox;Villin-CreERT+/-的小鼠作为实验组(Fgfr2 CKO组),同胎基因型为Fgfr2flox/flox;Villin-CreERT-/-的小鼠作为野生型对照组。小鼠鉴定:取小鼠尾部,通过组织消化、聚合酶链式反应(polymerase chain reaction, PCR)扩增、琼脂糖凝胶电泳判定小鼠基因型。小鼠经鉴定后,生长到100~120 d时,通过他莫昔芬(tamoxifen)诱导产生小肠Fgfr2功能缺失的小鼠。他莫昔芬0.05 mg/g连续腹腔注射4 d后,小鼠继续常规饲养10 d,获取组织样本和蛋白样本。

|
| 图 1 小肠上皮敲除Fgfr2小鼠的繁殖过程及分组 |
1.2.2 蛋白表达检测
进行小肠黏膜刮除,获取小鼠小肠上皮细胞,并从小鼠的小肠上皮细胞中分离蛋白质提取物。将总蛋白提取物进行NuPAGE凝胶电泳,然后进行Western blot实验,用于比较不同基因型小鼠肠上皮Fgfr2蛋白表达量。
1.2.3 组织样本收集、HE染色和Alcian染色收集小鼠小肠组织样本,用10% Zinc Formalin固定过夜,脱水后包埋在石蜡中。将组织切片(3.5 μm)经过二甲苯浸泡30 min,100%酒精浸泡5 min,80%酒精浸泡5 min,70%酒精浸泡5 min,纯净水浸泡5 min脱蜡水化后进行HE染色并进行组织学分析。另外,用Alcian试剂染色5 min,计数杯状细胞数量。
1.2.4 免疫组化和免疫荧光分析如1.2.3所述,取下小鼠小肠切片后进行组织学分析。在免疫染色前,切片经过二甲苯浸泡30 min,100%酒精浸泡5 min,80%酒精浸泡5 min,70%酒精浸泡5 min,纯净水浸泡5 min脱蜡水化,然后用柠檬酸钠溶液95 ℃进行抗原修复30 min。运用抗Brdu抗体比较Fgfr2 CKO小鼠和Cre-ng小鼠的上皮隐窝细胞增殖水平,通过比较单个隐窝中Brdu+细胞数量和单只小鼠Brdu+>4的隐窝总数评价上皮细胞的增殖水平。同时,运用抗-Lysozyme抗体(1 :200)计数潘氏细胞数量,抗-Chromogranin A计数小肠内分泌细胞数量。完成后都用显微镜观察记录。
1.3 统计学分析采用GraphPad Prism 6统计软件进行统计学分析。对计量资料进行正态性检验,根据正态性检验结果,对正态性分布资料进行两独立样本t检验;对不服从正态分布经过转换呈正态分布再进行分析。对计数资料进行χ2检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 小肠上皮特定敲除Fgfr2小鼠的鉴定提取小鼠尾巴DNA进行PCR扩增完成后,将扩增产物于琼脂糖凝胶电泳进行分析,野生型条带约为240 bp,Fgfr2fl/fl小鼠条带约为320 bp,杂合子Fgfr3fl/+包含240 bp及320 bp两根条带(图 2A)。含Villin-CreERT的条带约为350 bp,无条带则为野生型(图 2B)。

|
|
A:Fgfr2;B:Villin-CreERT M:标准;1~12:分别是进行基因型鉴定的小鼠 图 2 琼脂糖凝胶电泳鉴定Fgfr2 CKO组小鼠和野生型对照组小鼠基因型 |
2.2 小肠上皮特定敲除的Fgfr2小鼠构建成功
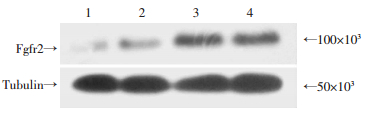
Western blot检测Fgfr2在小肠上皮细胞的功能缺失情况。结果显示:与对照组比较,Fgfr2fl/fl;Villin-CreERT+/-小鼠Fgfr2表达下降明显(图 3),提示动物模型构建较成功。
|
| 图 3 Western blot检测Fgfr CKO组小鼠和野生型对照组小鼠Fgfr2蛋白表达 |
2.3 小肠上皮细胞内Fgfr2功能缺失影响小肠上皮细胞的分化
从十二指肠、空肠和回肠随机计数24个绒毛-隐窝单位中潘氏细胞占肠上皮细胞的比例,与野生型对照组小鼠比较,标记潘氏细胞在Fgfr2 CKO组小鼠的十二指肠(P < 0.01)、空肠(P=0.001)和回肠(P=0.001,图 4、表 1)中显著增加。与野生型对照组小鼠比较,Alcian蓝染色显示Fgfr2 CKO组小鼠的十二指肠(P=0.020 6)、空肠(P=0.004 6)和回肠(P=0.000 1,图 5、表 1)中杯状细胞在肠上皮细胞中的比例显著减少。与野生型对照组小鼠比较,Fgfr2 CKO组小鼠隐窝的小肠内分泌细胞数差异无统计学意义(P=0.300 8、0.830 7、0.566 7,图 6、表 1)。

|
| 红色代表抗-Lysozyme,蓝色代表DAPI 图 4 抗-Lysozyme免疫荧光染色检测小肠上皮Fgfr2缺失对潘氏细胞分化的影响 |
| 组别 | 潘氏细胞/肠上皮细胞 | 杯状细胞/肠上皮细胞 | 内分泌细胞/肠上皮细胞 | ||||||||
| 十二指肠 | 空肠 | 回肠 | 十二指肠 | 空肠 | 回肠 | 十二指肠 | 空肠 | 回肠 | |||
| 野生型对照组 | 1.23±0.00 | 4.95±0.03 | 4.72±0.02 | 16.62±0.05 | 39.97±12.71 | 39.97±0.13 | 1.34±0.37 | 2.14±1.26 | 1.34±0.91 | ||
| Fgfr2 CKO组 | 3.14±0.01a | 8.57±0.01a | 8.50±0.02a | 11.67±0.04b | 24.54±6.18a | 21.04±0.04a | 1.48±0.26 | 2.04±0.96 | 1.59±1.09 | ||
| a: P < 0.01, b: P < 0.05,与野生型对照组比较 | |||||||||||

|
| 图 5 Alcian染色检测小肠上皮Fgfr2缺失对杯状细胞分化的影响 |

|
| 绿色代表抗-Chromogranin A免疫荧光染色,蓝色代表DAPI 图 6 抗-Chromogranin A免疫荧光染色检测小肠上皮Fgfr2缺失对小肠内分泌细胞分化的影响 |
2.4 小肠上皮细胞内Fgfr2功能缺失能对小肠上皮细胞增殖无显著影响
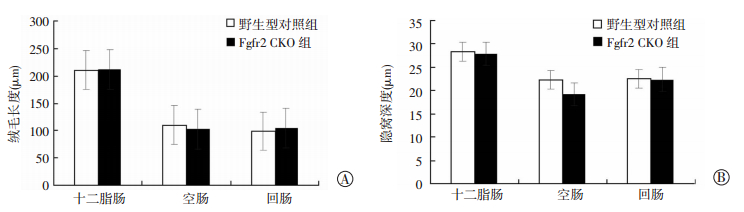
进一步测量Fgfr2 CKO组和野生型对照组小鼠诱导后小肠长度的变化。结果显示:Fgfr2 CKO组(38.53±1.68)和野生型对照组(36.93±1.23)小鼠小肠长度相近(P>0.05)。通过组织学手段检测Fgfr2 CKO组和野生型对照组小鼠小肠上皮细胞的增殖情况,HE染色观察各小肠断绒毛长度和隐窝的深度,Fgfr2 CKO组与野生型对照组比较均无明显变化(图 7、8)。免疫组化Brdu染色结果显示,Fgfr2 CKO组Brdu+细胞>4的隐窝数量相较于野生型对照组无明显变化(图 9、表 2), 单个隐窝中Brdu+细胞数量也无明显变化。

|
| 图 7 HE染色检测小肠上皮Fgfr2缺失对小肠绒毛长度和隐窝深度的影响 |
|
| 图 8 各组小鼠小肠中绒毛长度(A)和隐窝深度(B) |

|
| 图 9 抗Brdu免疫组化染色检测小肠上皮Fgfr2缺失对小肠细胞增殖的影响 |
| 组别 | Brda阳性克隆 > 4 | 十二指肠 | 空肠 | 回肠 |
| 野生型对照组 | 1 819.667±46.544 | 17.182±4.579 | 10.272±2.054 | 9.364±1.502 |
| Fgfr2 CKO组 | 1 864.333±38.214 | 17.636±4.365 | 10.545±1.440 | 9.727±1.009 |
3 讨论
以往的研究提示Fgfr2在斑马鱼小肠发育过程中是必需的[8],但斑马鱼模型不具有含有潘氏细胞的隐窝,针对哺乳动物的研究有一定局限性。本研究构建了Fgfr2在小肠上皮诱导缺失的小鼠用于研究其对成年小鼠小肠上皮细胞的影响。由于是诱导性组织特异敲除Fgfr2,排除了其他组织器官和生长发育过程Fgfr2缺失对于小肠增殖和分化的影响,更有利于研究成体肠道组织中Fgfr2的功能。另外还有研究通过构建Fgf10过表达的小鼠模型和全身敲除Fgfr2和Fgfr3模型研究Fgf通路在小鼠小肠发育过程中的作用[4, 7],这些模型也都是立足于小鼠的整个发育过程,而且都是运用Fgfr全身敲除模型,不能避免其他组织Fgfr2缺失对于小肠的影响。可以看出,虽然Fgf信号在小肠发育过程中得到了广泛的研究,但人们对其在小鼠成年期的功能知之甚少。
研究表明,在短肠综合征的斑马鱼模型中,抑制Fgf通路后的小肠上皮细胞增殖数量增加[9]。Fgf2、Fgf4、Fgf7和Fgf10都能促进小肠上皮细胞增殖[4]。本研究结果则表明,在成年小鼠小肠上皮特异性敲除Fgfr2以后,小肠上皮细胞的增殖未见显著影响,而且小肠的长度、小肠绒毛的长度和隐窝深度并没有明显变化。很多国内外的研究都立足于小肠从胚胎开始的整个发育过程,且运用的模型不同,结果可能出现不同[4, 9-10]。
本研究结果显示Fgfr2调控了小肠杯状细胞和潘氏细胞的分化,提示Fgfr2介导的微环境信号影响了成年小鼠小肠上皮细胞的分化。以往的研究表明:小肠微环境相关信号通路中,Notch信号传导通路和Wnt/β-Catenin信号传导通路是影响小肠上皮分化的主要通路[7, 11-14]。在Fgf信号传导通路方面,Fgf10过表达导致杯状细胞增加以及潘氏细胞减少,与此同时Hes1表达量降低[4],提示Fgf信号传导通路和Notch信号传导通路之间可能存在交互作用,使Hes1表达量降低从而影响分泌系细胞的分化[15]。对Fgfr3的研究提示,Fgfr3通过TCF4/β-Catenin依赖性信号传导途径调节肠上皮细胞中潘氏细胞谱系特异性基因的表达,从而调节潘氏细胞的分化[7, 16],说明Fgf信号传导通路可能影响多种和小肠微环境密切相关的信号传导通路,从而影响小肠干细胞的分化。
综上所述,本研究提示Fgf信号参与调节小肠分泌系细胞分化。尚需进一步的研究阐明Fgfr2通过何种机制如何影响这些分泌系细胞的分化,以及调控Fgfr受体是否对辐射损伤修复有重要作用。
| [1] | MORI-AKIYAMA Y, VAN DEN BORN M, VAN ES J H, et al. SOX9 is required for the differentiation of paneth cells in the intestinal epithelium[J]. Gastroenterology, 2007, 133(2): 539–546. DOI:10.1053/j.gastro.2007.05.020 |
| [2] | ORNITZ D M, ITOH N. The fibroblast growth factor signaling pathway[J]. Wiley Interdiscip Rev Dev Biol, 2015, 4(3): 215–266. DOI:10.1002/wdev.176 |
| [3] | DANOPOULOS S, SCHLIEVE C R, GRIKSCHEIT T C, et al. Fibroblast growth factors in the gastrointestinal tract: twists and turns[J]. Dev Dyn, 2017, 246(4): 344–352. DOI:10.1002/dvdy.24491 |
| [4] | AL ALAM D, DANOPOULOS S, SCHALL K, et al. Fibroblast growth factor 10 alters the balance between goblet and Paneth cells in the adult mouse small intestine[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308(8): G678–G690. DOI:10.1152/ajpgi.00158.2014 |
| [5] | STARK K L, MCMAHON J A, MCMAHON A P. FGFR-4, a new member of the fibroblast growth factor receptor family, expressed in the definitive endoderm and skeletal muscle lineages of the mouse[J]. Development, 1991, 113(2): 641–651. |
| [6] | SU N, JIN M, CHEN L. Role of FGF/FGFR signaling in skeletal development and homeostasis: learning from mouse models[J]. Bone Res, 2014, 2: 14003. DOI:10.1038/boneres.2014.3 |
| [7] | BRODRICK B, VIDRICH A, PORTER E, et al. Fibroblast growth factor receptor-3 (FGFR-3) regulates expression of paneth cell lineage-specific genes in intestinal epithelial cells through both TCF4/beta-catenin-dependent and -independent signaling pathways[J]. J Biol Chem, 2011, 286(21): 18515–18525. DOI:10.1074/jbc.M111.229252 |
| [8] | LIU D W, TSAI S M, LIN B F, et al. Fibroblast growth factor receptor 2c signaling is required for intestinal cell differentiation in zebrafish[J]. PLoS ONE, 2013, 8(3): e58310. DOI:10.1371/journal.pone.0058310 |
| [9] | SCHALL K A, HOLOYDA K A, ISANI M, et al. Inhibition of Fgf signaling in short bowel syndrome increases weight loss and epithelial proliferation[J]. Surgery, 2017, 161(3): 694–703. DOI:10.1016/j.surg.2016.08.044 |
| [10] | SPENCER-DENE B, SALA F G, BELLUSCI S, et al. Stomach development is dependent on fibroblast growth factor 10/fibroblast growth factor receptor 2b-mediated signaling[J]. Gastroenterology, 2006, 130(4): 1233–1244. DOI:10.1053/j.gastro.2006.02.018 |
| [11] | YANG Q. Requirement of math1 for secretory cell lineage commitment in the mouse intestine[J]. Science, 2001, 294(5549): 2155–2158. DOI:10.1126/science.1065718 |
| [12] | VAN DEN BRINK G R, DE SANTA BARBARA P, ROBERTS D J. Epithelial cell differentiation--a Mather of choice[J]. Science, 2001, 294(5549): 2115–2116. DOI:10.1126/science.1067751 |
| [13] | JENSEN J, PEDERSEN E E, GALANTE P, et al. Control of endodermal endocrine development by Hes-1[J]. Nat Genet, 2000, 24(1): 36–44. DOI:10.1038/71657 |
| [14] | VANDUSSEN KL, CARULLI AJ, KEELEY TM, et al. Notch signaling modulates proliferation and differentiation of intestinal crypt base columnar stem cells[J]. Development, 2012, 139(3): 488–497. DOI:10.1242/dev.070763 |
| [15] | FRE S, HUYGHE M, MOURIKIS P, et al. Notch signals control the fate of immature progenitor cells in the intestine[J]. Nature, 2005, 435(7044): 964–968. DOI:10.1038/nature03589 |
| [16] | VIDRICH A, BUZAN J M, BRODRICK B, et al. Fibroblast growth factor receptor-3 regulates Paneth cell lineage allocation and accrual of epithelial stem cells during murine intestinal development[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 297(1): G168–G178. DOI:10.1152/ajpgi.90589.2008 |



