SUN Zhongyi, E-mail:sunzhy199481@hotmail.com
男性不育发病率呈逐年增高趋势, 已占到整个不育夫妇比例的40%~50%[1], 其中约30%的男性不育症患者存在弱精子症[2]。弱精子症病因较为复杂, 早期的研究结果认为其包括精液凝固及液化异常、精子本身结构异常、精索静脉曲张、免疫性不育、内分泌紊乱、染色体异常及微生物感染等[3]。然而, 目前临床工作中我们发现有相当部分弱精子症患者没有明确病因, 我们将其称为特发性弱精子症。临床上对于这种特发性弱精子症多采用经验性的对症治疗, 缺乏统一的规范化诊断及治疗方案。
目前, 国内外对弱精子症蛋白组学研究主要集中在精子蛋白组学研究, 但对精子生存、运动环境的精浆蛋白研究相对较少, 所得到的结果各不相同, 不利于后续的相关研究。我们对同一地区育龄男性中特发性弱精子症精浆蛋白进行研究, 并采用等重同位素多标签相对定量蛋白质组学(isobaric tags for relative and absolute quantitation, iTRAQ)技术[4], 以期得到特发性弱精子症精浆蛋白组学差异, 为明确其诊断和治疗靶点提供帮助。
1 资料与方法 1.1 资料 1.1.1 标本来源研究对象精液采集前禁欲3~5 d, 精液采集后置37 ℃液化。特发性弱精子症诊断标准依据《WHO人类精液检验与处理实验室手册》第5版综合制定:①常规进行2次或以上精液分析, 精子密度>15× 106/mL, 精子前向运动(PR, %)<32%;②无精索静脉曲张、前列腺炎、精囊炎等导致精子质量下降的疾病。试验组纳入标准:①符合本实验的诊断标准; ② 4项生殖激素指标:卵泡刺激素(FSH)、黄体生成素(LH)、睾酮(T)和雌二醇(E2)均在正常范围内; ③在性交或者手淫中能够获得精液; ④年龄在21~47岁之间并自愿参加。试验组排除标准:①依据《WHO人类精液检验与处理实验室手册》第5版, 除了精子总活力(PR+NP, %)<40%, 精子前向运动(PR, %)<32%以外, 精液检查存在其他异常; ②患有精索静脉曲张、精囊炎、前列腺炎等导致精子质量下降的疾病; ③4项激素指标:卵泡刺激素(FSH)、黄体生成素(LH)、睾酮(T)和雌二醇(E2)存在异常; ④有明确职业危险因素。
1.1.2 分组在2017年1-5月间, 共收集第三附属医院(野战外科研究所)泌尿外科门诊特发性弱精子症患者15例作为试验组(B组), 年龄24~47岁。同时, 选择15例第三附属医院(野战外科研究所)泌尿外科门诊精液正常青年男性人群作为对照组(A组), 年龄21~44岁。两组患者年龄、禁欲时间比较, 差异无统计学意义(P>0.05), 具有可比性。所有纳入研究人员均告知其参加本研究并签署了知情同意书。本研究于2016年12月通过第三附属医院(野战外科研究所)伦理委员会批准。
1.1.3 主要仪器和试剂Easy nLC色谱系统(Thermo Scientific), Q Exactive Plus质谱仪(Thermo Scientific), Agilent 1260 infinity Ⅱ HPLC系统, Multiskcan FC酶标仪(Thermo Scientific), 低温高速离心机(Eppendorf 5430R), 真空离心浓缩仪(太仓华美LNG-T98), 电泳仪(Bio-Rad), Nano Drop(Thermo scientific ND2000), SDS(生工, SB0485-500g), 溴酚蓝(生工, A100449-0025), Tris(生工, T0826-500g), BCA定量试剂盒(碧云天, P0012), BSA(生工, A0332), 二硫苏糖醇(DTT, Sigma, 43819-5G), 甲酸(Thermo Fisher Scientific, A117), 乙腈(默克, 1000304008), 30kD超滤离心管(Sartorius, VN01H22)。
1.2 方法 1.2.1 样品制备将30例液化后的精液样本以10 000×g离心10 min取上清, 并储存于-80 ℃冰箱[5]。对试验组和对照组样本进行混样, 每5个样品混为1个样, 对照组和试验组各得3个混样, 分别标记为A1、A2、A3和B1、B2、B3。取混样后样品进行SDT裂解[6], 加入适量SDT裂解液(4%SDS, 100 mmol/L Tris-HCl, pH7.6), 沸水浴15 min。14 000×g离心15 min, 取上清。采用BCA法进行蛋白质定量。分装样品, -80 ℃保存。
1.2.2 SDS-PAGE电泳各样品取蛋白质20 μg分别加入5×上样缓冲液, 沸水浴5 min, 12% SDS-PAGE电泳(恒压250 V, 40 min), 考马斯亮蓝染色。
1.2.3 FASP酶解[6]各样品取30 μL蛋白质溶液, 分别加入DTT至终浓度为100 mmol/L, 沸水浴5 min, 冷却至室温。加入200 μL UA Buffer混匀, 转入30 kD超滤离心管中, 14 000×g离心15 min, 弃滤液(重复该步骤1次)。加入100 μL IAA Buffer(100 mmol/L IAA in UA), 振荡600 r/min离心1 min, 室温避光反应30 min, 14 000×g离心15 min。加入100 μL UA Buffer 14 000×g离心15 min, 重复该步骤2次。加入100 μL 10倍稀释的Dissolution Buffer, 14 000×g离心15 min, 重复该步骤2次。加入40 μL Trypsin buffer(4 μg Trypsin in 40 μL Dissolution buffer), 600 r/min振荡1 min, 37 ℃放置16~18 h。换新收集管, 14 000×g离心15 min; 再加入40 μL 10倍稀释的Dissolution buffer, 14 000×g离心15 min, 收集滤液。肽段定量(Nano Drop 2000)。
1.2.4 iTRAQ标记各样品分别取100 μg肽段, 按照AB SCIEX公司iTRAQ标记试剂盒说明书进行标记。对照组和试验组分别用8标iTRAQ试剂115、116、117、118、119和121标记。
1.2.5 High pH RP分级将每组标记后的肽段混合, 采用Agilent 1260 infinity Ⅱ HPLC系统进行分级。缓冲液A为10 mmol/L HCOONH4, 5% ACN, pH 10.0, B液为10 mmol/L HCOONH4, 85% ACN, pH 10.0。色谱柱以A液平衡, 样品由手动进样器上样到色谱柱进行分离, 流速为1 mL/min。液相梯度如下:0~25 min, B液0%;25~30 min, B液线性梯度从0%~7%;30~65 min, B液线性梯度从7%~40%;65~70 min, B液线性梯度从40%~100%;70~85 min, B液维持在100%。洗脱过程中监测214 nm的光密度值D(214), 每隔1 min收集洗脱组分, 共计收集洗脱组分约36份。将样品冻干后用0.1%FA复溶合并为10份。
1.2.6 质谱分析每份样品采用纳升流速Easy nLC系统进行分离。缓冲液A液为0.1%甲酸水溶液, B液为0.1%甲酸乙腈水溶液(乙腈为80%)。色谱柱以100%的A液平衡, 样品由自动进样器上样到分析柱(Thermo scientific, Acclaim PepMap RSLC 50 μm×15 cm, nanoviper, P/N164943)分离, 流速为300 nL/min。1 h液相梯度:0~5 min, B液线性梯度从0%~6%;5~45 min, B液线性梯度从6%~28%;45~50 min, B液线性梯度从28%~38%;50~55 min, B液线性梯度从38%~100%;55~60 min, B液维持在100%。
样品经色谱分离后用Q-Exactive Plus质谱仪进行质谱分析。分析时长为60 min, 检测方式为正离子, 母离子扫描范围350~1 800 m/z, 一级质谱分辨率为70 000, AGC target为3e6, 一级Maximum IT为50 ms。多肽和多肽碎片的质量电荷比按照下列方法采集:每次全扫描(full scan)后采集10个碎片图谱(MS2 scan), MS2 Activation Type为HCD, Isolation window为2 m/z, 二级质谱分辨率17 500, Microscans为1, 二级Maximum IT为45 ms, Normalized Collision Energy为30 eV。
质谱分析原始数据为RAW文件, 用软件Mascot2.5和Proteome Discoverer 2.1进行查库鉴定及定量分析。
1.2.7 数据处理两组患者年龄、禁欲时间差异比较采用t检验, 数据采用SPSS 19.0系统软件处理。检验水准:α=0.05。
本研究使用高分辨质谱仪Q Exactive Plus(Thermo Scientific)进行iTRAQ定量蛋白质组学分析。使用Proteome Discoverer 2.1(Thermo Scientific)软件将Q Exactive Plus产生的原始图谱文件(.raw文件)转化为.mgf文件, 通过软件内置的工具提交到MASCOT2.5服务器进行数据库检索。然后再通过Proteome Discoverer 2.1将MASCOT服务器上形成的查库文件(.dat文件)传回软件, 根据FDR<0.01的标准对数据进行筛选, 获得高度可信的定性结果。
本研究使用数据库为:uniprot_HomoSapiens_20161205.fasta(下载时间:2016-12-05, 下载链接:http://www.uniprot.org)。
1.2.8 Gene Ontology (GO)功能注释利用Blast2GO[7]对目标蛋白质集合进行GO注释的过程大致可以归纳为序列比对(Blast)、GO条目提取(Mapping)、GO注释(Annotation)和补充注释(Annotation Augmentation)等4个步骤。
首先, 利用本地化序列比对工具NCBI BLAST+(ncbi-blast-2.2.28+-win32.exe)将目标蛋白质集合与适当的蛋白质序列数据库进行比对, 并保留满足E-value≤1e-3的前10条比对序列进行后续分析。其次, 利用Blast2GO Command Line对目标蛋白质集合及之前步骤中符合条件的比对序列所关联的GO条目进行提取(数据库版本:go_201504.obo, 下载地址:www.geneontology.org)。在Annotation过程中, Blast2GO Command Line通过综合考量目标蛋白质序列和比对序列的相似性、GO条目来源的可靠度, 以及GO有向无环图的结构, 将Mapping过程中提取的GO条目注释给目标蛋白质序列。完成Annotation后, 为进一步提高注释效率, 可以通过InterProScan[8]搜索EBI数据库中与目标蛋白质匹配的保守基序(motif), 并将motif相关的功能信息注释给目标蛋白质序列; 并运行ANNEX对注释信息进一步补充, 并在不同的GO类别之间建立联系, 以提高注释的准确性。
1.2.9 KEGG通路注释在KEGG数据库中, KO (KEGG Orthology)是1个基因及其产物的分类体系。在同一条通路上具有相似功能的直系同源基因及其产物被归为1组, 并赋予同一个KO(或者K)标签。对目标蛋白质集合进行KEGG通路注释时, 利用KAAS (KEGG Automatic Annotation Server)软件[9], 首先通过比对KEGG GENES数据库, 将目标蛋白质序列进行KO归类, 并根据KO归类自动获取目标蛋白质序列参与的通路信息。
1.2.10 GO注释与KEGG注释的富集分析在对目标蛋白质集合进行GO注释或KEGG通路注释的富集分析时, 通过Fisher精确检验(Fisher’s Exact Test), 比较各个GO分类或KEGG通路在目标蛋白质集合和总体蛋白质集合中的分布情况, 来评价某个GO term或KEGG通路蛋白质富集度的显著性水平。
1.2.11 蛋白质斑点印迹按照Abcam公司Dot blot protocol进行蛋白质斑点印迹杂交。准备好硝酸纤维素膜(北京鼎国昌盛, Cat#XLL092-2), 用铅笔画出网格, 将2 μL样品滴在栅格中心的硝酸纤维素膜上, 让膜干燥。在TBS-T的5%BSA中浸泡40 min, 加一抗(INF2, Proteintech 20466-1-AP, 1 :2 000稀释)在室温下溶于BSA/TBS-T 30 min。用TBS-T(3×5 min)洗涤3次。与HRP结合的二抗孵育(Zen BioScience 511203, 1 :4 000稀释)30 min。用TBS-T(15 min×1, 5 min×2)洗涤3次, 然后用TBS(5 min)洗涤1次。用ECL试剂孵育1 min, 在荧光及化学发光成像系统(上海勤翔)中曝光。
2 结果 2.1 蛋白质定量及SDS-PAGE电泳结果样本混样后定量以及SDS-PAGE结果显示蛋白质质量好, 且样本间平行性较好(表 1, 图 1)。
| 组别 | 蛋白浓度 (μg/μL) |
蛋白浓度 (μg/μL) |
蛋白总量 (μg) |
| 对照组 | |||
| A1 | 21.5 | 900 | 19 350 |
| A2 | 26.0 | 900 | 23 400 |
| A3 | 24.3 | 900 | 21 870 |
| 试验组 | |||
| B1 | 28.1 | 900 | 25 290 |
| B2 | 29.3 | 900 | 26 370 |
| B3 | 19.8 | 900 | 17 820 |
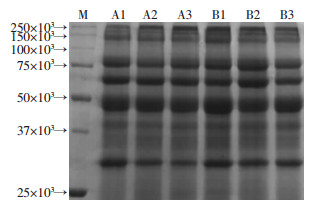
|
| M:标准; A1:对照组1;A2:对照组2;A3:对照组3;B1:试验组1;B2:试验组2;B3:试验组3 图 1 SDS-PAGE电泳结果 |
2.2 正常精子与特发性弱精子症精浆蛋白差异情况
本研究共发现精浆中2 784个蛋白质。其中, 与正常组相比, 特发性弱精子症患者精浆中表达上调蛋白数为14个, 精浆中表达下调蛋白数为79个。其中差异最显著的10个蛋白是:①下调蛋白:INF2、SNX12、GMPR2、HNRNPM、SULT1A4、PTGR1、SEPT9、DKFZp686O01196; ②上调蛋白:MUC6、KRT14。聚类分析结果表明, 差异表达蛋白被分成了两个主要的簇, 每一组又分别分成上调表达蛋白和下调表达蛋白, 热图(图 2)同时还表明聚类分析的样品来自于不同的组别。
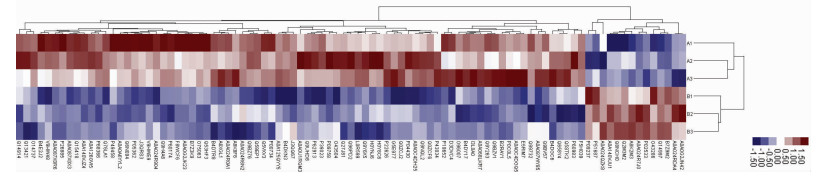
|
| 图 2 聚类分析结果(B vs A) |
2.3 特发性弱精子症精浆蛋白质生物信息分析
通过对试验组和对照组精浆蛋白GO注释发现, 其差异蛋白主要参加的生物学过程包括:代谢过程, 细胞过程, 单一生物体过程, 生物过程的调节、定位、信号传导等; 差异蛋白主要分子功能包括:整合、催化活性、分子功能调节、信号转导等; 差异蛋白主要参与细胞成分包括:细胞器、细胞零件、细胞膜、突触等(图 3)。GO蛋白功能富集分析发现, 特发性弱精子症精浆中差异蛋白主要为调节钙离子跨膜转运、胞浆内转运以及螯合相关蛋白, 蝶呤钼辅因子合成及代谢相关蛋白, 调节铜离子跨膜转运等相关蛋白(图 4)。KEGG蛋白通路注释及富集分析发现, 差异蛋白主要富集于类风湿关节炎、肿瘤坏死因子信号通路、叶酸生物合成、金黄色葡萄球菌感染等通路(图 5)。

|
| 生物进程:1:多生物体过程; 2:代谢过程; 3:细胞过程; 4:节律过程; 5:细胞成分组织或生物发生; 6:细胞杀伤; 7:发展过程; 8:多细胞生物体过程; 9:生殖过程; 10:生物过程的正调控; 11:生物过程的负调控; 12:行为; 13:突触前过程涉及化学突触传递; 14:单生物体过程; 15:运动; 16:发育; 17:免疫系统进程; 18:生物过程的调节; 19:生物调节; 20:生殖; 21:生物粘附; 22:回应刺激; 23:定位; 24:信号传导; 25:解毒。分子功能:26:结合; 27:催化活性; 28:分子功能调节剂; 29:信号转导活动; 30:金属伴侣蛋白活动; 31:转运活动; 32:分子转导活性; 33:结构分子活性。细胞构成:34:细胞连接; 35:膜部分; 36:突触部分; 37:细胞; 38:膜; 39:大分子复合物; 40:膜封闭腔; 41:细胞外区域部分; 42:细胞外区域; 43:其他有机体; 44:细胞器; 45:超分子复合物; 46:突触; 47:细胞零件; 48:其他有机体部分; 49:细胞器部分 图 3 GO注释结果的level 2统计结果(B vs A) |
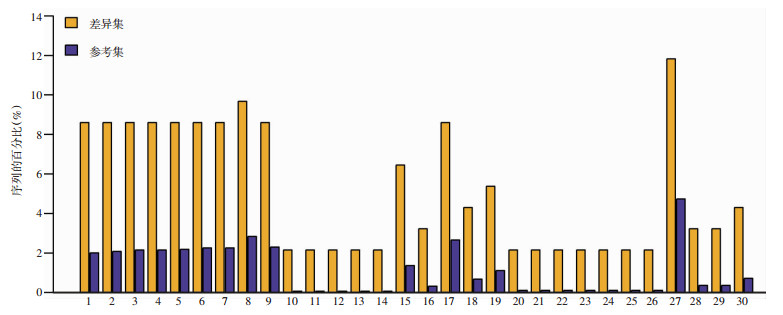
|
| 1:调节螯合钙离子释放到细胞质中; 2:调节钙离子转运到胞浆中; 3:钙离子螯合的负调控; 4:将螯合的钙离子释放到胞质中; 5:调节钙离子的螯合; 6:钙离子转运到胞质溶胶中; 7:胞浆钙离子转运; 8:稳态过程的负调节; 9:螯合钙离子; 10:钼-蝶呤型钼辅因子生物合成过程; 11:钼蝶辅因子的生物合成过程; 12:辅基代谢过程; 13:蝶呤型钼辅因子代谢过程; 14:钼-蝶呤型钼辅因子代谢过程; 15:对氨基酸的反应; 16:正调节螯合钙离子释放到细胞质中; 17:螯合金属离子; 18:细胞代谢复合物补救; 19:兰尼碱敏感的钙释放通道活性的调节; 20:一氧化氮合酶生物合成过程的负调控; 21:铜离子的跨膜转运活性; 22:二亚硝酰铁络合物结合; 23:S-亚硝基谷胱甘肽结合; 24:铜离子跨膜运输; 25:牙本质牙的牙源性调节; 26:TRAF2-GSTP1复合物; 27:细胞二价无机阳离子平衡; 28:TOR信号的正调控; 29:正向调节钙离子转运入细胞质; 30:通过电耦合进行细胞通信 图 4 差异表达蛋白显著富集的GO term统计(B vs A) |
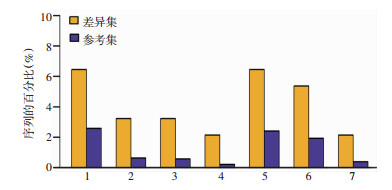
|
| 1:类风湿关节炎; 2:TNF信号通路; 3:化学致癌作用; 4:叶酸生物合成; 5:金黄色葡萄球菌感染; 6:非洲锥虫病; 7:嗅觉转导 图 5 显著富集的KEGG通路统计(B vs A) |
2.4 INF2蛋白质斑点印迹结果
选择差异表达蛋白中下调最显著的蛋白INF2, 对其结果通过蛋白质斑点印迹技术进行验证。INF2斑点印迹结果中, 曝光后灰度越高提示其蛋白浓度越大。因验证实验前遗失一试验组样本, 固其斑点印迹结果少1列, 但并未影响对照组中INF2含量明显高于试验组这一趋势(图 6)。对两组结果进行灰度值统计分析发现, 对照组灰度值(10 590±1 331)显著高于试验组灰度值(6 565±1 294), 差异具有统计学意义(P < 0.05)。说明斑点印迹验证结果同iTRAQ结果一致。

|
| 图 6 INF2斑点印迹结果 |
3 讨论
目前, 男性不育越来越受到重视, 其已知的病因包括精索静脉曲张(12.3%)、生殖道感染(6.6%)、免疫性因素(3.1%)、后天获得性疾病(2.6%)、先天性发育异常(2.1%)、性功能障碍(1.7%)及其他异常(3%)等[10]。但是高达60%~75%的患者找不到病因, 称为特发性男性不育, 其只表现为少精子、弱精子和/或畸形精子症等精子质量异常。其中, 特发性弱精子症在临床中较为常见, 对其发病机制的研究就显得尤为必要。
精浆是精子生存的介质和能量来源, 对精子的存活和运动功能有重要作用[11]。精浆中的蛋白质、糖类、电解质及微量元素等作为精子生存和运动的物质基础, 对精子受精能力的维持起着关键性的作用, 而精浆中蛋白含量的改变, 可能导致精子的活力及受精能力下降[12]。对精浆蛋白质组学的研究, 能够为研究精子的成熟、运动、受精能力等提供线索, 而且还可以为男性不育的临床诊断和治疗提供帮助。然而, 既往弱精子症精浆蛋白组学研究并未针对特发性弱精子症, 且可能因为研究方法、研究对象种群的不同, 其结果存在较大差异[13-14]。因此, 对特发性弱精子症精浆蛋白差异表达的研究, 有助于探寻导致其精子活力低下的原因。
iTRAQ技术是由AB SCIEX公司研发的一种基于体外等重同位素标记的相对与绝对定量技术。该技术定量敏感、反应速度快、标记完全, 有较高的重复性, 可同时比较多达8种样品之间的蛋白质表达量, 定性与定量可同时进行, 是近年来定量蛋白质组学常用的高通量筛选技术[4]。本研究运用该技术检测特发性弱精子症患者精浆蛋白组同正常成年男性精浆蛋白组差异, 发现表达差异蛋白93个, 表达上调蛋白数为14个, 精浆中表达下调蛋白数为79个。其中, 上调蛋白中没有差异超过2倍, 而下调蛋白中有2个蛋白差异超过2倍, 它们是INF2、SNX12, 并且INF2在特发性弱精子症患者精浆中表达下调已得到验证。这说明, 在特发性弱精子症中, 精浆蛋白表达量更多可能是呈下调状态。CHAKRABARTI等[15]发现, 在内质网中的INF2能够介导肌动蛋白聚合, 从而刺激线粒体钙摄取、内膜收缩和分裂。这一研究提示, 特发性弱精子症精浆中的INF2显著下降, 其可能通过某种方式引起精子线粒体功能异常, 最终导致精子前向运动能力下降。目前, 并没有研究发现SNX12同特发性弱精子症相关, 这一蛋白的发现可能为特发性弱精子症的病因研究提供新的方向。
GO蛋白功能富集分析发现差异蛋白功能主要有调节钙离子跨膜转运、细胞质内转运、释放以及螯合、蝶呤型钼辅因子合成及代谢、调节铜离子跨膜转运、一氧化氮合酶生物合成过程的负调控等。既往ESPINO等[16]发现, 弱精子症患者的精子细胞内钙释放水平降低, 而本研究中差异蛋白功能富集于钙离子调控这一结果同以往研究结果具有相关性, 特发性弱精子症患者精浆中差异表达蛋白可能引起精浆及精子中钙离子调控异常, 最终导致精子前向运动能力下降。一氧化氮(NO)是人体内重要的活性氧分子, 其参与精子生成及成熟过程, 影响精子的质量和功能, 在精子获能、顶体反应、精卵结合中均起重要作用[17]。HELLSTROM等[18]认为, NO可降低氧自由基, 从而使精子质膜过氧化水平降低。但过高浓度NO却会损害精子的结构和功能[19]。本研究发现差异蛋白功能富集于一氧化氮合酶生物合成过程的负调控这一结果同以往研究具有相关性, 差异表达蛋白可能影响了一氧化氮合酶生物合成过程的负调控, 引起精浆和精子中NO浓度异常, 从而导致精子前向运动能力下降。蝶呤型钼辅因子、铜离子在以往的精子及精浆研究少有涉及, 为进一步研究特发性弱精子症可能病因提供了可选方向。
KEGG蛋白通路富集分析结果显示, 差异蛋白主要富集于类风湿关节炎、肿瘤坏死因子信号通路、叶酸生物合成、金黄色葡萄球菌感染等通路。有研究表明[20-21], 补充叶酸提高不育男性精子浓度, 从而提高其生育能力, 但目前未发现叶酸能够提高精子活力。DIAO等[22]发现, 精子活力与其杀菌能力相互关联, 精子活力越强其杀灭金黄色葡萄球菌能力就越强, 这是由精浆中β防御素1(DEFB1)引起, 并与其浓度正相关。但本研究中并未测得精浆中DEFB1, 可能由于其他蛋白导致精子前向运动能力降低。本研究结果同以往研究具有一定相关性, 且本研究中仍有部分富集通路在以往不育研究中未涉及, 为进一步研究特发性弱精子症发生机制提供了可能方向。
综上所述, 成年男性特发性弱精子症患者精浆蛋白同成年男性正常精浆蛋白存在差异, 其可能是引起特发性弱精子症的原因。但仍需对特发性弱精子症患者精浆差异蛋白进行鉴别, 筛选出与精子活力关联密切且重要度高的蛋白质, 明确其功能, 为临床诊断和寻找治疗靶点提供帮助。
| [1] | MOORE F L, REIJO-PERA R A. Male sperm motility dictated by mother's mtDNA[J]. Am J Hum Genet, 2000, 67(3): 543–548. DOI:10.1086/303061 |
| [2] |
李维娜, 朱文兵, 唐章明, 等. 16835例中国不育男性的精液质量分析[J].
中南大学学报(医学版), 2014, 39(2): 157–160.
LI W N, ZHU W B, TANG Z M, et al. Semen quality of 16 835 infertile men in China[J]. J Cent South Univ (Med Sci), 2014, 39(2): 157–160. DOI:10.11817/j.issn.1672-7347.2014.02.008 |
| [3] |
黎兴盛, 鲍琳, 杨春, 等. 216例男性不育症精液检验与血清中抗精子抗体的关系[J].
实验与检验医学, 2011, 29(2): 121–122, 148.
LI X S, BAO L, YANG C, et al. The correlation between the semen routine indicators and serum anti-sperm antibody level in infertility patients[J]. Exp Lab Med, 2011, 29(2): 121–122, 148. DOI:10.3969/j.issn.1674-1129.2011.02.007 |
| [4] | ROSS P L, HUANG Y N, MARCHESE J N, et al. Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents[J]. Mol Cell Proteomics, 2004, 3(12): 1154–1169. DOI:10.1074/mcp.M400129-MCP200 |
| [5] | VÉGVÁRI Á, REZELI M, SIHLBOM C, et al. Molecular microheterogeneity of prostate specific antigen in seminal fluid by mass spectrometry[J]. Clin Biochem, 2012, 45(4/5): 331–338. DOI:10.1016/j.clinbiochem.2011.11.018 |
| [6] | ẂISNIEWSKI J R, ZOUGMAN A, NAGARAJ N, et al. Universal sample preparation method for proteome analysis[J]. Nat Methods, 2009, 6(5): 359–362. DOI:10.1038/nmeth.1322 |
| [7] | GÖTZ S, GARCÍA-GÓMEZ J M, TEROL J, et al. High-throughput functional annotation and data mining with the Blast2GO suite[J]. Nucleic Acids Res, 2008, 36(10): 3420–3435. DOI:10.1093/nar/gkn176 |
| [8] | QUEVILLON E, SILVENTOINEN V, PILLAI S, et al. InterProScan:protein domains identifier[J]. Nucleic Acids Res, 2005, 33(Web Server issue): W116–W120. DOI:10.1093/nar/gki442 |
| [9] | MORIYA Y, ITOH M, OKUDA S, et al. KAAS:an automatic genome annotation and pathway reconstruction server[J]. Nucleic Acids Res, 2007, 35(Web Server issue): W182–W185. DOI:10.1093/nar/gkm321 |
| [10] |
周青松, 曾凡春, 张祯雪, 等. 复方氨基酸胶囊联合维生素E治疗特发性弱精子症的临床研究[J].
中华男科学杂志, 2016, 22(4): 343–346.
ZHOU Q S, ZENG F C, ZHANG Z X, et al. Compound amino acid combined with vitamin E for idiopathic asthenospermia[J]. Nat J Androl, 2016, 22(4): 343–346. DOI:10.13263/j.cnki.nja.2016.04.012 |
| [11] |
万学红, 卢雪峰. 诊断学[M]. 8版. 北京: 人民卫生出版社, 2013: 336.
WAN X H, LU X F. Diagnostics[M]. 8th Ed. Beijing: People's Medical Publishing House, 2013: 336. |
| [12] | CHIU W W, CHAMLEY L W. Human seminal plasma antibody-binding proteins[J]. Am J Reprod Immunol, 2003, 50(3): 196–201. DOI:10.1034/j.1600-0897.2003.00067.x |
| [13] |
徐建新, 朱涛, 吕胜启, 等. 应用蛋白质芯片飞行时间质谱仪研究弱精子症患者精浆差异蛋白表达[J].
中国男科学杂志, 2015, 29(10): 12–16.
XU J X, ZHU T, LV S Q, et al. Differential protein profile analysis in seminal plasma of asthenospermia patients by SELDI-TOF-MS[J]. Chin J Androl, 2015, 29(10): 12–16. DOI:10.3969/j.issn.1008-0848.2015.10.003 |
| [14] | SARASWAT M, JOENVÄÄRÄ S, JAIN T, et al. Human spermatozoa quantitative proteomic signature classifies normo-and asthenozoospermia[J]. Mol Cell Proteomics, 2017, 16(1): 57–72. DOI:10.1074/mcp.M116.061028 |
| [15] | CHAKRABARTI R, JI W K, STAN R V, et al. INF2-mediated actin polymerization at the ER stimulates mitochondrial calcium uptake, inner membrane constriction, and division[J]. J Cell Biol, 2018, 217(1): 251–268. DOI:10.1083/jcb.201709111 |
| [16] | ESPINO J, MEDIERO M, LOZANO G M, et al. Reduced levels of intracellular calcium releasing in spermatozoa from asthenozoospermic patients[J]. Reprod Biol Endocrinol, 2009, 7: 11. DOI:10.1186/1477-7827-7-11 |
| [17] |
刘睿智, 江露, 许宗革, 等. 精浆一氧化氮与精液主要参数之间关系探讨[J].
中国妇幼保健, 2006, 21(9): 1245–1247.
LIU R Z, JIANG L, XU Z G, et al. Study of the relationsllip between seminal parameters and concentrations of Ilitric oxide in semen plasma[J]. Matern Child Health Care China, 2006, 21(9): 1245–1247. |
| [18] | HELLSTROM W J, BELL M, WANG R, et al. Effect of sodium nitroprusside on sperm motility, viability, and lipid peroxidation[J]. Fertil Steril, 1994, 61(6): 1117–1122. DOI:10.1016/s0015-0282(16)56766-1 |
| [19] |
吴世木, 王培书, 郑金川, 等. 男性不育患者精浆NO水平及其与抗精子抗体的关系[J].
生殖与避孕, 2001, 21(5): 304–306.
WU S M, WANG P S, ZHEN J C, et al. The study on relat ions between NO level in seminal plasma and anti-sperm antibody in infertile patients[J]. Reprod Contracept, 2001, 21(5): 304–306. |
| [20] | WONG W Y, MERKUS H M, THOMAS C M, et al. Effects of folic acid and zinc sulfate on male factor subfertility:a double-blind, randomized, placebo-controlled trial[J]. Fertil Steril, 2002, 77(3): 491–498. DOI:10.1016/s0015-0282(01)03229-0 |
| [21] | EBISCH I M, THOMAS C M, PETERS W H, et al. The importance of folate, zinc and antioxidants in the pathogenesis and prevention of subfertility[J]. Hum Reprod Update, 2007, 13(2): 163–174. DOI:10.1093/humupd/dml054 |
| [22] | DIAO R, FOK K L, CHEN H, et al. Deficient human β-defensin 1 underlies male infertility associated with poor sperm motility and genital tract infection[J]. Sci Transl Med, 2014, 6(249): 249ra108. DOI:10.1126/scitranslmed.3009071 |



