非小细胞肺癌(non-smoll cell lung cancer,NSCLC)约占所有肺癌的85%[1-2]。晚期NSCLC患者易发包括淋巴结转移以及脑转移在内的全身多脏器转移[3-4]。虽然全身淋巴结清扫被认为是有淋巴结转移NSCLC的重要治疗手段,但每年仍有数百万人因为发生脑转移、骨转移等加速肺癌进展导致死亡[3, 5]。脑转移是NSCLC较严重的转移方式,虽然目前国内外已有不少对肺癌脑转移的研究,但绝大多数仍为运用放疗和/或手术等方法对脑转移病灶治疗效果的临床观察[6-7]。肺癌脑转移的基础研究仍非常薄弱,其发生机制尚不清楚。因此,迫切需要探明其分子机制或在NSCLC的脑转移中寻找潜在的分子靶点。CD151位于人类染色体11p15.5,全长4.3 kb,其编码的蛋白含有253个氨基酸,属于TM4SF家族。前期研究已有报道CD151在调节多种肿瘤细胞的侵袭、转移、迁移及信号中起到了重要作用[8]。本研究拟在临床标本及细胞水平明确CD151在肺癌脑转移过程中的作用, 初步探讨其机制,以期为明确CD151作为预测脑转移的生物指标提供前期研究。
1 材料与方法 1.1 病例资料及标本收集收集2010年12月至2015年6月本中心160例NSCLC患者临床资料,包括88例脑转移患者,72例非脑转移患者,其中单独全脑放疗37例,全脑放疗联合EGFR-TKI治疗的51例,男性42例,女性46例,年龄32~72(55.0±6.8)岁,有无脑转移患者在年龄、性别、吸烟史、病理类型等方面差异无统计学意义(P>0.05,表 1)。患者组织标本均来自本院所病理科标本库。本研究获得陆军军医大学(第三军医大学)第三附属医院(野战外科研究所)伦理委员会批准(2015-81),遵循伦理学要求。
| 患者 | n | 年龄 | 性别 | 吸烟史 | ECOG PS评分 | 病理类型 | |||||||||
| ≥60岁 | <60岁 | 女 | 男 | 不吸烟 | 现在/曾经吸烟 | 0~1分 | 2分 | 腺癌 | 非腺癌 | ||||||
| 脑转移 | 88 | 47 | 41 | 49 | 39 | 23 | 65 | 34 | 54 | 84 | 4 | ||||
| 非脑转移 | 72 | 35 | 37 | 33 | 39 | 25 | 47 | 30 | 42 | 66 | 6 | ||||
1.2 实验材料
DMEM高糖培养液、胰蛋白酶购自HyClone公司,胎牛血清购自Biolind Industries公司;CD151 siRNA购自广州锐博公司;Transwell细胞培养小室、细胞培养耗材和Matrigel基质胶均购自美国BD公司;Ecadherin,vimentin、SOX2、CD44、CD133一抗均购自中国Proteintech公司;HRP-羊抗兔、HPR-羊抗鼠抗体购自北京中杉金桥公司,CD151 siRNA以及引物来自广州锐博。
1.3 细胞培养肺癌细胞株HCC827由本实验室提供。细胞用含100 mL/L胎牛血清的DMEM高糖培养液,置于37 ℃、5% CO2培养箱中培养。
1.4 免疫组织化学实验取非脑转移及脑转移NSCLC患者肺部肿瘤组织石蜡切片,将脱蜡后切片置于加热至100 ℃的枸橼酸盐缓冲液的500 mL烧杯中进行抗原修复,用PBS液清洗3次,用羊血清封闭20 min,予以PBS液清洗3次后,配制兔抗CD151一抗(1:200),加至载玻片上的肺部肿瘤组织,置于4 ℃孵育过夜。次日取出载玻片复温20 min,用PBS液清洗3次。于37 ℃孵育抗兔的Goat-rabbit IgG1/TRITC二抗30 min,用PBS液清洗3次。用DAB显色液于室温下显色约5 min,苏木精复染5 min,脱水干燥后封片,用倒置显微镜观察并照相。
1.5 qRT-PCR检测基因的表达根据试剂盒方案使用TRIzol试剂(Invitrogen)从细胞和新鲜组织分离总RNA。分别用高容量cDNA逆转录试剂盒和QuantiTect SYBR Green PCR试剂盒(Qiagen)进行逆转录和qPCR。以GAPDH为内源对照,CD151引物上游:5′-ACTCTTGAGGGCCAGCGTCC-3′,下游:5′-TAATACGACTCACTATAGGG-3′;GAPDH引物上游:5′-GCAGGGGGGAGCCAAAAGGGT-3′,下游:5′-TGGGTGGCAGTGATGGCATGG-3′。使用2-ΔΔCt方法将CD151的相对表达针对GAPDH表达进行归一化。
1.6 HCC827细胞转染和干扰效率的鉴定接种HCC827细胞于60 mm细胞培养皿使其细胞密度为20%~30%。HCC827细胞的感染复数(multiplicity of infection,MOI)为5。加入1 mL无血清无抗生素的DMEM高糖培养液、10 pmol和1 μL Lipofectamine® 2000(lip2000),混匀后培养7 h更换完全DMEM高糖培养液,继续培养3 d。提取总蛋白,Western blot鉴定CD151干扰RNA的干扰效率。
1.7 细胞增殖实验按照7 000/孔接种CD151干扰的实验组和正常对照组细胞于96孔板,细胞贴壁后继续培养24 h,每孔加入10 μL CCK-8溶液,2 h后用酶标仪检测450 nm的光密度值[D(450)]。接种3 500/孔的细胞于96孔板中,细胞贴壁后48 h,用上述方法检测光密度值。接种1 750个/孔的细胞于96孔板中,细胞贴壁后72 h,用上述方法检测光密度值。根据光密度值计算细胞存活率,并绘制生长曲线。
1.8 细胞迁移实验 1.8.1 迁移实验Transwell小室置于无菌的24孔板中,将用无血清无抗生素的DMEM高糖培养液重悬浮的CD151干扰的实验组和正常对照组的细胞按照3×104/孔接种到小室上室,下室加入完全DMEM高糖培养液(避免产生气泡),培养16 h。取出小室,用棉签擦拭掉上室未穿过的细胞,4%多聚甲醛固定10 min,结晶紫染色15 min,用刀片将小室底部切下,置于载玻片上,显微镜下观察,取3个视野照相,计算穿膜的细胞数。
1.8.2 划痕实验将CD151干扰的实验组和正常对照组的细胞分别接种到6孔板中,使其密度为80%,置于37 ℃、5% CO2培养箱中培养至细胞长满6孔板底,用灭菌的黄枪头在6孔板中间画出一条直线,每次划痕力度一致,更换新鲜的培养液,在倒置显微镜上拍照,记录0 h的划痕宽度。继续培养,24、48 h在同一位置拍照,并记录划痕宽度。
1.9 Western blot检测与肺癌细胞侵袭转移相关的蛋白表达待细胞长满60 mm培养皿底时,收集总蛋白。BCA法测定总蛋白浓度,加入loading buffer混匀,100 ℃变性5 min。取20 μg处理好的蛋白上样,10%分离胶电泳分离。采用湿式转膜法,使蛋白电转移至硝酸纤维素(NC)膜。10%脱脂奶粉封闭后依次与一抗(抗CD151、Ecadherin、Vimentin、CD44、CD133、SOX2、β-actin均为兔多抗),以及二抗孵育结合,采用增强化学发光法(ECL)显色,胶片暗室曝光、显影、定影。
1.10 统计学方法所有测定至少独立进行3次。采用SPSS 19.0统计软件,计量资料数据以x±s表示。单因素方差分析用于评估计量资料多组比较,χ2检验或Fisher’s确切概率法评估计数资料。Spearman相关系数分析CD151与肺癌脑转移发生之间的关系。P < 0.05表示差异有统计学意义。
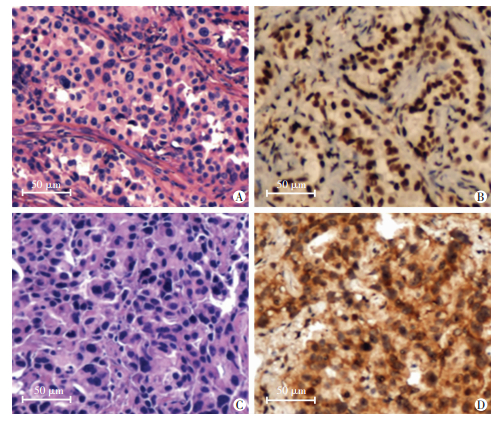
2 结果 2.1 CD151的表达与肺癌脑转移正相关针对随访资料以及标本完整的34例肺癌患者(其中脑转移与非脑转移患者各17例),进行免疫组化与PCR分析。结果显示,CD151以浆表达为主,与非脑转移患者相比,脑转移患者CD151表达明显增强(图 1),且qPCR结果显示肺癌脑转移患者的CD151 mRNA水平较非脑转移患者高2.1倍(P=0.012)。相关性分析结果显示,CD151的高表达与脑转移正相关(r=0.478,P=0.004,表 2)。
|
| A、C:HE染色;B、D:CD151染色;A、B:非脑转移患者组织;C、D:脑转移患者组织 图 1 免疫组化与HE染色观察CD151在肺癌患者组织中的表达 |
2.2 CD151 siRNA的敲除效果
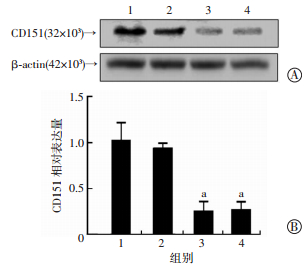
在HCC827细胞上利用Lip2000转染CD151(siRNA)与正常对照后,Western blot检测结果显示,siRNA2和siRNA3能显著敲低CD151的表达(P < 0.05,图 2)。
|
|
1:正常对照组;2: CD151(siRNA1);3: CD151(siRNA2);4: CD151(siRNA3) A: Western blot检测CD151的表达;B: CD151相对表达量a: P < 0.05,与正常对照组比较 图 2 抑制CD151的表达可以抑制细胞增殖 |
2.3 干扰CD151的表达可以抑制肺癌细胞增殖
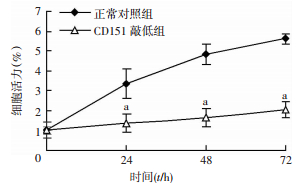
采用CCK-8法检测CD151敲低肺癌HCC827细胞的增殖情况,并绘制生长曲线。结果显示,CD151敲低与正常对照组比较,在转染后的第1、2、3天后,敲低CD151显著抑制了肺癌细胞的增殖(P < 0.05,图 3)。
|
| a: P < 0.05,与正常对照组比较 图 3 肺癌细胞增殖曲线 |
2.4 干扰CD151的表达可以阻止肺癌细胞迁移
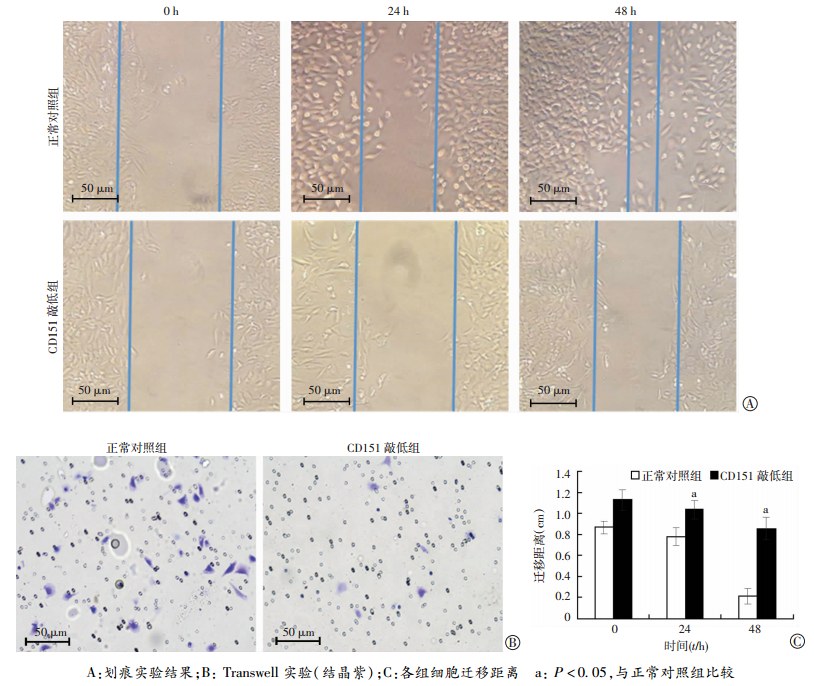
利用Transwell实验检测敲低CD151过表达对HCC827细胞迁移能力的影响。在无基质胶的条件下,观察CD151敲低的实验组与正常对照组穿过小室细胞的数量。结果表明,敲低CD151后HCC827细胞的迁移能力(54.7±13.3)比正常对照组(244.0±71.7)显著减弱(P=0.032, 图 4A、B)。利用划痕实验检测敲低CD151过表达对HCC827细胞迁移能力的影响,观察细胞向划痕中央移动距离。结果表明,敲低CD151细胞的迁移能力在24 h与48 h后比正常对照组显著减弱(P < 0.05, 图 4B、C)。敲低CD151后HCC827细胞的迁移能力比正常对照组显著减弱。上诉结果反向提示CD151可以促进肺腺癌细胞的迁移能力。
|
| A:划痕实验结果;B: Transwell实验(结晶紫);C:各组细胞迁移距离a: P < 0.05,与正常对照组比较 图 4 干扰CD151的表达对肺癌细胞系Hcc827迁移的影响 |
2.5 CD151可以调控上皮间质转化(EMT)及干性通路相关蛋白表达
Western blot检测发现,敲低CD151后可以上调Ecadherin的表达,同时下调Vimentin、SOX2、CD44、CD133等表达且差异有统计学意义(P < 0.05), 抑制CD151的表达会阻止细胞EMT以及干性的发生(图 5)。
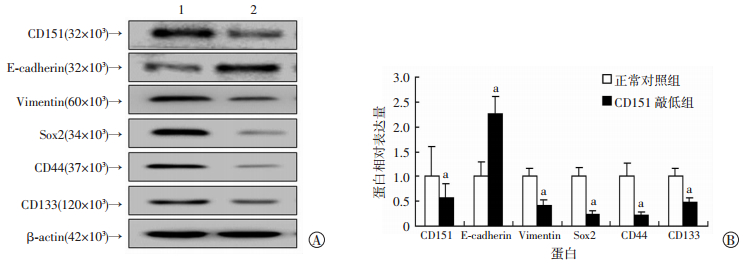
|
| A: Western blot检测敲低CD151后EMT与干性相关蛋白的表达1:正常对照组, 2: CD151敲低组;B:半定量分析a: P < 0.05,与正常对照组比较 图 5 CD151可以调控EMT及干性通路相关蛋白表达 |
3 讨论
NSCLC脑转移极大地影响患者的生存时间及生存质量,但是至今没有比较精准的针对NSCLC脑转移的预测靶标。寻找转移预测指标、针对脑转移高危人群进行早期检测预防具有重要意义。换言之,通过某些指标有效地筛选出可能发生脑转移的高危患者显得尤为迫切。大量研究已经表明EMT以及肿瘤细胞干性在肿瘤的转移、侵袭、放化疗抵抗等方面的作用[9-11]。EMT是上皮细胞在某些药物、基因表达变化的影响下转化成间质细胞的过程。EMT可导致细胞更容易发生侵袭、迁移。肿瘤干细胞性也在肿瘤复发、转移、侵袭中扮演重要角色。
本研究显示,CD151在肺癌脑转移与非脑转移患者的表达存在明显差异。CD151在脑转移患者中表达明显高于非脑转移组,其表达程度与脑转移这一因素正相关。体外实验发现,干扰CD151表达能促进E-cadherin表达,抑制Vemtein表达,同时SOX2、CD133、CD44表达也明显受到抑制。这说明干扰CD151表达能明显抑制肺癌细胞EMT的发生,同时抑制NSCLC细胞获得干性。而且干扰CD151后能抑制NSCLC细胞HCC827的增殖,也能抑制HCC827的转移。这与李科等[12]的研究结果一致。
综上所述,本研究发现CD151在肺癌脑转移与非脑转移患者组织中的表达存在差异;脑转移患者CD151明显上调,同时证实CD151对细胞EMT以及肿瘤干细胞性存在诱导作用。这预示着CD151可作为肺癌脑转移的潜在生物预测指标,为非小细胞脑转移的精准治疗提供理论依据。本课题也存在不足:免疫组化与PCR样本例数偏少;其针对CD151通过EMT以及干性来抑制脑转移的深层次研究还需要相关体内试验进一步验证。
| [1] | CHEN W, ZHENG R, BAADE P D. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | JEMAL A, CENTER M M, DESANTIS C. Global patterns of cancer incidence and mortality rates and trends[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(8): 1893–1907. DOI:10.1158/1055-9965 |
| [3] | BROWN T, PILKINGTON G, BAGUST A, et al. Clinical effectiveness and cost-effectiveness of first-line chemotherapy for adult patients with locally advanced or metastatic non-small cell lung cancer: a systematic review and economic evaluation[J]. Health Technol Assess, 2013, 17(31): 1–278. DOI:10.3310/hta17310 |
| [4] | SPIRO S G, TANNER N T, SILVESTRI G A, et al. Lungcancer: progress in diagnosis, staging andtherapy[J]. Respirology, 2010, 15(1): 44–50. DOI:10.1111/j.1440-1843.2009.01674.x |
| [5] | KAWAHARA M, ATAGI S, KOMUTA K, et al. Carboplatin plus either docetaxel or paclitaxel for Japanese patients with advanced non-small cell lung cancer[J]. Anticancer Res, 2013, 33(10): 4631–4637. |
| [6] | TATAR Z, THIVAT E, PLANCHAT E, et al. Temozolomide and unusual indications: review of literature[J]. Cancer Treat Rev, 2013, 39(2): 125–135. DOI:10.1016/j.ctrv.2012.06.002 |
| [7] | LIU WJ, ZENG XT, QIN HF, et al. Whole brain radiotherapy plus chemotherapy in the treatment of brain metastases from lung cancer: a meta-analysis of 19 randomized controlled trails[J]. Asian Pac J Cancer Prev, 2012, 13(7): 3253–3258. DOI:10.7314/APJCP.2012.13.7.3253 |
| [8] | WANG H X, LI Q, SHARMAC, et al. Tetraspanin protein contributions to cancer[J]. Biochem Soc Trans, 2011, 39(2): 547–552. DOI:10.1042/BST0390547 |
| [9] | GHELDOF A, BERX G. Cadherins and epithelial-to-mesenchymaltransition[J]. Prog Mol Biol Transl Sci, 2013, 116: 317–336. DOI:10.1016/B978-0-12-394311-8.00014-5 |
| [10] | THIERY J P, ACLOQUE H, HUANG RY J, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell, 2009, 139(5): 871–890. DOI:10.1016/j.cell.2009.11.007 |
| [11] | MEDEMA J P. Cancer stem cells: the challenges ahead[J]. Nat Cell Biol, 2013, 15(4): 338–344. DOI:10.1038/ncb2717 |
| [12] |
李科, 洪志鹏, 沈丽达, 等. CD151及整合素α整合素蛋白在非小细胞肺癌中的表达及意义[J].
中国全科医学, 2014, 17(5): 531–535.
LI K, HONG Z P, SHEN L D, et al. CD151 and integrin α3β1 expression in non-small cell lung cancer[J]. Chin Gen Prac, 2014, 17(5): 531–535. DOI:10.3969/j.issn.1007-9572 |



