盐对代谢的影响一直是人们研究的重点。高盐摄入可以导致电解质紊乱和渗透压的升高,是心血管相关疾病和代谢性疾病的主要危险因素,所以不断加深理解高盐对机体代谢的影响显得尤为重要。近年研究发现高盐负荷可以引起中枢交感神经系统的激活,并参与高血压的形成。有研究显示盐敏感性高血压大鼠盐摄入量与交感神经活性呈正相关[1-2]。而交感神经的兴奋也被认为是引起外周白色脂肪组织(white adipose tissue,WAT)棕色化的主要刺激因素[3]。哺乳动物体内有两种类型的脂肪组织,棕色脂肪组织(brown adipose tissue,BAT)和WAT。BAT的主要功能是通过解耦联蛋白-1(uncoupling protein-1,UCP-1)控制线粒体呼吸过程中ATP的合成,使ATP转换为热能,并以非颤抖性产热方式释放能量,从而起到保暖及维持机体能量平衡的作用[4-5]。WAT一向被认为是一种被动器官,只能发挥一些简单的功能,如储存能量、隔绝热量和机械缓冲,而实际上WAT是一个能够发挥更多作用的复杂器官[6]。WAT棕色化是指WAT在某些环境刺激和调节因子的作用下出现形态和功能类似于BAT的细胞,也叫米色脂肪细胞[brown-in-white (brite) cells],发挥类似BAT的产热功能,从而增加产热,提高机体代谢水平[7]。
常见的调控WAT棕色化的因素有寒冷暴露和交感神经的激活[6]。既然高盐能够引起交感神经的兴奋,那么高盐摄入对WAT棕色化是否有调控作用?COELHO等[8]发现高盐饮食会减轻脂肪的含量,并增加BAT中UCP-1的表达,提高能量代谢;DEJIMA等[9]发现在寒冷环境中,盐的摄入会增加非颤抖性产热,并维持小鼠在寒冷环境中的体温。但目前有关高盐是否对WAT棕色化有调控作用的证据还很匮乏,且高盐激活中枢交感神经的调控机制尚不十分清楚。本研究通过对C57小鼠给予高盐饮食诱导,观察高盐对小鼠WAT棕色化的影响,并进一步探讨其相关的中枢调控机制。
1 材料与方法 1.1 实验动物与分组8周龄雄性C57BL/6J小鼠20只[购于陆军军医大学(第三军医大学)实验动物中心],体质量20~21 g,用随机数字表法分为短期(24 h)高盐实验组与对照组及长期(8周)高盐实验组与对照组,每组各5只。实验动物均饲养于本院实验动物房,温度(23±2)℃,湿度55%~61%,昼夜比12 h:12 h,环境为清洁级。小鼠单笼饲养,自由饮水和进食。高盐组小鼠给予含有2%氯化钠的盐水,对照组给予正常饮水。
1.2 试剂和仪器 1.2.1 主要试剂c-Fos多克隆抗体(Cell Signaling Technology,美国);免疫组化试剂盒、DAB显色试剂盒(中杉金桥,北京);PCR引物(生工,上海),引物序列见表 1;反转录试剂盒(TaKaRa,大连);PCR提取试剂及qRT-PCR试剂盒(艾德莱,北京)。
| 目标基因 | 上游引物(5′→3′) | 下游引物(5′→3′) | 片段大小 |
| UCP-1 | AAGCTGTGCGATGTCCATGT | AAGCCACAAACCCTTTGAAAA | 65 bp |
| PGC-1α | GACTCAGTGTCACCACCGAAA | GGCAGAGAAGAAGCCACTGC | 63 bp |
| PRDM-16 | CAGCACGGTGAAGCCATTC | GCGTGCATTCGCTTGTG | 87 bp |
| PPARγ | GCCCTTTGGTGACTTTATGGA | GCAGCAGGTTGTCTTGGATG | 170 bp |
| Adrb-3 | CGCCTTCCGTCGTCTTCTGTG | GTGGACTCTGCCTGGCTTCAAC | 101 bp |
| GAPDH | ACCACAGTCCATGCCATCAC | CACCACCCTGTTGCTGTAGCC | 142 bp |
1.2.2 主要仪器
冰冻切片机(Leica CM3000,德国),PCR仪(Bio-rad,美国),全自动生化仪(本院检验科),体温计(FT3400小鼠体温计,南京),照相显微镜(Olympus,日本),分光光度计(Thermo Nano drop 2000c,美国)。
1.3 短期高盐刺激实验 1.3.1 标本留取饲养观察24 h后处死所有小鼠,迅速取脑置于4%的多聚甲醛固定,后转移到30%的蔗糖溶液中脱水沉底,-80 ℃冷冻后用冰冻切片机行冠状面冰冻切片(30 μm)备用。
1.3.2 c-Fos免疫组化① 冰冻切片放入含3%过氧化氢溶液中浸泡30 min(室温);②羊血清封闭30 min(室温);③加入兔源c-Fos抗体稀释液(1:1 000,CST),孵育12 h(4 ℃);④依次加入生物素标记的羊抗兔抗体和生物素-卵白素-HRP复合物,放置2 h(室温);⑤DAB染色,中性树脂封片。以上每一步都要用PBS充分漂洗3次,5 min/次。而后用显微镜观察并照相,用Image J进行c-Fos阳性细胞的PVN区域的单侧计数,最后计算取平均数。
1.4 长期高盐刺激实验 1.4.1 观察与监测连续观察、监测8周,主要内容:①每周同一时间测量1次小鼠体质量;②每周计算小鼠24 h内饲料和饮水的差值,得出小鼠进食和饮水量改变;③于给予高盐刺激前、后4周,每周同一时间测量1次小鼠体温。
1.4.2 标本留取实验结束后,戊巴比妥腹腔麻醉,用1 mL空针穿刺右心房取血,常温静置2 h,离心机2 500 r/min离心5 min,取上清备用。立即处死动物,冰上取小鼠单侧性腺脂肪和脑组织,称质量后置于液氮罐,后转-80 ℃保存备用。
1.4.3 血清学检测用全自动生化仪检测血清中钠离子、甘油三酯和游离脂肪酸的水平。
1.4.4 总RNA提取、反转录和荧光定量PCR(1) 总RNA提取。性腺脂肪组织:按照TRIzol提取试剂盒的步骤提取标本总RNA,并进行浓度测定。脑组织:通过冰冻切片机对照小鼠脑图谱准确收集小鼠下丘脑室旁核,然后按照同样方法提取标本的总RNA。(2)反转录:按照TaKaRa反转录试剂盒的步骤进行操作。①去除基因组DNA的反应:吸取2 μg的RNA和gDNA Eraser溶液混合成10 μL的混合液42 ℃ 2 min后4 ℃暂放。②反转录反应:去除上一步的溶液,加入1 μL Primescript RT Enzyme Mix+1 μL RTPrimer Mix+4 μL Primescript Buffer+4 μL RNase Free dH2O,混合后37 ℃ 15 min,85 ℃ 5 s,反转录为cDNA。(3)荧光定量PCR检测相关调控基因。以上述反转录的cDNA为模板,用相关引物进行qRT-PCR。总反应体系为10 μL:1 μL的cDNA模板、5 μL的2×Sybr green qPCR Mix、0.2 μL的正向引物、0.2 μL的Reverse Primer和3.6 μL的ddH2O。运用两步法进行扩增,共进行40个循环。以GAPDH基因作为内参,采用2-ΔΔCt法对棕色化相关调控基因UCP-1、过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator activated receptor-γ coactivator-1α,PGC-1α)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor-γ,PPARγ)、含PR结构域的锌指蛋白-16(positive regulatory domain zinc finger protein 16,PRDM16)、肾上腺素β3受体(Ardb-3)及下丘脑室旁核脑源性生长因子(brain derived neuro-trophic factor,BDNF)的mRNA表达进行定量检测。
1.5 统计学方法采用SPSS 21.0统计软件进行统计分析,计量资料数据以x±s表示,两组间比较用t检验,多组间比较用方差分析。
2 结果 2.1 短期实验组脑组织c-Fos免疫组化检测小鼠给予高盐刺激24 h后脑组织免疫组化检测显示,与对照组(30.67±5.51)比较,高盐组下丘脑室旁核区域c-Fos阳性细胞数(112.67±11.24)明显增加(P < 0.01,图 1)。

|
| 箭头示第三脑室(3V);红圈示室旁核(PVN) A:短期实验对照组;B:短期实验高盐组 图 1 免疫组化检测短期高盐刺激后小鼠室旁核c-Fos阳性细胞数改变 |
2.2 长期实验组小鼠进食与饮水量变化
通过8周饲养与监测发现,与对照组比较,小鼠进食量无明显改变(P>0.05),饮水量在给予高盐刺激后第2周明显增加,并在后期一直维持在较高水平,为对照组小鼠的4~5倍(P < 0.05,图 2)。
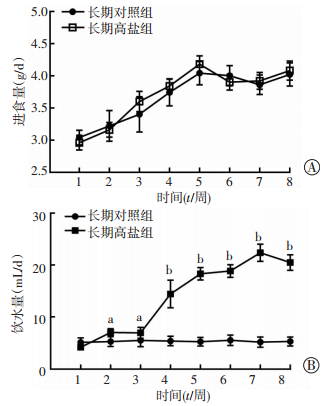
|
| A:进食量;B:饮水量a:P < 0.05,b:P < 0.01,与长期对照组比较 图 2 长期高盐刺激后小鼠进食与饮水量的改变(n=5,x±s) |
2.3 长期实验组小鼠体温与体质量变化
通过对给予高盐刺激前、后4周两组小鼠体温监测发现,高盐刺激后小鼠体温较对照组小鼠明显升高(P < 0.05, 表 2)。两组小鼠连续8周体质量比较显示,4周后高盐组小鼠体质量与对照组比较有减轻趋势,但差异无统计学意义(P>0.05,图 3)。
| 组别 | 刺激前 | 刺激后 | |||||||
| 4周 | 3周 | 2周 | 1周 | 1周 | 2周 | 3周 | 4周 | ||
| 长期对照组 | 36.375±0.126 | 36.600±0.356 | 36.475±0.150 | 36.450±0.265 | 37.250±0.192 | 37.050±0.332 | 37.150±0.173 | 37.025±0.126 | |
| 长期高盐组 | 36.325±0.591 | 36.600±0.183 | 36.750±0.332 | 36.625±0.276 | 36.350±0.614 | 36.300±0.337 | 36.375±0.419 | 36.425±0.150 | |
| a:P < 0.05,b:P < 0.01,与长期对照组比较 | |||||||||

|
| 图 3 长期高盐刺激后小鼠体质量的改变(n=5,x±s) |
2.4 长期实验组小鼠血钠、血脂与性腺脂肪质量变化
与对照组(137.5±4.64)比较,高盐组(152.36±7.27)小鼠呈明显的高钠状态(P < 0.01),血清甘油三酯和游离脂肪酸水平明显下降(P < 0.05),且单侧性腺脂肪质量明显减少(P < 0.01,表 3)。
| 组别 | 血钠(mmol/L) | 血甘油三酯(mmol/ L) | 血游离脂肪酸(mmol/ L) | 单侧性腺脂肪质量(g) |
| 长期对照组 | 137.50±4.64 | 1.07±0.08 | 0.92±0.15 | 0.15±0.01 |
| 长期高盐组 | 152.36±7.27b | 0.75±0.19a | 0.64±0.14a | 0.11±0.01b |
| a:P < 0.05,b:P < 0.01,与长期对照组比较 | ||||
2.5 长期实验组小鼠WAT棕色化调控基因mRNA水平变化
荧光定量PCR技术检测发现,与对照组比较,高盐组小鼠WAT中UCP-1、PRDM16、PPARγ、PGC-1α、Ardb-3的mRNA均明显上调(P < 0.01,图 4),而下丘脑室旁核BDNF mRNA也明显增加[(3.14±0.31)vs(1.00±0.12),P < 0.01]。
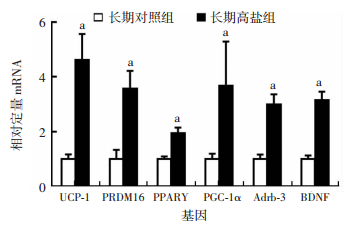
|
| a:P < 0.01,与长期对照组比较 图 4 长期高盐刺激后小鼠WAT棕色化相关基因和PVN中BDNF mRNA改变(n=5,x±s) |
3 讨论
肥胖和代谢综合征正逐渐成为亟须解决的全球性棘手问题。既往研究已证实体内BAT的含量对于改善肥胖、糖尿病和心血管疾病等发挥重要作用。人体内的BAT含量较少,发挥功能有限,WAT棕色化的相关研究就显得尤为重要[10]。
本研究通过给予小鼠长达8周的高盐刺激后,发现小鼠WAT质量减轻,体温升高,同时饮食摄入及能量摄入没有区别,说明WAT质量的减轻是通过能量代谢增加实现的。而WAT中棕色脂肪细胞特异性基因UCP-1的表达增加,说明WAT发生棕色化,WAT棕色化增加甘油三酯的代谢,导致脂肪质量减轻。WAT棕色化过程涉及一系列的转录调控因子,PPARγ、PGC-1α、PRDM16在此过程中发挥了核心调控作用,多数调控通路均直接或间接通过这些转录因子发挥作用。PRDM16被认为是决定BAT形成和发挥功能的基因开关[11]。PPARγ是一种WAT和BAT细胞分化所必需的一种专性转录因子,其激动剂可以促进WAT PRDM16和PGC-1α的表达增加[12]。PGC-1α可以实现增强线粒体功能和促进氧化通路的作用[13]。在人类皮下WAT中,PGC-1α过表达使脂肪细胞中出现棕色脂肪表型,在PGC-1α基因缺失的小鼠皮下WAT中,产热和线粒体相关基因的表达均减少[14]。本实验中这些调控因子在给予长期高盐刺激后均发生明显升高,同时血液循环中的甘油三酯和游离脂肪酸水平降低,进一步证实WAT发生了明显的棕色化。而WAT中Adrb-3表达上调,说明高盐促进WAT棕色化与交感神经兴奋密不可分。激活的交感神经系统释放肾上腺素,进而通过Adrb-3受体促进PRDM16及PPAR等转录因子激活WAT中UCP-1的表达,进而诱导WAT的棕色化[15]。
我们认为,高盐引起的交感神经激活同下丘脑室旁核密不可分,因为免疫组化c-Fos的结果显示下丘脑室旁核在高盐刺激后明显被激活。c-Fos蛋白是一种即刻早期蛋白,能够在应激状态下表达迅速增加,在一定程度上说明该处的神经元被激活[16]。中枢神经系统大部分被血脑屏障包裹,室周器作为血液和大脑交换的场所,其周围缺乏血脑屏障,可以感受外周钠离子和渗透压的改变,并将感受到的刺激传到下丘脑,下丘脑是中枢很多功能的整合中心,其在高渗导致的交感兴奋中扮演着重要的角色[17],而下丘脑室旁核中的小细胞性神经元与脊髓交感神经节前神经元有直接联系[18]。研究发现下丘脑特异性BDNF基因过表达会引起小鼠体质量减轻及BAT相关基因表达增加[19],BDNF基因条件性敲除小鼠WAT中BAT相关基因表达则会下调[6],同时中枢BDNF同交感神经系统的兴奋密切相关。本研究结果显示,下丘脑室旁核的BDNF在高盐刺激下明显增加。由此我们认为室旁核的BDNF,作为一个关键性的调控者,连接着外部环境刺激,以及交感神经系统和WAT的棕色化。我们推测:高盐引起的高钠状态会被中枢的室周器感受到,并传导至下丘脑室旁核,室旁核BDNF增加导致交感神经的兴奋,分泌增加的肾上腺素作用于WAT的Adrb-3受体,通过PPARγ、PGC-1α、PRDM16等调控因子促进UCP-1的表达增加,诱导WAT棕色化。
长期以来高盐都被看作是很多疾病的危险因素。动物实验也发现高盐摄入会引起体内白色脂肪含量的增加[20]。但是查阅近几年文献,很多研究机构均发现高盐的摄入不仅没有引起体质量的增加,反而会降低脂肪的含量,抑制肥胖的发生[21-22],这同本研究结论一致。FONSECA-ALANIZ等[20]发现高盐摄入会诱导更多食物的摄入,而本实验中采取高盐饮水后小鼠在进食量方面没有明显差异。我们认为这种争议可能是高盐进食途径的差异引起能量摄入或食物消化效率不同导致的,同时种属差异和高盐刺激时间的长短也可能是导致结果相反的原因。
高盐饮食对心血管疾病有着诸多危害,如诱导高血压、心室肥厚等,是高血压的一个独立危险因素[18]。但值得注意的是,日本在人均盐摄入高达10.5 g/d情况下,却拥有全球最低的肥胖率[23]。流行病学调查表明,生活在我国北方、西北寒冷地区的居民食用盐的摄入量明显高于南方,喜食盐含量较高的食物[24],而SAEKI等[25]也发现寒冷环境会刺激人群盐摄入的增加。本研究证实的高盐饮食诱导WAT棕色化,将会使人们对高盐饮食的看法有所改观。我们推测寒冷环境中喜食高盐可能有其相应的生理机制,高盐会促进人体WAT棕色化,增加非颤抖性产热,更有助于人们抵抗寒冷的伤害。WAT棕色化已成为近年代谢领域的研究热点,而高盐本身促进WAT棕色化的能力将为以后的研究提供一些新的方向。
本研究结果显示,高盐会通过下丘脑室旁核的BDNF来促进WAT棕色化,但相关的证据还很缺乏,具体的中枢调控途径还只是初步探讨,下一步基因编辑小鼠的应用以及中枢交感抑制剂的使用将是很好的研究手段。总之,高盐导致WAT棕色化还需要更进一步的研究,而如何平衡其有利因素和有害因素的作用也将会是一个重要的研究方向。
| [1] | OSBORN J W, FINK G D, SVED A F, et al. Circulating angiotensin Ⅱ and dietary salt: converging signals for neurogenic hypertension[J]. Curr Hypertens Rep, 2007, 9(3): 228–235. DOI:10.1007/s11906-007-0041-3 |
| [2] | ADAMS J M, MADDEN C J, SVED A F, et al. Increased dietary salt enhances sympathoexcitatory and sympathoinhibitory responses from the rostral ventrolateral medulla[J]. Hypertension, 2007, 50(2): 354–359. DOI:10.1161/HYPERTENSIONAHA.107.091843 |
| [3] |
邓文英, 陶婷, 张玉珍. 白色脂肪棕色化的研究进展[J].
内科理论与实践, 2015, 10(6): 460–464.
DENG W Y, TAO T, ZHANG Y Z. Research progress of the browning of white adipose[J]. J Intern Med Concepts Pract, 2015, 10(6): 460–464. DOI:10.16138/j.1673-6087.2015.06.016 |
| [4] | GIL A, OLZA J, GIL-CAMPOS M, et al. Is adipose tissue metabolically different at different sites?[J]. Int J Pediatr Obes, 2011, 6(Suppl 1): 13–20. DOI:10.3109/17477166.2011.604326 |
| [5] | BAI Y, SUN Q. Macrophage recruitment in obese adipose tissue[J]. Obes Rev, 2015, 16(2): 127–136. DOI:10.1111/obr.12242 |
| [6] | MOISAN A, LEE Y K, ZHANG J D, et al. White-to-brown metabolic conversion of human adipocytes by JAK inhibition[J]. Nat Cell Biol, 2015, 17(1): 57–67. DOI:10.1038/ncb3075 |
| [7] | PETROVIC N, WALDEN T B, SHABALINA I G, et al. Chronic peroxisome proliferator-activated receptor γ (PPARγ) activation of epididymally derived white adipocyte cultures reveals a population of thermogenically competent, UCP1-containing adipocytes molecularly distinct from classic brown adipocytes[J]. J Biol Chem, 2010, 285(10): 7153–7164. DOI:10.1074/jbc.M109.053942 |
| [8] | COELHO M S, PASSADORE M D, GASPARETTI A L, et al. High- or low-salt diet from weaning to adulthood: effect on body weight, food intake and energy balance in rats[J]. Nutr Metab Cardiovasc Dis, 2006, 16(2): 148–155. DOI:10.1016/j.numecd.2005.09.001 |
| [9] | DEJIMA Y, FUKUDA S, ICHIJOH Y, et al. Cold-induced salt intake in mice and catecholamine, renin and thermogenesis mechanisms[J]. Appetite, 1996, 26(3): 203–219. DOI:10.1006/appe.1996.0016 |
| [10] | NEDERGAARD J, CANNON B. The changed metabolic world with human brown adipose tissue: therapeutic visions[J]. Cell Metab, 2010, 11(4): 268–272. DOI:10.1016/j.cmet.2010.03.007 |
| [11] | SEALE P, BJORK B, YANG W, et al. PRDM16 controls a brown fat/skeletal muscle switch[J]. Nature, 2008, 454(7207): 961–967. DOI:10.1038/nature07182 |
| [12] | VERNOCHET C, PERES S B, DAVIS K E, et al. C/EBP alpha and the corepressors CtBP1 and CtBP2 regulate repression of select visceral white adipose genes during induction of the brown phenotype in white adipocytes by peroxisome proliferator-activated receptor gamma agonists[J]. Mol Cell Biol, 2009, 29(17): 4714–4728. DOI:10.1128/MCB.01899-08 |
| [13] | OHNO H, SHINODA K, SPIEGELMAN B M, et al. PPARgamma agonists induce a white-to-brown fat conversion through stabilization of PRDM16 protein[J]. Cell Metab, 2012, 15(3): 395–404. DOI:10.1016/j.cmet.2012.01.019 |
| [14] | KLEINER S, MEPANI R J, LAZNIK D, et al. Development of insulin resistance in mice lacking PGC-1alpha in adipose tissues[J]. Proc Natl Acad Sci U S A, 2012, 109(24): 9635–9640. DOI:10.1073/pnas.1207287109 |
| [15] | OELKRUG R, POLYMEROPOULOS E T, JASTROCH M. Brown adipose tissue: physiological function and evolutionary significance[J]. J Comp Physiol B, 2015, 185(6): 587–606. DOI:10.1007/s00360-015-0907-7 |
| [16] | CESAR-TOGNOLI L M, SALAMONI S D, TAVARES A A, et al. Effects of spider venom toxin PWTX-I (6-Hydroxytrypargine) on the central nervous system of rats[J]. Toxins (Basel), 2011, 3(2): 142–162. DOI:10.3390/toxins3020142 |
| [17] | BOURQUE C W. Central mechanisms of osmosensation and systemic osmoregulation[J]. Nat Rev Neurosci, 2008, 9(7): 519–531. DOI:10.1038/nrn2400 |
| [18] |
桂乐, 朱健华, 陈庆辉. 盐敏感性高血压与中枢调控机制[J].
中华高血压杂志, 2010, 18(1): 34–37.
GUI L, ZHU J H, CHEN Q H. Salt-sensitive hypertension and central regulatory mechanism[J]. Chin J Hypertens, 2010, 18(1): 34–37. DOI:10.16439/j.cnki.1673-7245.2010.01.005 |
| [19] | ERDOS B, BACKES I, MCCOWAN M L, et al. Brain-derived neurotrophic factor modulates angiotensin signaling in the hypothalamus to increase blood pressure in rats[J]. Am J Physiol Heart Circ Physiol, 2015, 308(6): H612–H622. DOI:10.1152/ajpheart.00776.2014 |
| [20] | FONSECA-ALANIZ M H, BRITO L C, BORGES-SILVA C N, et al. High dietary sodium intake increases white adipose tissue mass and plasma leptin in rats[J]. Obesity (Silver Spring), 2007, 15(9): 2200–2208. DOI:10.1038/oby.2007.261 |
| [21] | PITYNSKI-MILLER D, ROSS M, SCHMILL M, et al. A high salt diet inhibits obesity and delays puberty in the female rat[J]. Int J Obes, 2017, 41(11): 1685–1692. DOI:10.1038/ijo.2017.154 |
| [22] | WEIDEMANN B J, VOONG S, MORALES-SANTIAGO F I, et al. Dietary sodium suppresses digestive efficiency via the renin-angiotensin system[J]. Sci Rep, 2015, 5: 11123. DOI:10.1038/srep11123 |
| [23] | OKUDA M, ASAKURA K, SASAKI S, et al. Twenty-four-hour urinary sodium and potassium excretion and associated factors in Japanese secondary school students[J]. Hypertens Res, 2016, 39(7): 524–529. DOI:10.1038/hr.2016.24 |
| [24] |
马冠生, 周琴, 李艳平, 等. 中国居民食盐消费情况分析[J].
中国慢性病预防与控制, 2008, 16(4): 331–333.
MA G S, ZHOU Q, LI Y P, et al. The salt consumption of residents in China[J]. Chin J Prev Contr Chron Dis, 2008, 16(4): 331–333. |
| [25] | SAEKI K, OBAYASHI K, TONE N, et al. Daytime cold exposure and salt intake based on nocturnal urinary sodium excretion: A cross-sectional analysis of the HEIJO-KYO study[J]. Physiol Behav, 2015, 152(Pt A): 300–306. DOI:10.1016/j.physbeh.2015.10.015 |



