2. 610064 成都,四川大学高分子研究所,高分子材料工程国家重点实验室;
3. MB R3T 2N2加拿大 温哥华,曼尼托巴大学和曼尼托巴儿童健康研究所,机械工程、生物化学和医学遗传学系
2. State Key Laboratory of Polymer Materials Engineering, Polymer Research Institute of Sichuan University, Chengdu, Sichuan Province, 610064, China;
3. Department of Mechanical Engineering, Biochemistry and Medical Genetics, University of Manitoba, and Manitoba Institute of Child Health, Winnipeg, MB R3T 2N2, Canada
皮肤损伤后愈合是一个极其复杂的病理生理过程,许多细胞和非细胞成分都参与其中[1]。再上皮化是创面愈合的基本过程与重要表现,这主要依靠表皮细胞增殖并由创周等向创面中心迁移,该过程是决定创面愈合的关键环节之一[2-3]。细胞定向移动是一个主动耗能过程,需要细胞骨架系统参与。肌动蛋白(F-actin)是细胞微丝骨架的主要组成成分,其解聚、重排及形态变化在细胞迁移中发挥至关重要的作用[4-8]。
石墨烯是一类由单层碳原子组成的二维蜂窝状晶格结构物质,由于优良的导电性和热性能,独特的光学行为,优异的机械性能,极大的比表面积和良好的生物相容性,被广泛应用于工业领域。近年研究发现其还可应用于生物医学领域[9]。氧化石墨烯是石墨烯最重要的衍生物之一,其表面含有多种含氧官能团,如羟基、羧基、羰基及环氧基等[10-11],这些特性赋予其良好的水溶性及易修饰性。研究表明,氧化石墨烯可以促进干细胞向不同胚层细胞分化(如神经细胞、心肌细胞、成骨细胞等)[12-15],还可以促进多能细胞的增殖[16]。因此,氧化石墨烯具有调控细胞行为的潜能,但其对皮肤细胞的研究则鲜有报道。本研究结合氧化石墨烯对皮肤细胞的潜在影响,以表皮细胞株HaCaT细胞为研究对象[17],探讨氧化石墨烯对皮肤表皮细胞的影响及可能机制。
1 材料与方法 1.1 主要试剂和仪器氧化石墨烯购自美国Sigma公司(Graphene Oxide, GO;货号:763705),HaCaT细胞(人KC细胞株,YB-ATCC-2249)来源于美国ATCC公司,无钙RPMI1640培养液和胎牛血清购自美国Hyclone公司,胰蛋白酶、鼠抗Vinculin(V9132)购自美国Sigma公司,中性蛋白酶购自美国罗氏公司,CCK-8购自同仁公司(Kumamoto,Japan),鼠抗F-actin(ab205)、兔抗PCNA(ab18197)、鼠抗β-actin(ab8226)、鼠抗GAPDH(ab8245)均购于英国Abcom公司,罗丹明-鬼笔环肽(CA1610)、DAPI(C0065)购自美国Solarbio公司。
倒置相差显微镜购自日本Olympus公司,DU800 UV/Vis型分光光度计购自美国Beckman Coulter公司,化学发光成像分析系统购自美国Bio-Rad公司,荧光显微镜购自德国Leica公司。
1.2 方法 1.2.1 HaCaT细胞培养及GO培养液配制采用含100 U/mL青霉素、100 μg/mL链霉素和体积分数为10% FBS的RPMI1640培养液于37 ℃、5% CO2培养箱常规培养HaCaT细胞,每隔1天换液1次,取对数生长期细胞用于后续实验。每次处理细胞前,将浓度为2.0 mg/mL的GO母液,以培养液稀释成不同终浓度,即0(对照)、0.001、0.01、0.1、1.0、10.0 μg/mL。
1.2.2 GO表征检测使用透射电子显微镜(transmission electron microscope, TEM;Inspect F, Philips, Netherlands)和原子力显微镜(atomic force microscope,AFM;MFP-3D-BIO,Asylum Research,USA)观察GO纳米片的横向直径、厚度及形貌特征。AFM观察GO纳米片的厚度及形貌特征:将GO溶液旋涂到单独的云母基板上,4 000 r/min离心30 s,然后45 ℃干燥3 h。AFM使用纳米级V控制器执行(Bruker)扫描探针(no.np-s10)进行检测。TEM观察GO纳米片的横向直径:将GO溶液滴到铜网(Age Science,Stanstead, UK)上,空气干燥后立即插入TEM进行测试,TEM使用电压20 kV。测试样品1式3份。
1.2.3 GO对细胞形态的影响采用培养液调整细胞数为2.0×104/mL,以每孔100 μL接种于96孔板。细胞贴壁后弃原培养液,PBS冲洗3次,按照随机数字表法将其分为对照组及GO组。5个GO组细胞分别加入含终浓度为0.001、0.01、0.1、1.0、10.0 μg/mL GO培养液,对照组细胞为正常培养液(不含GO)。培养24 h后,用光学显微镜(Olympus, Japan)观察细胞形态。
1.2.4 GO对HaCaT细胞活性的影响按1.2.3中所述方法分组处理细胞。各组细胞常规培养24、48、72 h后置换为新的培养液,并于每孔加入10 μL CCK-8溶液孵育2 h。采用多功能酶标仪(Thermo Varioskan Flash, USA)在450 nm波长处检测光密度值。本实验重复3次。
1.2.5 采用细胞划痕实验检测GO对HaCaT细胞迁移的影响用培养液将细胞数调整为10×104/mL,以1 mL/孔接种于24孔板。待细胞贴壁生长良好,达到约80%融合时,采用含终浓度为4 μg/mL丝裂霉素的1640培养液培养2 h后[18],以规格为10 μL无菌移液器枪头在孔板底部中央处垂直划痕,弃培养液,PBS清洗3次,采用随机数字表法分为对照组和GO组(取0.001、0.01、0.1、1.0 μg/mL),每组3孔。活细胞工作站下观察并用Image J软件测量划痕后0(即刻)、6、12、24 h划痕面积,计算细胞迁移率。细胞迁移率=(划痕0 h划痕面积-其余各时相点划痕面积)/划痕0 h划痕面积×100%。
1.2.6 GO对HaCaT细胞骨架的影响将HaCaT细胞接种于盖玻片上,细胞贴壁后,弃上清液,同1.2.5中分组。细胞培养24 h后,用4%多聚甲醛固定,打孔、染色、封片后在激光共聚焦显微镜(780, Zeiss, Germany)下观察细胞骨架的变化。
1.2.7 蛋白质印迹法检测GO对HaCaT细胞PCNA、F-actin、Vinculin表达的影响以培养液调整细胞数为1×106/mL,按1 mL/孔接种于6孔板,常规培养至细胞达到约80%融合时,应用不含及含不同浓度GO培养液(0.001、0.01、0.1、1.0 μg/mL)常规培养24 h。加入RIPA裂解液冰上充分裂解细胞,提取细胞总蛋白并定量。蛋白上样量为20 μg,以10% SDS-PAGE凝胶电泳分离;湿转法转移蛋白至NC膜。3% BSA封闭后加入兔抗PCNA、鼠抗F-actin、鼠抗Vinculin、鼠抗β-actin、鼠抗GAPDH一抗4 ℃孵育过夜。次日以Tris-Tween 20缓冲液洗膜5次(每次5 min),加入抗兔、鼠来源辣根过氧化物酶标记IgG二抗室温孵育1 h。加入化学发光试剂、显影、凝胶电泳仪获取图像。以β-actin、GAPDH蛋白作为内参照,采用Quantity One软件行灰度分析。
1.3 统计学分析计量资料以x±s表示,采用SPSS 13.0统计软件行单因素方差分析,多个样本中的两两比较行LSD检验,两样本比较行独立样本t检验。检验水准α=0.05。
2 结果 2.1 GO的物理特征TEM观察显示:GO纳米片是一个二维结构,呈现超薄的“层片状结构”,横向直径约为10.0 μm(图 1A);AFM观察显示:GO纳米片厚度约为1.0 nm(图 1B~D)。

|
| A:GO透射电子显微镜观察;B、C:GO原子力显微镜观察;D:GO厚度分析 图 1 透射电子显微镜和原子力显微镜观察GO纳米片 |
2.2 GO对HaCaT细胞增殖的影响 2.2.1 GO对HaCaT细胞形态的影响
如图 2所示,光镜下观察发现低浓度(<10.0 μg/mL)GO对细胞形态无明显影响,而高浓度组(≥10.0 μg/mL)细胞形态模糊,皱缩变形。
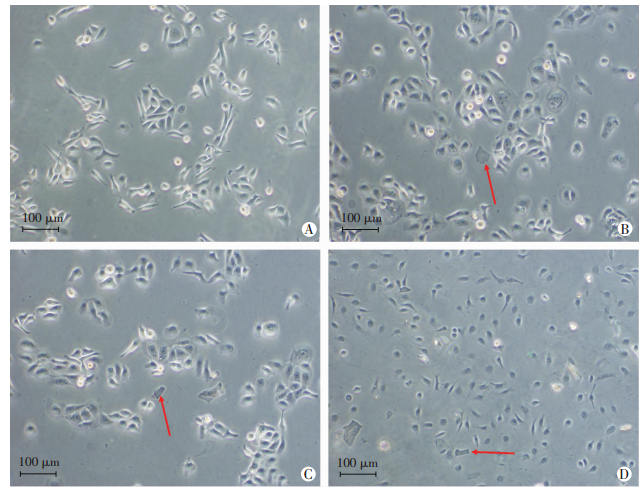
|
| A:0 μg/mL GO;B:0.001 μg/mL GO;C:0.01 μg/mL GO;D:10.0μg/mL GO;红色箭头示GO纳米片 图 2 不同浓度GO培养液处理24 h后细胞形态观察(倒置相差显微镜) |
2.2.2 GO对HaCaT细胞活性的影响
如图 3所示,GO对HaCaT细胞活性的影响呈浓度和时间依赖性。在24 h内,各浓度对细胞活性影响差异无统计学意义(P>0.05),但24 h后,随着GO浓度逐渐增高及培养时间延长,细胞活性逐渐降低,发现10.0 μg/mL的GO可明显抑制细胞生长与活性(P < 0.01)。

|
| a: P < 0.05,b: P < 0.01,与对照组(0 μg/mL)比较 图 3 不同浓度GO培养液处理后不同时间HaCaT细胞活性变化(n=4) |
2.2.3 GO对HaCaT细胞增殖的影响如
图 4所示,GO处理24 h后,0.001、0.01、0.1、1.0 μg/mL组PCNA表达情况与对照组差异无统计学意义(P>0.05),10.0 μg/mL组则明显低于对照组(P < 0.05)。因此,随后实验采用对细胞活性和增殖均无明显影响的浓度进行,即0.001、0.01、0.1、1.0 μg/mL GO。

|
|
1:0 μg/mL GO;2:0.001 μg/mL GO;3:0.01 μg/mL GO;4:0.1 μg/mL GO;5:1.0 μg/mL GO;6:10.0 μg/mL GO A:Western blot检测各组PCNA蛋白表达;B:各组PCNA的相对灰度值(n=3) a:P < 0.05,与对照组(0 μg/mL)比较 图 4 Western blot检测不同浓度GO处理24 h后各组PCNA表达 |
2.3 GO对HaCaT细胞迁移的影响及其机制探讨 2.3.1 GO对HaCaT细胞迁移的影响
如表 1,图 5、6所示,低浓度GO可促进HaCaT细胞的迁移,其中以0.01 μg/mL GO效果最明显。在划痕后24 h,该组细胞迁移面积比对照组增加了35.33%(P < 0.01)。而当GO浓度高于0.1 μg/mL时,尤其是浓度达到1.0 μg/mL时,HaCaT细胞迁移受到明显抑制(P < 0.01)。
| 组别 | 6 h | 12 h | 24 h |
| 0 μg/mL | 6.455±0.738 | 20.316±0.676 | 66.834±3.899 |
| 0.001μg/mL | 7.010±2.049 | 23.124±1.566 | 72.444±7.065 |
| 0.01 μg/mL | 7.245±2.545 | 30.281±2.940 | 90.445±4.416 |
| 0.1 μg/mL | 6.414±2.230 | 20.424±2.315 | 62.446±2.208 |
| 1.0 μg/mL | 5.135±1.969 | 9.315±0.867 | 20.436±4.253 |
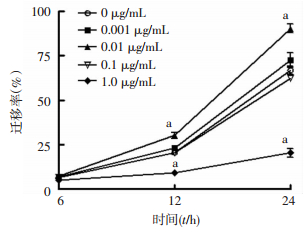
|
| a: P < 0.01,与对照组比较(0 μg/mL) 图 5 GO各浓度组HaCaT细胞划痕愈合面积曲线(n=3) |

|
| 图 6 活细胞工作站下观察GO各浓度组不同时间点HaCaT细胞划痕愈合情况 |
2.3.2 GO对HaCaT细胞骨架的影响
激光共聚焦显微镜观察发现,对照组(0 μg/mL)及GO组(0.001、0.1 μg/mL组)细胞纤毛稀少,细胞内应力纤维束纤细,1.0 μg/mL组最为显著,细胞变小、变圆,而0.01 μg/mL组纤毛明显增多,细胞内应力性纤维增粗(图 7A)。Western blot检测F-actin的表达,结果显示0.01 μg/mL组表达水平显著高于对照组(P < 0.05),而1.0 μg/mL组明显低于对照组(P < 0.05,图 7B、C)。

|
| A:激光共聚焦显微镜观察GO对HaCaT细胞骨架的影响 白色箭头示细胞纤毛和胞内应力纤维;B:Western blot检测各组F-actin蛋白表达;C:各组F-actin表达的相对灰度值(n=3) a:P < 0.05,与对照组(0 μg/mL)比较 图 7 观察不同浓度GO处理HaCaT细胞后的细胞骨架及F-actin表达 |
2.3.3 GO对HaCaT细胞Viculin蛋白表达的影响
如图 8所示,Vinculin表达水平随GO浓度升高而逐渐升高(P < 0.01)。

|
|
1:0 μg/mL;2:0.001 μg/mL;3:0.01 μg/mL;4:0.1 μg/mL;5:1.0 μg/mL A:Western blot检测各组Vinculin蛋白表达水平;B:各组Vinculin表达的相对灰度值(n=3) a:P < 0.05,b:P < 0.01,与对照组(0 μg/mL)比较 图 8 不同浓度GO处理HaCaT细胞后Vincunlin的表达 |
3 讨论
石墨烯由于其独特的理化性质和良好的生物相容性,正被广泛应用于工业等领域[9, 12-15]。由于石墨烯的内在属性,如可以调节某些细胞系的生物学性能[12-16, 19],提示它还可能具有强大的生物学调节作用。氧化石墨烯作为石墨烯最重要的衍生物之一,由于表面的各种含氧官能团,如羟基、羰基、羧基和环氧基等[10-11],而具备良好的水溶性及稳定性,并利于经一步化学修饰,因此,其在生物医学领域可能比不溶于水的石墨烯具有更大的应用潜力。
皮肤创面是最常见的临床病症,再上皮化是皮肤创面愈合最重要的环节之一,而表皮细胞的增殖及由创周等向创面中心迁移是创面上皮化的关键步骤[1-3]。但目前氧化石墨烯调节皮肤细胞行为的研究较少,其作用机制尚不清楚。
根据以往研究表明,GO纳米片的厚度、横向直径会影响其生物学作用[20-21]。因此我们首先对GO进行了物理表征。AFM和TEM数据(图 1)表明GO纳米片大多数为单层[22]不规则的片状结构,平均横向直径为10.0 μm。PELIN等[20]报道单层石墨烯在暴露72 h后才会产生轻微的细胞毒性。AKHAVAN等[21]发现大尺寸(3.8±0.4) μm GO纳米片比小尺寸的细胞毒性小,且同尺寸的氧化石墨烯要比还原型氧化石墨烯细胞毒性小。提示我们选用的GO对细胞的毒性影响不大。此外,AFM和TEM图像可以看出GO非常稳定地均匀分散在水中,这可能是GO表面极性官能团和水分子之间形成的氢键所致。
细胞活性及增殖能力是细胞参与生物学活动的基础。本研究通过显微镜观察不同浓度GO对细胞形态的影响,发现浓度低于10.0 μg/mL时对细胞无明显影响,但当浓度达到10.0 μg/mL时,细胞形态变得模糊,并发生皱缩、变形(图 2)。通过CCK-8试剂盒检测细胞活性(图 3),提示GO处理24 h后对照组和GO各浓度组细胞活性差异无统计学意义;但随培养周期延长,在刺激48 h后,浓度高的两组(1.0、10.0 μg/mL)最先出现毒性(P < 0.01),且10.0 μg/mL组比1.0 μg/mL组更明显,提示高浓度更能引发细胞毒性;在刺激72 h后,0.1 μg/mL组亦开始出现细胞毒性,提示GO毒性具有时间依赖性。GO的细胞毒性具有浓度和时间依赖性,这与前期报道[20, 23-25]一致。PCNA为反映细胞增殖状态的良好指标,因此我们利用Western blot检测PCNA的表达情况(图 4),发现GO低浓度组对细胞增殖无明显作用,GO高浓度组会抑制细胞的增殖。这些结果与已有研究结论“石墨烯和氧化石墨烯对小鼠NIH-3T3细胞或者U87、U118细胞有很弱的细胞毒性和抑制增殖效应”[26-27]一致。但与报道[20, 26-27]出现毒性和抗增殖效应的培养周期和浓度不同,我们分析可能是因为微米级的GO要比纳米级GO毒性小[25, 28],也可能是由于GO制备和体外实验中使用的细胞类型不同[29-30]。GO物理表征及对细胞活性和增殖性能的检测结果提示本研究选用的GO对HaCaT细胞活性和增殖影响小,因此进一步研究了GO对细胞迁移行为的影响。
创面再上皮化依赖于表皮细胞由创周等向创面中心迁移,因此表皮细胞的迁移被认为是创面愈合的核心和关键[2-3]。本研究通过传统划痕实验检测GO对细胞迁移的影响,发现低浓度GO可促进HaCaT细胞迁移,其中以0.01 μg/mL组效果最明显。MUKHERJEE等[31]也报道低浓度(10~100 ng/mL)氧化石墨烯可以通过提高活性氧表达促进细胞迁移。JIANG等[19]报道3D石墨烯支架可以通过改变细胞骨架、提高粘着斑蛋白等表达促进神经干细胞迁移。但也有报道石墨烯及其衍生物通过破坏细胞骨架蛋白重组等抑制细胞迁移[32-33]。本研究证实横向直径为10 μm左右GO可以促进表皮细胞迁移。
肌动蛋白重组装及其动态结构改变等在细胞迁移中发挥至关重要的作用[4-8]。另外Vinculin蛋白作为一种高度保守的细胞内蛋白,在维持、调节细胞粘附和迁移行为中也发挥关键作用[19, 34]。本研究进行GO处理后HaCaT细胞的鬼比环肽染色(图 6),共聚焦显微镜观察发现0.01 μg/mL组细胞周围的丝状伪足、片状伪足明显增多,细胞内应力纤维束增粗,而对照组(0 μg/mL)、0.001 μg/mL组和0.1 μg/mL组细胞纤毛稀少,细胞内未见明显纤维束,1.0 μg/mL组细胞则变小、变圆。Western blot检测发现0.01 μg/mL组细胞骨架蛋白(F-actin)表达高于其他各组,而1.0 μg/mL组显著降低,提示与激光共聚焦显示细胞骨架结果一致。Vinculin蛋白表达0.01 μg/mL组高于对照组(0 μg/mL)、0.001 μg/mL组,且1.0 μg/mL组表达最高,提示粘着斑蛋白表达升高可以促进细胞迁移,但过度表达可能导致细胞粘附增加而降低迁移。因此,不同浓度GO处理后细胞粘附能力的不同也进一步解释本研究中观察到的不同的细胞迁移行为。
总而言之,本研究证明了GO对HaCaT细胞活性、增殖和迁移行为的影响。发现低浓度GO不会影响细胞的活性与增殖行为,但随着浓度升高和培养周期延长,GO对细胞的毒性及抑制细胞增殖的能力逐渐增强。进一步研究发现,一定浓度的GO可以通过改变细胞骨架和提高F-actin、Vinculin等表达促进细胞迁移,为石墨烯及其衍生物促进创面愈合和应用于组织工程皮肤领域提供新的理论依据。但还需要进一步研究明确石墨烯及其衍生物不同尺寸、作用时间等对实验结果的影响以及作用于细胞迁移行为的具体机制。
| [1] | HSU Y C, LI L, FUCHS E. Emerging interactions between skin stem cells and their niches[J]. Nat Med, 2014, 20(8): 847–856. DOI:10.1038/nm.3643 |
| [2] | KIRBY G T, MILLS S J, COWIN A J, et al. Stem cells for cutaneous wound healing[J]. Biomed Res Int, 2015, 2015: 285869. DOI:10.1155/2015/285869 |
| [3] | GUO S, DIPIETRO L A. Factors affecting wound healing[J]. J Dent Res, 2010, 89(3): 219–229. DOI:10.1177/0022034509359125 |
| [4] | NOBES C D, HALL A. Rho, rac, and cdc42 GTPases regulate the assembly of multimolecular focal complexes associated with actin stress fibers, lamellipodia, and filopodia[J]. Cell, 1995, 81(1): 53–62. DOI:10.1016/0092-8674(95)90370-4 |
| [5] | ARTHUR W T, NOREN N K, BURRIDGE K. Regulation of Rho family GTPases by cell-cell and cell-matrix adhesion[J]. Biol Res, 2002, 35(2): 239–246. DOI:10.4067/S0716-97602002000200016 |
| [6] | LEWIS A K, BRIDGMAN P C. Nerve growth cone lamellipodia contain two populations of actin laments that differ in organization and polarity[J]. J Cell Biology, 1992, 119(5): 1219–1243. DOI:10.1083/jcb.119.5.1219 |
| [7] | LE CLAINCHE C, CARLIER M F. Regulation of actin assembly associated with protrusion and adhesion in cell migration[J]. Physiol Rev, 2008, 88(2): 489–513. DOI:10.1152/physrev.00021.2007 |
| [8] | FRITZ G, JUST I, KAINA B. Rho GTPases are over-expressed in human tumors[J]. Int J Cancer, 1999, 81(5): 682–687. DOI:10.1002/(ISSN)1097-0215 |
| [9] | ZHU Y, MURALI S, CAI W, et al. Graphene and grapheme oxide: synthesis, properties, and applications[J]. Adv Mater, 2010, 22(35): 3906–3924. DOI:10.1002/adma.201001068 |
| [10] | STANKOVICH S, DIKIN D A, PINER R D, et al. Synthesis of graphene-based nanosheets via chemical reduction of exfoliated graphite oxide[J]. Carbon, 2007, 45(7): 1558–1565. DOI:10.1016/j.carbon.2007.02.034 |
| [11] | LERF A, HE H Y, FORSTER M, et al. Structure of graphite oxide revisited[J]. J Phys Chem B, 1998, 102(23): 4477–4482. DOI:10.1021/jp9731821 |
| [12] | NAYAK T R, ANDERSEN H, MAKAM V S, et al. Graphene for controlled and accelerated osteogenic differentiation of human mesenchymal stem cells[J]. ACS Nano, 2011, 5(6): 4670–4678. DOI:10.1021/nn200500h |
| [13] | YANG K, LEE J, LEE J S, et al. Graphene oxide hierarchical patterns for the derivation of electrophysiologically functional neuron-like cells from human neural stem cells[J]. ACS Appl Mater Interfaces, 2016, 8(28): 17763–17774. DOI:10.1021/acsami.6b01804 |
| [14] | AHADIAN S, ZHOU Y, YAMADA S, et al. Graphene induces spontaneous cardiac differentiation in embryoid bodies[J]. Nanoscale, 2016, 8(13): 7075–7084. DOI:10.1039/c5nr07059g |
| [15] | LEE J H, SHIN Y C, JIN O S, et al. Reduced graphene oxide-coated hydroxyapatite composites stimulate spontaneous osteogenic differentiation of human mesenchymal stem cells[J]. Nanoscale, 2015, 7(27): 11642–11651. DOI:10.1039/c5nr01580d |
| [16] | CHEN G Y, PANG D W, HWANG S M, et al. A graphene-based platform for induced pluripotent stem cells culture and differentiation[J]. Biomaterials, 2012, 33(2): 418–427. DOI:10.1016/j.biomaterials.2011.09.071 |
| [17] | GIBBS S. In vitro irritation models and immune reactions[J]. Skin Pharmacol Physiol, 2009, 22(2): 103–113. DOI:10.1159/000178869 |
| [18] | FRYE M, GARDNER C, LI E R, et al. Evidence that Myc activation depletes the epidermal stem cell compartment by modulating adhesive interactions with the local microenvironment[J]. Development, 2003, 130(12): 2793–2808. DOI:10.1242/dev.00462 |
| [19] | JIANG Z Y, SONG Q, TANG M L, et al. Enhanced migration of neural stem cells by microglia grown on a three-dimensional graphene scaffold[J]. ACS Appl Mater Interfaces, 2016, 8(38): 25069–25077. DOI:10.1021/acsami.6b06780 |
| [20] | PELIN M, FUSCO L, LEÓN V, et al. Differential cytotoxic effects of graphene and graphene oxide on skin keratinocytes[J]. Sci Rep, 2017, 7: 40572. DOI:10.1038/srep40572 |
| [21] | AKHAVAN O, GHADERI E, AKHAVAN A. Size-dependent genotoxicity of grapheme nanoplatelets in human stem cells[J]. Biomaterials, 2012, 33(32): 8017–8025. DOI:10.1016/j.biomaterials.2012.07.040 |
| [22] | WANG J, MANGA K K, BAO Q, et al. High-yield synthesis of few-layer grapheme flakes through electrochemical expansion of graphite in propylene carbonate electrolyte[J]. J Am Chem Soc, 2011, 133(23): 8888–8891. DOI:10.1021/ja203725d |
| [23] | MONTEIRO-RIVIERE N A, INMAN A O. Challenges for assessing carbon nanomaterial toxicity to the skin[J]. Carbon, 2006, 44(6): 1070–1078. DOI:10.1016/j.carbon.2005.11.004 |
| [24] | WICK P, LOUW-GAUME A E, KUCKI M, et al. Classification framework for graphene-based materials[J]. Angew Chem Int Ed Engl, 2014, 53(30): 7714–7718. DOI:10.1002/anie.201403335 |
| [25] | LIAO K H, LIN Y S, MACOSKO C W, et al. Cytotoxicity of graphene oxide and graphene in human erythrocytes and skin fibroblasts[J]. ACS Appl Mater Interfaces, 2011, 3(7): 2607–2615. DOI:10.1021/am200428v |
| [26] | RYOO S R, KIM Y K, KIM M H, et al. Behaviors of NIH-3T3 fibroblasts on graphene/carbon nanotubes: proliferation, focal adhesion, and gene transfection studies[J]. ACS Nano, 2010, 4(11): 6587–6598. DOI:10.1021/nn1018279 |
| [27] | JAWORSKI S, SAWOSZ E, KUTWIN M, et al. In vitro and in vivo effects of graphene oxide and reduced graphene oxide on glioblastoma[J]. Int J Nanomedicine, 2015, 10: 1585–1596. DOI:10.2147/IJN.S77591 |
| [28] | ZHANG H, PENG C, YANG J, et al. Uniform ultra-small graphene oxide nanosheets with low cytotoxicity and high cellular uptake[J]. ACS Appl Mater Interfaces, 2013, 5(5): 1761–1767. DOI:10.1021/am303005j |
| [29] | CHANG Y, YANG S T, LIU J H, et al. In vitro toxicity evaluation of graphene oxide on A549 cells[J]. Toxicol Lett, 2011, 200(3): 201–210. DOI:10.1016/j.toxlet.2010.11.016 |
| [30] | DAS S, SINGH S, SINGH V, et al. Oxygenated functional group density on grapheme oxide: its effect on cell toxicity[J]. Particle & Particle Systems Characterization, 2013, 30(2): 148–157. DOI:10.1002/ppsc.201200066 |
| [31] | MUKHERJEE S, SRIRAM P, BARUI A K, et al. Graphene oxides show angiogenic properties[J]. Adv Healthc Mater, 2015, 4(11): 1722–1732. DOI:10.1002/adhm.201500155 |
| [32] | ZHOU H, ZHANG B, ZHENG J, et al. The inhibition of migration and invasion of cancer cells by graphene via the impairment of mitochondrial respiration[J]. Biomaterials, 2014, 35(5): 1597–1607. DOI:10.1016/j.biomaterials.2013.11.020 |
| [33] | TIAN X, YANG Z, DUAN G, et al. Graphene oxide nanosheets retard cellular migration via disruption of actin cytoskeleton[J]. Small, 2017, 13(3): 1602133. DOI:10.1002/smll.201602133 |
| [34] | BAKOLITSA C, COHEN D M, BANKSTON L A, et al. Structural basis for vinculin activation at sites of cell adhesion[J]. Nature, 2004, 430(6999): 583–586. DOI:10.1038/nature02610 |



